
Задание 2.
1. Выполните действия, указанные в пунктах 1,2 задания 1.
2. Быстро откройте кран, включив одновременно секундомер. Держите кран открытым в течение 5 секунд, затем закройте его. Выждав, когда давление установится, сделайте отсчет разности уровней h в манометре.
3.Повторите опыт с различными временами запаздывания не менее 5 раз, увеличивая время на 2-3 секунды в каждом опыте (по указанию преподавателя).
4. Результаты измерений занесите в таблицу 3.
Таблица 3
, мм |
t, c |
5 |
7 |
... |
|
|
|
|
|
|
|
|
|
5.Постройте
по данным таблицы 3 график
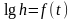 (см. рис. 3).
(см. рис. 3).
6.Продолжите график до пересечения с осью , найдите . Вычислите по формуле (14).
7. Рассчитайте экспериментальное значение по формуле (12) и сравните с теоретическим значением для воздуха, рассчитанным по формуле (9).
Задание 3.
Определение изменение температуры при адиабатическом расширении воздуха
1. Запишите по приборам в лаборатории комнатную температуру и атмосферное давление .
2. Запишите уравнение адиабатического процесса для состояний 1,2 на рис.2, используя формулу (3):
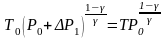 (17)
(17)
3. Найдите температуру Т в конце процесса адиабатического расширения
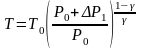 ,
где
,
где
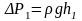 (
-
плотность жидкости в манометре.
(
-
плотность жидкости в манометре.
4.
Рассчитайте изменение температуры
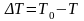 .
.
5.
Сделайте вывод о причине изменения
температуры
 .
.
Вопросы для контроля.
1. Объясните ход эксперимента и результаты расчета.
2. Назовите процессы показанные на рис.2.
3.Запишите уравнения для вывода формулы (12).
4. Сформулируйте первое начало термодинамики.
5. Как выражается внутренняя энергия идеального газа через число степеней свободы молекул?
6.Как вычисляется работа расширения газа?
7.Дайте определения молярной, удельной теплоёмкостью? Как вычисляется количество теплоты ?
8.Как вычисляются молярные теплоемкости идеального газа в изобарном и изохорном процессах?
Библиографический список
1. Е.И. Иродов Физика макросистем основные законы. §1.2, 1.3, 1.6 Изд-во "Лаборатория базовых знаний", М. 2001г, 200с.
2. И.С.Булкин, И.И.Попова. Общий физический практикум молекулярная физика. Изд-во Московского университета, 1988г, 216с, стр. 109-114.
Лабораторная работа №15
ЗАДАНИЕ 1.
Проверка закона возрастания энтропии в процессе диффузии
газов на модели перемешивания шаров
Цель работы: экспериментальное изучение изменения энтропии и термодинамической вероятности в процессе диффузии и проверка второго начала термодинамики.
Описание лабораторной установки и оборудования
Лабораторная установка представляет собой горизонтальную коробку (см. рис.1), колеблющуюся вдоль оси y, в которой размещены шары двух цветов (А и В), моделирующие молекулы двух разных газов. Вынужденные колебания коробки осуществляются электродвигателем ЭД.

Рис.1.
В результате колебаний коробки шары в ней движутся хаотично. Причем в направлении х система шаров является замкнутой и перемещение их в этом направлении происходит только за счет соударений друг с другом (модель теплового движения молекул). Равное количество шаров А и В размещают первоначально в «левой» и «правой» частях коробки. В процессе колебаний коробки шары перемешиваются, что является модельным представлением теплового движения молекул и диффузии двух газов. И если этот процесс достаточно продолжительный, то шары А и В в конце концов будут равномерно распределятся по площади коробки, что соответствует равновесному состоянию системы.
Для измерения времени протекания моделируемого диффузионного процесса в лабораторной работе используется секундомер.
Общие сведения
Физические основы эксперимента
Физические величины, количественно характеризующие отдельные молекулы, называются микропараметрами. К ним относятся координаты молекул, их импульсы, скорости и т.д.
Физические величины, характеризующие тело в целом называются макропараметрами. Это температура, давление, концентрация молекул и т. д.
Состояние системы, заданное микропараметрами ее молекул, называют микросостоянием. Состояние системы, характеризующееся набором макропараметров, называют макросостоянием. Количество микросостояний, которым может быть реализовано данное макросостояние, называется термодинамической вероятностью Ω (или статическим весом).
В данной лабораторной работе рассматривается только один микропараметр молекул (шаров) - положение (координата) молекулы, которое может иметь всего два значения : в «левой» или «правой» половине сосуда (коробки). Макросостояние системы шаров, когда их число в «левой» и «правой» половинных одинаково, является равновесным. Любое другое макросостояние, когда количество шаров одного цвета не одинаково в разных половинах коробки, является в той или иной степени неравновесным. Нетрудно понять, что любое из этих состояний, можно реализовать разными вариантами перестановок шаров одного цвета между правой и левой половинами коробки. Как это следует из определения, количество таких перестановок и есть термодинамическая вероятность Ω данного состояния.
В [1] для данной физической ситуации термодинамическая вероятность определяется как
 ,
(1)
,
(1)
где N- количество шаров одного цвета в коробке, n- количество шаров в одной половине коробки, (N-n)- количество шаров в другой половине коробки.
 Отсюда следует,
что в крайне неравновесном состоянии,
когда все шары находятся в одной половине
коробки (n=0),
термодинамическая вероятность имеет
минимальной значение Ω=1 (т.к. 0! принимается
равным единице). Т.е. такое макросостояние
реализуется всего одним способом. В
равновесном состоянии, когда n=N/2,
термодинамическая вероятность Ω
максимальна. Значит в процессе перехода
системы в равновесное состояние Ω растет
от 1 до максимального значения Ωравн
(рис. 2).
Отсюда следует,
что в крайне неравновесном состоянии,
когда все шары находятся в одной половине
коробки (n=0),
термодинамическая вероятность имеет
минимальной значение Ω=1 (т.к. 0! принимается
равным единице). Т.е. такое макросостояние
реализуется всего одним способом. В
равновесном состоянии, когда n=N/2,
термодинамическая вероятность Ω
максимальна. Значит в процессе перехода
системы в равновесное состояние Ω растет
от 1 до максимального значения Ωравн
(рис. 2).

Рис. 2.
Однако в принципе этот рост не монотонный (см. рис.2), т.к. соударения молекул в процессе теплового движения (случайные соударения шаров в данном эксперименте) приводят к случайным изменениям Ω. В частности, поэтому в равновесном состоянии термодинамическая вероятность со временем случайным образом отклоняется от Ωравн (см. рис. 2). Такие отклонения называются флуктуациями.
Абсолютная флуктуация Ω относительно равновесного состояния определяется как
∆Ω
= Ωравн
- Ωτ ,
(2)
где Ωτ
- термодинамическая вероятность в
данный момент времени τ. Относительная
флуктуация термодинамической вероятности:
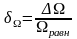 .
Методами статистики показано [1], что
эта величина пропорциональна ~
.
Методами статистики показано [1], что
эта величина пропорциональна ~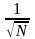 .
Т.е. флуктуации велики в системах с
небольшим количеством молекул. В реальных
системах, состоящих из огромного числа
молекул, флуктуации пренебрежительно
малы.
.
Т.е. флуктуации велики в системах с
небольшим количеством молекул. В реальных
системах, состоящих из огромного числа
молекул, флуктуации пренебрежительно
малы.
Термодинамические
вероятности молекулярных систем имеют
очень большие числовые значения, т.к.
количество молекул, из которых они
состоят чрезвычайно велико (например,
в 1 см3
воздуха при н.у. содержится ~2·1019
шт. молекул). Это создает определенные
трудности расчета величины Ω и ее
изменения. Поэтому на практике для
количественной оценки макросостояния
системы используется т. н. энтропия
S,
которая в
соответствие с формулой Больцмана
определяется как:
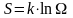 ,
(3)
,
(3)
где - постоянная Больцмана.
Формула Больцмана показывает, что в соответствие со свойствами термодинамической вероятности Ω, описанными выше, энтропия в крайне неравновесном состоянии (все шары-молекулы одного цвета находятся в одной половине коробки) равна 0, в процессе диффузии энтропия будет возрастать, в равновесном состоянии энтропия достигнет максимального значения, далее энтропия будет оставаться постоянной с точностью до флуктуаций.
Все эти изменения энтропии можно экспериментально проверить на данной лабораторной установке, фиксируя во времени изменения положений шаров по площади колеблющейся коробки. Тем самым можно проверить выполнимость одного из фундаментальных физических законов - второго начала термодинамики, которое формулируется следующим образом:
-
В замкнутой системе наиболее вероятен такой процесс, в котором энтропия возрастает.

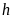 ,
мм
,
мм