
- •Циклова комісія монтажних дисциплін Курс лекцій по теоретичним основам холодильної техніки
- •Лекція 1 вступ
- •1.1 Значення курсу “теоретичні основи холодильної техніки”
- •1.2 Короткий історичний огляд
- •1.3 Призначення холодильних установок
- •1.4 Промислові технології із застосуванням холоду
- •1.5 Класифікація холодильних установок
- •Питання для самоконтролю
- •Лекція 2 термодинаміка, як загальне вчення про енергетику
- •2.1 Фізичні основи одержання холоду
- •2.2 Термодинаміка, як загальне вчення про енергетику
- •2.3 Енергія, теплота, робота
- •2.4 Закон збереження енергії
- •2.5 Параметри стану
- •2.5 Рівняння стану
- •Питання для самоконтролю
- •Лекція 3 калоричні параметри стану
- •3.1 Рівноважний термодинамічний стан і рівноважні процеси
- •3.2 Зворотні і незворотні процеси
- •3.3 Кругові процеси Калоричні параметри стану: внутрішня енергія, ентальпія, ентропія
- •3.5 Робота й теплота процесу
- •Питання для самоконтролю
- •Лекція 4. Другий закон термодинаміки. Цикл карно
- •4.1 Другий початок термодинаміки
- •4.2 Цикл Карно
- •Питання для самоконтролю
- •Лекція 5 способи одержання низьких температур
- •5.1 Охолодження при фазових перетвореннях речовин
- •5.2 Охолодження шляхом розширення газів.
- •5.3 Термоелектричний метод
- •5.4 Холодильні установки з вихровою трубкою.
- •5.5 Способи охолодження камер
- •Питання для самоконтролю
- •Питання для самоконтролю
- •Лекція 7 холодоагенти
- •7.1 Основні визначення, короткий історичний огляд, позначення й торговельні марки
- •7.2 Критерії вибору і вимоги до холодоагенту
- •7.3 Холодильні агенти і охорона навколишнього середовища
- •7.4 Альтернативні однокомпонентні холодоагенти
- •7.5 Альтернативні багатокомпонентні холодоагенти групи гфв
- •7.6 Альтернативні багатокомпонентні холодоагенти групи гхфв
- •7.7 Який же холодоагент значніший ?
- •7.8 Особливості термодинаміки сумішей холодоагентів.
- •Лекція 8. Холодоносії
- •8.1 Призначення холодоносіїв та вимоги до них
- •8.2 Характеристика холодоносіїв
- •9.1 Вимоги до мастил
- •9.2 Типи мастил та їх характеристики
- •9.3 Циркуляція мастила у холодильній установці
- •Лекція 10 розширювальні та нагнітальні машини холодильних установок
- •10.1 Призначення та класифікація розширювальних та нагнітальних машин
- •10.2 Термодинамічні основи процесів стиску та розширювання.
- •10.3 Поршневі детандери
- •10.4 Процеси стиску у компресорі
- •10.5 Холодопродуктивність компресора
- •10.6 Потужність компресора й енергетичні втрати
- •11.7 Область застосування компресорів
- •Лекція 11 основи теорії компресійних холодильних машин.
- •11.1 Ідеальна парова компресійна холодильна машина
- •11.2 Дійсний цикл парової холодильної машини.
- •11.3 Побудова холодильного циклу
- •Питання для самоконтрою
- •Лекція 12 ексергетичний метод аналізу ефективності холодильних систем
- •12.1 Властивості оборотних і необоротних циклів. Математичне вираження другого закону термодинаміки
- •7.2 Максимальна робота. Ексергія.
- •7.3 Ексергетичний баланс парокомпресорної холодильної установки
- •Питання для самоконтролю
- •Лекція 13 основи теорії газових холодильних машин.
- •13.1 Повітряна холодильна машина
- •13.2 Холодильна машина Стірлінга
- •Питання для самоконтрою
- •Лекція 14 Цикли багатоступінчатих холодильних машин
- •14.1 Причини переходу до багатоступінчастого стиску.
- •14.2 Вибір проміжного тиску.
- •14.3 Двоступінчаста холодильна машина зі змійовиковою проміжною посудиною й неповним проміжним охолодженням.
- •14.4 Двоступінчаста холодильна машина зі змієвиковою проміжною посудиною й повним проміжним охолодженням.
- •14.5 Двоступінчаста холодильна машина з теплообмінниками.
- •Питання для самоконтрою
- •Лекція 15 цикли каскадних холодильних машин
- •15.1 Найпростіша каскадна холодильна машина.
- •15.2 Реальна каскадна холодильна машина.
- •Питання для самоконтролю
- •Лекция 16 абсорбційні та пароежекторні холодильні установки
- •16.1 Принцип дії абсорбційної холодильної установки.
- •16.2 Цикл пароежекторної холодильної установки
- •Питання для самоконтролю
- •Лекція 17 теплові насоси
- •17.1 Компресія низкопотенційного природного тепла
- •17.2 Схема і принцип дії теплового насосу
- •17.3 Розрахунок тепонасосної установки
- •17.4 Двоступінчасті тепло насосні установки
- •17.5 Геотермальні теплові насоси
- •17.6 Екологічні аспекти впровадження теплових насосів
- •Питання для самоконтролю
- •Лекція 18 Енергозбереження при виробництві холоду
- •18.1 Стратегія енергозбереження
- •18.2 Законодавство України про енергозбереження.
- •18.3 Основні принципи енергозбереження
- •18.4 Вплив компонентів системи на ефективність
- •18.5 Сучасні енергозберігаючі технології компанії Данфосс
- •18.6 Застосування теплових насосів в Украъні
- •Використана література
Питання для самоконтролю
1. В чому полягає основна ідея Карно?
2. Сформулюйте другий закон термодинаміки.
3. Яке тіло називають термостатом?
4. Як не порушити ідеальності теплової машини?
5. Відтворіть цикли Карно.
6. Як оцінюють ефективність циклів?
Лекція 5 способи одержання низьких температур
З фізики відомо, що поняття “холод” і “теплота” умовні, тому що їхня фізична природа однакова. Теплота – це один з видів енергії, що може бути перетворений у її інші види, і навпаки. Теплота може переходити від однієї речовини (тіла) до іншої лише при наявності різниці температур між ними.
Речовини перебувають в одному із трьох (основних) фазових (агрегатних) станів – твердому, рідкому або газоподібному – залежно від навколишніх умов (тиску та температури) і можуть переходити з одного стану в інше при підведенні або відводі теплоти, що викликає зміну будови речовини.
Тверда фаза – агрегатний стан речовини, який характеризується твердою молекулярною структурою. Тверде тіло зберігає свою форму та розміри, практично не стискується.
Рідка фаза – агрегатний стан речовини, молекули якого, що воло- діють більшою енергією, чим молекули твердого тіла, не так щільно з’єднані одна з другою. Це дозволяє їм більш легко переборювати сили взаємного притягання. Рідина практично не стискується, зберігає свій обсяг. Найбільш характерна особливість рідини – плинність, завдяки якій вона приймає форму посудини, у якій перебуває.
Газова або парова фаза – агрегатний стан речовини, молекули якої, що володіють більшою енергією, чим молекули рідини, не зв’язані силами взаємного притягання й рухаються вільно. Газ легко стискується й заповнює весь обсяг посудини, у якій перебуває.
Пара відрізняється від газу тим, що її стан ближче до рідкого стану. Газ – це сильно перегріта пара. У парокомпресійних холодильних маши- нах робоча речовина звичайно перебуває в рідкому й пароподібному стані, на відміну від так званих газових холодильних машин, у яких робоча речовина – газ – не міняє свого агрегатного стану.
Якщо температура речовини вище температури навколишнього середовища (повітря, води та ін.), то її називають гарячим (теплим або нагрітим). Мимовільне зниження температури речовини до температури навколишнього середовища називають природним охолодженням.
Зниження температури речовини нижче температури навколишньо- го середовища можливо шляхом штучного охолодження, а саму речови-на, температура якої нижче температури навколишнього середовища, називають холодною.
Таким чином, виходячи з відносності понять холоду й теплоти, можна дати наступне визначення: холод – це теплота, що відводиться від речовини, температура якої нижче температури навколишнього середовища.
5.1 Охолодження при фазових перетвореннях речовин
Істотною відмінністю реального газу від ідеального є те, що реальний газ, залежно від зовнішніх умов, може перебувати в газоподібному, рідкому та твердому агрегатних станах.
Перехід речовини з одного агрегатного стану в інший називається фазовим переходом або фазовим перетворенням. Речовина в різних агрегатних станах має різні властивості, зокрема щільність, що передбачена характером міжмолекулярної взаємодії.
Фазові перетворення однорідних тіл відбуваються при постійній температурі, що залежить від умов переходу й фізичних властивостей речовини і супроводжуються виділенням або поглинанням теплоти.
К


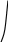

 риві
фазових переходів зображені Р В
на Р-t діаграмі (Рис. 5.1). Тут
ми бачи- рідка
фаза
К
мо три області однофазних станів:
уліво а
в
с d
від
кривої САВ розташована область
твердого стану; праворуч від
кривої тверда
А газоподібна
САК
розташована область газоподіб-
фаза
фаза
ного
стану; а між кривими АВ й АК –
область
рідкого стану. У точці А речо-
С
вина одночасно існує в трьох
агрегатних
t
станах
(потрійна точка). Такий стан
Рис.5.1.
Фазові переходи.
називається евтектичним.
Для кожної
речовини потрійній
точці відповідають
строго певні
параметри. Наприклад, для води РА
= 611 Па, t = 0,01 0C;
для азоту РА
=
12530 Па,t
= - 210 0C.
риві
фазових переходів зображені Р В
на Р-t діаграмі (Рис. 5.1). Тут
ми бачи- рідка
фаза
К
мо три області однофазних станів:
уліво а
в
с d
від
кривої САВ розташована область
твердого стану; праворуч від
кривої тверда
А газоподібна
САК
розташована область газоподіб-
фаза
фаза
ного
стану; а між кривими АВ й АК –
область
рідкого стану. У точці А речо-
С
вина одночасно існує в трьох
агрегатних
t
станах
(потрійна точка). Такий стан
Рис.5.1.
Фазові переходи.
називається евтектичним.
Для кожної
речовини потрійній
точці відповідають
строго певні
параметри. Наприклад, для води РА
= 611 Па, t = 0,01 0C;
для азоту РА
=
12530 Па,t
= - 210 0C.
Якщо до речовини у твердому стані підводити теплоту при Р = const, то процес ав буде відповідати нагріванню твердого тіла до температури плавлення, процес вс – нагріванню рідини до температури кипіння й сd – перегріву газової (парової) фази. Таким чином, крива АВ відповідає рівноважним станам тверде тіло + рідина, крива АК – рівноважним станам рідина + пара, а крива АС – рівноважним станам тверде тіло + газ. Інакше: АВ - крива плавлення, АК - крива кипіння (насичення), АС - крива сублімації.
Фазові перетворення не супроводжуються хімічними змінами і є фізичними процесами. Деякі речовини при цих перетвореннях (плавленні, кипінні, сублімації) поглинають відносно більшу кількость тепла при низькій температурі, що дозволяє застосовувати їх для одержання охолодного ефекту.
Плавлення. Плавлення водного льоду широко використовується для охолодження при t >0 °С. Для одержання більш низьких температур у лід або сніг додається сіль. Суміші готують з речовин, які в процесі розчинення поглинають тепло. Найпоширеніші суміші для охолодження: хлористий натрій з льодом (до - 21,2 °С) і хлористий кальцій з льодом (до - 55 °С).
Кількість тепла, необхідна для плавлення 1 кг льоду або суміші, називається їхньою теплотою плавлення, або холодопродуктивністю 1 кг. Зі зменшенням температури плавлення компонентів розчину tпл зменшується й холодопродуктивність 1 кг охолодної суміші qпл.
У практиці для охолодження застосовується лід з евтектичних розчинів, нижча tпл якого визначається евтектичною точкою. Так, наприклад, водяні розчини тіосульфату натрію (Na2S2O3) та нітрати натрію NaNO3 мають температуру замерзання t3 відповідно - 11 °С і - 18,5 °С.
Низькі температури можна одержати при змішанні льоду з розве- деними кислотами. Наприклад, суміш із рівних кількостей 66%-ної сірчаної кислоти й снігу або здрібненого льоду має tз = - 37 °С.
Кипіння. Процес одержання пари з рідини може здійснюватися двома шляхами: випаром і кипінням. Випаром називається паротворення, що відбувається тільки з поверхні рідини при будь-якій температурі. Кипінням називається бурхливе паротворення по всій масі рідини, що відбувається при надаванні рідині, через стінку посудини, певної кількості теплоти. Пухирці пари, що утворилися на стінах посудини й усередині рідини, збільшуючись в об’ємі, піднімаються при цьому на поверхню рідини.
Процес паротворення починається, коли температура рідини досягає температури кипіння, що протягом усього процесу залишається незмінною. Треба добре засвоїти, що процес кипіння відбувається тільки при постійній температурі та відповідному їй тиску. Спробуйте вимкнути газ коли йде процес кипіння. Він зупиниться та почнеться зворотній процес – процес конденсації з відводом теплоти. Процеси випаровування й конденсації практично “родичі” і безупинно протікають у холодильних установках при постійних тисках і температурах, відпо- відних даному процесу. Таким чином, ми з’ясували, що ізобарно-ізо- термічна зміна агрегатного стану можлива тільки при підводі або відво- ді теплоти, яка називається теплотою відповідного фазового перет- ворення. У випадку кипіння маємо справу з теплотою пароутворення.
Куди ж зникає тепло, коли температура залишається незмінною? Це питання ви повинні задавати собі кожний раз коли готуєте собі “чайок” на кухні, а поблизу мирно “посапує” холодильник.
Розглянемо це фізичне явище, без якого не може відбуватися холодильний цикл. Холодоагент, який перебуває у стані рідини, практично не може бути стисненим. Спробуйте стиснути, наприклад, воду. Думаємо, що зробити це буде дуже важко, практично неможливо. Це говорить про те, що молекули рідини знаходяться дуже близько одна від одної, тобто щільно упаковані і, звичайно, тут діють великі сили міжмолекулярного зчеплення. У процесі кипіння рідина перетворюється на пару, тому значна частина теплоти паротворення йде на збільшення швидкості теплового руху молекул рідини до такого рівня, щоб вони змогли вирватися зі сфери притяжіння сусідніх молекул.
Таким чином, теплота фазового перетворення містить у собі, по-перше, зміну внутрішньої енергії речовини, по-друге, роботу зміни об’єму при фазовому переході.
Температура кипіння, або температура насичення, tн залежить від природи речовини й тиску, причому з підвищенням тиску tн збільшується. Насиченою парою називають пар, що перебуває в динамічній рівновазі з усією рідиною. Насичена пара буває суха і волога. Суха насичена пара являє собою пару, що не містить рідини і має температуру кипіння tн при даному тиску. Двофазна система, що складається із сухої насиченої пари й рідини, називається вологою насиченою парою.
Відношення маси сухої пари mс.п. до маси вологої пари mв.п = mс.п + + mp називається ступенем сухості вологої пари
![]() = 0 ÷ 1
= 0 ÷ 1
Очевидно, що для рідини х = 0; для сухої насиченої пари x = 1.
Якщо до сухої насиченої пари продовжувати підводити теплоту, то її температура збільшується. Пара, температура якої при даному тиску більше, ніж температура кипіння (насичення) t > tн, називається перегрітою парою.
Кількість тепла, необхідна для перетворення 1 кг насиченої рідини в суху насичену пару, називається теплотою паротворення qn. У холодильних циклах застосовують рідини, що мають при атмосферному тиску Рат низьку температуру кипіння і велику теплоту паротворення, які залежать від тиску. Зі збільшенням тиску tн підвищується, a qn зменшується. Процес кипіння рідини широко застосовується в циклах парових холодильних машин.
Сублімація. Процес переходу тіл із твердого стану в пароподібний, минаючи проміжний – рідкий, називається сублімацією. Для охолодження застосовується тверда вуглекислота, що сублімує, або «сухий лід». Температура сублімації сухого льоду при Рат дорівнює - 78,9 °С, холодопродуктивність (теплота сублімації) 574 кдж/кг; зменшуючи тиск, можна знизити температуру сублімації «сухого льоду» до - 100 °С.
