
Ответы на экзаменационные вопросы
.doc
|
65.Электролиз с растворимыми и нерастворимыми анодами.
Электролиз –
процессы, происходящие на электродах
под действием эл. тока, подаваемого
от внешнего источника. На аноде в
первую очередь реагируют наиболее
сильные восстановители – вещ-ва,
имеющие наиболее отрицательный
потенциал. Если потенциал металлического
анода имеет более отрицательное
значение, чем потенциал ионов
Из тетради: 1)растворимый анод. На аноде окисляется тот металл и тот анион, потенциал которого меньше. 2)нерастворимый анод. К аноду подходят анионы:
Может, еще что-то надо? Я не знаю… тут какая-то ерунда получилась… |
67.Поляризация, ее причины. Виды перенапряжений.
Равновесные
потенциалы электродов могут быть
определены в условиях отсутствия в
цепи тока. При прохождении эл тока
потенциалы электродов изменяются.
Изменение потенциала электрода при
прохождении тока наз-ся поляризацией: Конц-ая пол-ция снижается с ↑коэф-та диф-ии и конц-ции реагента и толщины диффузионного слоя
(тонкий (продолжение
вопроса 67) слой ок. поверхности эл-да,
в кот-ом не происходит перемешивания
жидкости). Толщина этого слоя, а также
конц-ая пол-ция
при перемешивании раствора. Изменение
потенциала, обусловленное замедленностью
собственно э/хим-их стадий р-ций, наз-ся
э/хим-ой пол-ей(перенапряжением).
Замедленность эл-их стадий объясняется
существенной перестройкой структуры
реагирующих частиц в ходе реакции.
Э/хим-ие процессы происходят лишь
тогда, когда реагирующие частицы
обладают энергией, кот больше или
равна эн-ии активации. Скорость э/хим-их
р-ий может быть увеличена ↑ t
и применением катализатора. При ↑ t
↑ доля активных молекул, в случае
применения катализатора
эн-ия активации. Эн-ия активации
э/хим-ой р-ии может быть снижена при
изменении потенциала электрода по
сравнению с поляризацией. Т.к. при
эн-ии активации растет скорость р-ии,
то ↑ поляризации приводт к ускорению
э/хим-ой р-ции, т.е. к повышению плотности
тока. И чем больше эн-ия активации
процесса, тем большая поляризация
требуется для обеспечения определенной
скорости э/хим-ого процесса, выражаемой
ч/з плотность тока. Связь м/у э/хим-им
перенапряжением
|
68. Последовательность электродных реакций.
Часто в эл-те
присутствуют несколько видов катионов
и анионов. При наличии неск-их видов
ионов или недиссоциированных молекул
э/хим-ки активных вещ-в возможно
протекание неск-их электродных р-ий.
Рассмотрим их последовательность.
Т.к. на катоде идет р-ия восстановления,
т.е. прием e
окислителем, то в первую очередь должны
реагировать наиболее сильные окислители.
На катоде прежде всего протекает р-ия
с наиболее + потенциалом. Для катодного
восстановления при эл-зе водного
раствора эл-та все окис-ли разделяют
на 3 группы: 1)ионы металлов, потенциал
кот существенно более -, чем потенциал
водородного эл-да(ионы щелочных и
щелочно-земельных металлов, стоящих
в ряду стандартных эл-ых потенциалов
левее Al).
В водных растворах разряд этих ионов
на катоде почти не происходит, т.к. на
катоде выделяется H:
|
|
||||||||||
|
11. Ковалентная связь. Механизм образования по Льюису. Хим. связь, образованная путем обобществления пары электронов двумя атомами., наз-ся ковалентной связью.(КС) В 1916г Г. Льюис предложил, что устойчивые внешние электронные конфигурации у молекул могут возникнуть в результате обобществления электронов. Связь, образованная за счет обобществленной пары электронов, поставляемых по одному от каждого атома,получила название КС. Св-ва КС: насыщ-ть, направленность, гибридизация, кратность. Т.к. атомные орбитали пространственно ориентированы, то перекрывание электронных облаков происходит по определенным направлениям, что и обуславливает направленность КС. Насыщаемость КС вызывается ограничением числа электронов, находящихся на внешних оболочках, кот-е могут учавствовать в образовании КС. Гибридизация – под этим понятием понимают смещение s- и p- орбиталей, кот-е приводит к образованию гибридной орбитали.
|
66. Законы Фарадея. Электрохимический эквивалент В 1833 г.он их открыл. Они определяют зависимость между количеством прошедшего электричества и количеством вещества испытавшего химическое превращение на электроде. I. Количество вещества, испытавшего электрохимическое превращение на электроде, прямо пропорционально количеству прошедшего электричества. II. Массы прореагировавших на электродах веществ при постоянном количестве электричества относятся друг к другу как молярные массы их эквивалентов. F=96500 Кл (А * с) |
69. Сорбция, адсорбция, хемосорбция поверхностно-активного вещества(ПАВ) Адсорбция- изменение концентрации вещества на границе раздела фаз Абсорбция – это разновидность сорбции, т.е поглощение одного вещества другим веществом. Количественной мерой адсорбции является избыток адсорбированного вещества Г, который = разности концентраций вещества в поверхностном слое и в объеме раствора. Единицей измерения адсорбции (Г) явл. моль/м² Хемосорбция – на границе раздела О2, концет, на поверхности образует хим соединения. Адсорбция протекает самопроизвольно, то ⌂Gадс< 0 Тепловой эффект тоже ⌂Надс< 0 Энтропия системы ⌂Sадс< 0 адсорбция
А десорбция Равновесие ⌂Gадс = 0 Тр ⌂S = ⌂Hадс Т>Тр равновесие сдвигается в сторону десорбции ПАВ- обладают способностью уменьшать поверхностное натяжение(молекулы валерьяновой кислоты). |
8. s-, p-, d-, f- элементы |
Полярность молекулы характеризуется значением электрического момента диполя μм , который равен векторной сумме электрических моментов диполей связи, имеющихся в молекуле. Электрический момент диполя двухатомный молекул μм равен электрическому моменту диполя связи μм . Если связь неполярная, то и молекула неполярная. В многоатомных молекулах зависимость электрического момента диполя молекулы от электрических моментов диполей связей более сложная. |
|||||||||

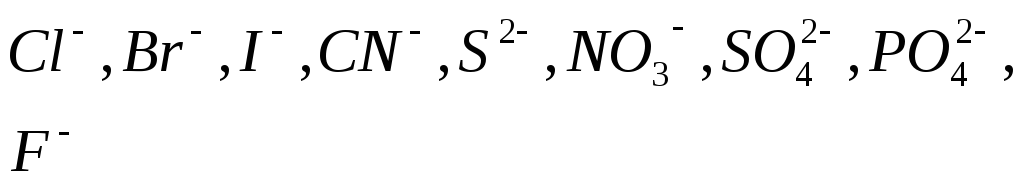 Потенциал
кислородосодержащих ионов больше 2В.
Поэтому эти анионы из водных растворов
не выделяются. Идет разряд воды или
ионов
Потенциал
кислородосодержащих ионов больше 2В.
Поэтому эти анионы из водных растворов
не выделяются. Идет разряд воды или
ионов
 Аадс
Аадс