
Ответы на экзаменационные вопросы
.doc
|
|
28. Самопроизвольное протекание процессов. Самопроизвольные процессы-процессы, протекающие без подвода Е от вн источника. СП в обратном направлении не могут протекать самопроизвольно. Многие ХР протекают самопроизвольно(образование ржавчины, растворение соли в Н2О, диффузия). Большинство экзотермических р-й (Н<0) протекают самопроизвольно. Но условие Н<0 не явл критерием самопроизвольного течения ХР, т.к. самопроизвольные эндотермич ХР, у кот Н>0(растворение некоторых солей в Н2О). Движущей силой самопроизвольного течения процесса явл стремление частиц к хаотичному движению, а системы- к переходу от более упорядоченного состояния к менее упорядоченному. Н-р, если 2 сосуда с индивидуальными жидкостями соединить друг с другом через отверстие, то через некоторое время произойдёт смешение жидкостей, система из более упорядоченного состояния перейдёт в менее упорядоченное(смесь жидкостей). Процесс идёт самопроизвольно, если S>0 и G<0. Самопроизвольно идут процессы в сторону ↑ беспорядка в системе.
|
39. Влияние cat на скорость ХР.
Cat-вещ-ва,
участвующие в хим процессе, изменяя
V
процесса, но в ре-те выходят в неизменном
виде. "Cat"
ввёл Берцелиус. Гомогенный
катализ-катализ,
при кот реагирующие вещ-ва и cat
находятся в 1 фазе, м/у cat
и реагирующими вещ-ми нет поверхности
раздела. V2+V3>V1
А+В АВ V1 А+К АК V2 АК+В АВ+К V3
CO+O2 (H2O) CO2 V1 CO+O2 (K2SO4) CO2 V2;V2>V1 При гетерогенном катализе-реагирующие вещ-ва и cat образуют систему из разных фаз. Есть поверхность раздела. Особенность ГК - протекает на границе раздела сред. Н2О2(ж) (Fe2+(тв)) Н2О(ж)+О2(г) Суммарная V химич превращения зависит от S поверхности cat.Все каталитические гетерогенные реакции включают в себя стадии адсорбции и десорбции. Адсорбция - поглощение или концентрирование вещ-ва на границе раздела 2 фаз, происходящее самопроизвольно из-за стремления системы к свободной Е. Рисунок!!!!!!!
Процесс адсорбции явл самопроизвольным процессом. Доделать!!!!!!
|
42. Принцип сдвига химического равновесия, принцип Ле-Шателье Принцип Ле-Шателье (принцип сдвига равновесия): если на систему, находящуюся в равновесии, оказывается внешнее воздействие, то равновесие смещается в таком направлении, которое ослабляет внешнее воздействие. 1. Чтобы сдвинуть равновесие в сторону исходных веществ (вправо), нужно увеличить их концентрацию. 2. При увеличении температуры равновесие сдвигается в сторону эндотермического процесса (вправо). 3. Увеличение давления сдвигает равновесие в сторону образования меньших объемов (меньшего количества моль)
|
40.Цепные реакции, простые и разветвленные.
Впервые идею о
возможности цепного механизма реакций
высказал русский ученый Н.А.Шилов в
1905 г. большой вклад в разработку теории
цепных реакций внес Н.Н.Семенов. ЦР
начинаются
со стадии
инициирования, или зарождения цепи,
т.е. образования активных частиц-свободных
радикалов. Св-ые рад-лы представляют
собой осколки молекул, имеющие
неспаренные электроны. Некоторые
св-ые рад-лы яв-ся стабильными при
обычных условиях (н-р,
Инициирование происходит в рез-те воздействия на систему светом, излучением высокой энергии, теплом, в рез-те протекания экзотер-их р-ций. Потребление энергии на инициирование в ЦР невелико, т.к. активируются не все молекулы, а только небольшая их доля. В следующей стадии ЦР происходит рост цепи. В рез-те взаимодействия радикалов с молекулами обр-ся продукты р-ции и новые радикалы. Например:
В процессе р-ии рад-лы воспроизводятся и ЦР продолжается, т.е. р-я протекает ч/з цепь последовательных стадий, в кот зарождаются и реагируют свободные радикалы. Св.р-лы реакционно активны и энергия активации ЦР мала(0-40 кДж/моль). Поэтому ЦР протекают быстрее обычных.Третьей стадией ЦР яв-ся обрыв цепи. В рез-те взаимод радикалов на стенках сосудов или на инертных молекулах образуются нейтральные молекулы, например:
Этим объясняется влияние объема и природы сосуда, инертных примесей и др. факторов, влияющих на скорость ЦР. Если в ходе ЦР вместо 1-го зарождаются 2 или более рад-ла,то число рад-ов растет и происходит разветвление цепи. Такие р-ции наз-ся разветвленными. Вследствие увеличения числа рад-ов скорость р-ции возрастает лавинообразно и может завершиться взрывом. Например, взрыв гремучего газа протекает по схеме:
|
45.Закон Рауля. Давление пара над раствором. Молекулы нелетучего растворенного компонента раствора препятствуют улетучиванию из раствора молекул растворителя. Р.Рауль открыл закон, согласно кот понижение давления насыщенного пара растворителя над р-ом пропорционально мольной доле раств-ого нелетучего вещ-ва.
Пусть
Тогда
|
|||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
|
|
15. Неполярная связь, полярная связь
Если ковалентная
связь образована одинаковыми атомами,
например H–H,
O=O,
Cl–Cl,
N |
48. Растворы электролитов. Электролитическая диссоциация. Сольватация - взаим м/у молекулами и ионами растворяемого вещ-ва и молекулами растворителя. 1-я стадия: молекулярная диссоциация растворённого вещ-ва. Процесс молекулярной диссоциации: АВ+(n+m)SAB(n+m)S (1) AB(n+m)SАp+nS+Bq-mS (2) Если процесс сольватации протекает до (1), то система представляет собой р-р неэлектролита. Она характеризуется отсутствием ионов в р-ре и не обладает ионной электрической проводимостью. Разб р-ры неэлектролитов подчин законам Рауля, Вант-Гоффа. (Н-р, р-р О, сахара в Н2О). Если процесс протекает до (2), то система является р-ом электролита, т.е. имеет место ЭД с образованием ионов (идея Аррениуса). Уравнение ЭД: АВ+(n+m)SАp+nS+Bq-mS. Процесс ЭД уксусной кислоты в Н2О: СН3СООН+(n+m)Н2ОСН3СОО-•nН2О+Н+ •mН2О. Особенностью сольватов как хим соед явл то, что n и m меняются с изменением параметров р-ра. Пример растворов неэлектролитов-р-ры щелочей, солей в воде. Р-ры электролитов явл ионными проводниками. В них набл отклонения от законов Рауля, Вант-Гоффа. Диссоциация-химич процесс распада молекул на ионы. |
54.Дисперсные системы. Коллоидные растворы. Свойства. Дисперсные системы-системы, в кот 1 вещ-во равномерно распределено в виде частиц в др вещ-ве. Дисперсная фаза-вещ-во, кот рассеяно в среде. Дисперсная среда-вещ-во, кот образует сплошную фазу. 3 вида ДС в зависимости от размеров частиц ДФ: истинные р-ры (R<10-9м, р-ры кислот, щелочей, солей), коллоидные р-ры (10-9<R<10-7), грубодисперсные р-ры (R=10-7, эмульсии, взвеси). Коллоидные растворы - высокодисперсные двухфазные системы, состоящие из ДС и ДФ, причём линейные размеры частиц ДФ[1…100]нм. Коллоидные частицы состоят из большого числа молекул или ионов. Коллоидное состояние хар-но для многих веществ, если их частицы имеют размер [1…500] нм. Суммарная поверхность этих частиц огромна. Характерной особенностью коллоидных частиц явл наличие на их поверхности q, обусловленного избирательной адсорбцией ионов. КЧ имеет сложное строение: ядро, адсорбированные ионы, противоионы, растворитель. Гидрофильные коллоиды - растворитель взаимод с ядрами частиц, гидрофобные коллоиды- растворитель не взаимод с ядрами частиц. Свойства: Оптические. Если рассм путь светового луча, проходящего через КР, сбоку на тёмном фоне, то он становится видимым (конус Тиндаля). Он вызван рассеянием света частицами ДФ и явл следствием коллоидной степени дисперсности этих частиц. При сильном увеличении каждая частица кажется светящейся точкой. Частицы ДФ золей по своим размерам< волн лучей видимого светаони рассеивают свет, но не отражают его. Частицы в грубодисперсных системах отражают свет. Кинетические свойства КР близки кин св-ам истинных р-в. Для КР хар-но движение частиц ДФ, вызываемое беспорядочными ударами со стороны молекул среды, находящихся в тепловом движении. Электрические. 1909 Рейсс набл воздействие const эл тока на диспергированную в Н2О глину: частицы ДФ(глины) перемещались к аноду (электрофорез), где из-за их большого скопления наблюдалось помутнение р-ра. Частицы ДС(Н2О) перемещались к катоду (электроосмос), где наблюдалось повышение уровня прозрачности жидкости. Направленное движение частиц к электродам говорило об их q, причём q(ДФ)=-q(ДС).
|
51. Ионное произведение Н2О. Водородный показатель рН. Процесс диссоциации Н2О: Н2ОН++ОН-, 2Н2ОН+•Н2О +ОН-. Н2О+-ион гидроксония. Кдис=[Н+][ОН-]/[Н2О], [Н+][ОН-] ={Кдис[Н2О]}-ионное произведениеН2О. [Н+]=[ОН-]=СН2О. [Н+]=[ОН-]=1,8*10-10*55,5=10-7(г*ион/л). СН2О=1000/18=55,5 моль/л.[Н+]=[ОН-]=10-7. Ионное произведение Н2О ↑ с ↑t. рН-взятый с обратным знаком десятичный логарифм активности ионов Н в растворе. рН=-lg[H+]=-lgH+. рОН= -lgОH-. Шкала рН: кислые р-ры [Н+]>[ОН-]>10-7; рН<7; щелочная среда [ОН-]>[Н+]>10-7; рН>7; нейтр среда [ОН-]=[Н+]=10-7. Для определения рН: индикаторы-вещ-ва, меняющие свою окраску в определённой области рН раствора; слабые органические кислоты НInd и основания IndOH. НIndH++Ind (равновесие сместится слева направо); IndOHInd++ОН-. рН служит критерием силы кислоты и основания. рН имеет важное значение для жизнедеятельности организма. Отклонение рН от нормальных значений приводит к расстройству деятельности организма.
|
52. Произведение растворимости. Большинство в-в обл ограниченной растворимостью в воде. ВаSO4Ba2++SO2-4. Кдис=[Ba2+][SO2-4]/[ ВаSO4]; Кдис*[ВаSO4]=[Ba2+][SO2-4]-произведение растворимости. ПР малорастворимого электролита равно произведению концентраций ионов данного вещества при стандартной температуре. ??? |
|||||||||||||||||||||||||
|
|
57.Окисление, восстановление. Окисление-процесс отдачи е или повышение степени окисления эл. (Al-3e=Al3+, Н2-2е=2Н+, Zn0-2e=Zn2+).Восстановление-процесс присоединения е или понижение степени окисления эл. (S+2e=S2-, Cl2+2e=2Cl, Fe3++e=Fe2+) Восстановитель-в-во, отдающее е.Окислитель-в-во, принимающее е. Металлы обл восстановительными свойствами. В периодах с ↑порядкового № восстановительные св-ва ,а окислительные ↑ и становятся максимальными у галогенов(в 8 периоде Na-самый активный восстановитель, Cl-самый активный окислитель). У эл гл подгрупп с ↑ порядкового № ↑восстановительные свойства и окислительные. Лучшие восстановители-щелочные металлы, лучшие окислители-галогены. Неметаллы гл подгрупп 4-7 групп могут проявлять и окислит, и восстановит св-ва. Исключение F, кот проявляет тлк окислит св-ва. Элементы побочных подгрупп имеют металлический хар-рих простые вещ-ва явл восстановителями. Важн восстановители: металлы, Н, уголь, СО, HCl, H2S, SO2, H2SO3, FeSO4, глюкоза, катод при электролизе. Важн окислители: галогены, анод при электролизе, H2SO4, KMnO4,O2, O3, HNO3, ионы благородных металлов.
|
58. ОВР. Ионно-электронный метод уравнивания ОВР. ОВР - реакции, протекающие с изменением степени окисления атомов, входящих в состав реагирующих в-в. Степень окисления - кол-во е, перемещённых от 1 атома к др. Окисление - процесс отдачи е или повышение степени окисления эл. Восстановление - процесс присоединения е или понижение степени окисления эл. Межмолекулярные реакции-р-ии, в кот окислитель и восст представляют собой разные вещества. Внутримолекулярные реакцииии-р-ии, в кот окислитель и восст-атомы 1 и той же молекулы: N-22H+14=N02+2H02. В ОВР окисление и восстановление связаны: С+О2=С+4О-22. В некоторых ОВР происходит окисление и восстановление атомов или ионов 1 и того же эл: 3Н2Mn6+O4=2HMn7+O4+Mn4+O2+2H2O. В ОВР наряду с окислителями и восстановителями могут участвовать ионы или мол среды: 5K2S4+O3+2KMn7+O4+3H2S6+O4= 6K2SO4+3H2O+2Mn2+SO4. Ионно-электронный метод уравнивания ОВР. K+2(Cr6+2O2-7)2-+3Na+2(S4+O2-3)2-+4H+2(S6+O-24)2-Cr3+2(SO4)2-3+3Na+2(S6+O2-4)2-+K+2S6+O2-4+4H2О, 14H++(Cr6+2O7)2-+6e2Cr3++7H2O6 1 (S4+O3)2-+H2O-2e(S6+O4)2-+2H+ 3 Полуреакции пишем в соответствии с законом сохранения масс и с учётом числа атомов, кот отдают или присоединяют е. 14H++(Cr6+2O7)2-+3H2O+3(SO3)2- 2Cr3++7H2O+3(SO4)2-+6H+. Уравниваем катионы металлов, которые меняли степень окисления. Уравниваем количество анионов. Правильность подбора проверяем по кислороду. ОВ процессы зависят от рН. Хорошо протекают в нейтральной среде. K(Mn7+O4)-+Na2SO3+H2SO4 Na2SO4+Mn2+(SO4)2-+H2SO4+H2O (pH<7); KMnO4+Na2SO3+H2O Na2SO4+Mn4+O2+KOH (pH7); KMnO4+Na2SO3+KOHNa2SO4+K2(Mn6+O4)2-+H2O (рН>7). |
59. Электродный потенциал. Водородный электрод.
Э р-ом возникает разность потенциалов, кот наз-ся электродным . По мере перхода ионов в р-р растёт –заряд поверхности М и +заряд р-ра , что препятствует окислению М. Также протекает обратная р-я-восстановление ионов М до втомов: М(Н2О)n+m+neМ+mН2О. С увеличением скачка м/у элетродом и раствором Vпр р-ии падает, а обратной растёт. При некотором значении электродного Vпр=Vобр, устанавливается равновесие: ММn++nе. Абсолютные значения электродных экспер определить нельзя. Но можно определить разность электродных для характеристики электродных процессов пользуются относительными значениями электродных . Для этого находят разность измеряемого электрода и электрода, кот усл принимают =0.Водородный электрод состоит из платинированной платины, контактирующей с газообразным Н, находящимся под Р=100кПа, и раствором, в кот активность ионов Н+ =1.ВЭ относится к газовым электродам. Газовые электроды содержат проводники 1-го рода. В качестве проводника 1-го рода в ВЭ служит Pt. При контакте Pt с молекулярным Н происходит адсорбция Н на Pt. Адсорбированный Н, взаимодействуя с молекулами Н2О, переходит в р-р в виде ионов, оставляя в Pt е. При этом Pt заряжается-, а р-р +. Возникает скачок м/у Pt и р-ом. Наряду с переходом ионов в р-р идёт обратный процесс восстановления ионов Н+ с образованием молекул водорода. Равновесие на ВЭ можно представить в виде 2Н++2еН2. |
61.Гальванический элемент Даниэля-Якоби. Элемент Вольта. Состоит из медной пластины, погруженной в р-р CuSO4, и цинковой пластины, погружённый в р-р ZnSO4. Для предотвращения прямого взаимодействия окислителя и восстановителя электроды отделены друг от друга пористой перегородкой. На поверхности цинковой пластины и медной пластины возникает ДЭС и устанавливается равновесие ZnZn2++2e и CuCu2++2е. В результате протекания этого процесса возникает электродный Zn и Cu. цинкового электрода имеет более отрицательное значение, чем медного электродапри замыкании внешней цепи, е будут переходить от Zn к Сu. В рез-те перехода е от Zn к Сu равновесие на Zn электроде сместится вправов р-р перейдёт дополнит кол-во ионов Zn. Одновременно равновесие на Cu электроде сместится влево и произойдёт разряд ионов Cu. При замыкании внешней цепи возникают самопроизвольные процессы растворения Zn на цинковом электроде и выделения Сu на медном электроде. Эти процессы будут продолжаться до тех пор, пока не выравняются электродов или не растворится весь Zn. При работе элемента Даниэля-Якоби протекают процессы: 1)реакция окисления Zn: Zn-2eZn2+. Процессы окисления анодные процессы; аноды-электроды, на кот идут процессы окисления. 2)Р-я восстановления ионов Cu: Cu2++2еCu. 3)Движение е во внешней цепи.4)Движение ионов в р-ре: анионов (SО2-4) к аноду, катионов (Cu2+,Zn2+) к катоду. Движение ионов в р-ре замыкает электрич цепь гальв элемента. Суммарная р-я(токообразующая): Zn+Cu2+=Cu+Zn2+.Схема элемента: ZnZn2+Cu2+Cu.
|
63. Аккумуляторы (кислотные и щелочные).
Аккумуляторы-устройства,
в кот электрич Ехимич
Е и обратно. В аккумуляторах под
воздействием вн источника тока
накапливается химич Е, кот затем
переходит в электрич. Процесс накопления
хим Е называют зарядом, процесс
превращения хим Е в электрич-разрядом.
При заряде ак работает как электролизер,
при разряде-как гальванич элемент.
Наиболее распространёнными явл
свинцовые ак, в кот в кач-ве электролита
используется раствор Н2SO4.
поэтому они наз-ся кислотными.
Электроды кислотного ак обычно
представляют собой свинцовые решётки.
Решётки вначале заполняются оксидом
Pb,
кот при взаим с Н2SО4
превращается в PbSО4.
Электроды разделяются друг от друга
раствором Н2SO4
и пористыми сепараторами. Ак соединяют
в батарею, кот помещается в баки из
эбонита или полипропилена. Суммарная
р-я в аккумуляторе: 2PbSО4+2Н2О Достоинства свинцового ак: 80, высокая ЭДС и относит малое её изменение при разряде, простота и невысокая цена. Недостатки: Небольшая удельная Е, саморазряд ак при хранении и малы срок службы. Применяется в транспортных средствах, электро- и телефонных станциях. Щелочные ак. Самые распростр никель-кадмиевые и никель-железные. + электрод содержит гидроксид Ni, -содержит Cd или Fe. Ионным проводником служит 20-30 р-р КОН. Суммарные р-ии: 2NiOOH+Cd+2H2O2Ni(OH)2+ Cd(OH)2; 2NiOOH+Fe+2H2O2Ni(OH)2+ Fe(OH)2. Достоинства: большой срок службы, высокая механическая прочность. Недостатки: невысокие . Никель-кадмиевые применяются для питания электронной аппаратуры.
|
|||||||||||||||||||||||||
|
|
64. Топливные элементы. Если окислитель и восстановитель хранятся вне элемента и в процессе работы подаются электродам, кот не расходуются, то эл может работать длит время. Такие эл наз-ся топливными. В ТЭ химич Е восстановителя(топлива) и окислителя, непрерывно и раздельно подаваемые к электродам, непосредственно превращается в электрич Е. Удельная Е ТЭ значительно выше Е гальванич эл. В ТЭ используются жидкие или газообразные восстановители (Н, метанол, метан) и окислители, обычно О воздуха. Рассмотрим работу ТЭ на примере кислородно-водородной системы с щелочным электролитом. В таком элементе происходит превращение химич Е р-ии окисления водорода Н2+1/2О2=Н2О в электрич Е. К аноду подводится Н(восстановитель), к катоду-чистый О или О воздуха(окислитель). Схема кислородно-водородного ТЭ: Н2,МКОНМ,О2, где М-проводник 1-го рода, играющий роль cat электродного процесса. На аноде элемента протекает р-я окисления водорода: Н2+2ОН—2е=2Н2О. На катоде восстанавливается кислород: 1/2О2+Н2О+2е=2ОН-. Во внешней цепи происходит движение е от анода к катоду, а в р-ре-движение ионов ОН- от катода к аноду. Суммарная токообразующая р-я: Н2+1/2О2=Н2О. В рез-те протекания этой р-ии в цепи генерируется const ток и химич Е непосредственно превращается в электрич. ТЭ характеризуются ЭДС, U, N, . Снижение поляризации ТЭ достигается применением cat, ↑поверхности электродов, ↑t и концентрации. Особую роль в ТЭ играют электроды, т.к. они определяют поляризацию элемента. В кач-ве cat Электродов ТЭ используются М платиновой группы. ТЭ, работающие при 25-100С, называют низкотемпературными. Ионными проводниками в них служат р-ры КОН, Н3РО4. |
53. Гидролиз солей. Солями называются электролиты, при диссоциации кот образуются катионы металлов и анионы кислотных остатков. Гидролиз солей - разложение солей водой. В результате гидролиза соли в растворе появляется избыточное количество ионов Н+ или ОН-. Гидролизу не подвергается соли, образованные сильными кислотами и сильными основаниями. Гидролиз протекает в 3 случаях: 1). Соль сильного основания и слабой кислоты. Сильные электролиты: кислоты HCl, HNO3, H2SO4; щелочи NaOH, Ca(OH)2, Ba(OH)2. Слабые электролиты: H2CO3, H2S, NH4OH, все основания d-металлов Fe(OH)3, Cu(OH)2. (Na+NaOH, CO32- H2CO3, рН>7) Na+2CO2-3+HOHNaOH+NaHCO3 I-я стадия гидролиза, 2Na2++CO2-3+HOH2Na++OH-+HCO-3, CO3+HOHOH-+HCO-3, NaHCO3+HOHNaOH+H2CO3 II-я стадия гидролиза (H2O и CO2); Na++HCO-3+HOHNa++OH-+H2CO3; HCO-3+HOHH2CO3+OH- (H2O и CO2). Сильное основание+сильная кислотанет гидролиза. KCl гидролизу не подвергается. Т.к. процесс гидролиза обратимый, то он не приводит к выводу продукта. 2). Соль слабого основания и сильной кислоты: (Fe3+Fe(OH)3, Cl-3HCl, pH<7): FeCl3+3HOHFe(OH)3+3HCl, Fe3++3Cl-+3HOHFe(OH)3+3H++3Cl-, Fe3++3HOHFe(OH)3+3H+. 3). Соль слабого основания и слабой кислоты: (Fe3+2Fe(OH)3, S2+3H2S): Fe2S3+3HOH2Fe(OH)3+3H2S↑. Полный необратимый гидролиз. Соли слабого основания и сильной кислоты в растворе не существуют, т.к. происходит полное гидратическое разложение. |
43. Свойства растворов. {К общим св-ам р-в относятся давления насыщенного пара растворителя нал р-ом и t замерзания, ↑t кипения и осмотическое давление.} По мере ↑концентрации растворённого вещ-ва ↑отклонения от з-в идеальных растворовбыло предложено сохранить для описания свойств растворов все общие закономерности, применимые к идеальным растворам, но вместо входящих в них концентраций компонентов ввести активности. Связь активности с концентрацией: =c, где -коэф активности, кот учитывает все виды взаимодействия частиц в данном р-ре, приводящие к отклонению от свойств идеальных р-в. сами по себе не раскрывают природу процессов, протекающих в реальных системах, тлк позволяют рассчитать реальные св-ва р-в. Общие св-ва р-в выражаются законами Рауля и Вант-Гоффа. В реальных р-ах вместо концентрации используется активность. |
50. Активность растворов электролитов, ионная сила. По мере ↑концентрации растворённого вещ-ва ↑отклонения от з-в идеальных растворовбыло предложено сохранить для описания свойств растворов все общие закономерности, применимые к идеальным растворам, но вместо входящих в них концентраций компонентов ввести активности. Связь активности с концентрацией: =c, где -коэф активности, кот учитывает все виды взаимодействия частиц в данном р-ре, приводящие к отклонению от свойств идеальных р-в. =экспериментальная величина/теоретическая величина. Метод вычисления по экспериментальным данным позволяет определить значения средних электролита. Нет методов экспериментального определения отдельных ионов. При расчётах принимают, что средний коэф активности представляет собой ср геометрич коэф активности образующих его ионов. Для электролита АnВm:
+-=
зависит от
природы растворителя и растворённого
вещ-ва, от концентрации р-ра, от t.
меняется в оч широких пределах: в обл
разб р-в 1,
в обл высококонц р-в
достигает 1,10,100. В обл разб р-в (0,1
моль/л)
зависит от концентрации и q
ионов, присутствующих в р-ах и мало
зависят от природы растворённых в-в.
Эти закономерности наз-ся правилом
ионной силы.
Согл этому правилу, ионы одинаковой
зарядности, независимо от их природы,
в разб р-ах с одинаковой ионной силой
имеют равные .
Ионной силой р-ра наз-ся полусумма
произведений концентраций всех ионов,
присутствующих в р-ре, на квадрат их
q:
I=0,5 |
46. II-ой закон Рауля-криоскопия, эбулиоскопия. Антифризы. Определение молярной массы вещ-ва. 1)t кипения ратвора выше t кип-ия растворителя. Это обусловлено тем, что давление пара растворителя над раствором = внешнему давлению при более высокой t, чем в случае чистого растворителя. Повышение t кипения пропорционально моляльности раствора:
где Эб-ая константа хар-ет t кипения одномоляльного раствора. Составим пропорцию:
2)Жидкость замерзает, если давление пара над кристаллами = внешнему давлению. Понижение t замерзания пропорционально моляльности раствора:
где
Составим пропорцию:
Тогда
Антифризы-незамерзающие жидкости.
|
|||||||||||||||||||||||||
|
49. Степень диссоциации, константа диссоциации, изотонический коэффициент.
Степень
диссоциации
-отношение
числа молекул, диссоциированных на
ионы, к общему числу молекул растворённого
электролита. В р-ах некоторых электролитов
диссоциирует тлк часть молекул. Для
количественной хар-ки ЭД введено
понятие степени диссоциации. По
в растворах электролиты : на 2 группы:
=1
и почти не зависит от конц раствора -
сильные электролиты (кислоты
HCl,
HNO3,
H2SO4;
щелочи NaOH,
Ca(OH)2,
Ba(OH)2,
LiOH,
большинство солей); <1
и
с ростом концентрации -
слабые электролиты (H2CO3,
H2S,
NH4OH,
Н2О;
основания p-,d-,
f-элементов).
Одно и то же вещ-во в 1 растворителе
может проявлять св-ва сильного, а в др
- слабого электролита. Н-р, хлорид Li
и йодит Na
при растворении в Н2О
ведут себя как сильные электролиты,
а при растворении в ацетоне или в
уксусной кислоте эти вещ-ва явл слабыми
электролитами.
зависит от концентрации и от t.
С
концентрации ↑,
с ↑t
↑.
Константа
диссоциации
Кд -константа
равновесия для процесса диссоциации.
Для процесса диссоциации кислоты
НАН++А-
Рассм
зависимость
от концентрации слабого электролита
на примере уксусной кислоты:
СН3СООНСН3СОО-+Н+.
Принимая исх концентрацию кислоты
равной с, и степень диссоциации =,
получаем, что концентрация части
кислоты, кот диссоциирована, будет
=с.
Т.к. при диссоциации 1 молекулы кислоты
образуется по 1 иону Н+
и СН3СОО-,
то их концентрации будут =с.
Концентрация кислоты, оставшейся в
недиссоц состоянии, будет равна
с-с=с(1-).
Подставим значения равновесных
концентраций ионов и кислоты в (*):
|
47.Осмос. Закон Нернста. Значение его для живых организмов. Осмос - односторонняя диффузия молекул ч/з полунепроницаемую перегородку. Количественно осмос хар-ся осм-им давлением, равным силе, приходящейся на единицу площади поверхности, и заставляющей молекулы вещ-ва проникать ч/з полунепроницаемую перегородку. Оно равно давлению столба жидкости высотой h. При равновесии внешнее давление уравновешивает осмотическое давление. В этом случае скорости прямого и обратного переходов молекул ч/з полунепроницаемую перегородку становятся одинаковыми.
Допустим, нам
даны раствор и растворитель. Если
внешнее давление, приложенное к более
концентрированному раствору, ↑
осмотического
Осмос играет очень важную роль в биологических процессах, обеспечивая поступление воды в клетки и др. структуры. Растворы с одинаковым осм-им давл. наз-ся изотоническими. Если осм-ое давл-е выше внутриклеточного, то оно наз-ся гипертоническим, если ниже внутриклеточного – гипотоническим.
Гипертонические
рас-ры сахара(сироп) и соли (рассол)
широко применяются для консервирования
продуктов, т.к. вызывают удаление воды
из микроорганизмов. Если в сосуде
растворяется к-л вещ-во в двух
несмешивающихся м/у собой жидкостях,
то соблюдается закон распределения
Нернста-Шилова, согласно кот при const
t
соотношение равновесных концентраций
м/у несмешивающимися жидкостями
(фазами) яв-ся величиной const,
независимой от общего кол-ва
компонентов:
|
55. Золи, гели, лиофильные, лиофобные коллоиды.
Коллоидное
состояние характерно для многих вещ-в,
если их частицы имеют размер от 1 до
500 нм. Суммарная поверхность этих
частиц огромна. Поверхностный слой
хар-ся поверхностной энергией и
способностью адсорбировать те или
иные частицы, в том числе ионы из
раствора. Характерной особенностью
коллоидных частиц яв-ся наличие на их
поверхности заряда, обусловленного
избирательной адсорбцией ионов.
Коллоидная частица имеет сложное
строение. Она включает в себя ядро,
адсорбированные ионы, противоионы и
растворитель. Существуют лиофильные
(гидрофильные) коллоиды,в кот-ых
растворитель взаимодействует с ядрами
частиц, и лиофобные (гидрофобные)
коллоиды, в кот-ых растворитель не
взаимодействует с ядром частиц.
Лиофильные коллоидные растворы
приближаются по св-ам к истинным
растворам. Это, как правило, золи
органического происхождения. Коллоидные
растворы большинства неорганических
вещ-в имеют лиофобный хар-р. Коллоидный
раствор наз-ся золем. При длительном
хранении гидрофильные золи переходят
в особое «студнеобразное» коллоидное
состояние. В таком виде их называют
гелями. Структура геля такова, что
мицеллы не разрушаются, а просто
связываются друг с другом, образуя
своеобразные ячейки, впутри кот
сохраняетя среда
Примером гидрофильного золя может служить золь желатина. При набухании в воде твердого золя желатина образуется гель. При нагревании геля образуется золь. Все процессы обратимы:
Золь Процесс перехода геля в золь наз-ся пиктизацией. Пиктизация присуща только лиофильным коллоидам.
|
56.Строение мицеллы коллоидов. Оптические и электрические св-ва. Ядро ч-цы состоит из электронейтрального агрегата ч-ц с адсорбированными ионами элементов, входящих в состав ядра. Кол-ая ч-ца кроме ядра имеет противоионы и молекулы растворителя. Адсорбированные ионы и противоионы с растворителем образуют адсорбированный слой. Суммарно q частицы = разности q адсорбированных ионов и противоионов. Вокруг частиц находится диф-ый слой ионов,q кот = заряду коллоидной частицы. Кол-ая ч-ца и диф-ый слой образуют электронейтральную мицеллу. Оптические св-ва. Если рассматривать путь светового луча, проходящего ч/з прозрачный кол-ый раствор, то он становится видимым. Этот опт-ий эффект наз-ся конусом Тиндаля. Он вызывается рассеянием света частицами дисперсной фазы коллоидного раствора и яв-ся следствием коллоидной степени дисперсности этих частиц. При сильном увеличении каждая частица в конусе Тиндаля кажется светящейся точкой. Размеры и форму частиц нельзя установить, можно лишь подсчитать их число. Частицы дисперсной фазы золей по своим размерам меньше волн лучей видимого светаони интенсивно рассеивают свет, но не отражают его. Частицы в грубодисперсных системах отражают свет, их величину и форму часто можно установить без оптического увеличения. Эффект Тиндаля можно наблюдать в темноте при прохождении луча света ч/з запыленное и накуренное помещение. Электрические св-ва .В 1909 г. Рейсс наблюдал воздействие постоянного эл. тока на диспергированную в воде глину и на этом основании описал эл. св-ва коллоидных растворов. Частицы дисперсной фазы (глины) перемещались к аноду, где вследствие их большого скопления наблюдалось помутнение раствора. Частицы дисперсной среды (воды) перемещались к катоду, где наблюдалось ↑уровня прозрачной жидкости. Направленное движение частиц к электродам говорило об их q, причем стало ясным, что дисперсная фаза несет на себе q, противоположный по знаку q среды. Движение частиц дисперсной фазы к одному из электродов при пропускании ч/з золь const эл. тока получило название электрофореза, а движение частиц дисперсной среды-электроосмоса. Электрофорез и электроосмос обусловлены наличием разноименного q у частиц дисперсной фазы и дисп-ой среды. На границе раздела фаз возникает двойной эл-ий слой, состоящий из тонкой (адсорбционной) части и протяженной диффузной части. М/у фазами возникает разность потенциалов (электротермодинамический потенциал).Часть скачка потенциала,обусловленная диф-ым слоем, наз-ся электрокинетическим или дзета-пот-ом. Эл-кин-ий пот-ал определяется толщиной и зарядом диффузного слоя, кот зависят от концентрации и q противоионов и t.
|
|
||||||||||||||||||||||||||

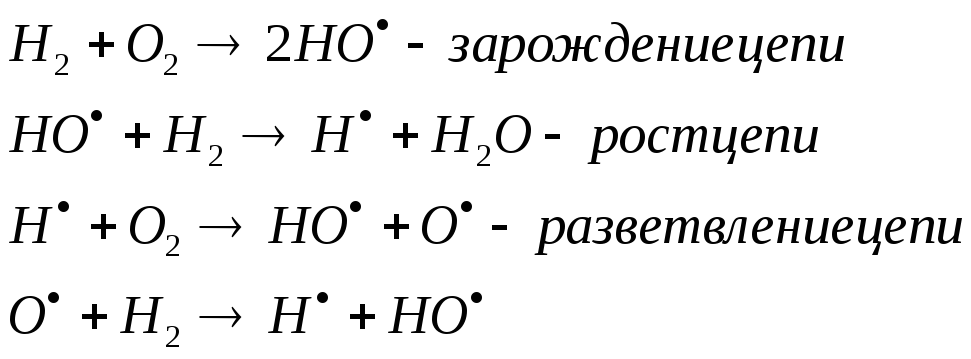 Затем возникшие
радикалы вызывают удвоение новых
радикалов, скорость р-ии резко возрастает
и происходит взрыв.
Затем возникшие
радикалы вызывают удвоение новых
радикалов, скорость р-ии резко возрастает
и происходит взрыв.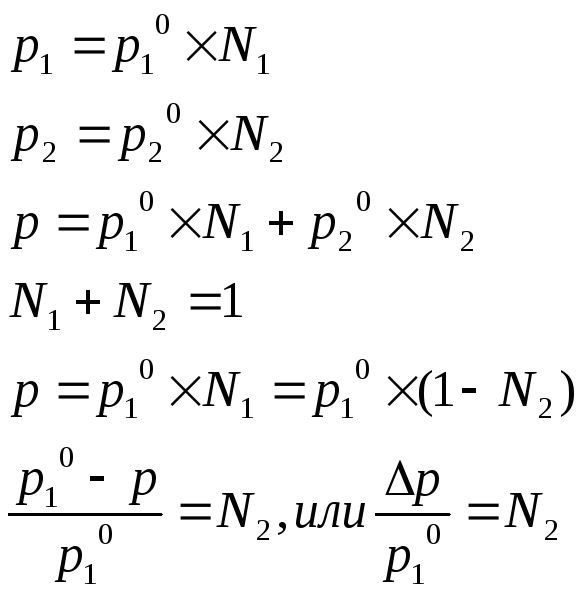
 лектродный
потенциал - ,
устанавливающийся в условиях равновесия
электродной р-ии. В узлах крист решётки
М расположены ионы, находящиеся в
равновесии со свободеыми е: М+•еМ++е.
При погружении М в р-р начинается
взаимод М с компонентами р-ра.Наиболее
важной явл р-я поверхностных ионов
М, находящихся в узлах решётки, с
полярными молекулами Н2О.
В рез-те взаим-я происходит окисление
М и его гидратированные ионы переходят
в р-р,оставляя в М е, заряд кот не
скомпенсирован +заряженными ионами
в М: М+mН2ОМ(Н2О)n+m+ne.
М становится заряженным -, а р-р +.
+заряженные ионы из р-ра притягиваются
к -заряженной поверхности М. На границе
М-р-р возикает ДЭС. М/у М и
лектродный
потенциал - ,
устанавливающийся в условиях равновесия
электродной р-ии. В узлах крист решётки
М расположены ионы, находящиеся в
равновесии со свободеыми е: М+•еМ++е.
При погружении М в р-р начинается
взаимод М с компонентами р-ра.Наиболее
важной явл р-я поверхностных ионов
М, находящихся в узлах решётки, с
полярными молекулами Н2О.
В рез-те взаим-я происходит окисление
М и его гидратированные ионы переходят
в р-р,оставляя в М е, заряд кот не
скомпенсирован +заряженными ионами
в М: М+mН2ОМ(Н2О)n+m+ne.
М становится заряженным -, а р-р +.
+заряженные ионы из р-ра притягиваются
к -заряженной поверхности М. На границе
М-р-р возикает ДЭС. М/у М и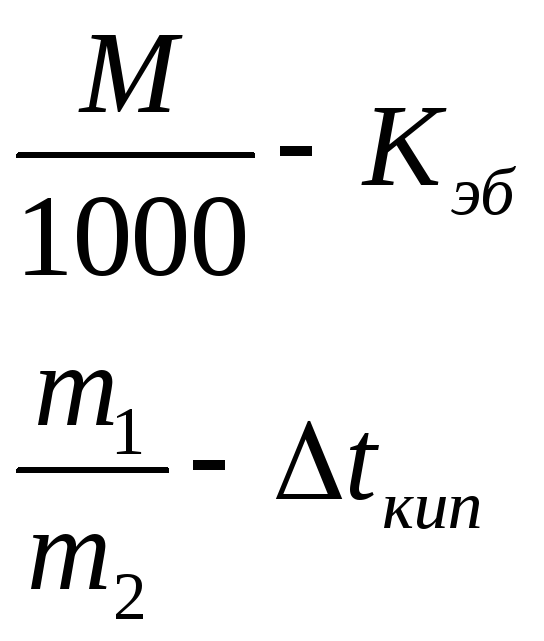 ,
где
,
где
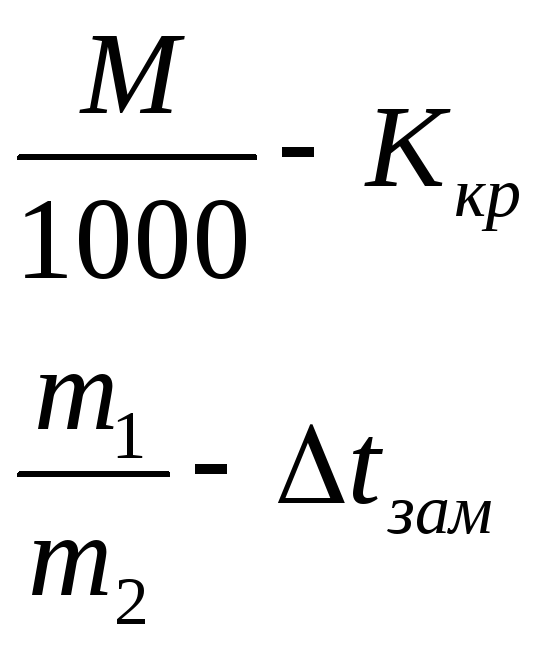
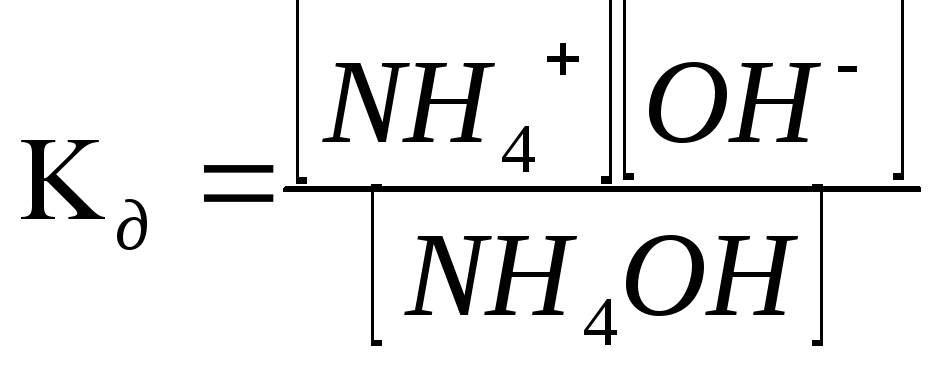 .
Кд
зависит от природы диссоциирующего
вещ-ва и растворителя и не зависит от
концентрации р-ра. Кд
указывает
на прочность молекул в р-ре. Чем
Кд
в данном растворителе, тем слабее
диссоциирует электролит, тем его
молекулы устойчивее. Многоосновные
слабые кислоты и основания диссоциируют
ступенчато, причём Кд
по каждой следующей ступени всегда
на несколько порядков ниже, чем по
предыдущей. В Ур-е =сRT
Вант-Гофф ввёл поправочный коэф i,
называемый изотоническим
коэффициентом
и позволяющий использовать это ур-е
для
разб р-в: осм=
iсRT.
i
хар-ет отклонение от законов идеальных
р-в вследствие электролитической
диссоциации электролитов.
.
Кд
зависит от природы диссоциирующего
вещ-ва и растворителя и не зависит от
концентрации р-ра. Кд
указывает
на прочность молекул в р-ре. Чем
Кд
в данном растворителе, тем слабее
диссоциирует электролит, тем его
молекулы устойчивее. Многоосновные
слабые кислоты и основания диссоциируют
ступенчато, причём Кд
по каждой следующей ступени всегда
на несколько порядков ниже, чем по
предыдущей. В Ур-е =сRT
Вант-Гофф ввёл поправочный коэф i,
называемый изотоническим
коэффициентом
и позволяющий использовать это ур-е
для
разб р-в: осм=
iсRT.
i
хар-ет отклонение от законов идеальных
р-в вследствие электролитической
диссоциации электролитов.