
8542
.pdf
71
Рис. 1. Внутреннее строение беззубки Anodonta sp. (вид слева)
1 – пищевод; 2 – передний аддуктор; 3 – ротовое отверстие; 4 – нога; 5 – кишка; 6 – правая мантийная складка; 7 – предсердие; 8 – правая жабра; 9 – правая почка; 10 – задний аддуктор; 11 – вводящий сифон; 12 – анальное отверстие; 13 – выводящий сифон; 14 – клоакальная камера; 15 – прямая кишка; 16 – спинной мантийный канал; 17 – задний ретрактор ноги; 18 – спинное мантийное отверстие; 19 – задняя аорта; 20 – артиовентрикулярный клапан; 21 – желудочек; 22 – полость перикардия; 23 – передняя аорта; 24 – печеночный проток; 25 – пилорическое отверстие желудка; 26
– желудок; 27 – отверстие печеночного протока; 28 – печень.
Определение содержания МТ методом радиоактивных индикаторов проводят по методике D. L. Eaton и М. G. Cherian с модификацией Б.И. Сынзыныса. Количество (М) МТ (мкг/г) определяют по формуле:
(1)
где К- кратность разбавления образца; 17,8 - коэффициент; т - масса навески органа или ткани, г; А, К, С- количество распадов в пробе, контроле и стандарте соответственно.
Если содержание МТ в тканях равно 2-3 мкг/г ткани моллюска, это свидетельствует о чистой воде на данном участке водоема.
72
Более высокое удельное содержание говорит о постоянном наличии в воде тяжелых металлов.
Внимание! Концентрация и активность меченого вещества столь мала (0,1 % индикаторного реагента в воде при активности рабочего раствора 40 кБк/мл), что не требует создания особых условий безопасности для работы. Нельзя допускать попадания раствора в рот или на поверхность слизистых глаза; также следует тщательно собирать остатки раствора и отходы от опыта (неиспользованные части тел моллюсков) в контейнер и сдавать их на утилизацию.
Цель работы — определение удельного содержания МТ в мягких тканях двухстворчатых моллюсков, культивируемых в воде с солями тяжелых металлов.
Оборудование, материалы и реактивы:
аквариумы с отстоянной водопроводной водой, не содержащей и содержащей CdCl2 в концентрации 0,2 мг/л; беззубки или перловицы размером примерно 5— 10 см; индикаторный реагент l09CdCl2 в 0,01 М трис-HCl буфере, рН 7,4 — 8,2 ( суммарная концентрация Cd2+ в смеси
— 2,0 мкг/мл, радиоактивность — 40,0 кБк/мл); 2 %-й гемоглобин кролика; водяная баня; холодильник; центрифуга; гамма-счетчик.
Порядок выполнения лабораторной работы
1.Получить у преподавателя моллюсков, культивируемых в контрольной воде и загрязненной солями Cd в течение разного времени.
2.Извлечь жабры, печень, почки, мантию.
3.Гомогенизировать органы в стеклянном гомогенизаторе Поттера в 0,01 М трис-HCl буфере.
4.Гомогенат прогреть на кипящей водяной бане в течение 3 мин и быстро охладить во льду до 4оС. Затем сразу центрифугировать При 10000g в течение 20 мин.
5.К 0,1 мл 0,01 М трис-HCl буфера, добавить 0,1 мл индика-
торного реагента l09CdCl2. Затем добавить 0,2 мл пробы, перемешать и инкубировать 10 мин при комнатной температуре.
6.Внести 0,1 мл 2 %-го гемоглобина кролика, перемешать, прогреть на кипящей бане 3 мин, охладить во льду. Эту операцию провести еще дважды.
7.Далее центрифугировать 8 мин при 7 000 об/мин на высокоскоростной центрифуге.
8.0,2 мл супернатанта после центрифугирования перенести в пробирки для счета и измерить радиоактивность на гамма-счетчике
("Весктап PU5500", США).
73
9.Для каждой серии измерений провести анализ "контрольной" пробы (вместо исследуемой на МТ пробы вносят буфер) и общей активности (вместо исследуемой пробы и гемоглобина вносят буфер).
10.Рассчитать количество МТ в каждой пробе по формуле (1).
11.Сделать вывод о влиянии солей Cd в концентрации 0,2 мг/л на
количество МТ в мягких тканях моллюсков по сравнению с контрольным уровнем.
Лабораторная работа №14
ОЦЕНКА ПОТЕНЦИАЛЬНОЙ ОПАСНОСТИ ХИМИЧЕСКИХ ВЕЩЕСТВ ПО ИХ СПОСОБНОСТИ СНИЖАТЬ
ФИЛЬТРАЦИОННУЮ АКТИВНОСТЬ ГИДРОБИОНТОВ.
74
В формировании качества воды, ее очищении в водных экосистемах участвуют многие физические, химические и биологические процессы. Среди примеров как наиболее важные можно привести процессы окисления органического вещества и фильтрацию воды гидробионтами.
Анализ фильтрационной активности некоторых групп гидробионтов (асцидий, усоногих раков, мшанок, иглокожих, двустворчатых моллюсков, полихет, губок) показывает, что скорость фильтрации обычно составляет от 1 ло 8,8 л в час в расчете на 1 г обеззоленной сухой массы тела. Более детальный анализ зависимости скорости фильтрации от массы гидробионта показал, что она имеет вид степенной функции. Суммарная фильтрация воды популяциями макробеспозвоночных (моллюсков, асцидий, полихет) оценивается величинами 1 – 10 м3 на 1 м2 дна водной экосистемы за сутки.
Данная работа содержит изложение новой методики биотестирования на гидробионтах - фильтраторах - двустворчатых моллюсках.
Принцип метода заключается в том, что моллюски в процессе фильтрации извлекают из воды одноклеточные организмы, что ведет к снижению оптической плотности (OD) воды в сосуде с моллюсками. Регистрация изменений оптической плотности позволяет характеризовать скорость фильтрационной активности и возможное торможение ее при воздействии изучаемого вещества, которое добавляют в воду.
Оборудование и материалы:
моллюски; спектрофотометр (счетчик Култера); весы; термометр для воды; шесть сосудов на 500 мл; сосуды для отстаивания воды; суспензия клеток одноклеточных организмов (одноклеточные водоросли, цианобактерии, дрожжи); исследуемое вещество.
Порядок выполнения лабораторной работы
1. В сосуды 1 – 5 внести одинаковое количество моллюсков.
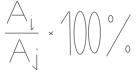
75
Первый сосуд использовать в качестве контроля 1.
Внимание! Предварительно с помощью взвешивания подобрать моллюсков так, чтобы биомасса (сырой вес) во всех сосудах была приблизительно равна 20 – 200 г сырого веса вместе с раковинами.
2.В сосуд 6 внести только суспензию одноклеточных организмов и использовать в качестве контроля 2.
3.Во все сосуды добавить по 500 мл воды (пресной для пресноводных моллюсков, морской – для морских).
4.Провести предварительную инкубацию в течение 1 ч для стабилизации условий при температуре 16 – 26 оС.
5. В сосуды 2 – 5 добавить исследуемое вещество в
концентрациях 0,1; 1; 10 и 100 ПДК (см табл 2. в методических указаниях " Экологическая диагностика факторов окружающей среды с помощью животных") Затем одновременно во все сосуды добавить концентрированную суспензию одноклеточных организмов (при использовании дрожжей рекомендуется начальная концентрация в сосудах 20 – 120 мг/л по сухому весу; при использовании водорослей 1 – 6 млн клеток в 1 мл).
6. С периодичностью в несколько минут измерять оптическую плотность во всех сосудах при одной и той же длине волны. Для дрожжей длина волны 500 или 550 нм; для водорослей и цианобактерий длина волны должна соответствовать длинноволновому максимуму поглощении хлорофилла (665 нм). Период проведения измерений обычно составляет 30—60 мин. Данные оптической плотности занести в таблицу.
7. Для каждого момента времени и каждой концентрации исследуемого вещества рассчитать эффективность ингибирования изъятия клеток из воды (ВЭИ) по формуле:
ВЭИ=
76
где Аi - оптическая плотность в сосудах с исследуемым веществом в определенной концентрации; Aj — оптическая плотность в сосуде с моллюсками без исследуемого вещества.
Поскольку обычно исследуется вещество, способное ингибировать фильтрацию, в сосудах с исследуемым веществом оптическая плотность выше и ВЭИ больше 100%. Результаты занести в таблицу.
Оценка потенциальной опасности химического вещества по его способности снижать фильтрационную активность гидробионтов
|
|
Оптическая |
|
|
|
|
|
||
|
плотность при |
|
ВЭИ, % при исследуемых |
||||||
|
исследуемых |
|
концентрациях |
|
|||||
Тестируемый образец |
концентрациях |
|
токсичного вещества (в |
||||||
|
токсичного вещества |
ПДК) |
|
|
|
||||
|
(в ПДК) |
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
0,1 |
|
1 |
10 |
100 |
0,1 |
1 |
10 |
100 |
|
|
|
|
|
|
|
|
|
|
Контроль (вода из при- |
|
|
|
|
|
|
|
|
|
родного источника) |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Исследуемое токсичное |
|
|
|
|
|
|
|
|
|
вещество |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Токсичность вещества |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
8. Сделать выводы о токсичности исследуемого вещества.
Внимание! При отсутствии спектрофотометра можно использовать ФЭК или счетчик Култера. Вместо регистрации оптической плотности
Лабораторная работа № 15
77
ОЦЕНКА ТОКСИЧНОСТИ ВОДЫ ПО ФИЛЬТРАЦИОННОЙ АКТИВНОСТИ ДАФНИЙ, РЕГИСТРИРУЕМОЙ С ПОМОЩЬЮ ФЛУОРЕСЦЕНЦИИ ХЛОРОФИЛЛА МИКРОВОДОРОСЛЕЙ
Дафниевый тест, основанный на оценке выживаемости, плодовитости и качества потомства в исследуемых пробах воды, относится к числу основных при нормировании качества природных и сточных вод во многих странах мира. Одной из первичных реакций дафний на действие токсикантов является уменьшение активности их питания, происходящее задолго до возможной гибели рачков. Высокочувствительным является метод слежения за изменением флуоресценции хлорофилла микроводорослей, которыми питаются дафнии. Это позволяет по выходу постоянной флуоресценции (Fo) в течение 1 – 2 мин определить концентрацию водорослей в пробе в диапазоне от 1 тыс кл./мл до 5 млн кл./мл по калибровочной кривой.
В настоящее время для этих целей используют флуориметры, {разработанные в России (в частности, на кафедре биофизики биологического факультета МГУ), а также зарубежными фирмами (в частности, ТоксиРАМ фирмы Walz GmbH, Германия).
Предлагаемая методика основана на использовании скорости фильтрации пищи (микроводорослей) дафниями, рассчитываемой по уменьшению флуоресценции водорослей в пробе в процессе выедания их рачками; методика удобна для быстрой предварительной оценки токсичности воды.
Оборудование, материалы, объекты:
флуориметр, стеклянные стаканчики объемом 50 мл, используемые в качестве садков для дафний; автоматическая пипетка на 1 мл с расширенным носиком для отлова дафнии, вода из природного источника; лабораторные культуры ветвистоусых рачков-фильтраторов Daphnia magna, выращиваемых по методике, приведенной в лабораторной работе № 8 методических указаниях "Экологическая диагностика факторов окружающей среды с помощью
78
животных".Кормом для дафний служит отмытая от среды и сконцентрированная культура зеленой водоросли Chlorella vulgaris, выращиваемая по методике, приведенной в лабораторной работе № 8 методических указаниях "Экологическая диагностика факторов окружающей среды с помощью животных".
Порядок выполнения лабораторной работы
1.В стеклянные стаканчики-садки налить по 50 мл исследуемой пробы воды из природного источника, а также воду, используемую для культивирования рачков (контрольная проба). Все в трех повторностях.
2.В каждый стаканчик отсадить по 5 дафний 6 — 8- дневного возраста (длиной примерно 3 — 4 мм), осторожно отобранных автоматической пипеткой (либо стеклянной пипеткой) из культуры.
Примечание. При хорошем навыке в пробу попадает не более 1 – 1,5 мл среды культивирования дафний.
3.Оставить дафний в садках на сутки. Корма не добавлять. Суточное голодание приводит, с одной стороны, к увеличению скорости фильтрации, с другой — к уменьшению разброса получаемых результатов.
4.После суточного выдерживания из садка осторожно отлить воду (объем воды в садках должен составить 25 мл).
5.Отобрать пробу воды (3 мл) в кварцевую кювету и измерить
фоновую флуоресценцию (Iф) на флуориметре. Результаты занести в таблицу.
Оценка токсичности природной воды по фильтрационной активности
79
Daphnia magna
Тестируемый |
|
Iф |
|
|
|
Io |
|
|
|
It |
|
|
|
повторности |
повторности |
среднее |
повторности |
среднее |
F |
||||||||
образец |
|||||||||||||
1 |
2 |
3 |
1 |
2 |
3 |
значение |
1 |
2 |
3 |
значение |
|
||
|
|
||||||||||||
Контроли: |
|
|
|
|
|
|
|
|
|
|
|
|
|
отстоянная |
|
|
|
|
|
|
|
|
|
|
|
|
|
водопроводная |
|
|
|
|
|
|
|
|
|
|
|
|
|
вода с |
|
|
|
|
|
|
|
|
|
|
|
|
|
дафниями |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
исследуемая |
|
|
|
|
|
|
|
|
|
|
|
|
|
вода без |
|
|
|
|
|
|
|
|
|
|
|
|
|
дафний |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Суспензия |
|
|
|
|
|
|
|
|
|
|
|
|
|
донных |
|
|
|
|
|
|
|
|
|
|
|
|
|
отложений или |
|
|
|
|
|
|
|
|
|
|
|
|
|
почв |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Вода из |
|
|
|
|
|
|
|
|
|
|
|
|
|
природного |
|
|
|
|
|
|
|
|
|
|
|
|
|
источника |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
6.Добавить в садок суспензию водорослей до плотности около 100 тыс. кл./мл, осторожно взболтать садок для равномерного распределения водорослей по объему.
7.Отобрать из садка пробу (3 мл) и измерить флуоресценцию в
начальный момент времени (Io). Отобранную пробу вновь вернуть в садок.
8.Аналогичные операции провести с остальными садками, содержащими дафний.
9.Кроме контроля с дафниями следует поставить контрольный стаканчик с исследуемой жидкостью, но без дафний — для оценки собственных изменений флуоресценции водорослей и внесения при расчетах соответствующих поправок.
Примечание. Для сведения этих изменений до минимума садки во время эксперимента должны быть помещены в затемненное место.
10. Через 30 мин после внесения корма садки можно повторно взболтать.
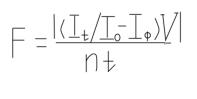
80
11. Через 1 ч садки следует осторожно взболтать, отобрать пробу воды из каждого садка (по 3 мл) и измерить флуоресценцию в конечный момент времени(It) Результаты занести в таблицу.
Она должна быть меньше начального значения в результате выедания водорослей рачками.
12. Рассчитать скорость фильтрации (F) пищи дафниями по формуле
Где V – общий объем пробы (25 мл); n – количество дафний в пробе (5 экз.); t – время опыта (1 ч); It/Io – коэффициент, соответствующий интенсивности флуоресценции в конечный (It) и начальный (Io) момент опыта. Величина F (мл/даф.ч) обозначает объем воды, профильтрованный дафнией в единицу времени. У 6 – 8 суточных дафний значение F в среднем составляет 3 – 4 мл/даф.ч; более низкие значения свидетельствуют о неблагоприятных для дафний условиях инкубирования (интоксикация).
Максимальные концентрации веществ, обнаруживаемые данным методом в суточных опытах, близки к ПДК этих веществ, установленным для рыбохозяйственных водоемов.
Лабораторная работа № 16
