
7273
.pdf
|
KP |
|
H |
|
1 |
|
1 |
|
|
lg |
|
2 |
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
K |
P1 |
|
2.303R T |
|
T |
|
||
|
|
|
|
|
2 |
|
1 |
|
|
7.Рассчитайте температуру, при которой давление паров воды в установке будет равно 760 мм рт.ст.
8.Напишите вывод.
3.3 Лабораторная работа №3 Влияние концентрации катализатора на скорость реакции
Цель работы: изучить влияние концентрации катализатора (K2Cr2O7) на скорость разложения пероксида водорода (Н2О2).
Под катализом понимается ускорение или замедление реакций под влиянием специальных веществ – катализаторов. При этом катализатор не расходуется в процессе реакции. Его молекулы многократно вступают в промежуточное взаимодействие с молекулами реагирующих веществ и восстанавливаются после каждого акта взаимодействия. Поэтому требуемое количество катализатора обычно во много раз меньше (в десятки и сотни тысяч раз и более), чем реагирующих веществ.
Суть влияния катализатора объясняется тем, что он с молекулами реагирующих веществ образует некое соединение, которое называется активированным комплексом. В последующем этот активированный комплекс очень быстро вступает в реакцию с образованием продукта реакции и свободного катализатора. Ускорение реакции в присутствии катализатора объясняется резким снижением энергии активации по сравнению с исходным, без участия катализатора, и, соответственно, увеличением доли активных молекул. Катализаторы – более мощное средство ускорения реакций, чем температура. Катализаторы действуют обычно очень специфично. Определенный катализатор ускоряет только конкретные реакции, не влияя на другие, которые также могут проходить с участием тех же веществ. Это свойство катализаторов называется
селективностью, или избирательностью. Различают гомогенный и гетерогенный катализ.
При гомогенном катализе реагирующие вещества и катализатор находятся в одной фазе (обычно в растворе).
При гетерогенном катализе катализатор находится в другой фазе, и химическая реакция протекает на границе раздела фаз.
Выполнение работы
Чистый Н2О2 разлагается медленно, но реакция сильно ускоряется в присутствии солей металлов переменной валентности, таких как железо, хром, марганец и др.
Н2О2 (ж) = Н2О(ж) + ½ О2 (г)
Разложение при комнатной температуре описывается уравнением реакции первого порядка. Скорость реакции проще всего измерять по объему выделяющегося кислорода.
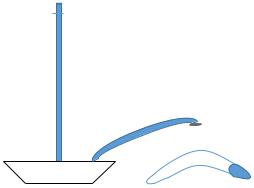
Исследования проводятся на установке, изображенной на рис.4.
21
3- 
2 -
 - 1
- 1
Рисунок 4 - Установка для изучения скорости разложения пероксида водорода.
Установка состоит из реакционного сосуда (1), закрытого резиновой пробкой с газоотводной трубкой, бюретки (2) для сбора газа, крана (3).
Порядок выполнения работы
1.8 мл 1%-го раствора пероксида водорода заливаем в длинное колено сосуда, а в короткое колено сосуда заливается 6 мл 1%-го раствора катализатора K2Cr2O7, не допуская попадание раствора катализатора в колено с Н2О2. Сосуд осторожно закрываем резиновой пробкой, соединенной с газоотводным шлангом.
2.Заполняем бюретку (2) водой до нулевой отметки.
3.Смешать раствор катализатора и пероксида водорода, когда в бюретке появится первый пузырек газа включить секундомер. Выделяющийся в результате реакции кислород будет вытеснять жидкость в бюретке, понижая её уровень. Не прекращая перемешивание реакционной смеси, через каждые 0,5 минуты определяем объем выделившегося кислорода. Результаты заносим в таблицу 2. Измерения прекращаются после того как скорость выделения сильно замедлится.
4.После окончания первого опыта провести еще один, с меньшей концентрацией катализатора. Для этого во втором опыте в короткое колено сосуда заливается 4 мл раствора катализатора и 2 мл воды. Таким образом, концентрации катализатора
K2Cr2O7 в опытах будут соответственно 1% и 0,67%.
Таблица 2 - Влияние концентрации катализатора на скорость разложения пероксида водорода.
Время реакции, |
Объем выделившегося |
|
|
|
|
|
|
|
t (мин) |
кислорода Vt (мл) к |
|
|
∞ |
|
|
Примечания |
|
|
моменту времени t |
|
|
− |
|
|||
|
|
|
|
|||||
|
|
|
∞ |
|
|
|
||
|
(мин) |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Опыт 1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
0,5 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Со= 1% |
1,0 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Ск = 1% |
1,5 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
V∞= ….. |
2,0 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
2,5 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
3,0 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
22
3,5 |
|
|
|
|
|
|
|
…… |
|
|
|
|
|
|
|
Опыт 2 |
|
||
|
|
|
Со= 1% |
0,5 |
|
|
|
|
|
|
Ск = 0,67% |
1,0 |
|
|
|
|
|
|
V∞= ….. |
1,5 |
|
|
|
|
|
|
|
2,0 |
|
|
|
|
|
|
|
2,5 |
|
|
|
|
|
|
|
3,0 |
|
|
|
|
|
|
|
3,5 |
|
|
|
|
|
|
|
…… |
|
|
|
|
|
|
|
5.По уравнению реакции вычислите объем кислорода (V∞), который должен выделиться при полном разложении 8 мл 1% раствора пероксида водорода (ρН2О2=1г/см3) при стандартных условиях.
6.Результаты опытов представить в виде графиков в координатах Vt (мл) (ось y) от t
мин (ось х) и |
|
∞ |
|
(ось y) от t мин (ось х). |
|
|
|
||
|
− |
|||
|
∞ |
|
||
7.Рассчитать константы скорости реакций, как тангенс угла наклона полученных прямых на графике.
k1= ………….
k2= ………….
Вывод: в выводе отразите влияние уменьшения концентрации катализатора на скорость разложения пероксида водорода.
3.4 Лабораторная работа №4 Построение диаграммы состояния двухкомпонентной системы (термический анализ)
Цель работы: освоить метод термического анализа, построить диаграмму состояния двухкомпонентной системы фенол-нафталин.
Приборы и реактивы
Учебно-лабораторный комплекс «Химия» в следующей комплектации:
–центральный контроллер;
–модуль «Термический анализ» в комплекте с одиннадцатью ампулами, содержащими смеси различных составов (от 10 до 90 мас.%), и ампулы с чистыми компонентами.
Термический анализ
Изучение многокомпонентных систем, образующих несколько фаз, производится при помощи физико-химического анализа, в основе которого лежит изучение функциональной зависимости между физическими свойствами системы и факторами,
23

определяющими ее равновесие. В качестве изучаемых свойств могут быть выбраны: тепловые, электрические, механические и др. Найденные из опыта зависимости изображают в виде диаграмм состав – свойство.
Частным случаем физико-химического анализа является термический анализ, заключающийся в определении температуры, при которой в равновесной системе изменяется число фаз. Анализ основан на изучении изменения температуры системы в зависимости от времени охлаждения. В результате получаются так называемые кривые охлаждения, вид которых зависит от состава и типа смеси.
Кривые охлаждения
При охлаждении системы скорость понижения температуры пропорциональна разности температур системы и окружающей среды:
wохл. dTdt k(Tохл. сист. Tсреды ) .
Из этого уравнения следует, что кривые охлаждения должны быть вогнуты к оси времени t. При большей разности температур они близки к прямой линии.
Кристаллизация расплавленного индивидуального вещества, подвергнутого медленному охлаждению, вызывает температурную остановку (рис. 12, кривая 1), так как состав жидкой фазы остается неизменным и выделяющаяся теплота кристаллизации полностью компенсирует отвод тепла в окружающую среду. На кривой охлаждения 1 моменту выпадения первого кристалла отвечает точка b. Длительность температурной остановки, и тем самым размер горизонтального участка на кривой охлаждения, зависят от количества вещества и от скорости отвода тепла. При исчезновении последней капли жидкости (точка c на кривой 1) температура вновь начинает понижаться, поскольку с этого момента потеря тепла в окружающую среду уже ничем не компенсируется.
Рисунок 5 - Кривые охлаждения расплавов индивидуальных веществ (Тк – температура кристаллизации)
При охлаждении расплава двухкомпонентной системы (рис. 6) сначала кристаллизуется тот компонент, относительно которого жидкий расплав становится насыщенным. Кривая охлаждения (рис. 6, кривая 2) в точке b имеет излом, т.к. скорость охлаждения понижается вследствие выделения теплоты кристаллизации. Отсутствие
24
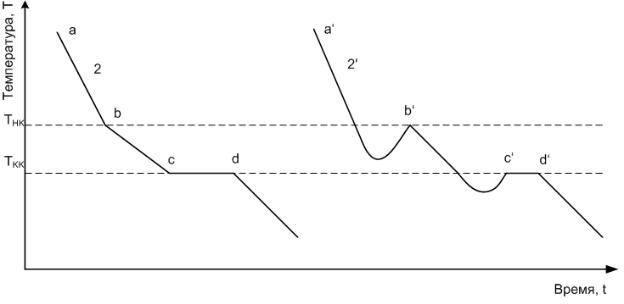
температурной остановки объясняется тем, что состав жидкой фазы при кристаллизации меняется. При достижении температуры, при которой жидкий раствор становится насыщенным относительно и второго компонента, происходит одновременная кристаллизация обоих компонентов. Раствор, насыщенный обоими компонентами и имеющий наименьшую температуру кристаллизации, называется эвтектическим. Состав жидкой фазы остается постоянным. Поэтому на кривой охлаждения 2 наблюдается температурная остановка cd. После отвердевания всей смеси (точка d на кривой 2) температура снова понижается.
Рисунок 6 - Кривых охлаждения расплавов двухкомпонентной системы (Тнк – температура начала кристаллизации; Ткк – температура конца кристаллизации)
Кривые 1 и 2 (рис. 6,6) представляют собой идеальные кривые охлаждения, которые наблюдаются при кристаллизации простых веществ. Сложные вещества и их смеси, в частности органические, как правило, кристаллизуются с переохлаждением, величина которого зависит от чистоты вещества и условий охлаждения.
Построение диаграммы состояния
Ординаты точек b и c, т.е. температуры начала и конца кристаллизации, зависят от состава каждой смеси. Эта зависимость, выраженная графически в координатах температура – состав, носит название диаграммы плавкости (рис. 7).
Точки ТА и ТВ соответствуют температурам кристаллизации чистых компонентов, точки Т1–4 – температурам начала кристаллизации смесей различных составов (x1 – x4). Линия, соединяющая все точки с температурами начала кристаллизации, называется линией ликвидуса. Поле диаграммы выше линии ликвидуса отвечает области условий существования системы в жидком состоянии. Линия, соединяющая все точки с температурами конца кристаллизации, называется линией солидуса. В области диаграммы ниже линии солидуса вся система находится в твердом состоянии.
25

Рисунок 7 - Вид диаграммы плавкости и принцип её построения
Точные координаты эвтектической точки можно определить с помощью треугольника Таммана. Тамманом было замечено, что длительность температурной остановки на кривой охлаждения пропорциональна количеству эвтектики в исходной смеси. Максимальную температурную остановку при кристаллизации имеет смесь эвтектического состава. Отложив длины отрезков cd (температурных остановок) как функцию состава смеси, Тамман получил две прямые, пересекающиеся при составе, имеющем наибольшую длительность температурной остановки, т.е. при составе эвтектики. Получившаяся фигура имеет вид треугольника.
Методика выполнения работы
Для получения диаграммы состояния двухкомпонентной системы методом термического анализа необходимо построить кривые охлаждения как чистых компонентов, так и их смесей в различных соотношениях. Для этого используют несколько смесей, составленных через 10 мас.% во всем возможном диапазоне изменения концентраций. Все смеси для выполнения работы приготовлены заранее и находятся в герметичных ампулах, выполненных из нержавеющей стали.
Каждую смесь необходимо нагреть до температуры, превышающей на несколько градусов температуру полного плавления смеси, чтобы исследуемая система находилась в виде расплава. Для этого модуль «Термический анализ» имеет специальный элемент, предназначенный для одновременного нагревания нескольких ампул.
Далее необходимо провести постепенное охлаждение каждой ампулы с фиксированием значения температуры через определенные интервалы времени. Оно происходит в специальном измерительном блоке модуля. Для равномерного охлаждения ампулы обдуваются потоком воздуха.
26
Наиболее ответственным этапом выполнения работы является анализ полученных кривых охлаждения. Кривые охлаждения часто бывают довольно сложными, перегибы и температурные остановки на них могут иметь маловыраженный характер.
Если до охлаждения система находилась в полностью расплавленном состоянии, то первый перегиб указывает на температуру начала кристаллизации системы (этот перегиб в нашем случае виден наиболее отчетливо). Наличие последующих перегибов или температурных остановок будет указывать на появление в системе новых фаз. Для построения диаграммы состояния изучаемой системы на нее переносятся все выявленные на кривых охлаждения точки.
Диаграмму строят в координатах температура – состав и для каждой изученной смеси откладывают температуры фазовых переходов (начала и конца кристаллизации), которые были определены в результате анализа кривых охлаждения. Таким образом, ордината каждой точки соответствует температуре начала выявленного фазового перехода для определенной смеси, а абсцисса – составу этой смеси (например, массовому или мольному проценту одного из компонентов). На основании полученных точек проводят линии диаграммы.
Порядок выполнения работы
Модуль «Термический анализ» имеет три группы гнезд для размещения ампул. Первая группа, предназначенная для нагревания ампул, имеет четыре гнезда и снабжена нагревательным элементом. Вторая группа (расположенная по середине) имеет шесть гнезд и предназначена для хранения ампул, не задействованных в текущем опыте. Третья группа – измерительный блок – имеет четыре гнезда, предназначенных для охлаждения предварительно нагретых ампул с фиксированием температуры в каждой ампуле в ходе охлаждения. Блок снабжен вентилятором для обдува ампул воздухом. Центральный контроллер позволяет управлять включением и выключением нагревательного элемента и вентилятора модуля.
Для подготовки модуля к работе необходимо при выключенном контроллере подключить шнур модуля к разъему контроллера и подключить контроллер и модуль к электрической сети (220 В). Каждая ампула на крышке имеет цифровую маркировку. Номер ампулы, умноженный на 10, соответствует содержанию одного из компонентов, выраженному в массовых процентах.
1.Включаем нагревательный элемент и вентилятор модуля. Ампулы, выбранные для текущего эксперимента, размещаем в нагревательном блоке и нагреваем выше температуры плавления смесей. Следим за показаниями термодатчиков на измерительных каналах.
2.После достаточного нагрева ампулы перемещаем в измерительный блок для проведения охлаждения. Начинаем охлаждение ампул с фиксированием значений температуры в каждой ампуле через равные промежутки времени (10 сек.). Измерения проводим до температуры 25 – 26 °С.
3.По окончании всего цикла измерений (работы со всеми ампулами) начинаем просмотр экспериментальных данных. Результаты измерений хранятся в энергонезависимой памяти контроллера.
4.Строим кривые охлаждения – графики зависимости температуры в ампуле от времени охлаждения.
27
5.Проводим анализ кривых охлаждения: выявляют перегибы и температурные остановки на графиках.
6.По графикам определяем температуры начала кристаллизации (Tнк), заносим результаты в таблицу 3.
Таблица 3 - Результаты измерения Номер ампулы
мас. %
Состав
мольн.
%
Температура, °С начала кристаллизации,
Tнк
7.С целью определения координат точки эвтектики строят треугольник Таммана в координатах время – состав.
8.На основании полученных данных строят фазовую диаграмму системы фенол–
нафталин.
Вывод:
28
ЛИТЕРАТУРА
1.Березовчук А. В. Физическая химия: Учебное пособие. / Березовчук А. В.; Березовчук А. В. – Саратов: Научная книга, 2012. – 159 с. – URL: http://www.iprbookshop.ru/8191.html.
2.Бокштейн Б.С. Физическая химия. Термодинамика и кинетика: учебник. / Бокштейн Б.С., Менделев М.И., Похвиснев Ю.В.; Ю.В. Похвиснев; М.И. Менделев; Б.С. Бокштейн. – Москва: Издательский Дом МИСиС, 2012. – 258 c. – URL: http://www.iprbookshop.ru/57094.html. – ISBN 978-5-87623-619-7.
3.Романенко Е. С. Физическая химия: Учебное пособие. / Романенко Е. С., Францева Н. Н.; Романенко Е. С. – Ставрополь: Ставропольский государственный аграрный университет, Параграф, 2012. – 88 с. – URL: http://www.iprbookshop.ru/47378.html.
4.Митрофанова Светлана Валерьевна. Фазовые превращения вещества: учебнометодическое пособие по выполнению лабораторных работ по дисциплинам "Физическая химия. Основы водоподготовки" для обучающихся по направлению подготовки 13.03.01 Теплоэнергетика и теплотехника, направленность (профиль) Промышленная теплоэнергетика и "Физическая химия силикатов" для обучающихся по направлению подготовки 08.03.01 Строительство, направленность (профиль) Производство и применение строительных материалов, изделий и конструкций. / Митрофанова Светлана Валерьевна; Нижегородский государственный архитектурно-строительный университет. – Нижний Новгород: ННГАСУ, 2021. – 1 CD ROM. – URL: URL: http://catalog.nngasu.ru/MarcWeb2/.
29

С.В. Митрофанова
ФИЗИЧЕСКАЯ ХИМИЯ СИЛИКАТОВ
Учебно-методическое пособие
по:
-подготовке к практическим занятиям и лабораторным работам для обучающихся по дисциплине «Физическая химия силикатов»
направлению подготовки 08.03.01 Строительство направленность (профиль) Производство и применение строительных материалов, изделий и конструкций
Федеральное государственное бюджетное образовательное учреждение высшего образования «Нижегородский государственный архитектурно-строительный университет»
603950, Нижний Новгород, ул. Ильинская, 65. http://www. nngasu.ru, srec@nngasu.ru
30
