
7273
.pdfВариантность системы характеризуется числом степеней свободы, т е числом независимых переменных (давление, температура и концентрация компонентов), которые можно произвольно изменять в некоторых пределах, так, чтобы число равновесных фаз в системе оставалось неизменным. По этому признаку системы делят на инвариантные (С=0), моновариантные (С=1), дивариантные (С=2), …., поливариантные.
Это правило устанавливает соотношение между числом фаз, числом компонентов и числом степеней свободы.
С = К – Ф + 2 , где К- компонент системы, Ф- число фаз,
С- число степеней свободы 2- число независимых компонентов (Т и Р).
Правило фаз показывает, что число степеней свободы возрастает с увеличением числа компонентов и уменьшается с увеличением числа фаз системы.
ФАЗОВЫЕ ДИАГРАММЫ
Фазовая диаграмма - это графическое изображение всех возможных фазовых состояний термодинамической системы в пространстве основных параметров состояния – температуры и/или давления.
Фазовые диаграммы позволяют узнать, какие фазы (т. е. однородные подсистемы, отличающиеся строением и/или свойствами от других) могут присутствовать в данной системе при данных условиях и составе. Для сложных систем, состоящих из многих фаз и компонентов, построение диаграмм состояния по экспериментальным данным и данным термодинамического моделирования является важнейшим способом предсказания поведения в ходе различных процессов. Анализ относительного расположения полей, разделяющих их поверхностей и линий, а также точек сочленения последних позволяет однозначно и наглядно определять условия фазовых равновесий, появления в системе новых фаз и химических соединений, образования и распада жидких и твердых растворов и т. п.
Фазы могут иметь различное агрегатное состояние, тем ни менее все описанные закономерности и правила будут оставаться в силе несмотря на это различие. Однако, существуют некоторые договоренности по обозначению элементов диаграмм и их названиям.
Так, некоторые линии имеют специальные названия:
1.Линия ликвидуса — наклонная линия ограничивающая поле жидкого раствора, и характеризующая состав этого жидкого раствора, находящегося в равновесии с другим раствором — твердым, жидким или газообразным.
2.Линия солидуса — линия характеризующая состав твердого раствора, находящегося в равновесии с жидким раствором. Ниже линии солидуса (на диаграмме температура– состав) система находится в твердом состоянии.
3.Горизонтальные — «вырожденные» — линии описывают инвариантное равновесие между тремя фазами.
Двойная фазовая диаграмма (диаграмма состояния двойной системы) представляет состояние системы с двумя компонентами. На таких диаграммах по оси ординат откладывается температура, по оси абсцисс - процентное соотношение компонент смеси
11
(обычно это или процент от общей массы (вес. %), или процент от общего числа атомов (ат. %)). Давление обычно полагается равным 1 атм. Если рассматривается жидкая и твердая фазы, измерением объема пренебрегают. На следующем рисунке представлена типичная двухфазная диаграмма состояний для компонент A и B с использованием весового или атомного процента.
Фазовая диаграмма двухкомпонентной системы с эвтектикой
Образование эвтектик (от греческого «легко плавящийся») наблюдается, как правило, в том случае, когда компоненты A и B имеют разные типы кристаллических решеток и различные размеры радиусов частиц решетки, или при наличии одинакового типа решетки, но резко различных радиусов частиц (разница радиусов > 10 %).
Например, соединения LiCl−KCl образуют эвтектическую смесь, так как, несмотря на химическое сходство этих соединений, разница радиусов ионов Li+ и K+ составляет ≈ 45 %.
Двухкомпонентная диаграмма с эвтектикой приведена на рис. 1, а. Температуры плавления чистых компонентов A и B отмечены точками ТА и ТВ.
Кривые ТАЕ и ТВЕ называются линиями ликвидуса: каждая точка этих линий показывает состав расплава, находящегося в равновесии с твердой фазой (кристаллами A или кристаллами B). Выше линии ликвидуса система находится в жидком состоянии. Ниже линии ликвидуса начинается кристаллизация.
Точка Е пересечения кривых ТАЕ и ТВЕ показывает температуру и состав расплава, который находится в равновесии с кристаллами A и кристаллами B.
Точка Е называется эвтектической точкой. Расплав, соответствующий точке Е, называется эвтектическим расплавом, температура ТЕ — эвтектической температурой.
Механическая смесь кристаллов A и B, которые одновременно выпадают при температуре ТЕ, называется твердой эвтектикой.
Кривая охлаждения ТВЕ соответствует охлаждению расплава и выпадению кристаллического вещества В. Выше кривой охлаждения ТВЕ существует расплав В и А. В точке Е одновременно выпадают кристаллы В и А. Состав расплава и состав кристаллических фаз не меняется и температура остается постоянной, пока весь расплав не закристаллизуется. Расплав такого состава называется эвтектическим расплавом.
Кривая охлаждения ТАЕ соответствует охлаждению расплава и выпадению кристаллического вещества А вплоть до эвтектики, когда происходит одновременное выпадение кристаллов обоих компонентов, о чем говорилось выше.
Каждая точка прямой FG показывает состав системы, состоящей из расплава состава точки Е и двух твердых фаз из кристаллов A и кристаллов В, находящихся в равновесии.
Линия называется эвтектической прямой или линией солидуса.
12
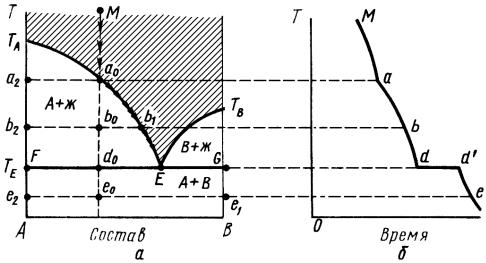
Рис. 1. Двухкомпонентная диаграмма с эвтектикой Ниже этой линии жидкая фаза отсутствует. Линиями ликвидуса ТАЕ, ТВЕ и линией
солидуса FG диаграмма делится на четыре участка. Поле выше линии ликвидуса ТАЕТВ сплошное (заштрихованное поле) — область существования только жидкой фазы. Остальные три поля «вырожденные»: — ТАFЕ — расплав + кристаллы A; ТВGЕ — расплав +кристаллы B; АFGВ — смесь кристаллов A и B.
В таблице 1 приведено описание состояния системы при охлаждении расплава состава, заданного фигуративной точкой М. Соответствующая кривая охлаждения приведена на рис. 9, б.
Линия, показывающая изменение состава жидкой фазы от начала процесса охлаждения расплава до полной кристаллизации расплава, называется путем кристаллизации (кривая Ма0b1E на рис. 1).
Отметим некоторые особенности процесса охлаждения. Кривая охлаждения в интервале температур между точками а и d изменяется не линейно, так как при кристаллизации выделяется тепло, которое замедляет охлаждение.
Кристаллы A или B, которые выпадают при температурах, далеких от температуры эвтектики, крупные.
Таблица 1. Изменение состояния системы в результате охлаждения расплава т. М
(рис. 1)
Точка на диаграмме |
Что происходит |
Ф |
С |
|
|
|
|
М |
Охлаждение жидкой фазы |
1 |
2 |
|
|
|
|
a0 |
Появляются первые кристаллы компонента A |
2 |
1 |
|
|
|
|
b0 |
Продолжают выпадать кристаллы |
2 |
1 |
|
компонента A |
|
|
|
|
|
|
d0 |
Кристаллизуются одновременно компонент |
3 |
0 |
|
A и компонент B |
|
|
|
|
|
|
е0 |
Продолжается охлаждение двух твердых фаз |
2 |
1 |
|
|
|
|
13

Соотношение масс кристаллов A и B в выпадающей твердой эвтектике такое же, как и массовое содержание веществ A и B в расплаве эвтектического состава.
Кристаллы A и B выпадают при температуре эвтектики одновременно и у них нет условий для роста, поэтому твердая эвтектика имеет мелкокристаллическую структуру.
На рис. 2 приведена диаграмма состояния системы H2O–KCl с эвтектикой. При 273 К растворимость KCl в воде 21,9 % (точка а). При 381,6 К и 0,1013 МПа насыщенный раствор KCl, содержащий 36,5 % соли, закипает, поэтому дальнейший ход кривой ЕаВ обрывается. При смешении льда (или снега) с кристаллами KCl лед начинает таять, соль растворяется в воде и при достаточном количестве льда и соли образуется трехфазная система, состоящая из льда, кристаллов KCl и раствора KCl.
Рисунок 2 - Диаграмма состояния системы вода−хлорид калия
В трехфазной системе число степеней свободы равно С = 3 – 3 = 0. Таким образом, три фазы могут существовать при эвтектической температуре 262,3 К и составе раствора 19,8 % KCl. Пока в системе в равновесии находятся три фазы, в равновесной смеси поддерживается температура 262,3 К. На этом принципе основано применение холодильных смесей.
Построение диаграмм состояния термическим методом
Для построения диаграмм состояния пользуются результатами термического анализа. Термический анализ заключается в наблюдении за изменением температуры расплавленного вещества в процессе его охлаждения и кристаллизации. По результатам наблюдений строят зависимости температуры сплава от времени, которые называются кривыми охлаждения. Метод кривых охлаждения основан на том, что пока в охлаждаемой системе не происходит никаких превращений, температура падает практически равномерно. Появление или исчезновение фаз сопровождается тепловыми эффектами и на кривой охлаждения появляются перегибы или изменение температуры временно прекращается (происходит температурная остановка). Таким образом, по остановкам и перегибам на кривых охлаждения, вызванных тепловыми эффектами превращений, определяют температуры превращений.
14
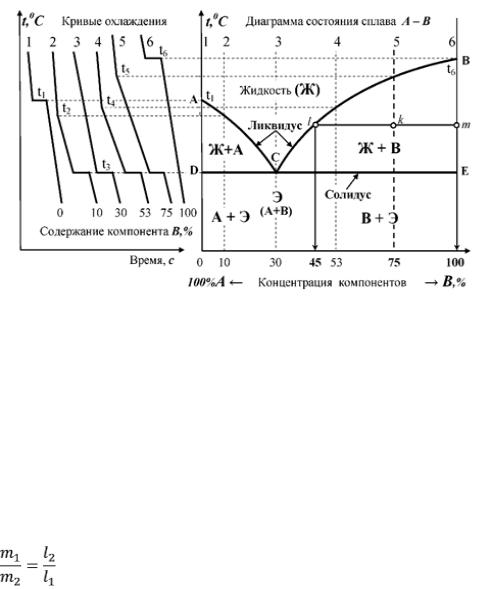
Очень важно отметить, что в случае двухкомпонентных систем излом на кривой охлаждения соответствует переходу системы через наклонную линию (на фазовой диаграмме). При этом происходит появление новой фазы или исчезновение одной из двух фаз составляющих систему. Температурная остановка на кривой охлаждения соответствует переходу системы через горизонтальную линию на фазовой диаграмме (во время температурной остановки в равновесии находятся три фазы и система находится в инвариантном состоянии). При этом происходит исчезновение одной фазы и появление другой.
Рисунок 3 - Построение диаграмм состояния термическим методом
Правило рычага
Кроме состава каждой равновесной фазы в случае двухфазной системы мы можем также определить массовое соотношение между фазами. Когда система состоит из двух фаз, фигуративная точка (F) лежит внутри «вырожденного» поля, через нее проводится коннода и определяются длины плеч конноды справа и слева (от фигуративной точки до точек, характеризующих состав равновесных фаз — f1 и f2)
В случае, если состав системы выражен в массовых процентах (или долях), то соотношение длин этих плеч (ℓ1и ℓ2) будет равно соотношению масс равновесных фаз, так как масса каждой фазы обратно пропорциональна своему плечу рычага:
где m1 и m2 — массы первой и второй фазы, соответственно, ℓ1 = f0 – f1 и ℓ2 = f2 – f0 , f0
—состав всей системы в целом, f1 и f2 — составы первой и второй фазы, соответственно.
•Таким образом, мы имеет полную аналогию с механическим рычагом, находящимся в равновесии, если в фигуративной точке мы поместим упор, а на концах рычага поместим массы соответствующих фаз. Поэтому это соотношение называется правилом рычага.
•Если известна общая масса системы (m0), то можно вычислить массу каждой фазы, так как
15
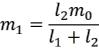
m0 = m1 + m2.
Решая полученную систему уравнений, найдем выражение для m1
В случае, когда состав системы выражен на диаграмме в молярных долях (или процентах), аналогичное выражению уравнение даст соотношение количеств равновесных фаз.
П р и м е р 1. Определите давление, при котором вода закипит при 98°С. Р е ш е н и е: Кипение воды представляет собой фазовый переход:
жидкость →газ. Из справочных данных известно, что при 100°С давление насыщенного водяного пара равно 760 мм рт.ст, а молярная теплота испарения составляет 40644 Дж/моль.
р |
= р |
|
− |
∆Нисп |
( |
2 − 1 |
) = 760 − |
40644(373 − 371) |
= 6,562 |
2 |
|
|
|
||||||
1 |
|
|
|
|
2 1 |
|
8,314 ∙ 373 ∙ 371 |
||
|
|
|
|
|
|
||||
P1 = exp 6,562 = 707,7 мм рт.ст.
Задачи для самостоятельного решения
1.Давление пара бензола при 20°С и 30°С соответственно равно 100·102 Па и 157·102 Па. Рассчитайте удельную теплоту испарения бензола.
2.Удельная теплота испарения амилового спирта С5Н11ОН при температуре кипения 138°С и давлении 1,013∙105 Па равна 592 Дж/г. Рассчитайте давление пара спирта при
140ºС.
3.ЛАБОРАТОРНЫЕ РАБОТЫ
3.1 Лабораторная работа №1 Определение интегральной теплоты растворения соли
Для большинства физико-химических и технологических расчетов необходимо знать теплоемкости веществ, участвующих в процессе, тепловые эффекты процессов растворения, фазовых превращений и химических реакций. Эти величины можно определить экспериментально. При температурах, близких к комнатной 20-50оС, широко применяется калориметрический метод.
Цель работы: Ознакомиться с калориметрическим методом измерения тепловых эффектов. Определить постоянную калориметра и теплоту растворения соли.
Теоретическая часть
Тепловым эффектом химической реакции называется количество теплоты (кДж), которое выделяется или поглощается при необратимом протекании реакции, когда единственным видом работы является работа расширения, а температуры исходных веществ и продуктов реакции одинаковы.
16
Изучением тепловых процессов, сопровождающихся изменением состояния системы, занимается термохимия. По закону Гесса тепловой эффект реакции зависит только от начального и конечного состояния реагирующих веществ и не зависит от пути перехода от одного состояния к другому.
Пользуясь этим законом можно рассчитать тепловой эффект процесса там, где невозможно произвести точное прямое измерение.
При растворении вещества в воде протекают одновременно следующие процессы:
1.Разрушение кристаллической решетки вещества. При этом происходит поглощение тепла в количестве равном Q кристаллической решетки.
2.Гидратация ионов, сопровождаемая выделением определенного количества тепла, равного Q гидратации. Теплота растворения соли равна алгебраической сумме тепловых эффектов этих процессов:
Q раств = Qкрист.реш. + Qгидр
Теплота растворения, помимо природы растворенного вещества и растворителя, зависит от температуры растворителя и концентрации полученного раствора.
Различают интегральную и дифференциальную теплоты растворения.
Интегральная теплота растворения – это тепловой эффект растворения одного грамма (удельная) и одного моля (мольная) вещества в определенном количестве растворителя, при данной температуре.
Дифференциальная или парциальная теплота растворения– это тепловой эффект,
сопровождающий процесс растворения одного моля или одного грамма вещества в настолько большом количестве растворителя определенной концентрации, что изменение ее, вызванное растворением этого количества вещества, можно считать равным нулю.
Интегральные теплоты растворения находятся экспериментально, а дифференциальные – методом расчета.
Для расчета теплового процесса, протекающего в калориметрической установке, необходимо знать постоянную калориметра, т.е. количество тепла, необходимое для нагревания всех частей калориметра на 10С. Эту величину можно определить разными методами.
Экспериментальная часть
Выполнение работы проводится на УЛК «Химия». При выполнении работы потребуется следующее оборудование:
1)Центральный контроллер.
2)Модуль «Термостат» в комплекте со стеклянным стаканчиком объемом 100-120 мл, термодатчиком, мешалкой и устройством для размещения навески соли в термостате.
3)Навеска соли с известной теплотой растворения массой ≈ 2 г.
4)Навеска соли с неизвестной теплотой растворения массой ≈ 2 г.
5)Мерный цилиндр на 100 мл.
6)Дистиллированная вода.
17
Порядок выполнения работ на УЛК «Химия»
Выполнение работы осуществляется с использованием модуля УЛК «Термостат». Термостат используется в пассивном режиме как калориметр. В ходе выполнения работы необходимо использовать магнитную мешалку. Изменение температуры раствора контролируется датчиком температуры.
1. Определение постоянной калориметра
Берем навеску NH4Cl массой ≈ 2 г пересыпаем ее в специальную пробирку. В стакан наливаем 80 мл дистиллированной воды, помещаем стакан в термостат, закрываем крышкой, в которую устанавливаем термодатчик и специальную пробирку с солью. Включаем мешалку и нажимаем кнопку «Измерение». Проводим 10 измерений температуры и добавляем соль, проводим ещё 15 измерений, нажимаем кнопку «Стоп». На полученном графике отмечаем интервал падения температуры и определяем T1. По формуле находим К – постоянную калориметра:
К = - Q1/ΔT1 - (mNH4Cl + mH2O)CH2O ,
CH2O = 4,18 Дж/г К
Q1 = (15270. mNH4Cl)/МNH4Cl
2. Определение теплоты растворения соли (NH4)2SO4
Повторяем опыт с солью (NH4)2SO4 растворения соли по формуле:
Q2 = – [(m(NH4)2SO4 + mH2O).CH2O + К] . Н = (Q2. М(NH4)2SO4)/ m(NH4)2SO4
и по графику находим T2. Рассчитываем теплоту
T2
Выводы:
3.2 Лабораторная работа 2. Гетерогенное химическое растворение
Цель работы – определение зависимости давления паров воды над кристаллогидратом сульфата меди от температуры с помощью статического метода и расчет энтальпии разложения кристаллогидрата.
Общими условиями устойчивого химического равновесия являются следующие:
1.Динамичность равновесия, т. е. протекание прямой и обратной реакций с равными скоростями: это кинетическое условие химического равновесия;
2.Неизменность равновесного состава системы Сi = const при постоянстве внешних параметров Т, Р, V = const – это концентрационное условие химического равновесия;
3.Минимальное постоянное значение энергии Гиббса Gr или энергии Гельмгольца Ar:
ΔGr = 0 или Аr = 0 – это термодинамическое условие химического равновесия;
4. Подвижность равновесия, т. е. возможность смещения равновесия при изменении параметров системы: Т, Р, Сi, pi;
18

5. Возможность подхода к состоянию равновесия с двух противоположных сторон: со стороны прямой и со стороны обратной реакции.
Закон действия масс. Константа химического равновесия.
Суть закона состоит в том, что в равновесной смеси концентрации всех веществ находятся между собой в определенных отношениях. Это отношение называется
константой химического равновесия.
Константа химического равновесия представляет собой отношение произведения равновесных концентраций (или давлений) продуктов реакции, возведенных в степени, равные коэффициентам реакции, к аналогичному произведению для исходных веществ.
Рассмотрим это выражение для условной реакции
аА + bВ сС + dD
Тогда концентрационная константа равновесия (выраженная через концентрации) выглядит так:
|
|
|
C c |
C d |
|
K |
|
|
C |
D |
|
C |
C a |
C b |
|||
|
|
||||
|
|
|
|||
|
|
|
A |
B |
Где Кс – константа химического равновесия, а подстрочный символ С означает, что она выражена через равновесные концентрации.
Аналогично выражается константа равновесия через равновесные давления веществ:
|
|
|
P c P d |
||
K |
|
|
C |
D |
|
P |
P a P b |
||||
|
|
||||
|
|
|
|||
|
|
|
A |
B |
|
В случае гетерогенных обратимых реакций в выражение константы химического равновесия входят равновесные парциальные давления или концентрации газов, или концентрации растворённых веществ, участвующих в реакции, так как активности твердых веществ или жидкостей при одновременном участии газов принимаются равными единице.
С(т) + СО2(г) 2СО(г)
р2
К р р СО
СО2
Закон действующих масс имеет большое значение в учении о химическом равновесии. Из него следует, что в системе, в которой протекает обратимая реакция:
-соотношение равновесных величин, характеризующих состав системы при Т=const, является постоянным и равным константе равновесия;
-константа равновесия не зависит от того, какие из реагирующих веществ будут исходными веществами, а какие – продуктами реакции;
-константа равновесия не зависит от начального состава исходных веществ;
-для расчета константы равновесия достаточно экспериментально определить равновесную концентрацию одного из реагирующих веществ.
19
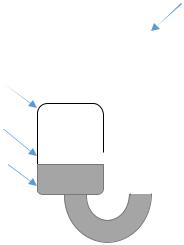
|
|
|
|
|
|
|
|
|
Экспериментальная часть |
|
|
|
|
|
|
|
|
|
|
Установка для измерения упругости пара |
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
представляет собой стеклянный манометр, состоящий из |
|
|
|
|
|
|
|
|
|
1 |
||
|
|
|
|
|
|
|
|
узкого – 1 и широкого – 2 колена, заполненных ртутью 4. |
||
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
В широком колене на поверхности ртути находится слой |
||
|
|
|
|
|
|
|
|
медного купороса 3. Свободное пространство над ртутью в |
||
|
|
|
|
|
|
|
|
обоих коленах вакуумировано и |
не содержит воздуха. |
|
2 |
|
|
|
|
|
|
||||
|
|
|
|
|
|
Свободное пространство над кристаллогидратом в широком |
||||
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
колене содержит только пары воды. При нагревании пары |
||
|
3 |
|
|
|
|
|
||||
|
|
|
|
|
|
|
воды давят на поверхность ртути |
в широком колене, что |
||
|
|
|
|
|
|
|
|
приводит к повышению уровня ртути в узком колене. |
||
|
4 |
|
|
|
|
|
|
|||
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Порядок выполнения работы
1.Поместить установку в водяную баню, чтобы широкое колено было полностью погружено в воду
2.При постоянном перемешивании включаем нагрев воды.
3.В процессе повышения температуры, начиная с 25оС, через каждые 5о, измеряем высоту ртутного столба в узком колене
4.Результаты заносим в таблицу
t, оС |
T,K |
1/T.103 |
P, мм рт. ст. |
lgP |
25 |
|
|
|
|
|
|
|
|
|
30 |
|
|
|
|
|
|
|
|
|
35 |
|
|
|
|
|
|
|
|
|
40 |
|
|
|
|
|
|
|
|
|
45 |
|
|
|
|
|
|
|
|
|
50 |
|
|
|
|
|
|
|
|
|
55 |
|
|
|
|
|
|
|
|
|
60 |
|
|
|
|
|
|
|
|
|
65 |
|
|
|
|
|
|
|
|
|
70 |
|
|
|
|
|
|
|
|
|
75 |
|
|
|
|
|
|
|
|
|
80 |
|
|
|
|
|
|
|
|
|
5.Заполните таблицу и постройте график зависимости lgP от 1/T.103.
6.Определите энтальпию разложения медного купороса графическим методом, для этого на прямолинейном участке графика выбираем две точки, стоящие подальше друг от друга, определяем их координаты и подставляем в уравнение вместо Кр подставляем значения P:
20
