
6116
.pdfзуют понятие коэффициент избытка воздуха - αв., который по-
казывает, во сколько раз количество воздуха, который действительно поступает в зону горения, отличается от теоретически необходимого количества для полного сгорания единицы количества горючего вещества.
Таким образом, действительный удельный объем воздуха
равняется:
vв = vов · αв.
Часть воздуха, неизрасходованная на горение, переходит
впродукты горения.
Вслучае кинетического горения при αв = 1, смесь горю-
чего с воздухом является стехиометрической. Величина тепловыделения на единицу продуктов сгорания при этом максимальна вследствие чего температура в зоне горения также макси-
мальна. При αв < 1 – в смеси недостаток окислителя и излишек горючего вещества. Такая смесь называется богатой. Характерной особенностью процесса горения в этом случае является об-
разование продуктов неполного сгорания. При αв > 1 – смесь называется бедной. В ней недостаток горючего вещества и излишек окислителя. При этом продукты горения включают в себя избыток воздуха.
Для удобства расчётов горючие вещества разделяют на три типа (табл.2): индивидуальные химические соединения, вещества сложного состава, смесь газов.
Здесь VВ0 – теоретическое количество воздуха; νг, νО2, νN2-
количество горючего, кислорода и азота, получаемого из уравнения химической реакции горения, кмоль; М – молекулярная масса горючего; V0 – объем 1 кмоля газа при нормальных условиях (22,4 м3); C, H, S, O – массовое содержание соответствующих элементов в составе горючего, % ϕГi - концентрация I - го
горючего компонента, % об.; ϕO2 -концентрация кислорода в составе горючего газа, % об.; nO2 i - количество кислорода, необхо-
41
димое для окисления одного кмоля i- го горючего компонента, кмоль.
Таблица 2
Название таблицы
Тип горючего ве- |
|
|
|
Расчётные формулы |
|
Размерность |
|||||||||||||||||
щества |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
V |
0 |
= |
ν O |
+ν N |
2 |
|
|
|
|
|
|
кмоль |
; |
м3 |
||||||||
|
|
2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
Индивидуальное |
В |
|
ν Г |
|
|
|
|
|
|
|
|
|
кмоль |
м3 |
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||
V 0 |
|
|
|
|
|
) ×V0 |
|
|
|
|
|
||||||||||||
вещество |
= (ν O2 |
+ν N2 |
|
|
|
|
|
3 |
|
|
|
|
|
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
м3 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
В |
|
|
|
ν Г M |
|
|
|
|
|
|
м |
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
Вещество слож- |
|
|
0 |
|
|
|
|
С |
+ Р + |
S − O |
|
м |
3 |
|
|
|
|
|
|||||
VВ |
= 0.269 |
|
|
|
|
|
|
|
|
|
|
|
|||||||||||
ного состава |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
3 |
|
|
|
|
8 |
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
кг |
|
|
|
|
|
|||||||
Смесь газов |
V |
|
0 |
= |
∑ϕ Гi nO2i |
− ϕO2 |
|
|
|
|
м3 |
; |
кмоль |
|
|||||||||
В |
|
|
|
|
|
|
|
м3 |
|
||||||||||||||
|
|
|
|
|
|
21 |
|
|
|
|
|
|
|
кмоль |
|||||||||
Механизм горения некоторых газов
Целый ряд окислительно-восстановительных реакций протекает таким образом, что вначале в системе образуются свободные атомы и радикалы.
Легкость взаимодействия свободных атомов и радикалов с молекулами-реагентами, сопровождающееся генерированием свободных атомов и радикалов, приводит к цепному взрыву в случае прогрессивно нарастающего количества активных частиц в ходе реакции.
Отступление. Принято неспаренный электрон обозначать точкой. В этом случае атом водорода, содержащий единственный электрон обозначают Н×. Атом кислорода содержит в своем составе два неспаренных электрона ×О×. Свободный радикал – это молекула, один из атомов которой содержит неспаренный электрон, например НО×
При контролируемом проведении цепной реакции взрыв исключается, так как происходит регулируемая подача окислителя и окисляемого вещества в зону реакции.
42
Механизм горения оксида углерода (II)
Оксид углерода СО является одним из важнейших и широко применяемых в промышленности видов газообразного топлива. Он применяется в металлургии, где получается при коксовании углей. Он является основным компонентом горючей газовой смеси при газификации углей (превращении углей в газообразное топливо):
2СО + О2 ® 2СО2
Особенностью реакции является то, что она идет очень медленно, если в смеси отсутствуют пары воды. Константа скорости горения сухого и влажного СО отличается на шесть порядков. Объясняется это тем, что молекула СО имеет очень прочную химическую связь, и не распадается при обычных условиях зажигания. Выше сообщалось, что молекула кислорода также очень прочная и не может служить источником радикалов. Поэтому процесс резко ускоряется в присутствии паров воды.
Зарождение цепи:
М* + Н2О ® ОН. + Н. |
(2.1) |
Продолжение цепи: |
|
Н. + О2 ® ОН. + ·О· |
(2.2) |
ОН. + СО ® СО2 + Н. |
(2.3) |
Реакция (2.3) является основной реакцией образования конечного продукта горения оксида углерода СО2.
На первый взгляд, реакция (2.2) является реакцией разветвления цепи. Однако особенность механизма горения СО заключается в том, что бирадикал ·О· улавливается оксидом углерода и далее не дает никаких активных частиц:
43
·О· + СО ® СО2 |
(2.4) |
Поэтому реакция горения, несмотря на наличие стадии разветвления цепи, не считается разветвленной цепной реакцией.
Обрыв цепи элементарная реакция рекомбинации атомов и радикалов. Реакции обрыва цепи идентична описанной при горении водорода:
НО× + Н + М ® Н2О + М*
Экспериментально полученная зависимость скорости горения СО выглядит так:
W = kCCO |
CO |
0,5CH |
O |
0, 25 |
(2.1) |
|
2 |
2 |
|
|
|
Важная роль воды для реакции горения СО подтверждается тем, что ее концентрация входит в уравнение скорости химической реакции 2.1.
Энергия активации реакции равна 28,3кДж/моль.
Механизм горения метана
Метан является простейшим насыщенным углеводородом и важнейшим газообразным топливом. Брутто-процесс записывается сложной реакцией:
СН4 + 2О2 ® СО2 + 2Н2О |
(2.5) |
Однако механизм этой реакции очень сложный. В реакции зарождения цепи важную роль играют пары воды. При их отсутствии радикалы образуются при распаде молекулы метана, а в присутствие воды – при более быстрой реакции разложения молекул воды.
Зарождение цепи:
44
СН4 + М* → .СН3 + Н. + М |
(2.6) |
М* + Н2О → ОН. + Н. |
(2.7) |
Продолжение цепи. |
|
Н. + О2 → ОН. + ·О· |
(2.8) |
Эта реакция является реакцией разветвления цепи.
Далее молекулы СН4 участвуют в двух параллельных реакциях, образуя метильный радикал:
СН4 + ·ОН → ·СН3 + Н2О
СН4 + ·О· → .СН3 + ·ОН
В свою очередь, метильный радикал также участвует в двух реакциях:
.СН3 + ОН. → :СН2 + Н2О
.СН3 + О2 → Н2СО + ОН
В первой из этих реакций образуется метиленовый бирадикал (карбен), а во второй – формальдегид.
Формальдегид является одним из продуктов реакций разветвления метана и других углеводородов. Поэтому он присутствует в автомобильных выхлопах и приводит к загрязнению окружающей среды.
Формальдегид образуется из карбена:
:СН2 + О2 → Н2СО + О:
Формальдегид принимает участие в двух реакциях продолжения цепи:
Н2СО + О: → СО + Н2О (2.14)
45
Н2СО + ОН. → НСО. + Н2О
а радикал НСО. дает еще одну реакцию разветвления:
НСО. + О2 → СО + О: + ОН
Оксид углерода реагирует по двум параллельным реакциям с образованием конечного продукта окисления углерода:
О: + СО → СО2 |
(41) |
ОН. + СО → СО2 + Н. |
(42) |
Таким образом, в процессе протекания реакций продолжения цепи происходит последовательная потеря углеродов атомов водорода и превращения метана по цепочке:
СН4 → .СН3 → :СН2 → НСО. → СО → СО2.
Обрыв цепи.
Реакции обрыва аналогичны тем, что были рассмотрены ранее для горения водорода и СО.
Нетрудно представить, насколько усложняется механизм горения еще более сложных углеводородов, чем метан. А для бензинов, состоящих из сотен насыщенных, ненасыщенных и ароматических углеводородов, знание механизма горения является просто нереальной задачей.
46

ГЛАВА 3
ГОРЕНИЕ ЖИДКИХ ВЕЩЕСТВ
Горение жидкостей имеет свои специфические особенности. Во-первых, горение горючего вещества происходит в смеси паров горючего вещества с кислородом воздуха над поверхностью жидкой фазы. Во-вторых, жидкость как таковая имеет относительно невысокую температуру в процессе горения паров. В-третьих, лимитирующей стадией горения является скорость испарения жидкости, а продолжение или прекращение горения зависит от соотношении скорости испарения топлива (ʋисп) и скорости его горения (ʋгор). Если соблюдается условие ʋисп < ʋгор, то процесс протекает как вспышка – процесс неустойчивого, быстро прекращающегося горения. Если ʋисп = ʋгор или ʋисп > ʋгор , происходит стабильное или интенсивно развивающееся горение.
Горение паров над жидкостью является турбулентным диффузионным горением.
Для горения жидкостей также существуют пределы воспламенения, но они выражаются температурой.
Температура вспышки, воспламенения и самовоспламенения жидких веществ
Температура вспышки – наименьшая температуре горючего вещества, при которой пары над его поверхностью способны вспыхивать при контакте с открытым источником огня. Устойчивого горения не возникает, все ограничивается быстрым сгоранием газопаровоздушной смеси над поверхностью горючего вещества, сопровождающееся кратковременным видимым свечением.
47
Метод Пенски-Мартенса позволяет определять температуру вспышки нефтепродуктов в закрытом тигле в диапазоне от 40 °C до 360 °C разнообразных жидких горючих веществ. Для дизельного топлива, авиационного керосина, смазочных масел, а также для отработанных нефтепродуктов могут быть определены температуры вспышки.
Рис. 8. Прибор закрытого типа для измерения температуры вспышки: 1 – зажигательное устройство; 2 – заслонка; 3 – термометр; 4 – крышка; 5 – тигель; 6 – мешалка [1 ]
Горение газовых смесей является гомогенным процессом. В испытательный тигель аппарата Пенски-Мартенса помещают испытуемый образец и подогревают таким образом, чтобы при непрерывном перемешивании происходило постоянное повышение температуры (рис.8). Источник зажигания опускают через равномерные интервалы времени через отверстие в крышке тигля, одновременно с этим перемешивание жидкости прекращают. Самую низкую температуру, при которой источник
48

зажигания вызывает возгорание паров испытуемого образца нефтепродукта, а пламя распространяется по поверхности жидкости, регистрируют как температуру вспышки при фактическом барометрическом давлении. Эту температуру приводят к стандартному атмосферному давлению 101.3 кПа (1 атм.), если отклонение от стандартного атмосферного давления более 1.3 кПа. В таком случае используют уравнение:
∆Т = (101.3 – р)·0.9/3.3, где р – фактическое барометрическое давление в кПа. Вычисленное значение ∆Т прибавляют к измеренной температуре вспышки.
В настоящее время существует широкий выбор автоматических приборов, измеряющих температуру вспышки горючих жидкостей в закрытом тигле (фото 1).
Фото 1. Автоматический анализатор температуры вспышки АРМ-7 [ссылка]
Анализатор АРМ-7 полностью автоматизирует определение температуры вспышки в закрытом тигле Пенски-Мартинеса таких жидкостей, как автомобильный бензин, авиационный керосин, судовой мазут, топочный мазут и, практически, любых образцов горючих жидкостей с неизвестной или высокой температурой вспышки.
49
Расчет температуры вспышки индивидуальных веществ
осуществляется различными методами. Наиболее точно величина Твсп. рассчитывается по линейной зависимости температуры вспышки от температуры кипения Ткип. представителей органических соединений одного класса по уравнению:
Твсп. = а + в Ткип.
В табл.3.представлены параметры, необходимые для вычисления температуры вспышки. Расчетные значения соответствуют температурам вспышки в закрытом тигле.
Т а б л и ц а 3
Параметры а и б для расчета температуры вспышки индивидуальных соединений
Класс веществ |
а |
б |
Алканы |
ʋ 73.22 |
0.693 |
Спирты |
ʋ 41.69 |
0.652 |
Алкиланилины |
ʋ 21.94 |
0.533 |
Карбоновые кисло- |
ʋ 43.57 |
0.708 |
ты |
|
|
Алкилфенолы |
ʋ 38.42 |
0.623 |
Ароматические уг- |
ʋ 67.83 |
0.665 |
леводороды |
|
|
Альдегиды |
ʋ 74.76 |
0.813 |
Бромалканы |
ʋ 49.56 |
0.665 |
Кетоны |
ʋ 52.69 |
0.643 |
Хлоралканы |
ʋ 55.70 |
0.631 |
Пример. Температура кипения этилового спирта равна +78 оС. Вычислим температуру вспышки этого вещества, воспользовавшись данными, приведенными в табл. . В соответствии с уравнением Твсп. = а + в Ткип.
Твсп. = ʋ 41.69 + 0.652·78 ≈ 9.2 оС
50
Получаем близкое значение температуры вспышки, определенное экспериментально и равное +13 оС (табл. ) при средней квадратичной погрешности ±4 оС.
Т а б л и ц а 4
Температура вспышки и связанные с ней параметры некоторых органических веществ
Вещество |
Ткип., |
Твсп. , |
Тсамовоспл., |
Пределы взры- |
|
|
оС |
оС |
оС |
ваемости |
|
|
|
|
|
мин. |
макс. |
|
|
|
|
об.% |
об.% |
Водород |
ʋ 253 |
ʋ |
465 |
4 |
77 |
Метан |
ʋ 162 |
ʋ |
595 |
4ю4 |
16.5 |
Ацетилен |
ʋ 84 |
ʋ |
305 |
2.3 |
82 |
Пропан |
ʋ 42 |
ʋ 96 |
470 |
1.7 |
10.9 |
Бутан |
0 |
ʋ 69 |
365 |
1.4 |
9.3 |
Ацетальдегид |
+20 |
ʋ 30 |
155 |
4 |
57 |
н-Пентан |
+36 |
ʋ 35 |
285 |
1.4 |
8.0 |
Диэтиловый |
+36 |
ʋ 40 |
170 |
1.7 |
36 |
эфир |
|
|
|
|
|
Сероуглерод |
+46 |
ʋ 30 |
102 |
1.0 |
60 |
Ацетон |
+65 |
ʋ 18 |
540 |
2.1 |
13 |
Метанол |
+65 |
+11 |
455 |
5.5 |
37 |
н-Гексан |
+69 |
ʋ 22 |
240 |
1.0 |
8.1 |
Этанол |
+78 |
+13 |
425 |
3.5 |
15 |
Изопропанол |
+82 |
+12 |
425 |
2 |
12 |
н-Гептан |
+98 |
ʋ 4 |
215 |
1.0 |
7 |
Изооктан, 2,2,4- |
+99 |
ʋ 12 |
410 |
1.0 |
6 |
триметилпентан |
|
|
|
|
|
н-Октан |
+126 |
+12 |
210 |
0.8 |
6.5 |
Бензин |
30-200 |
< -20 |
200-410 |
0.6 |
8 |
Дизельное топ- |
150- |
>+55 |
ок. 220 |
0.6 |
6.5 |
ливо |
390 |
|
|
|
|
51
Расчет температуры вспышки смесей горючих жидко-
стей выполняется по уравнениям, учитывающем мольные доли компонентов в жидкой фазе, мольные энтальпии испарения веществ. Для получения температуры вспышки смесей горючих жидкостей самым надежным является прямое экспериментальное измерение смесей горючих веществ.
Измерения температуры вспышки осуществляют также в открытом тигле по методам Кливленда и Бренкена. Сущность методов заключается в нагревании пробы нефтепродукта в открытом тигле с установленной скоростью до тех пор, пока не произойдет вспышка паров от зажигательного устройства. Метод измерения в открытом тигле менее точен, чем метод измерения в закрытом тигле, поэтому не так часто используется.
По температуре вспышке из группы горючих жидкостей выделяют легко воспламеняющиеся горючие жидкости с температурой вспышки не более 61 оС в закрытом тигле или 66 оС в открытом тигле.
Температура воспламенения – наименьшая температура вещества, при которой пары над поверхностью горючего вещества выделяются с такой скоростью, что при воздействии на них источника зажигания наблюдается воспламенение. Воспламенение соответствует пламенному горению вещества, инициированное источником зажигания и продолжающееся после его удаления.
Существуют полуавтоматические приборы для определения температуры воспламенения горючих жидкостей, воспламеняющихся в интервале температур от – 30 до + 300 °C. Один из таких приборов представлен на фото 2.
Если известна зависимость давления насыщенных паров от температуры, то для расчета температуры воспламенения Твоспл. Веществ, состоящих из атомов С, Н, О, N, используется уравнение:
Твоспл. = 453/(p·D·β)
52

где p – парциальное давление паров горючей жидкости при температуре вспышки [кПа]; D – коэффициент диффузии пара в воздух [см2/с]; β – стехиометрический коэффициент кислорода в реакции горения.
Фото 2. Полуавтоматический прибор Rapid Tester RT-1 для определения температуры воспламенения в закрытом тигле [ссылка]
Температура самовоспламенения соответствует наи-
меньшей температуре горючего вещества, при нагреве до которой происходит резкое увеличение скорости экзотермической реакции, приводящее к возникновению пламенного горения и/или взрыва.
Из-за сложности прямого измерения температуры самовоспламенения газов или паров, за температуру самовоспламе-
нения Тсамовоспл. Принимают температуру стенки реакционного сосуда, в котором наблюдают самовоспламенение. Эта темпера-
тура зависит от условий тепломассоообмена как внутри реакционного сосуда, так и самого сосуда с окружающей средой, а также каталитического влияния стенок сосуда.
Устройство, в котором осуществляется определение температуры самовоспламенения, представлен на рис. 9. В корпусе воздушного термостата (1) размещены электрическая спираль
53
нагревателя (2), вентилятор (3), реакционный сосуд (4), крышка термостата (5), зеркало (6) и термопары (7).
Рис.9.Устройство для определения температуры самовоспламенения
[1]
Для некоторых горючих жидкостей температуры самовоспламенения приведены в табл. 4 .
Структура и механизм горения жидкостей
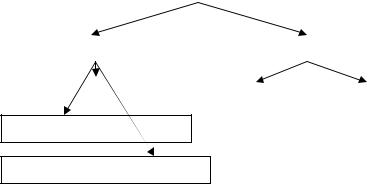
Структура диффузного факела пламени над зеркалом горючей жидкости отличается от горения газовой смеси тем, что поступающие с поверхности жидкости горючие пары смешиваются с кислородом воздуха не за счет кинетической энергии вытекающего газового потока, а более медленно по механизму кон-
вективной и молекулярной диффузии (рис. 10). Горячие продук-
ты сгорания устремляются вверх, а на их место из окружающего пространства поступает холодный воздух, который разбавляет горючие пары. От факела пламени к поверхности зеркала жидкости поступает лучистая энергия, нагревающая поверхностные слои жидкости, интенсифицируя процесс её испарения. По мере развития процесса пламя переходит в турбулентный режим го-
54

рения и будет расти до тех пор, пока не установится режим теплового равновесия и газодинамического равновесия. Максимальная температура турбулентного диффузионного пламени большинства горючих жидкостей не превышает 1250 – 1350 оС.
устанавливается относительно стационарный процесс испарения и выгорания паров.
Продукты горения
 Т ≈ 1250 оС
Т ≈ 1250 оС
Воздух
Воздух
Т ≈ 50 – 250
о
Рис. 10 . Распределение температур в пламени при горении жидких веществ
Скорость выгорания жидкостей
С температурой кипения связана такая характеристика жидкостей, как скорость выгорания. Под этим термином понимается линейная скорость уменьшения высоты слоя жидкости при ее горении со свободной поверхности в единицу времени. Скорость выгорания зависит от температуры, диаметра резервуара, уровня жидкости в резервуаре, скорости ветра и т.п.
Для резервуаров малого диаметра скорость выгорания сравнительно велика. При увеличении диаметра она сначала уменьшается, потом снова возрастает, пока не достигнет постоянной величины. Такая сложная зависимость связана с влиянием разных факторов на скорость выгорания. В резервуарах малого
55
диаметра горячие стенки нагревают жидкость и увеличивают скорость испарения и горения. При увеличении диаметра влияние нагретых стенок снижается, так как стенки контактируют с уменьшающейся частью жидкости. С другой стороны, при увеличении диаметра наблюдается переход горения от ламинарного к турбулентному. При этом уменьшается полнота сгорания, увеличивается количество образующейся сажи. Возрастание степени черноты пламени способствует увеличению теплового потока от пламени. Поверхность жидкости нагревается сильнее, и происходит увеличение скорости испарения и горения.
В резервуарах диаметром более 2 метров скорость выгорания жидкостей практически одинакова (горение со свободной поверхности). В табл. 5 приведены значения скорости выгорания некоторых жидкостей при комнатной температуре.
Т а б л и ц а 5.
Скорость выгорания некоторых жидкостей со свободной поверхности при комнатной температуре
Жидкость |
Скорость выгорания, |
|
мм/мин |
Ацетон |
1,4 |
Автомобильный бензин |
1,75 |
Бензол |
3,15 |
Керосин |
1,1 |
Метиловый спирт |
1,2 |
Диэтиловый эфир |
2,93 |
Сильный ветер способствует более эффективному смешиванию паров с воздухом, повышению температуры пламени и увеличению нагрева поверхности жидкости. В результате этого скорость выгорания увеличивается.
По мере снижения уровня жидкости в резервуаре увеличивается расстояние от пламени до поверхности жидкости, поэтому уменьшается приток тепла к жидкости. Скорость выгора-
56
ния постепенно уменьшается, и при некотором критическом рас- |
|
|
|
|
|
|
|
|
|
ГЛАВА 4 |
||
стоянии поверхности жидкости от борта резервуара горение мо- |
|
|
|
|
|
|
|
|
|
|
|
|
жет прекратиться. Это расстояние называется критической вы- |
|
|
ГОРЕНИЕ ТВЕРДЫХ ВЕЩЕСТВ |
|
|
|
||||||
сотой. Для больших резервуаров, в которых критическая высота |
|
|
|
|
|
|
|
|
|
|
|
|
всегда больше высоты резервуара, самотушение не происходит. |
|
Рассмотрим особенности горения твердых материалов, |
||||||||||
Расчеты показывают, что критическая высота резервуара димет- |
температура плавления или разложения которых превышает |
|||||||||||
ром 23м равна 1 км, в то время как его обычная высота равна |
50°C, а также веществ, не имеющие температуры плавления, на- |
|||||||||||
12м. |
пример таких, как древесина. |
|
|
|
|
|
|
|
|
|||
|
|
По химическому составу твердые горючие материалы де- |
||||||||||
|
лятся на органические и неорганические вещества. Среди горю- |
|||||||||||
|
чих органических веществ принято выделять углеводороды, |
|||||||||||
|
целлюлозосодержащие материалы и элементоорганические со- |
|||||||||||
|
единения. Среди неорганических материалов выделяют металлы |
|||||||||||
|
и неметаллы (рис. 11). |
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Твердые горючие материалы |
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
Органические |
|
|
Неорганические |
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
Углеводороды |
|
|
|
|
|
|
|
|
|
|
|
|
|
Металлы |
|
|
|
Неметаллы |
|
||||
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
Целлюлозосодержащие
Элементоорганические
Рис. 11. Классификация твердых горючих материалов по химическому составу
К горючим твердым углеводородам условно относят природные, искусственные и синтетические полимерные материалы, в состав которых входят С, H, N, O. По структуре углеводороды имеют однородное строение. К ним относятся, например, поли-
57 |
58 |

этилен –[CH 2 – CH 2]n–, глицин (аминокислота) H2N–CH 2–COOH
имиллионы других твердых материалов.
Вотдельную подгруппу сведены природные органические материалы, основой которых служит целлюлоза (углевод):
CH2OH |
|
|
H |
O |
|
H |
H |
O |
OH |
|
|
|
|
|
|
|
H |
H |
OH |
n = 3000 - 14000 |
Кним относят полимерные материалы растительного происхождения (древесина, хлопок и др.), которые в отличие от искусственных и синтетических полимеров являются не однородными материалами, а смесью природных полимеров, включая такой полимер, как целлюлоза. В условиях пожара поведение всех растительных материалов одинаковое, и по этой причине их объединяют в одну группу целлюлозосодержащих материалов.
Кэлементорганическим соединениям по данной классификации относят вещества, в состав которых входят такие элементы, как S, P, Si, Cl и металлы. С этих позиций поливинилхлорид является твердым элементоорганическим соединением:
–[CH 2 – CH] n–
│
Cl
В условиях пожара элементорганические соединения образуют особо токсичные вещества и по этой причине их объединяют в одну группу.
Неорганические твердые горючие вещества – это металлы и неметаллы. Практически все металлы при нормальных условиях окисляются на воздухе. Но к горючим относятся только те из них, которые могут воспламеняться на воздухе от открытого источника зажигания средней мощности и самостоятельно гореть
59
после его удаления. К наиболее горючим относятся щелочные и щелочноземельные металлы.
К неметаллам относят фосфор, мышьяк, кремний, серу. Механизм их воспламенения во многом напоминает горение металлов.
Подавляющее большинство конденсированных органических материалов при нагревании переходят в газовую фазу, после чего осуществляется гомогенное горение продуктов газификации. Этот фазовый переход может осуществляться путем плавления твердого горючего вещества и последующее испарение жидкости. В этом случае процесс воспламенения повторяет процесс подготовки и воспламенения горючих жидкостей. Их горение протекает в гомогенном режиме.
Твердые горючие материалы, которые переходят в парогазовое состояние минуя жидкую фазу за счет сублимации или термической деструкции молекул, горят как в гомогенном, так и в гетерогенный режиме горения.
Общие закономерности воспламенения и горения твердых горючих веществ
Возникновение и развитие горения для твердых горючих материалов имеют много общего с процессами горения газов и жидкостей. Кроме общих черт существует целый ряд особенностей, обусловленных агрегатным состоянием и различиями в строении.
Рассмотрим механизм воспламенения твердого горючего вещества. При контакте вещества с нагретым до высокой температуры источником загорания происходит нагрев поверхностного слоя до температуры фазового перехода (плавления) или термического разложения. Если это материал растительного происхождения, то из него сначала начинает испаряться влага.
Дальнейший нагрев приводит к температуре фазового перехода, происходит плавление материала, затем нагревание расплава до температуры кипения или разложения.
60
