
6116
.pdf
митировать может скорость химической реакции. В этом случае горение происходит в кинетической области.
Вгазовых смесях процесс может протекать также в диффузионной области, если общее давление низкое, так как самой медленной стадией будет взаимная диффузия и столкновение реагирующих частиц. Между этими крайними случаями есть область промежуточных давлений, при которых важны оба процесса – и химический, и физический.
Вдиффузионной области происходит также горение газа, выходящего из трубы. В этих случаях смесь паров и газов с воздухом образуется во время горения в результате диффузии кислорода к молекулам горючего.
При интенсивном высокотемпературном горении твердого топлива обычно лимитирует диффузия кислорода к поверхности топлива и отвод продуктов от поверхности. В таком процессе горения антрацита, кокса или древесного угля, когда температура на поверхности большая, скорость реакции очень большая.
Вэтом случае скорость подхода кислорода к поверхности отстает от скорости химической реакции.
Теория теплового воспламенения
Часто самовоспламенение газовых смесей горючего и окислителя при повышении температуры приводит к взрыву. Теория теплового воспламенения или взрыва разработана русским ученым, лауреатом Нобелевской премии, академиком Н.Н. Семеновым.
Рассмотрим тепловое воспламенение на примере элементарной бимолекулярной реакции:
А + В ® продукты реакции; DН [кДж] Скорость реакции
− |
Е |
|
|
u = k×CАСВ = k0× е RT ×CАСВ |
(1.1) |
||
Введем понятие скорость тепловыделения – |
количество энергии |
||
в форме теплоты, которое выделяется в единицу времени в еди-
21
нице объема реактора. Скорость тепловыделения Q1 имеет размерность [кДж/м3·с]
− Е
Q1 = DН×u = DН× k0× е RT ×CАСВ (1.2)
Воспользуемся уравнением идеального газа рV = nRT и мольными долями реагентов NА + NВ = 1 для преобразования уравнения
(2).
pi V = ni RT или pi = |
ni |
RT или pi = СiRT, отсюда |
|
|||
|
|
|||||
|
V |
|
||||
Сi = |
рi |
|
(1.3) |
|||
RT |
||||||
|
|
|
|
|||
Парциальные давления реагентов рА и рВ выразим через |
||||||
общее давление системы р = рА + рВ: |
|
|||||
рА = рNА |
(1.4) |
|||||
рВ = р (1 – NА) |
(1.5) |
|||||
Выразим CА и СВ через общее давление и мольные доли реагентов:
CА = |
|
|
p |
N A |
, CB = |
p |
(1- N A ) |
|
|
|
|||
|
|
|
|
|
|
|
|||||||
|
RT |
|
RT |
|
|
|
|||||||
и подставим в уравнение (2): |
|
|
|
|
|
|
|
|
|||||
|
|
|
Hk0 |
|
|
|
− |
Е |
|
|
|
|
|
Q1 = |
|
|
|
NA×(1 – |
NA)р2 е RT |
(1.6) |
|||||||
|
(RT )2 |
||||||||||||
|
|
|
|
|
|
|
|
|
|
||||
Обозначим выражение |
|
|
Hk0 |
= D. |
|
|
|
|
|
|
|
||
|
|
(RT )2 |
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
− |
Е |
|
По сравнению экспоненциальным выражением |
е RT зна- |
||||||||||||
чение D можно принять за постоянную величину, т.к. при изменении температуры D изменяется незначительно по сравнению с
− Е
экспоненциальным множителем е RT .
После всех преобразований тепловыделение, обусловленное химической реакцией примет вид:
22

− |
Е |
|
Q1 = D NA×(1 – NA)р2 е RT |
(1.7) |
|
Теплоотдача реактора Q2, в котором происходит химическое |
||
превращение, определяется уравнением: |
|
|
Q2 = æ ×(Т – Т0) |
(1.8) |
|
где æ – коэффициент теплопередачи, зависящий от конфигурации реактора, площади поверхности его стенок, Т – температура газообразной реакционной смеси, Т0 – температура стенки сосуда, через которую энергия в форме теплоты Q2 передается в окружающую среду. На рис. 2 представлены зависимости скоростей тепловыделения и теплоотдачи от температуры реакционной смеси.
Q1 Q2 |
|
Q1 Q2 |
|
|
||||||
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
1 |
2 |
3 |
|
|
|
р2 |
р0 р1 |
||||||
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
а) |
|
|
|
|
|
р0 |
|
|
|
|
|
|
|
|
б) |
|
|
|
||
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
Т0 |
Т1* |
Т1 |
Т2* Т |
Т01 Т0 |
Т1 Т03 |
T |
|
|
|
||||
|
Рис. 2. Зависимость скорости тепловыделения Q1 и скорости |
|||||
теплоотдачи Q2 от температуры: а) при различных давлениях |
|
|||||
р1 |
> р0 > |
р2; б) при различных температурах стенки |
|
|||
При данной температуре стенки Т0 зависимость теплопередачи Q2 от температуры выражается прямой линией (рис. 2, а). Если эту прямую сопоставить с кривой р2, то станет очевидной невозможность стационарного процесса. Скорость тепловыделения Q1 везде выше скорости теплопередачи: Q1 > Q2.
23
При более низком давлении р1 и температуре стенки Т0 смесь сначала разогревается до температуры Т1*. Разогрев прекращается при достижении температуры Т1*, т.к. скорости тепловыделения и теплопередачи становятся одинаковыми Q1 = Q2 и химический процесс становится стационарным.
При давлении р0 и температуре стенки Т0 разогревание реактора происходит до температуры Т1 и прекращается. Процесс становится стационарным. Самовоспламенение возможно, если по каким-то причинам температура Т1 повысится хотя бы ненамного, тогда Q1 станет больше Q2.
На рис. 2, б показано влияние температуры стенки при заданном давлении р0. Повышение температуры стенки ведет к уменьшению скорости теплоотдачи и созданию ситуации, когда процесс приведет к тепловому взрыву.
Расчеты показывают [см. Е.Н. Еремин. Основы химической кинетики в газах и растворах, М.: изд. МГУ, 1971, С. 248], что для заданного давления р0 температура стенки и температура воспламенения практически совпадают:
Т1 @ Т0 Иными словами, тепловое воспламенение в своем начале может
быть почти изотермическим, что объясняется сильной зависимостью скорости реакции от температуры и ведет к затруднениям при экспериментальном определении природы воспламенения.
В разнообразных случаях при давлениях выше р0 воспламенение происходит без существенной задержки (период индукции меньше одной секунды). Однако во многих случаях самовоспламенение происходит со значительным запозданием, ис- Tчисляемым секундами и минутами.
Таким образом, в зависимости от условий проведения реакции горения (температуры окружающей среды и смеси, энтальпии реакции и др. параметров системы), реакция горения может идти по разному: стационарно (редкое сочетание условий), с самоохлаждением, или со взрывом. Начиная с критиче-
24
ской температуры окружающей среды процесс всегда приводит к самовоспламенению из-за прогрессирующего самоускорения.
Теория самовоспламенения (теплового взрыва) играет огромную роль в изучении таких процессов, как взрывы в шахтах и на производствах с органическими пылевидными продуктами, в теории двигателей внутреннего сгорания, авиационных и ракетных двигателях, и других процессах.
Основы теории цепных реакций
Многие специфические особенности реакций горения и взрыва объясняются особым – цепным механизмом этих процессов. В обычных не цепных реакциях взаимодействие происходит путем столкновения между реагирующими молекулами. При столкновении молекулы сдвигаются до такого расстояния, при котором электроны и атомы одной молекулы попадают в сферу действия электрических сил другой молекулы. При столкновении происходят переходы электронов от одного атома к другому и перегруппировки атомов, в результате которых образуются новые молекулы. Чтобы эти процессы произошли, требуется минимально необходимый запас энергии у сталкивающихся молекул. Далеко не каждое столкновение приводит к реакции. Обычно их доля от общего числа столкновений составляет величину от 10-15 до 10-20. В реакциях, к которым относятся реакции цепного горения и взрыва, решающую роль играют промежуточные свободные атомы и радикалы – микрочастицы, располагающие неспаренными электронами и обладающие высокой реакционной способностью.
Они стремятся любым способом присоединить к себе другие атомы или активные частицы, чтобы реализовать свои валентные возможности. Атомы и радикалы, участвующие в цепных реакциях имеют очень низкую энергию активации, поэтому доля эффективных столкновений очень высока, близка к 1. Если учесть, что в газе при давлении 1 атм. каждая молекула претерпевает около 1010 столкновений, то время жизни активных
25
частиц составляет ~10-10 с. Ниже вы познакомитесь с механизмами некоторых цепных реакций горения, в которых реакции активных частиц имеют достаточно высокую энергию активации (десятки кДж/моль). Для них доля эффективных столкновений на несколько порядков меньше 1 и далеко не каждое столкновение заканчивается результативно. Например, при температуре 300К доля эффективных столкновений для реакций с энергией активации 5, 10, 15, 20 и 50 кДж/моль приблизительно равна со-
ответственно 10-1, 10-2, 10-3, 10-4 и 10-9.
Особенностью взаимодействия свободных радикалов или атомов заключается в том, что в реакциях с молекулами горючих веществ и молекулами окислителя (как правило, с молекулами кислорода) всегда образуются новые атомы и радикалы. Пока существуют свободные радикалы и атомы, происходит непрерывный процесс создания новых активных частиц. Выстраивается цепь последовательно и параллельно протекающих элементарных реакций, конечным результатом которых становятся продукты реакции. Так как мы рассматриваем химические процессы (не ядерные реакции, которые тоже имеют цепной характер), то цепные реакции можно определить так: цепные реакции
– это реакции в которых появление свободных атомов и радикалов вызывает появление цепь превращений исходных молекул вследствие регенерации активных частиц в каждом элементарном акте реакции (в каждом звене цепи).
Отступление. Различают сложные и элементарные химические реакции. Под элементарной реакцией подразумевают реакцию, которая идет в один акт, в одно действие. Сложная реакция представляет собой совокупность элементарных реакций, природа и последовательность которых составляют механизм реакции.
В создании теории цепных реакций основную роль сыграл советский ученый академик Н.Н Семенов. Он показал, что цепные реакции являются весьма распространенными и играют важную роль во многих практически важных процессах, в том числе и в реакциях горения топлива.
26
Рассмотрим механизм цепной реакции на примере горения водорода в кислороде.
Стехиометрическое уравнение реакции записывается в
виде:
2Н2 + О2 = 2Н2О
В таком виде записывается сложная реакция. За указанным стехиометрическим уравнением скрыты элементарные реакции зарождения, продолжения, разветвления и обрыва цепи.
Реакция зарождения цепи соответствует стадии появления свободных атомов и радикалов.
Возможны три варианта реакции:
Разложение молекул водорода при столкновении с нагретой стенкой реактора или возбужденной молекулой М*:
Н2 + М* = Н×. + ×Н. + М (2.1)
Столкновение возбужденных молекул водорода и кисло-
рода:
Н2* + О2* ® 2НО× |
(2.2) |
В воздухе, как правило, содержатся пары воды:
М* + Н2О ® Н×. + ×ОН. + М (2.3)
Низкая энергия связи Н–O в молекулах Н2О по сравнению с энергиями связи Н– Н и О=О в молекулах Н2 и О2 делает реакцию (3) основной реакцией зарождения цепи.
Продолжение цепи |
Н2. + ××ОН ® Н2О + ×Н. |
(2.4) |
Разветвление цепи |
Н×. + О2 ® ×ОН. + ×О× |
(2.5) |
×О× + Н2 ® ×ОН. + ×Н. |
(2.6) |
|
Обрыв цепи. НО× + Н + М ® Н2О + М* |
(2.7) |
|
Если сложить реакции 2.4 – 2.7 получим брутто-процесс:
2Н2 + О2 = 2Н2О
В реакции (2.5) образуется частица с двумя неспаренными электронами – бирадикал. В этой реакции одна активная частица образует две новых, поэтому реакция (2.5) является реакци-
27
ей разветвления цепи. Схематически цепная реакция горения водорода представлена на рис. 3.
|
|
|
О2 |
О |
|
||||
|
Н2 |
Н |
|
|
|||||
|
|
|
|||||||
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
НО |
|
||
|
|
|
|
|
|
|
|
||
|
НО |
Н2О |
|
|
|
|
|
|
|
|
|
|
|
|
|
Н |
|
||
Н2О |
О2 |
|
|
Н2 |
|
|
|
||
|
|
|
|
|
|
|
|||
НО |
|
|
|
||||||
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
||
|
Н |
|
|
|
|
|
|
Н2О |
|
|
|
|
|
|
|||||
ОН2
НО
Н
Рис. 3. Механизм горения водорода в кислороде
Реакции (2.4 – 2.6) имеют разные энергии активации – соответственно 22, 71 и 41 кДж/моль. Так как наибольший энергетический барьер имеет реакция (2.5), то она наиболее медленная и является лимитирующей.
Благодаря разветвлению происходит утроение числа активных частиц после каждой пары реакций (2.5) и (2.6). Число активных частиц увеличивается лавинообразно. После n пар реакций (2.5) и (2.6) разветвления их число становится равным 3n. Например, всего лишь после 50 пар реакций разветвления число активных частиц становится равным ~1*1024. Это огромное число. Каждая новая активная частица начинает новую цепь. После каждой пары реакций (2.5) и (2.6) одна цепь разветвляется на три. Потому правильнее было бы говорить об увеличении количества цепей в результате разветвления, то есть о лавинообразном ускорении реакции горения.
28
По такой же схеме развивается ядерный взрыв – один образующийся нейтрон поглощается ядром урана и вызывает его распад с образованием двух нейтронов, и т.д. Через мгновение число нейтронов достигает колоссальных величин, и происходит взрыв.
Пределы воспламенения. Полуостров воспламенения.
Для воспламенения газовой смеси концентрация горючего должна находиться в определенных пределах – между нижним и верхним пределами воспламенения.
Эти пределы зависят от горючего, окислителя, устройства, в котором изучается процесс (геометрии сосуда, материала его стенок), от наличия посторонних примесей в газовой смеси.
При замене воздуха на кислород оба предела возрастают, причем нижний немного, а верхний более сильно. Например, для водорода в смеси с кислородом нижний предел равен 4%, а верхний 77%. Для метана нижний предел равен 4,4%, а верхний
16,5%.
Объяснение наличия пределов воспламенения лежит в области химической кинетики. Как известно, скорость химических реакций пропорционально произведению концентрации реагирующих веществ. В данном случае это горючее и окислитель. Нижний предел характеризуется низкой концентрацией горючего, поэтому скорость мала и процесс затухает, происходит без самоускорения.
Верхний предел связан с малой концентрацией окислителя, с его нехваткой для развития процесса горения. Наиболее оптимальной для процесса горения является стехиометрическое соотношение горючего и окислителя, то есть соответствующее коэффициентам в уравнении реакции между ними.
Сильное отличие верхнего предела смесей с кислородом и воздухом связано с тем, что в воздухе всего 21% кислорода. При замене воздуха на кислород концентрация кислорода в го-
29
рючей смеси возрастает почти в пять раз, поэтому его нехватка наступает при гораздо более высоких концентрациях горючего.
Из-за наличия нижнего предела воспламенения практически редко происходит полное сгорание топлива. Особенно это проявляется в устройствах, где существует короткое время пребывания топлива в факелах (например, в двигателях внутреннего сгорания). В них всегда происходит выброс в атмосферу непрореагировавшего топлива (газ, бензин, дизельное топливо и т.д.). На крупных ТЭЦ горение происходит в длинных факелах, и доля несгоревшего топлива существенно ниже.
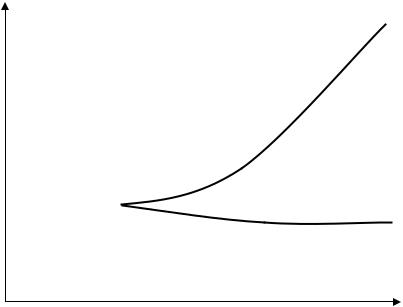
Для разветвленных цепных реакций существует зависимость способности гомогенной смеси к воспламенению от температуры и давления смеси. Эта зависимость называется полуостровом воспламенения. Типичный график зависимости представлен на рис.4.
Верхняя и нижняя кривая образуют верхний и нижний пределы воспламенения. При условиях выше верхнего предела или ниже нижнего предела воспламенение невозможно.
Объяснение существования пределов воспламенения связано с соотношением скорости разветвления и скорости обрыва цепи. Если первая больше второй, то воспламенение произойдет. В противном случае при постоянно действующем источнике зажигания реакция переходит в стационарный режим.
Существование нижнего предела связано с тем, что при снижении давления скорость реакции разветвления уменьшается, так как она пропорциональна концентрации веществ. В то же время скорость обрыва цепи на стенках увеличивается из-за снижения концентрации молекул и числа столкновений, препятствующих достижению стенок активными частицами. Увеличивается длина свободного пробега активных частиц. Все большая доля активных частиц может достигнуть стенок сосуда. При некотором давлении скорость обрыва цепей на стенке окажется больше скорости разветвления цепей, и реакция перейдет в стационарный режим.
30
Р
Верхний предел воспламенения
Область
цепного Область отсут- взрыва ствия цепного
взрыва
Нижний предел воспламенения
Т
Рис. 4. Полуостров воспламенения водорода в кислороде
Существование верхнего предела связано с тем, что с ростом давления скорость обрыва цепи в объеме начинает преобладать над скоростью разветвления. Реакция в условиях выше верхнего предела также переходит в стационарный режим, при котором скорость обычно очень мала.
Конкретные значения величин давления и температуры отличаются для разных систем. Например, точка, в которой соединяются верхняя и нижняя кривая (мыс полуострова воспламенения), для смеси водорода и кислорода, соответствует давлению 5 мм рт. ст. и температуре 385° С, а конец верхней кривой соответствует давлению 400 мм рт. ст. и температуре 580° С.
Верхний предел значительно зависит от температуры. На него оказывает также сильное влияние природа и количество
31
примесей, играющих роль третьей частицы при обрыве. На него мало влияет форма и размер сосуда.
Напротив, на нижний предел оказывает влияние форма сосуда, его диаметр и материал его стенок. Влияние температуры на нижний предел незначительно.
Поэтому каждому составу смеси и каждому реакционному сосуду отвечает своя область воспламенения. При постоянном общем давлении горючего и окислителя изменение их соотношения также приводит к изменению пределов воспламенения. При снижении концентрации горючего (при сохранении постоянным общего давления) весь график смещается вправо параллельно оси температуры. При добавлении в горючую смесь инертного газа пределы воспламенения также будут изменяться. Например, нижний предел будет снижаться. Смесь, которая могла находиться вне пределов воспламенения, при добавлении инертного газа может попасть внутрь полуострова и воспламениться.
32

ГЛАВА 2
ГОРЕНИЕ ГАЗООБРАЗНЫХ ВЕЩЕСТВ
Горение газовых смесей является гомогенным процессом. Особенностью горения гомогенных систем является наличие критических условий, т.е. определенных, характерных для данной конкретной горючей смеси, параметров, вне пределов которых реакция протекает стационарно, без самоускорения, а в их пределах она самоускоряется. К таким параметрам относится концентрация горючего вещества и окислителя, давление газовой смеси, начальная температура горения, наличие примесей, геометрия сосуда, в котором происходит горение, материал его стенок и некоторые другие параметры.
Переход от медленного процесса к быстрому процессу горения носит резкий характер. Достаточно изменить лишь некоторые параметры.
Время полного израсходования горючего зависит от источника зажигания – его мощности, температуры, площади действия. Если параметры смеси находятся в области воспламенения, то достаточно кратковременного воздействия источника зажигания, чтобы произошло быстрое сгорание смеси.
Характер горения гомогенной газовой смеси
Горение гомогенной газовой смеси зависит от способа подачи воздуха, необходимого для горения. Существуют различные виды сжигания газов. Осуществляют горение предварительно подготовленной горючей газовой смеси, состоящей из окислителя и окисляемого веществ и горение раздельно поступающих окислителя и горючего газа в зону реакции.
В предварительно перемешанной смеси окислителя и окисляемого веществ – стехиометрической газовой смеси интенсивность горения зависит только от скорости элементарных химических реакций. Такой вид горения называют кинетическим.
33
В стехиометрической газовой смеси реакция идет во всем объеме смеси при выходе из горелки.
Ламинарное и турбулентное горение стехиометрической газовой смеси
Для стехиометрической газовой смеси различают ламинарное и турбулентное горение. При ламинарном движении газа скорость её движения распределяется в горелке по параболе. Это обусловлено тем, что у стенок внутри горелки скорость газа очень мала в результате трения и достигает максимальной скорости на оси горелки. Аналогичное распределение скорости сохраняется и при выходе из горелки (рис. 5).
Поток стехиометрической смеси окислителя и горючего газа
Рис. 5. Ламинарное горение стехиометрической газовой смеси
На выходе из горелки скорость потока равна скорости распространения пламени ʋпот. = ʋпл.. Выходной срез горелки нагрет до высокой температуры и обеспечивает непрерывное зажигание стехиометрической смеси окислителя и горючего вещества.
У стенки горелки скорость потока меньше, чем скорость горения, но пламя не может проникнуть внутрь вследствие ох-
34

лаждения газа ниже разогретого выходного среза горелки, где
ʋпот. > ʋпл..
В процессе нарастания скорости потока от периферии к центру пламя образует конусообразный факел.
Ламинарное горение стехиометрической смеси характеризуется небольшой высотой пламени, высокой температурой и практически полным сгоранием горючего газа. Эти характеристики являются несомненным достоинством такого горения.
К недостаткам такого вида горелок следует отнести нестабильность пламени. Проскок пламени внутрь или отрыв пламени от устья горелки происходит при малейшем нарушении равенства скоростей движения и горения газового потока ʋпот. =
ʋпл.
Турбулентное горение однородной газовой наблюдается при высоких скоростях движения газа. Оно используется для интенсификации горения и требует стабилизации пламени. Попутный поток атмосферного воздуха, сопровождающий движение горящего газа, охлаждает зажигающее кольцо горелки. Оно теряет поджигающую способность и факел погасает.
Диффузное горение газа
Диффузное горение газа происходит в случае, когда через горелку подается горючий газ не смешанный с окислителем. Газ и воздух подаются раздельно, а горение поддерживается в результате взаимной диффузии окислителя и окисляемого вещества.
В зависимости от характера движения смешивающихся газов различают ламинарное диффузное горение и турбулентное диффузное горение.
Ламинарное диффузное горение осуществляется в усло-
виях, когда кислород, необходимый для горения, поступает из окружающей атмосферы и смешивается с горючим газом в результате молекулярной диффузии. При круглой горелке формируется конусообразный факел. Горение поддерживается за счет
35
кольцевой зоны зажигания раскаленной верхней кромки газовой горелки. Факел обладает большой устойчивостью. Проскок пламени в горелку исключается из-за раздельной подачи горючего газа и воздуха. Зона устойчивого горения располагается на поверхности факела, где устанавливается стехиометрическое соотношение между горючим газом и кислородом воздуха. Именно стехиометрическое соотношение обеспечивает устойчивость факела. Реакция горения осуществляется в узкой светящейся зоне фронта горения, которая значительно разбавлена горячими продуктами горения и не превышает по толщине 1 мм. Образующиеся продукты сгорания диффундируют как в окружающее пространство, так и внутрь факела. Поверхность пламени отделяет окислительную область вне факела, в которой имеются кислород и продукты сгорания, но нет горючего газа, от восстановительной области внутри факела, в которой нет кислорода, но есть горючий газ и продукты сгорания (рис. 6).
воздух воздух
Поток горючего газа
Рис. 6. Ламинарное диффузное горение газа
Газ, поступающий из горелки в зону горения, нагревается за счет горячих продуктов реакции и подвергается термическому разложению – пиролизу. Так метан в восстановительной зоне в отсутствии кислорода уже при 680 – 700 оС частично термически
36

распадается с образованием свободного углерода, высокодис- |
полнота сгорания горючего газа и продуктов пиролиза горючего |
|||||
персного углерода (сажи), водорода и трудносжигаемых углево- |
газа. |
|||||
дородов. Доля термической деструкции метана при 950 оС со- |
Структура и механизм горения газовых смесей |
|||||
ставляет 26%, а при 1150 оС достигает уже 90%. |
При вытекании вертикальной газовой струи снизу вверх в |
|||||
Свободный углерод, раскаленная сажа и другие мелко- |
атмосферное пространство, образуются зоны горения смеси га- |
|||||
дисперсные частицы, находящиеся в пламени, излучают яркий |
зов. Смеси с большим содержанием горючего газа условно на- |
|||||
свет. |
зываются «богатыми», а предел – верхним концентрационным |
|||||
Достоинства ламинарного диффузного горения: |
пределом воспламенения (ВКПВ). Смеси с малым содержанием |
|||||
- отсутствие проскока пламени внутрь горелки; |
горючего газа называются «бедными», а предел – нижним кон- |
|||||
- высокая устойчивость пламени при изменении тепловых нагру- |
центрационным пределом воспламенения (НКПВ). Вне этих |
|||||
зок |
пределов смеси горючего газа с окислителем (воздухом) не го- |
|||||
- равномерная температура по длине пламени. |
рят. В промежутке между концентрационными пределами горе- |
|||||
К недостаткам следует отнести: |
ния газовой смеси лежит поверхность стехиометрического со- |
|||||
- термический распад углеводородов; |
става газовой смеси. В этом тончайшем слое максимальная тем- |
|||||
- низкая интенсивность горения; |
пература и максимальная скорость горения. Благодаря этому |
|||||
- высокая доля продуктов неполного сгорания горючего газа. |
слою устанавливается стационарный режим горения и форма |
|||||
Турбулентное диффузное горение осуществляется в усло- |
пламени. Ориентировочно максимальная температура пламени в |
|||||
виях интенсивного перемешивания горючего газа и кислорода |
тонком слое стехиометрической смеси для большинства углево- |
|||||
воздуха. Именно этот способ горения широко используется в |
дородов равна 1350 – 1550 оС (рис. 7). |
|||||
промышленных теплогенерирующих установках. |
|
|
|
|
|
|
Положение зоны воспламенения и горения в турбулент- |
|
|
|
|
|
|
ном диффузном горении соответствует месту точек, где образу- |
|
|
|
|
|
|
ется смесь стехиометрического состава. |
|
НКПВ |
|
|
|
|
Практика показывает, что выделяющаяся при сгорании |
|
|
|
|
|
|
газа энергия в форме теплоты посредством диффузии и турбу- |
|
|
|
|
|
|
|
|
Т ≈ 1350 – 1550 оС |
|
|
||
лентной теплопроводности горячих продуктов горения переда- |
|
|
|
|||
ется горючей смеси, обеспечивая её воспламенение и распро- |
|
|
|
|
|
|
|
|
|
|
|
|
|
странение пламени. |
|
|
|
|
|
|
|
ВКПВ; Т ≈ 50 оС |
|
||||
Положение зоны горения определяется условиями турбу- |
|
|
||||
лентной диффузии, а скорость горения – скоростью диффузии. |
|
|
|
|
|
|
|
|
|
|
|
|
|
При наличии турбулентной диффузии фронт горения получается |
|
|
|
|
|
|
волнистым, размытым на отдельные части и слабо устойчивым. |
|
|
|
|
|
|
К тому же турбулентному диффузному горению присуща не- |
|
|
|
|
|
|
|
Рис. 7. Распределение температур в пламени при горении газообразных ве- |
|||||
|
ществ |
|||||
37 |
38 |
|
|
|
|
|
Расчет расхода воздуха на сжигание топлива
При горении веществ в воздухе происходит быстрая химическая реакция окисления между горючим веществом и кислородом воздуха с интенсивным тепловыделением. В результате этой реакции образуются в основном оксиды элементов, входящих в состав горючего вещества. При сгорании углеводородов, состоящих из атомов С и Н, образуется СО2 (двуокись углерода) и Н2О (вода). При неполном сгорании наряду с ними образуются СО (окись углерода) и Сn(тв) (углерод) в виде сажи. При написании уравнения горения и составлении материального баланса, как правило, записывают только продукты полного окисления СО2 и Н2О. Если в составе горючего вещества есть сера (S), то при сгорании образуется SО2. Азот (N), входящий в состав горючего вещества, при горении в воздухе не окисляется, а выделяется в виде свободного азота (N2).
С3Н8 + 5О2 → 3СО2 + 4Н2О
С3Н8 + 5О2 → 3СО2 + 4Н2О
С3Н6О + 4О2 → 3СО2 + 3Н2О
СS2 + 3О2 → СО2 + 2SО2
Н2S + 1,5О2 → Н2О + SО2
NН3 + 0,75О2 → 0,5N2 + 1,5Н2О
Записанные уравнения химических реакций горения являются брутто-уравнениями, которые показывают только начальное и конечное состояние системы. Они не отражают механизма химического взаимодействия при горении, который дос-
39
таточно сложен и протекает через ряд промежуточных стадий с участием атомов и радикалов.
Уравнение материального баланса процесса горения отличается от уравнения химической реакции тем, что в него для удобства расчетов включают азот, содержащийся в воздухе и не участвующий в химическом превращении. Для расчетов будем принимать, что воздух состоит на 21 % (об.) из кислорода и на 79 % (об.) из азота, т.е. в нем на 1 моль кислорода приходится 79/21 = 3,76 молей азота, поэтому в уравнении материального баланса перед азотом ставят коэффициент 3,76.
Например, уравнение материального баланса для горения пропана будет следующим:
С3Н8 + 5О2 + 5·3,76N2 → 3СО2 + 4Н2О + 5·3,76N2
Коэффициент, который записывают перед О2 (в данном случае 5) необходимо повторить и перед N2, так как азот и кислород в воздухе неразделимы. Это суммарная реакция, но она достаточна для проведения практических расчетов и является обобщенной записью материального баланса реакции горения.
Уравнение материального баланса позволяет рассчитывать количество воздуха, необходимое для горения любого горючего вещества и количество образующихся продуктов горения.
Минимальный объем воздуха, который необходим для полного сгорания единицы количества горючего вещества, на-
зывается удельным теоретическим объемом воздуха и обознача-
ется voв.В зависимости от единиц измерения количества горючего вещества (1 моль, 1 м³, 1 кг) удельный объем измеряется в м³/моль, м³/м³,м³/кг.
Действительное количество воздуха, который поступает в зону горения, отличается от теоретического. Соответствующий объем называется удельным действительным объемом воздуха и обозначается vв.. Разность между количеством воздуха, который идет на горение и теоретически необходимым, называется избытком воздуха. Для характеристики процесса горения исполь-
40
