
Лаба №3Скорость химических реакций
.doc

![]() Скорость
химических реакций.
Скорость
химических реакций.
-
Введение
1.1 Цель работы:
Изучение влияния концентрации реагирующих веществ и температуры на скорость гомогенной химической реакции.
-
Основные теоретические положения, лежащие в основе работы:
Согласно закону действующих масс при постоянной температуре скорость химической реакции прямо пропорциональна произведению концентраций реагирующих веществ, причем каждая из концентраций участвует в степени, равной стехиометрическому коэффициенту перед формулой данного вещества в уравнении реакции.
Условием протекания реакции является столкновение молекул, однако результативными оказываются те столкновения, в которых принимают участие так называемые «активные» молекулы. При повышении температуры энергия вещества и перераспределяется между молекулами таким образом, что значительно увеличивается число активных молекул, т.е. таких молекул, которые в момент столкновения обладают некоторым избытком энергии над средней энергией частиц. Избыточная энергия носит название энергии активации. Энергией активации реакции называется минимальная энергия (в расчете на 1моль), которой должны обладать реагирующие частицы, чтобы столкновение между ними привело к реакции.
-
Формулы для вычислений, перечень символов:
![]() ,
,
где
K – константа скорости
реакции, зависящая от природы реагирующих
веществ;
![]() - концентрации реагирующих веществ,
- концентрации реагирующих веществ,
![]() ;
m, n –
стехиометрические коэффициенты.
;
m, n –
стехиометрические коэффициенты.
Скорость большинства гомогенных реакций согласно эмпирическому правилу Вант-Гоффа при повышении температуры на100 увеличивается в 2-4 раза.
![]() ,
,
где
![]() - температурный коэффициент реакции,
принимающий значения 2-4 для большинства
реакций;
- температурный коэффициент реакции,
принимающий значения 2-4 для большинства
реакций;
![]() и
и
![]() - скорости реакции при температурах t1
и t2.
- скорости реакции при температурах t1
и t2.
Интегрирование в интервале T1 –T2 уравнения Аррениуса
![]()
при допущении, что в малом температурном интервале E не зависит от температуры, позволяет вычислить энергию активации:
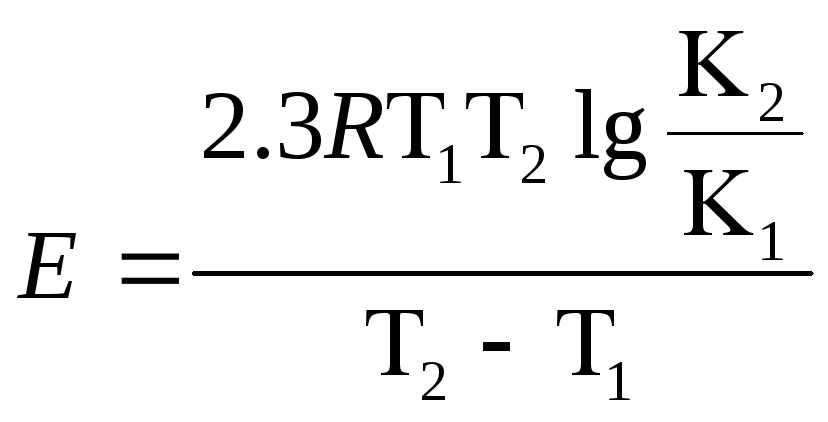 ,
,
где
Е – энергия активации, кДж; R
– универсальная газовая постоянная
(8,314![]() );
T1 и T2
– абсолютная температура, К.
);
T1 и T2
– абсолютная температура, К.
Для приближенных расчетов отношение К2/К1 может быть заменено отношением
![]()
-
Содержание работы
2.1 Методика эксперимента:
Для исследования зависимости скорости реакции от концентрации и температуры используется реакция взаимодействия серной кислоты H2SO4 и тиосульфата натрия Na2S2O3. Эта реакция протекает в две стадии:
-
Na2S2O3 + H2SO4 = H2S2O3 + Na2SO4,
-
H2S2O3 = H2O + SO2
 + S
+ S .
.
Экспериментально доказано, что первая стадия протекает с большей скоростью. Скорость всей реакции в целом определяется скоростью второй (медленной) стадии:
![]() .
.
Поскольку концентрация H2S2O3 в растворе прямо пропорциональна концентрации Na2S2O3, скорость реакции можно рассматривать как:
![]() .
.
Опыт №1
Зависимость скорости реакции от концентрации Na2S2O3:
В три большие пробирки налить 2%-ный раствор Na2S2O3 и воду. Затем в три маленькие пробирки налить по 5 мл 2%-ного раствора H2SO4.
В первую большую пробирку с раствором
Na2S2O3
прилить 5мл раствора H2SO4
(из маленькой пробирки) и замерить
секундомером, через сколько секунд
![]() после слияния растворов наблюдается
появление серы (помутнение раствора).
С последующими пробирками проделываем
аналогичные опыты, замеряем время
после слияния растворов наблюдается
появление серы (помутнение раствора).
С последующими пробирками проделываем
аналогичные опыты, замеряем время
![]() и
и
![]() .
.
Результат трех измерений (![]() )
записываем в таблицу №1.
)
записываем в таблицу №1.
Опыт №2
Зависимость скорости реакции от температуры:
Налить в одну пробирку 10мл раствора
Na2S2O3,
в другую 10 мл раствора H2SO4.
Обе пробирки закрепить зажимами с
деревянными рукоятками и опустить в
водяной термостат ТС-24А. После выдержки
пробирок в термостате при температуре
t1 в течение 5-7 мин
слить вместе содержимое обеих пробирок,
отметив время
![]() от момента сливания до помутнения
раствора.
от момента сливания до помутнения
раствора.
Проделать аналогичные опыты при температурах t2=t1+100 и t3=t2+100. Температура t1 задается преподавателем.
Результаты наблюдений (![]() )
при температурах t1,t2,t3
записываем в таблицу №2.
)
при температурах t1,t2,t3
записываем в таблицу №2.
Во время работы с термостатом запрещается:
-
работать без заземления термостата;
-
вскрывать коробку с электрическими переключателями;
-
опускать руки в термостат при включенной мешалке.
2.2 Экспериментальные результаты работы:
Таблица №1
|
Номер задания |
Номер опыта |
Объем, мл |
Концентрация
|
Время
|
Относительная скорость реакции |
|
|
Na2S2O3 + H2O (a) (b) |
H2SO4 (c) |
|||||
|
1
|
1 2 3 |
5 + 5 10 + 10 15 + 15 |
5 |
0,33 0,4 0,43 |
1=79 2=64 3=60 |
1 1/2=1,24 1/3=1,31 |
|
2 |
1 2 3 |
5 + 10 10 + 5 15 + 0 |
5 |
0,25 0,5 0,75 |
1=109 2=61 3=39 |
1 1/2=1,79 1/3=2,79 |
|
3 |
1 2 3 |
10 + 10 15 + 5 20 + 0 |
5 |
0,4 0,6 0,8 |
1=68 2=57 3=37
|
1 1/2=1,19 1/3=1,84 |
Скорость реакции считаем в относительных единицах, при этом за единицу принимается скорость для наименьшей концентрации Na2S2O3.
Таблица №2
|
Номер опыта |
Объем, мл |
Температура
t,
|
Время
|
Относительная скорость
реакции,
|
|
|
Na2S2O3 |
H2SO4 |
||||
|
1 2 3 |
10 10 10 |
10 10 10 |
t1=20 t2=30 t3=40 |
1=37 2=26 3=14 |
1 1/2=1,42 1/3=2,64 |
Скорость реакции считаем в относительных единицах, при этом за единицу принимается скорость для начальной температуры t1.
2.3 Обработка результатов:
Скорость гомогенной реакции:
![]()
Энергия активации:
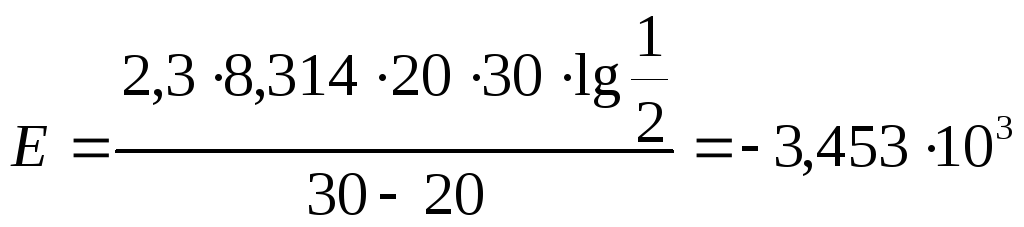
![]()
![]()
3. Заключение
Вывод:
Мы изучили влияние концентрации реагирующих веществ и температуры на скорость гомогенной химической реакции; выяснили, что действительно согласно закону действия масс при постоянной температуре скорость химической реакции прямо пропорциональна произведению концентраций реагирующих веществ.
