
Лекции 1, 11
.pdf
Л. 11. Строение и реакциоонная спообность элементов IV-ой группы.
ns2p2 ( 2s2p2 - полузаполненный второй уровень)
конфигурация 2s2p2 |
2s2p2 |
2s2p2 |
2s1p3 |
|
||||||||||||||||||||||||
терм |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
3P |
1D |
1S |
5S |
|
|||||||||
E, кДж/моль |
|
|
0 |
121,5258,2402,3 |
|
|
|
|||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
C |
|
Si |
Ge |
|
Sn |
Pb |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
rков., |
|
|
|
|
|
|
|
|
|
|
|
|
0.772 |
1.176 |
1.223 |
|
1.405 |
1.46 |
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
ЭО |
|
|
|
|
|
|
|
|
|
|
|
|
25 |
|
18 |
18 |
|
18 |
19 |
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
Тплав., оС |
|
|
|
|
4100 |
1420 |
945 |
|
232 |
327 |
||||||||||||||||||
Ткип., оС |
|
|
|
|
|
|
|
|
|
|
~5000 субл |
3820 |
2850 |
|
2613 |
1751 |
||||||||||||
d, г/см3 |
|
|
|
|
|
|
|
|
|
|
ал.3,514 |
2.336 |
5.323 |
|
5.769 |
11.342 |
||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
гр.2,256 |
2.905 |
6.71 |
|
7.26 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
∆Hпл., |
|
|
|
|
|
|
|
|
|
|
|
|
105,0 |
50.6 |
36.8 |
|
7.07 |
4.81 |
||||||||||
кДж/моль |
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
∆Нисп., |
|
|
|
|
|
|
|
|
|
|
|
|
710,9 |
383 |
328 |
|
296 |
177 |
||||||||||
кДж/моль |
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
∆Нат., |
|
|
|
|
|
|
|
|
|
|
|
|
716.7 |
454 |
383 |
|
300.7 |
195 |
||||||||||
кДж/моль |
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
ρ, ом-1см-1 |
|
|
|
|
10-14-10-16 |
48 |
47 |
|
β 10-6 |
10-10 |
||||||||||||||||||
∆Езап.з., |
|
|
|
|
|
|
|
|
|
580 |
|
106.8 |
64.2 |
|
α-7,7 |
0 |
||||||||||||
кДж/моль |
|
|
|
|
|
|
|
|
|
|
β-0 |
|
||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
% |
|
|
|
|
|
|
|
% |
|
|
|
|
|
|
|
% |
|
|
|
|
|
|
||||||
% |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
% |
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
% |
|
|
|
|
% |
|
|
% |
|
|
|
|
|
|
|
|
||||||||||||
% |
|
|
|
|
|
|
% |
|
|
|
|
|
|
% |
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
%% |
|
|
|
|
|
|
|
|
|
|
|
% |
|
|
|
|
|
|
||||||||||
|
|
|
|
|
|
% |
|
|
|
|
|
|
% |
|
|
|
|
|
|
|||||||||
% |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
% |
алмаз |
|
|
|
графит |
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
радиус |
|
|
|
|
|
1.6 |
|
|
|
|
|
6500 |
|
|
|
Sn |
|
|
|
6000 |
|
1.4 |
|
|
Pb |
|
5500 |
|
|
|
|
|
|
5000 |
||
|
|
|
|
|
|
||
|
|
Si |
|
|
|
I,кДж/моль |
4500 |
(ков.),А |
1.2 |
|
|
|
4000 |
||
|
|
|
|
3500 |
|||
|
|
Ge |
|
|
|||
|
|
|
|
3000 |
|||
r |
|
|
|
|
|
|
|
|
1.0 |
|
|
|
|
|
2500 |
|
|
|
|
|
|
|
2000 |
|
0.8 |
|
|
|
|
|
1500 |
|
С |
|
|
|
|
1000 |
|
|
|
|
|
|
|
||
|
0 |
20 |
40 |
60 |
80 |
|
500 |
|
|
|
|||||
|
|
|
Порядковыйномер |
|
|
|
|
|
C |
|
|
I1 |
|
|
|
I2 |
|
|
|
|
|
I3 |
|
|
|
|
I4 |
|
Si |
Ge |
|
Pb |
|
|
Sn |
|
|
0 |
20 |
40 |
60 |
80 |
|
|
порядковыйномер |
|
|
4000 - |
›,ä*%“2ü |
T |
|
3000 -ã!=-,2 |
|
2000 - =ëì=ƒ
1000 -
0 |
i |
i |
i |
|
|
i |
|
i |
|
600 |
|
|
|
P, *K=! |
|
|
|
|
|
|
||
100 |
200 |
300 |
400 |
500 |
|
|
|
|
|
|
|
|
|
|
|
|||||||
Интеркалированные соединения графита. |
|
|
|
|
|
|
||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
% |
|
|
% |
% |
% |
% |
% |
% |
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
% |
|
|
% |
|
|
|
% % % % % % |
% % % % % % |
||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
% |
|
% |
% |
% |
% |
% |
|
% |
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||
|
|
|
|
|
% % % % % % |
|
|
|
% % % % % % |
|
||||||||||||
% |
|
|
% |
|
|
|
% |
% % |
% |
% |
|
|
|
|
|
|
|
|
|
|
||
|
|
% |
|
C8K C8K |
|
|
|
|
|
|
|
|
|
C12K |
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||
|
|
|
|
|
||||||||||||||||||
Вещество |
ρ, ом-1см-1 (90 К) |
|
ρ, ом-1см-1 (285 К) |
|||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
α - графит |
37,7 |
|
|
|
|
|
28,4 |
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
C8K |
|
0,768 |
|
|
|
|
|
1,02 |
|
|
|
|
|
|
|
|
|
|
|
|
||
C12K |
|
0,932 |
|
|
|
|
|
1,15 |
|
|
|
|
|
|
|
|
|
|
|
|
||
KxC60 |
Tc = 18,0±0,1 K |
J.Inorg.Chem. ,1991, v.30, p.2838 |
RbxC60 |
Tc = 28,6 K |
p.2962 |
Получение фуллеренов.
Cгр. → пар → конденсация → перекристаллизация (разделение C60 и
C70).
Š, %q |
|
Si |
Sn |
|
1500 |
- |
Ge |
Pb |
|
|
|
|
|
|
1000 |
- |
|
|
|
500 |
- |
|
|
|
0 - |
|
|
|
|
|
|
i |
i |
|
|
|
50 |
100 |
P, кбар |
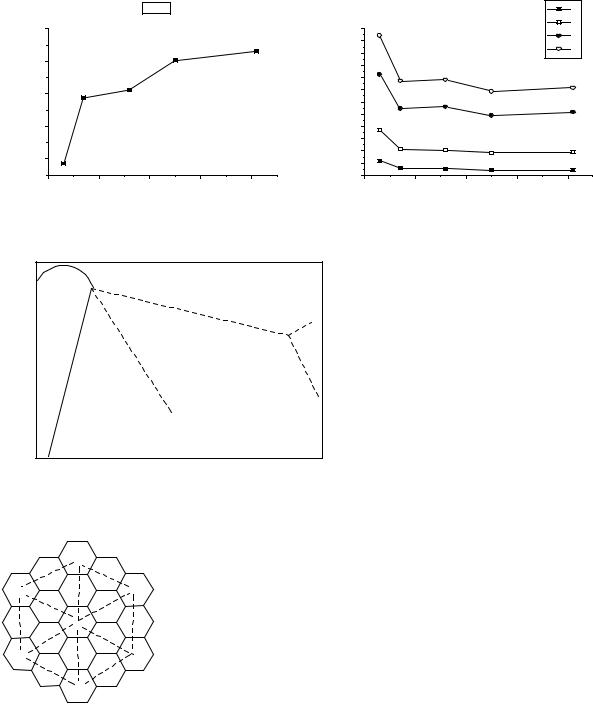
Рис.1. Р - Т диаграммы высокого давления для простых веществ IV-ой группы.
1. Уменьшение Р,Т тройной точки (C→ Pb).
2.Уменьшение параметров поля (Р,Т) алмазоподобной модификации.
3.Увеличение устойчивости металлической фазы.
Салмаз кубический → гексагональный (Р,Т =?)
|
|
Лансделит d куб. = d гекс. |
Si |
1.кубический |
|
|
2. |
тетрагональный (тип белого олова). |
Ge |
1. кубический а = 5,6575 |
|
|
2. |
тетрагональный (тип белого олова) |
Sn |
1. кубическое (α -Sn) а = 6,4892 |
|
|
2. о.ц.тетрагональное (β- Sn) а = 5,8317, с = 3,1813 |
||||
Pb |
ГЦК а = 4,9502 |
|
|
|
|
Si + 2 NaOH + H2O → Na2SiO3 + 2 H2 |
|
|
|||
Pb + 2 H+ → Pb2+ + H2 |
|
|
|
|
|
Sn + 2 H+ → Sn2+ + H2 |
|
|
|
|
|
Ge + 2 NaOH + 2 H2O2 → Na2[Ge(OH)6] |
|
|
|||
5 PbO2 + 2 Mn(NO3)2 + 6 HNO3 → 5 Pb(NO3)2 + 2 HMnO4 + 2 H2O |
|||||
|
|
|
C |
|
|
|
|
|
Si |
|
|
|
|
|
Ge |
|
|
|
4 |
|
Sn |
|
|
|
|
Pb |
|
|
|
|
2 |
|
|
|
|
|
0 |
|
|
|
|
,в |
|
|
|
|
|
o |
|
|
|
|
|
nE |
-2 |
|
|
|
|
|
-4 |
|
|
|
|
|
-6 |
|
|
|
|
|
-4 |
-2 |
0 |
2 |
4 |
|
|
|
степеньокисления |
|
|
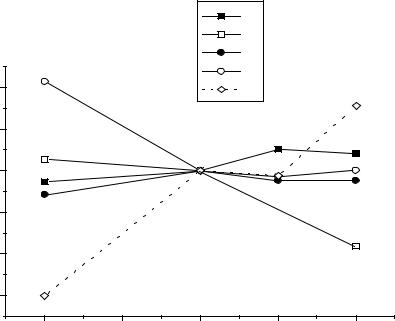
Рис.2. Диаграмма Фроста для элементов IV-ой группы рН=0.
координационные C - 2 (sp); |
3 (sp2); 4 (sp3); 5, 6 (гипервалентные св.) |
|
числа |
Si - 4 , 6 (SiF62-) |
|
|
Ge - 4 (GeO2); 6 (GeO2) |
|
|
Sn (2+) 3 (SnCl2, CsSnCl3) |
|
|
4 |
(SnO) |
|
Sn(4+) - 4 |
(SnCl4); 6 (K2SnCl6) |
|
Pb(2+) - 4 |
(PbO) |
|
Pb(4+0 - 4 (Pb(C2H5)4 ); 6 (K2PbCl6) |
|
Оксиды углерода.
|
CO |
CO2 |
|
C3O2 |
Тпл., оС |
-205,1 |
-56,6 |
(5,2 атм) |
-112,5 |
Ткип., оС |
-191,5 |
-78,5 |
(субл.) |
6,7 |
∆Hfo, кДж/моль |
-110,5 |
-393,5 |
+97,8 |
|
|
|
|
|
|
lС -O, A |
1,128 |
1,163 |
|
1,16 |
Свойства COX2.
|
|
|
COF2 |
COCl2 |
COBr2 |
Тпл., оС |
|
-114 |
-127,8 |
- |
|
Ткип., оС |
|
-83,1 |
7,6 |
64,5 |
|
d, г/см3 (оС) |
1,139 (-114) |
1,392 (-19) |
- |
||
lC-O, A |
|
1,174 |
1,166 |
1,13 |
|
lC-O, A |
|
1,312 |
1,746 |
(2,05) |
|
|
|
|
|
|
|
|
X-C-X, |
o |
108 |
111,3 |
± |
|
|
|
|
110 5 |
|
O-C-X,o |
126 |
124,3 |
125 |
||
|
|
|
|
|
|
Свойства гидридов.
|
CH4 |
SiH4 |
Si2H6 |
GeH4 |
Ge2H6 |
Тпл., оС |
-182,5 |
-185 |
-132,5 |
-164,8 |
-109 |
Ткип., оС |
-161,5 |
-111,8 |
-14,3 |
-88,1 |
29 |
d, г/см3 |
0,242 |
0,68 |
0,686 |
1,52 |
1,98 |
(оС) |
(-164) |
(-186) |
(-25) |
(-142) |
(-109) |
|
|
|
|
|
|
Галогениды..
1. Фториды.
|
CF4 |
SiF4 |
GeF4 |
SnF4 |
Тпл., оС |
-183,5 |
-86,8 |
-151 (4 атм) |
- |
Ткип., оС |
-128,5 |
-95,25 субл. |
-36,5 субл. |
705 субл. |
d, г/см3 (оС) |
1,96 (-184) |
1,66 (-95) |
2,126 (0) |
4,78 (20) |
2. Хлориды.
|
|
|
CCl4 |
|
SiCl4 |
|
GeCl4 |
|
SnCl4 |
PbCl4 |
||
Тпл., |
оС |
|
-22,9 |
-68,9 |
-49,5 |
|
-33,3 |
|
-7 |
|||
Ткип., оС |
|
76,6 |
57 |
83,1 |
|
114 |
|
взр. 100о |
||||
d, г/см3 |
|
1,594 (20) |
1,48 (20) |
1,844 (30) |
|
2,234 (20) |
|
3,18 (0) |
||||
(оС) |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
3. Бромиды. |
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
CBr4 |
|
SiBr4 |
|
GeBr4 |
SnBr4 |
|
||
Тпл., оС |
|
90,1 |
|
5,4 |
|
26 |
31 |
|
|
|||
Ткип., оС |
|
189,5 |
|
152,6 |
|
186 |
205 |
|
|
|||
d, г/см3 (оС) |
|
2,94 (10) |
|
2,77 (25) |
|
2,10 (30) |
3,40 (35) |
|
|
|||
CCl4 + H2O →
SiCl4 + 2 H2O → SiO2 + 4 HCl
GeCl4 + 2 H2O → GeO2 + 4 HCl
GeCl4 + 2 HCl → H2[GeCl6] раствор
SnCl4 + (2+n) → SnO2•nH2O + 4 HCl
SnCl4 + 2 HCl → H2[SnCl6]
PbCl4 + 2 H2O → PbO2 + 4 HCl
PbCl4 + 2 HCl → h2[PbCl6]
PbCl2 тв. + 2 HCl + Cl2 → H2[PbCl6]
Литература.
1. Ахметов Н.С. “Общая и нерганическая химия”, М.”Высшая школа”, 1988,
стр.371-409.
2.Некрасов Б.В., “Основы общей химии”, М., “Химия”, т.1, стр.492-535, 620643, 1973.
3.Коттон Ф.А., Уилкинсон Дж., “Современная неорганическая химия”, М., ”Мир”, 1969, т.2, стр.117-154, 306-338.
Дополнительная литература.
1.Уэллс А. “Сруктурная неорганическая химия”, М., “Мир”, 1987, т.3, стр. 5-
114, 316-336.
2.“Химическик и физические свойства углерода”, под.ред Ф.Уокера,
М., “Мир”, 1969.
