
- •Министерство образования рф
- •Строение атомов
- •Периодическая система элементов д. И. Менделеева
- •Химическая связь и строение молекул. Конденсированное состояние вещества
- •Стандартные теплоты (энтальпии) образования некоторых веществ
- •Химическое сродство4
- •Стандартные изобарные потенциалы образования некоторых веществ
- •Стандартные абсолютные энтропии некоторых веществ
- •Химическая кинетика и равновесие
- •Способы выражения концентрации раствора
- •Свойства растворов
- •Ионные реакции обмена5
- •Гидролиз солей
- •Контрольное задание 2 Окислительно-восстановительные реакции
- •Электродные потенциалы и электродвижущие силы*6
- •Стандартные электродные потенциалы е° некоторых металлов (ряд напряжений)
- •Электролиз
- •Коррозия металлов7
- •Комплексные соединения
- •Жесткость воды и методы ее устранения
- •Органические соединения. Полимеры
- •Приложение
- •Наименование наиболее важных кислот и их солей
- •Константы диссоциации и степени диссоциации некоторых слабых электролитов
Министерство образования рф
ОРЛОВСКИЙ ГОСУДАРСТВЕННЫЙ ТЕХНИЧЕСКИЙ
УНИВЕРСИТЕТ
Автор: доцент кафедры «Химия», кандидат технических наук, Фроленков К.Ю.
Контрольные задания
по «Химии»
Орел 2000
КОНТРОЛЬНОЕ ЗАДАНИЕ 1
Эквиваленты простых и сложных веществ.
Закон эквивалентов
Пример 1. На восстановление 7,09 г оксида двухвалентного металла требуется 2,24 л водорода, измеренного при н. у.31 Вычислить эквивалент оксида и эквивалент металла. Чему равен атомный вес2 металла?
Решение. По закону эквивалентов массы веществ m1 и m2, вступающих в реакцию, пропорциональны их эквивалентам Э1 и Э2:
-
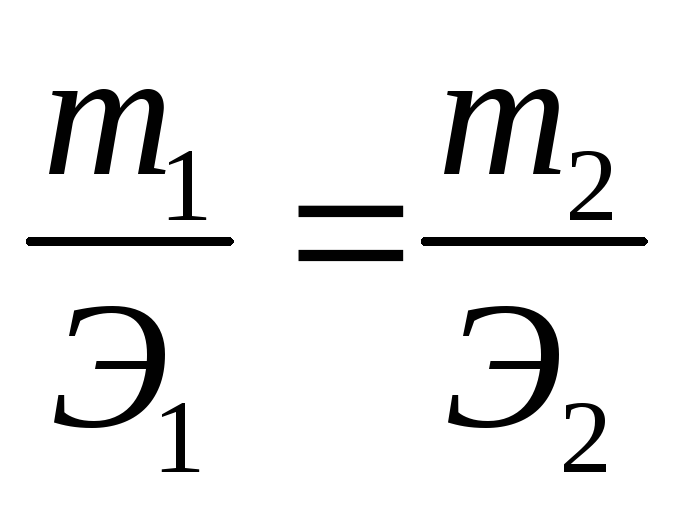
(1)
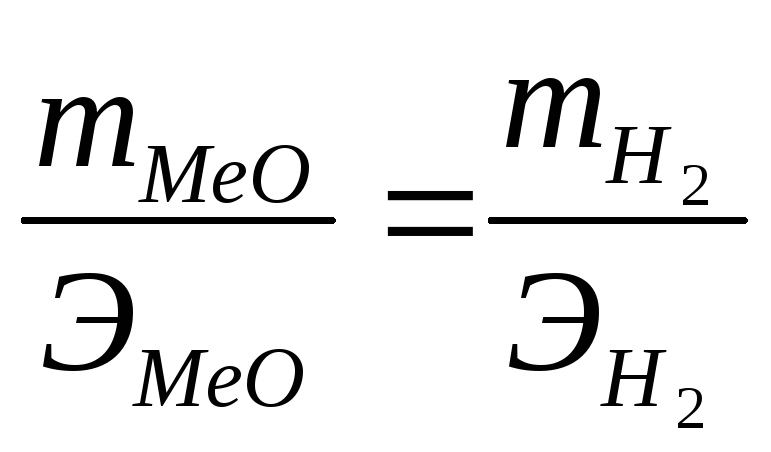
(2)
Если одно из веществ находится в газообразном состоянии, то, как правило, его количество измеряется в объемных единицах (см3, л, м3).
В
(2) отношение
![]() заменяем
равным ему отношением
заменяем
равным ему отношением
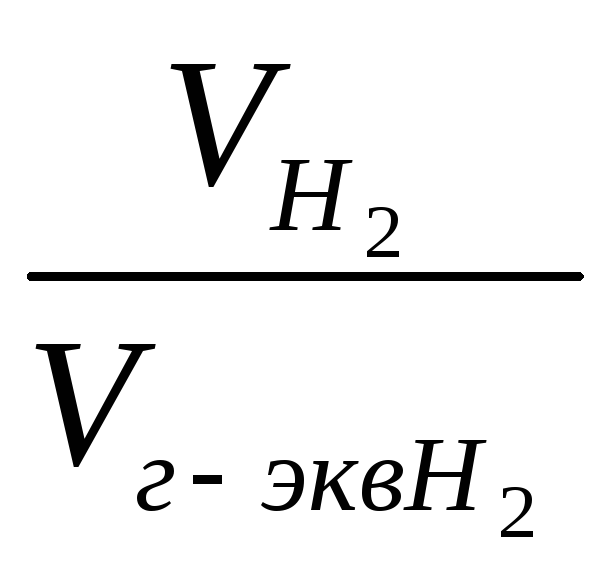 ,
где
,
где ![]() ,
- объем водорода;
,
- объем водорода; ![]() -
объем грамм-эквивалента водорода.
-
объем грамм-эквивалента водорода.
-
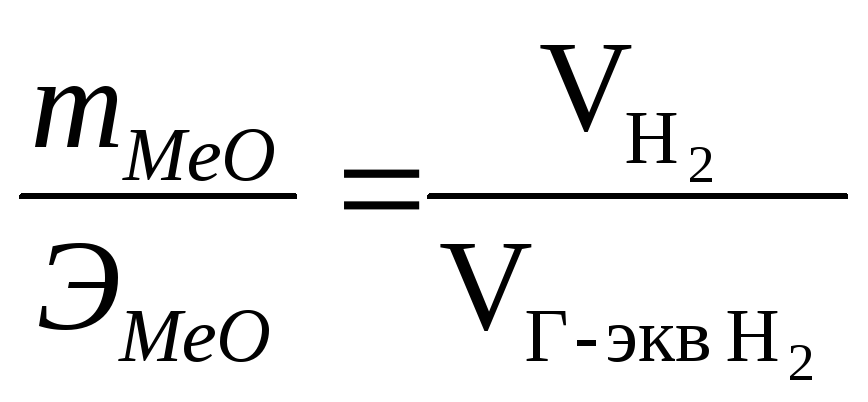
(3)
Грамм-эквивалент водорода (1,008 г) равен половине его грамм-молекулы (2,016 г), поэтому согласно следствию из закона Авогадро (при н. у.)
![]()
Из (3) находим эквивалент оксида металла (МеО):
По закону эквивалентов
ЭMeO
= ЭMе
+
![]() отсюда
отсюда
ЭMе
= ЭMeO
-
![]() = 35,45 - 8 = 27,45.
= 35,45 - 8 = 27,45.
Атомный вес металла определяем из соотношения Э= А/В,
где Э - эквивалент, А - атомный вес, В - валентность элемента. А = ЭВ = 27,452=54,9.
Пример 2. Сколько металла, эквивалент которого 12,16, взаимодействует с 310 см3 кислорода, измеренного при н.у.?
Решение. Грамм-молекула О2 (32 г) при н.у. занимает объем 22,4 л, а объем грамм-эквивалента кислорода (8 г)
![]()
По
закону эквивалентов
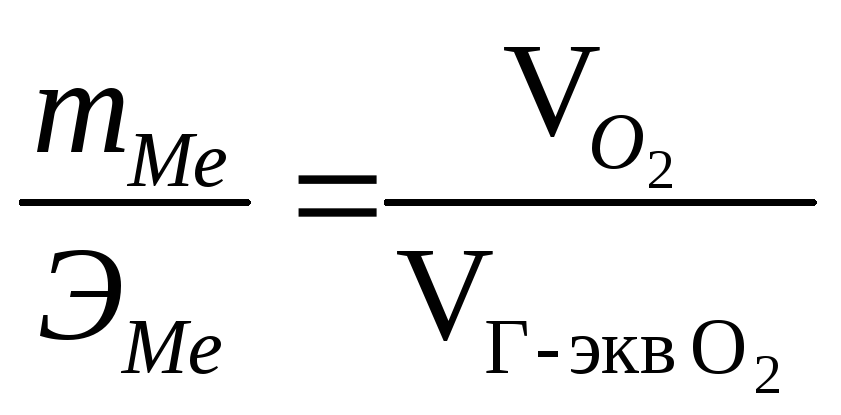 ,
или,
,
или,
![]() откуда
откуда ![]()
Пример 3. Вычислить эквиваленты Н2SО4 и А1(ОН)3 в реакциях, выражаемых уравнениями:
-
Н2SО4 + КОН = КНSО4 + Н2О
(1)
Н2SО4 + Мg = МgSO4 + Н2
(2)
А1(ОН)3 + НС1 = А1(ОН)2С1 + Н2О
(3)
А1(ОН)3 + ЗНNО3 = А1(NО3)3 + ЗН2О
(4)
Решение.
Эквивалент сложного вещества, так же
как и эквивалент элемента, может иметь
различные значения и зависит от того,
в какую реакцию обмена вступает это
вещество. Эквивалент кислоты (основания)
равен молекулярному весу (М),
деленному на число атомов водорода,
замещенных в данной реакции на металл
(на число вступающих в реакцию гидроксильных
групп). Следовательно, эквивалент
Н2SО4
в реакции (1) равен
![]() ,
а в реакции(2)
,
а в реакции(2)
![]() Эквивалент Аl
(ОН)3
в реакции (3) равен,
Эквивалент Аl
(ОН)3
в реакции (3) равен,
![]() а
в реакции (4)
а
в реакции (4)
![]()
Задачу можно решить и другим способом.
Так как Н2SО4 взаимодействует с одним эквивалентом КОН и двумя эквивалентами магния, то ее эквивалент равен в реакций (1) М/1 и в реакции (2) М/2.
Аl(ОН)3 взаимодействует с одним эквивалентом НС1 и тремя эквивалентами НNО3, поэтому его эквивалент в реакции (3) равен М/1, в реакции (4) М/3.
Пример 4. Из 3,85 г нитрата металла получено 1,60 г его гидроксида. Вычислить эквивалент металла.
Решение. При решении задачи следует иметь в виду: а) эквивалент гидроксида равен сумме эквивалентов металла и гидроксильной группы; б) эквивалент соли равен сумме эквивалентов металла и кислотного остатка. Учитывая сказанное, подставляем соответствующие данные в (1) (см. пример 1):
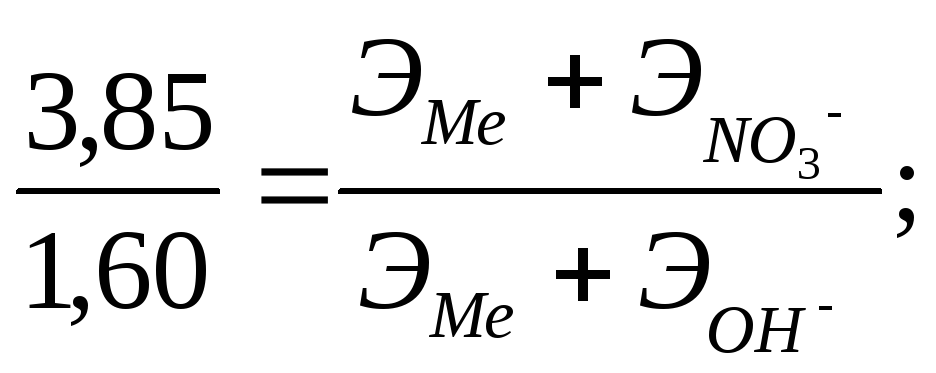
![]()
Ответ: ЭМе = 15.
1. При восстановлении водородом 10,17 г оксида двухвалентного металла образовалось 2,25 г воды, эквивалент которой 9,00. Вычислите эквивалент оксида и эквивалент металла. Чему равен атомный вес металла?
2. Эквивалент трехвалентного металла равен 9. Вычислите атомный вес металла, эквивалент его оксида и процентное содержание кислорода в оксиде.
3. Из 1,35 г оксида металла получается 3,15 г его нитрата. Вычислите эквивалент металла. Ответ: 32,5.
4. Из 1,3 г гидроксида металла получается 2,85 г сульфата этого же металла. Вычислите эквивалент металла. Ответ: 9.
5. Оксид трехвалентного элемента содержит 31,58% кислорода. Вычислите эквивалент и атомный вес этого элемента.
6. Один оксид марганца содержит 22,56% кислорода, а другой - 50,50%. Вычислите эквиваленты марганца в этих оксидах и составьте их формулы.
7. При сгорании серы в кислороде образовалось 12,8 г SO2. Сколько эквивалентов кислорода требуется на эту реакцию? Чему равны эквиваленты серы и ее оксида?
8. Вычислите эквиваленты Н3РО4 в реакциях образования; а) гидрофосфата, б) дигидрофосфата, в) ортофосфата.
9. В 2,48 г оксида одновалентного металла содержится 1,84 г металла. Вычислите эквиваленты металла и его оксида.
10. Чему равен эквивалент воды при взаимодействии ее: а) с натрием, б) с оксидом натрия. Ответ: 9.
11. При восстановлении 1,2 оксида металла водородом образовалось 0,27 г воды. Вычислите эквивалент оксида и эквивалент металла.
12. Напишите уравнения реакций Fе(ОН)3 с соляной кислотой, при которых образуются следующие соединения железа: а) дигидроксохлорид, б) гидроксохлорид, в) три - хлорид. Вычислите эквивалент Fе(ОН)3 в каждой из этих реакций.
13. Избытком едкого кали подействовали на растворы: а) дигидрофосфата калия, б) дигидроксонитрата висмута(+3). Напишите уравнения реакций этих веществ с КОН и определите их эквиваленты.
14. Вещество содержит 39,0% серы, эквивалент которой 16,0, и мышьяк. Вычислите эквивалент и валентность мышьяка, составьте формулу этого вещества.
15. Избытком соляной кислоты подействовали на растворы: а) гидрокарбоната кальция, б) гидроксодихлорида алюминия. Напишите уравнения реакций этих веществ с КОН и определите их эквиваленты.
16. При окислении 16,74 г двухвалентного металла образовалось 21,54 г оксида. Вычислите эквиваленты металла и его оксида. Чему равен атомный вес металла?
17. При взаимодействии 3,24 г трехвалентного металла с кислотой выделяется 4,03 л водорода, измеренного при н. у. Вычислите эквивалент и атомный вес металла.
18. В оксидах азота на два атома азота приходится: а) пять, б) четыре, в) один атом кислорода. Вычислите эквиваленты азота в оксидах и эквиваленты оксидов.
19. Одна и та же масса металла соединяется с 1,591 г галогена и с 70,2 см3 кислорода, измеренного при н.у. Вычислите эквивалент галогена. Ответ: 126,9.
20. На нейтрализацию 0,943 г фосфористой кислоты Н3РО3 израсходовано 1,291 г КОН. Вычислите эквивалент кислоты и ее основность. Ответ: Э = 41.
