
3 курс / 2 семестр / Методы изучения экологии животных и растений / metody_polev_ekol_issl_2014
.pdfтолько на специально созданных копиях, исходные файлы должны всегда оставаться неизменными во избежание потери снимка или его качества.
3.5. Определение грибов
Определение грибов – трудоемкая процедура, требующая наличия микроскопа, т.к. в разделении видов главную роль играют особенности строения гиф кутикулы, трамы и гимения, спор, базидий и асков, стерильных элементов гимения. Для приготовления препаратов обычно используют растворы КОН, Ca(ClO)2, NH4OH, йодосодержащие реактивы Мельцера и Люголя, красители Конго красный и метиленовый синий. Определение желательно проводить на свежем материале, но и засушенные образцы прекрасно определяются.
При определении делаются тонкие срезы гименофора, трамы, поверхностей шляпки и ножки. Желательно делать зарисовки микроструктур, по возможности с указанием их размеров. Для измерения необходимо наличие в микроскопе окуляр-микрометра, который при отсутствии можно заказать. Для микроскопирования достаточно увеличения в 400 раз.
Все наиболее качественные и современные определители издаются за рубежом, преимущественно на английском языке, поэтому знание его – залог успешного определения.
Хороших современных определителей грибов на русском языке не так много, тираж их небольшой, и поэтому их довольно сложно достать. Большинство из российских и советских определителей оцифровано и выложено для открытого доступа в Интернет, например, на сайт «Библиотека «Флора и фауна», где их можно бесплатно скачать. В качестве основных определителей можно рекомендовать следующие издания: «Определитель грибов России» (ранее – «Определитель грибов СССР»), «Определитель лишайников России» (ранее – «Определитель лишайников СССР»), «Флора Беларуси. Грибы», «Флора грибов Украины» и другие сводки, указанные в списке литературы. Следует избегать пользоваться определителями, изданными более 30 лет назад, т.к. неизбежны ошибки в определении.
Большим подспорьем для идентификации видов является Интернет. В первую очередь начинающим микологам стоит посетить форум сайта «Грибы Калужской области» и форум Санкт-Петербургского микологического общества «Планета грибов», где можно получить ответы от грамотных микологов.
РЕКОМЕНДУЕМАЯЛИТЕРАТУРА
Балашова Н.Б., Тобиас А.В., Гимельбрант Д.Е. Летняя практика по альгологии и микологии в Санкт-Петербургском университете: учеб. пособие. СПб.: Изд-во С.-Петерб. ун-та, 2005. 236 с.
Биоразнообразие и экология низших растений. Методика сбора, описания и определения агарикоидных базидиомицетов: Метод. указания для летней полевой практики / сост. Л.Г. Переведенцева. Пермь, 2007. 28 с.
80
Бондарцев А.С., Зингер Р.А. Руководство по сбору высших базидиальных грибов для научного их изучения // Труды Ботанического института им. В.Л. Комарова АН СССР. 1950.
Сер. II, вып. 6. С. 499–543.
Бондарцев А.С. Шкала цветов. Пособие для биологов при научных и научноприкладных исследованиях. М.; Л.: Изд-во АН СССР, 1954. 28 с.
Бондарцева М.А. Определитель грибов России. Порядок афиллофоровые. Вып. 2. Семейства альбатрелловые, апорпиевые, болетопсиевые, бондарцевиевые, ганодермовые, кортициевые (виды с порообразным гименофором), лахнокладиевые (виды с трубчатым гименофором), полипоровые (роды с трубчатым гименофором), пориевые, ригидопоровые, феоловые, фистулиновые. СПб.: Наука, 1998. 391 с.
Бондарцева М.А., Пармасто Э.Х. Определитель грибов СССР. Порядок афиллофоровые. Вып. 1. Семейства гименохетовые, лахнокладиевые, кониофоровые, щелелистниковые.
Л.: Наука, 1986. 192 с.
Бурова Л.Г., Томилин Б.А. Изучение грибов как компонента биогеоценоза // Программа и методика биогеоценологических исследований. М.: Наука, 1974. С. 122–131.
Васильева Л.Н. Изучение макроскопических грибов (макромицетов) как компонентов растительных сообществ // Полевая геоботаника: в 5 т. М., Л.: Наука, 1959. Т. 1. С. 387–398.
Васильков Б.П. Съедобные и ядовитые грибы средней полосы европейской части России: Определитель. Изд. 2-е, перераб. СПб.: Наука, 1995. 190 с.
Вассер С.П. Флора грибов Украины. Агариковые грибы. Киев: Наук. думка, 1980.
328 с.
Вассер С.П. Флора грибов Украины. Аманитальные грибы. Киев: Наук. думка, 1992.
168 с.
Вишневский М.В. Определитель агарикоидных базидиомицетов Московской области. Часть 1: Определитель родов. М.: ИД «Муравей», 1999. 40 с.
Все о съедобных грибах. Вильнюс: UAB «Bestiary», 2012. 128 с.
Гарибова Л.В. Сбор и составление гербария грибов // Грибы СССР / М.В. Горленко, М.А. Бондарцева, Л.В. Гарибова [и др.]; отв. ред. М.В. Горленко. М.: Мысль, 1980. С. 54–60.
Грюнтер Г., Грюнтерт Р. Грибы / пер. с нем. И. Шаталова. М.: АСТ; Астрель, 2002.
288 с.
Дудка И.А., Вассер С.П. Грибы. Справочник миколога и грибника. Киев: Наук. думка, 1987. 535 с.
Змитрович И.В. Определитель грибов России. Порядок афиллофоровые. Вып. 3. Семейства ателиевые и амилокортициевые. – М.; СПб.: Товарищество научных изданий КМК, 2008. 278 с.
Змитрович И.В., Малышева В.Ф., Малышева Е.Ф., Спирин В.А. Плевротоидные грибы Ленинградской области (с заметками о редких и интересных восточноевропейских таксонах). СПб.: Изд-во ВИЗР, 2004. 124 с.
Карманная энциклопедия. Грибы. СПб.: ООО «СЗКЭО», 2010. 608 с.
Кибби Дж. Атлас грибов: определитель видов / пер. с англ. Е.С. Попова. СПб.: ТИД Амфора, 2009. 269 с.
Коваленко А.Е. Определитель грибов СССР. Порядок Hygrophorales. Л.: Наука, 1989.
175 с.
Кутафьева Н.П. Морфология грибов: учеб пособие. Изд. 2-е, испр., доп. Новосибирск: Сиб. университ. изд-во, 2003. 215 с.
Лессо Т. Грибы: определитель. М.: АСТ; Астрель, 2003. 304 с.
Лиштва А.В. Лихенология: учеб.-метод. пособие. Иркутск: Изд-во Иркут. гос. ун-та, 2007. 122 с.
Мучник Е.Э., Инсарова И.Д., Казакова М.В. Учебный определитель лишайников Средней России: учебно-методическое пособие. Рязань, 2011. 360 с.
Нездойминого Э.Л. Определитель грибов России. Порядок агариковые. Вып. 1. Семейство паутинниковые. СПб.: Наука, 1996. 408 с.
Ниемеля Т. Трутовые грибы Финляндии и прилегающей территории России // Norrlinia. 2001. Т. 8. С. 1–120.
81
Николаева Т.Л. Флора споровых растений СССР. Т. VI. Ежовиковые грибы. М.; Л.: Изд-во АН СССР, 1964. 433 с.
Определитель лишайников СССР. Вып. 1–5 / отв. ред. И.И. Абрамов. Л.: Наука, 1971–
1978.
Определитель лишайников России. Вып. 6–10 / отв. ред. Н.С. Голубкова. СПб.: Наука, 1996–2008.
Престон-Мэфем К. Фотографирование живой природы: практическое руководство.
М.: Мир, 1985. 165 с.
Сафонов М.А. Трутовые грибы Оренбургской области. Оренбург: Изд-во ОГПУ, 2000.
152 с.
Сержанина Г.И. Шляпочные грибы Белоруссии. Определитель и конспект флоры. Минск: Наука и техника, 1984. 407 с.
Сонина А.В., Степанова В.И., Тарасова В.Н. Лишайники: учеб. пособие. Ч. 1: Морфология, анатомия, систематика. Петрозаводск: Изд-во ПетрГУ, 2006. 216 с.
Смицкая М.Ф. Флора грибов Украины. Оперкулятные дискомицеты. Киев: Наук. дум-
ка, 1980. 224 с.
Флора Беларуси. Грибы. В 7 т. Т. 1: Boletales, Amanitales, Russulales / О.С. Гапиенко,
Я.А. Шапорова; под ред. В.И. Парфенова. Минск: Беларус. навука, 2012. 199 с.
Эванс Ш., Кибби Дж. Грибы. Энциклопедия / пер. с англ. и науч. ред. Е.Н. Лекомцевой. М.: АСТ; Астрель, 2008. 296 с.
Biodiversity of the Fungi. Inventory and Monitoring Methods / Eds. G.M. Mueller, G.F. Bills, M.S. Foster. Burlington: Elsevier Academic Press, 2004. 777 p.
Buyck B., Læssøe T., Meyer M., Hofsetter V. Guidelines for the field mycologist with emphasis on the larger fungi // Abc Taxa. 2010. Vol. 8: Manual on field recording techniques and protocols for all taxa biodiversity inventories / Eds. J. Eymann, J. Degreef, C.L. Häuser [et al.]. P. 308– 330.
Collecting and Preserving Fungi. A Manual for Mycology / Ed. by A.P. Baxter, E. van der Linde. Johannesburg: ARC – PPRI, 1999. 86 p.
Courtecuisse R., Duhem B. Mushrooms & toadstools of Britain and Europe. London: Harper Collins, 1995. 480 p.
Leonard P.L. A guide to collecting and preserving fungal specimens for the Queensland Herbarium. Brisbane, 2010. 45 p.
82
ГЛАВА 4. МЕТОДЫ ЭНТОМОЛОГИЧЕСКИХ ИССЛЕДОВАНИЙ
Насекомые – самая многочисленная группа животных. До сих пор она остается недостаточно изученной в силу большого разнообразия и ряда трудностей, сопряженных с ее исследованием. Выполняя работу в данной области при квалифицированном руководстве, можно внести существенный научный вклад в изучение биоразнообразия конкретного региона.
Перед выбором темы энтомологического исследования следует учесть ряд моментов. Во-первых, желательно выбрать актуальную тему, что позволит выполнить солидную работу. В данной области сделать это нетрудно, поскольку многие аспекты изучения насекомых конкретных регионов остаются недостаточно исследованными. Окончательно выяснить, актуальна тема или нет, можно только после консультации со специалистом. Во-вторых, работу имеет смысл выполнять, если в перспективе имеется возможность проверить правильность определения видов у специалиста по данной группе. В противном случае либо исследование можно проводить, ограничиваясь идентификацией до классов, отрядов и основных семейств, либо этого не стоит делать вовсе. Работа, основанная на непроверенном материале, не имеет научной ценности (хотя исследовательские навыки при этом развиваются). Если результаты ее в дальнейшем опубликуют, то это внесет путаницу в дальнейшие исследования по данной теме. Кроме того, собранные животные совершенно бесполезно будут изъяты из природы, что противоречит целям сохранения биоразнообразия. Опубликованное справочное издание «Кто есть кто: биоразнообразие» (1997) позволяет найти координаты специалиста практически по любой группе животных.
Остановимся теперь на конкретных рекомендациях по методикам исследования насекомых. Подавляющее большинство методик относится к энтомологическим исследованиям эколого-фаунистического характера. Подобные работы выполняются в 2 этапа: 1) полевые исследования; 2) камеральная обработка материала.
Камеральная обработка материала заключается, прежде всего, в определении собранных насекомых. Для этого используют бинокулярный микроскоп
исовременные определители. Далее производят подсчет собранных насекомых
иосуществляют статистическую обработку.
Входе полевых исследований необходимо собрать богатый и обширный фактический материал. Он может быть и небольшим, но обязательно достаточным для последующей статистической обработки. Даже работая над реализацией конкретной задачи, желательно изучать все стороны жизни животного. Важно добывать сравнимые сведения, что достигается применением единой методики одним исследователем. Допустим, перед исследователем стоит задача – выяснить и сравнить составы фаун какой-то группы насекомых разных биотопов. Для получения сравнимых данных необходимо соблюсти следующие условия: 1) работа выполняется одним и тем же сборщиком; 2) используется
83
одна и та же методика; 3) в разных биотопах берется одинаковое число проб; 4) отбор проб производится примерно в одни и те же сроки. В противном случае, последующая статистическая обработка не даст ответов на поставленные в задачах вопросы. Наконец, обязательным требованием данного этапа является точное документирование материала в полевом дневнике. Перед началом отбора проб в каком-то биотопе необходимо детально описать географическое положение, микроклиматические условия, фитоценоз сообщества, погоду, время исследования. В последующем эти данные, зафиксированные в дневнике, помогут в интерпретации полученных результатов.
Оборудование для полевых энтомологических исследований
Перед началом полевых исследований, помимо знакомства с методикой работы, необходимо подготовить специальное оборудование. Речь идет преимущественно об энтомологическом снаряжении. Не останавливаясь подробно на его описании (см., например, Козлов, Нинбург, 1971; Фасулати, 1971; Голуб и др., 1980; Голуб, Цуриков, Прокин, 2012), перечислим основные принадлежности энтомолога-исследователя.
Сачок. Различаются сачки воздушные, для энтомологического кошения и водные. Диаметр обруча обычно 30 см. Мешок воздушного сачка изготавливают из мельничного газа или марли, сачка для кошения – из бязи, водного сачка
– из канвы или из мелкоячеистого капронового тюля (выкройка – см. рис. 4.1). Обруч сачка для кошения и водного сачка изготавливают из проволоки толщиной 3–5 мм, для воздушного – 2–3 мм. Длина палки сачка для кошения – на 20 см меньше роста сборщика, водного сачка – 2–2,5 м, воздушного – не более
1,5 м.
Морилка – широкогорлая склянка с герметично закрывающейся пробкой (обычно корковой), служащая для умерщвления собранных насекомых (рис. 4.2). Банку заполняют ленточками фильтровальной бумаги, сложенными «гармошкой». Перед началом экскурсии сюда же помещают кусочек ваты, завернутый в фильтровальную бумагу и пропитанный замором. В качестве последнего лучше использовать уксусно-этиловый эфир (этилацетат) или хлороформ. Ватку с замором можно вставить в небольшую пробирку, укрепленную в нижней части пробки. В полевых условиях необходимо иметь несколько морилок. Насекомых в морилке держат от 2–3 минут до 6–8 часов.
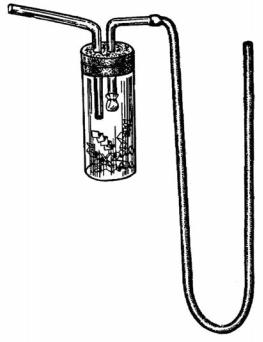
Для сбора мягких и мелких насекомых используют эксгаустер (рис. 4.3). Он представляет собой широкую пробирку диаметром обычно 20–25 мм и длиной 85–110 мм, плотно закрывающуюся корковой или резиновой пробкой. В пробку вставляются две стеклянные трубочки диаметром 5–6 мм. Длина одной трубочки 40–50 мм, другой – 160–180 мм. Короткая трубочка проходит внутрь пробирки на 10–15 мм, длинная – на 15–30 мм. На наружный конец короткой трубочки надевается резиновая трубка длиной до 40 см. На внутреннем конце этой же трубочки с помощью нитки или резинового колечка укрепляется фильтр из марли (2–3 слоя) или мелкоячеистой капроновой сетки для предотвращения попадания пыли и самих насекомых в рот сборщика.
84
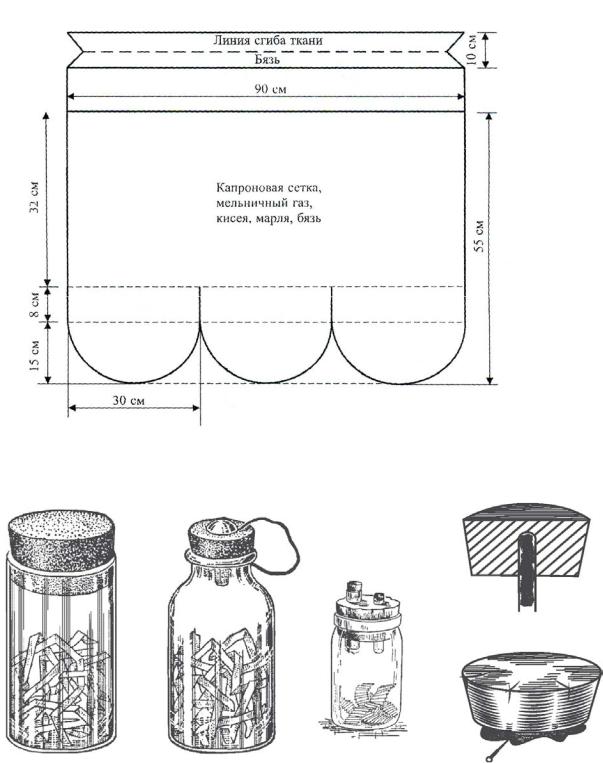
Рисунок 4.1. Выкройка мешка энтомологического сачка стандартных размеров (по: Козлов, Нинбург, 1971).
Рисунок 4.2. Морилки и пробки к ним (по: Голуб и др., 2012).
Кроме этого в полевой сумке должны быть пробирки (для переноса живых насекомых), пинцеты, малая саперная лопатка, крепкий нож, полевой дневник и карандаш. Очень полезным прибором при проведении полевых исследований, определения географических координат местонахождения, пунктов
85
отбора проб, высоты над уровнем моря, прокладывания маршрутов и т.п. явля-
ется персональный навигатор GPS (Global Positioning System).
В настоящее время существует много интернет-магазинов, через которые можно заказать практически любое энтомологическое оборудование.
Рисунок 4.3. Эксгаустер (по: Козлов, Нинбург, 1971).
4.1. Методы изучения почвенных насекомых
Здесь и далее при характеристике методик информация в значительной степени заимствована из ряда известных источников (Козлов, Нинбург, 1971; Фасулати, 1971; Голуб и др., 1980; Голуб и др., 2012).
Метод почвенных проб
Почвенные беспозвоночные животные подразделяются на несколько групп. Реально рекомендуем выполнить исследования по мезофауне. По классификации М.С. Гилярова, к мезофауне относятся почвенные беспозвоночные средних размеров, выбираемые из почвы методом ручной разборки (дождевые черви, пауки, насекомые и их личинки и т.д.). Подразделяясь по способу питания на сапрофагов, фитофагов и зоофагов, они играют важную роль в процессах почвообразования и потребления органического вещества.
Задачи исследования: изучение сходства и различия почвенной мезофауны насекомых в лесных и луговых ценозах различных типов, на полях под разными культурами.
Методика. На площадках 50×50 см (отмеряется особой металлической рамкой) почва выкапывается послойно (0–10 см, 10–20 см, 20–30 см) и
86
выкладывается на клеенку. Комочки почвы тщательно разминаются руками, все собранные животные помещаются в отдельные флакончики с 2–5% формалином или 70% спиртом. Туда же помещается этикетка, на которой указаны дата, пункт (село, район, город), биотоп и место взятия пробы, номер пробы, номер слоя. Образцы на исследуемом участке берутся со всех вариантов рельефа и почвы с учетом разнообразия растительного покрова (10–12 проб на исследуемый участок).
Число почвенных проб зависит от характера обследования, особенностей биологии обследуемого объекта или объектов и от величины участка. Как правило, чем больше площадь, тем большее число проб следует брать. При обследовании отчетливо пересеченного рельефа количество проб должно быть довольно большим (обследуются разнообразные микростации), а при обследовании сглаженного или равнинного рельефа количество проб может быть небольшим (в пределах десяти, часто 6–8). Во втором случае количество проб зависит только или почти только от обследуемой площади. Если вредители встречаются отдельными очагами, число проб следует увеличить. Напротив, если вредители встречаются в большой численности и распределяются по участку равномерно, число почвенных проб можно уменьшить.
Пробные площадки располагаются на участке равномерно, так, чтобы обследовать и края, и середину участка. Пробы на обследуемом участке размещают по диагонали (особенно, если участки большие и измеряются десятками гектар; при этом первую пробу выкапывают на расстоянии примерно 20 м от края обследуемого участка) или равномерно по всей площади в шахматном порядке. На однородных участках небольшой площади пробы размещают по двум пересекающимся прямым. На узких длинных участках – окраинах дорог, вдоль оросительных каналов и т.п. – пробы размещают «змейкой». Примеры расположения проб на обследуемых участках показаны на рис. 4.4.
Метод выплескивания
Этот метод необходим для сбора почвенных обитателей линии уреза во-
ды (Georissidae, Heteroceridae, Saldidae и т.д.). Наиболее удобен он на открытых мелководьях. Руками или любой емкостью вода выплескивается на берег, после чего вымытые из почвы насекомые собираются с поверхности воды у берега аквариумным сачком. На заросших мелководьях следует с корнем выдергивать растения, которые сразу же осматривать на предмет наличия насекомых, а лишь потом переходить к выплескиванию, оставляя растения в зоне исследования. Как правило, берег заселен гидрофильными насекомыми не более чем на расстоянии 1 м от уреза воды.
87
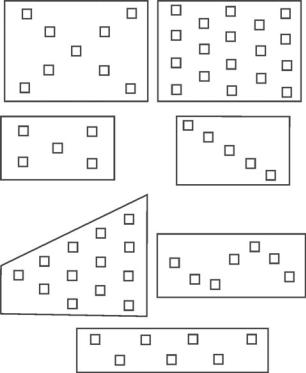
Рисунок 4.4. Варианты размещения почвенных проб (по: Фасулати, 1971).
4.2. Методы изучения напочвенных насекомых
Изучение насекомых-герпетобионтов
Герпетобионты – это насекомые, передвигающиеся по поверхности поч-
вы.
Задачи исследования: выявление состава фауны насекомыхгерпетобионтов, соотношения таксонов, сезонной и суточной динамики численности видов в разных биотопах, выявление сходства и различия фаун основных биотопов, зависимости состояния фауны от воздействия различных факторов, в том числе и антропогенного.
Методика. Для изучения можно использовать 3 основных метода.
1) Установка почвенных ловушек. В выбранных биотопах вкапывается в одну линию по 10 стеклянных банок емкостью 0,5 л на расстоянии 2,5 м друг от друга. При этом верхний край банки должен находиться на одном уровне с почвой. Внутренние края банок должны быть чистыми и гладкими, чтобы попавшие туда насекомые не смогли выбраться наружу. В банки после установки их в почве на 1/3 заливается жидкость. Если это вода, то ловушки следует проверять ежедневно. Лучше использовать слабые растворы (например, 3%) этиленгликоля или уксусной кислоты (последний обладает к тому же привлекательным для некоторых видов запахом). Фиксирующие свойства растворов позволяют увеличить период между выборками (до 7 дней). Жидкость в банки необходимо по мере надобности добавлять или заменять раствор на новый. Отловленных таким образом крупных насекомых выбирают из банок с помощью пинцета, а мелких – путем процеживания содержимого ловушки через мелкое сито. Далее насекомых помещают в морилки, а затем просушивают с помощью
88
фильтровальной бумаги и раскладывают на матрасики. Перед укладкой в коробку необходимо тщательно просушить материал на матрасиках.
Стеклянные банки можно заменить пластиковыми стаканчиками. Для удобства сбора материала целесообразно использовать 2 стаканчика, вкладываемых друг в друга. В ходе отбора пробы верхний стаканчик вынимается, из него выбирается материал, обновляется фиксатор. Далее этот стаканчик легко вставляется в стационарный, находящийся в почвенном углублении.
Как правило, в одном биотопе ставят не одну банку, а серию – 3–5 или более. Такая серия почвенных ловушек соответствует количеству повторностей в обследуемом биотопе. Оставляют ловушки, в зависимости от целей исследований и возможностей для проведения проверки, на ночь, сутки или несколько суток. При выставлении почвенных ловушек на несколько суток существует опасность заливания их дождевой водой, вплоть до заполнения и переливания через край. При этом концентрация фиксатора сильно снижается, и собранный материал может пропасть. Для предотвращения заливания ловушки водой можно прикрывать ее сверху приподнятой над горловиной банки «крышей», изготовленной, например, из отрезанной и перевернутой вершинной части пластиковой бутылки с навинченной крышечкой. Такая «крыша» укрепляется стойками над ловушкой-банкой или прикрепляется непосредственно к ней.
2)Ловчие ямы выкапывают прямоугольной формы глубиной 30–35 см, размером 25×25 см, лучше – 50×50 см. Канавки выкапывают той же глубины, шириной 20–30 см и длиной, зависящей от целей исследования и физических возможностей исследователя, делающего канавки. На дно ям и канавок нередко помещают различные приманки или просто банки с фиксирующей жидкостью. Осматривают ямы по утрам, выбирая в морилку попавших насекомых. Для увеличения эффективности сборов насекомых-герпетобионтов почвенные канавки можно располагать крестообразно.
3)При изучении фауны герпетобионтов применяют также отлов на притеняющие приманки. Для этого готовят из смеси диких злаковых или сорных
растений пучки по 2–3 горсти каждый. Раскладывают полученные притеняющие приманки на площади 30 см2, высота пучка при этом – 10–15 см. В разных биотопах (обычно в антропоценозах) раскладывают в одну линию по 10 приманок на расстоянии 10 м друг от друга. Утром и вечером ежедневно выбирают всех насекомых, собравшихся под травой. Кроме типичных герпетобионтов в сборах обычно бывает много жуков-щелкунов.
Изучение насекомых подстилки
Задачи исследования: выявление состава фауны жуков подстилки, соотношения таксонов, сезонной динамики численности видов в разных биотопах, зависимости состояния фауны от воздействия различных факторов.
Работа выполняется в лесных биотопах ранней весной (когда только что растаял снег, и подстилка еще не просохла) или поздней осенью. Она позволяет выявить состав насекомых подстилки, который включает 2 основные группы: зимующие виды и типичные герпетобионты.
89
