
1 КУРС (Разобранные билеты по неоргхимии
.doc)Билет№1.
Эквивале́нт — условная или реальная,равноценная частица. Эквивалентом называется такая часть атома, иона или молекулы, которая химически равноценна (эквивалентна) одному иону водорода в данной кислотно-основной реакции или одному электрону в данной окислительно-восстановительной реакции. Единицей количества эквивалента вещества является моль.
Например, в реакции
2NaOH+ H2SO4 =Na2SO4 +2H2 О или
NaOH+1/2 H2SO4 =1/2Na2SO4 +H2 О
эквивалент серной кислоты будет равен 1/2H2SO4 , где 1/2 - фактор эквивалентности.
Фактор эквивалентности ( f ) - это число, показывающее какая часть моля вещества равноценна одному иону водорода в данной кислотно-основной реакции или одному электрону в данной, окислительно-восстановительной реакции.
Фактор эквивалентности может быть равен 1 или меньше 1, например, f (NH4OH)=1; f (H2SO4 )=1/2; f (KMnO4)= 1/5 и т.д.
Для нахождения фактора эквивалентности вещества обязательно надо указывать реакцию , в которой данное вещество участвует.
Количество вещества — физическая величина, характеризующая количество однотипных структурных единиц, содержащихся в веществе. Под структурными единицами понимаются любые частицы, из которых состоит вещество (атомы, молекулы, ионы, электроны или любые другие частицы). Единица измерения количества вещества — моль.
Моль- единица количества вещества,в которой содержится столько же частиц,сколько атомов в 12 граммах углерода.
способы выражения концентрации растворов:
Массовая доля растворённого вещества w(B) - это безразмерная величина, равная отношению массы растворённого вещества к общей массе раствора m.(w(B)= m(B) / m)
В количественном анализе массовую долю измеряют в процентах.
Она характеризует содержание компонента в твердом веществе или растворе: (А) = [m (А)/ mобщ]100(%).)
Закон эквивалентов
В результате работ И. В. Рихтера (1792—1800) был открыт закон эквивалентов:
все вещества реагируют и образуются в эквивалентных отношениях.
формула, выражающая Закон эквивалентов: m1Э2=m2Э1
Молярная концентрация C(B) показывает, сколько моль растворённого вещества содержится в 1 литре раствора.
Нормальность раствора -число грамм-эквивалентов данного вещества в одном литре раствора.
Концентрация раствора (С) - это отношение количества растворенного вещества (А) к объему раствора (V). Другими словами, С (А) показывает количество вещества в единице объема раствора.
Основной единицей измерения количества вещества является моль.1 моль вещества содержит 6,022 * 1023 элементарных объектов (например атомов).
В количественном анализе широко используют и дольную единицу моля - миллимоль (ммоль). 1 моль = 1000 ммоль.
В системе СИ основной единицей выражения концентрации растворов является молярная концентрации (моль/м3), на практике - моль/дм3, допускается моль/л.
Билет№2.
Раствори́мость — способность вещества образовывать с другими веществами однородные системы — растворы, в которых вещество находится в виде отдельных атомов, ионов, молекул или частиц.
Произведение растворимости (ПР, Ksp) — произведение концентраций ионов малорастворимого электролита в его насыщенном растворе при постоянной температуре и давлении. Произведение растворимости — величина постоянная.
влияние внешних воздействий на растворимость:
1.С повышением температуры растворимость увеличивается. У газов наоборот.
2.Присутствие посторонних веществ, как правило, уменьшает растворимость данного вещества.(примеси).
3.Давление.
Билет№3 .
Диссоциация — распад сложных химических соединений на составляющие компоненты или элементы.
Электролитическая диссоациация-это процесс распада веществ на ионы при растворении или расплавлении.В результате диссоциации в растворе появляются ионы, которые являются предпосылкой для появления у раствора или расплава такого физического свойства как электропроводимость.Разрушение ионной кристаллической решётки происходит под воздействием растворителя, например воды. Полярные молекулы воды настолько снижают силы электростатического притяжения между ионами в кристаллической решётке, что ионы становятся свободными и переходят в раствор.
При расплавлении , когда происходит нагревание кристалла, ионы начинают совершать интенсивные колебания в узлах кристаллической решётки, в результате чего она разрушается, образуется расплав, который состоит из ионов.
Слабые электролиты — химические соединения, молекулы которых даже в сильно разбавленных растворах незначительно диссоциированны на ионы, которые находятся в динамическом равновесии с недиссоциированными молекулами.
Слабыми электролитами являются:
почти все органические кислоты и вода;
некоторые неорганические кислоты:H3PO4,H2CO3, H2SiO3, H2SO3
Сильные электролиты — химические соединения, молекулы которых в разбавленных растворах практически полностью диссоциированы на ионы.
Примеры сильных электролитов: H2SO4,NaOH,KOH.
Ио́нное произведе́ние воды́ — произведение концентраций ионов водорода Н+ и ионов гидроксила OH− в воде или в водных растворах, константа автопротолиза воды.
Вода, хотя и является слабым электролитом, в небольшой степени диссоциирует:
![]()
Водоро́дный показа́тель, pH — мера активности ионов водорода в растворе,количественно выражающая его кислотность.Отрицательный десятичный логарифм концентрации ионов Н.
Константа диссоциации — вид константы равновесия, которая характеризует склонность объекта диссоциировать (разделяться) обратимым образом на частицы,Константа диссоциации обычно обозначается Kd и обратна константе ассоциации.
Степень диссоциации — величина, характеризующая состояние равновесия в реакции диссоциации в гомогенных (однородных) системах.
"Степень диссоциации это есть отношения числа продиссоциируемых молекул к общему числу молекул и умноженному на 100%":
![]() .
.
Буферные растворы — растворы с определённой устойчивой концентрацией водородных ионов ; смесь слабой кислоты с сопряженным основанием (напр., СН3СООН и CH3COONa — ацетатный буфер) или слабого основания и сопряженной кислоты (напр., NH3 и NH4CI — аммиачный буфер).
БИЛЕТ№4.
Гидролиз-взаимодействие вещества с водой, при котором составные части вещества соединяются с составными частями воды.
СОЛИ - это электролиты, при диссоциации которых образуются катионы (положительно заряженные ионы) металлов и анионы, отрицательно заряженные ионы кислотных остатков.
Соли по отношению к гидролизу делятся на 4 группы:

Степень гидролиза-отношение части соли, подвергающейся гидролизу, к общей концентрации её ионов в растворе. Обозначается α (или hгидр);
α = (cгидр/cобщ)·100 %
где cгидр — число молей гидролизованной соли, cобщ — общее число молей растворённой соли.
Константа гидролиза — константа равновесия гидролитической реакции. Так константа гидролиза соли равна отношению произведения равновесных концентраций продуктов реакции гидролиза к равновесной концентрации соли с учетом стехиометрических коэффициентов.
1. Гидролиз соли слабой кислоты и сильного основания:
Na2CO3 + Н2О = NaHCO3 + NaOH
CO32− + H2O = HCO3− + OH−
(раствор имеет щелочную среду, реакция протекает обратимо)
2. Гидролиз соли сильной кислоты и слабого основания:
CuCl2 + Н2О = CuOHCl + HCl
Cu2+ + Н2О = CuOH+ + Н+
(раствор имеет кислую среду, реакция протекает обратимо)
3. Гидролиз соли слабой кислоты и слабого основания:
Al2S3 + 6H2O = 2Al(OH)3 + 3H2S
2Al3+ + 3S2− + 6Н2О = 2Al(OH)3(осадок) + ЗН2S(газ)
Билет№5.
Хими́ческая реа́кция — превращение одного или нескольких исходных веществ (реагентов) в отличающиеся от них по химическому составу или строению вещества (продукты реакции).
Классификация.
По фазовому составу реагирующей системы:
Гомогенные гомофазные реакции. В реакциях такого типа реакционная смесь является гомогенной, а реагенты и продукты принадлежат одной и той же фазе. Примером таких реакций могут служить реакции ионного обмена, например, нейтрализация кислоты и щелочи в растворе:
NaOH(раств.) + HCl(раств.) → NaCl(раств.) + H2O(ж.)
Гетерогенные гомофазные реакции. Компоненты находятся в пределах одной фазы, однако реакция протекает на границе раздела фаз, например, на поверхности катализатора. Примером может быть гидрирование этилена на никелевом катализаторе:
C2H4(газ) + H2(газ) → C2H6(газ)
По изменению степеней окисления реагентов:
Окислительно-восстановительные реакции, в которых атомы одного элемента (окислителя) восстанавливаются, то есть понижают свою степень окисления, а атомы другого элемента (восстановителя) окисляются, то есть повышают свою степень окисления.
По тепловому эффекту:
экзотермические реакции, которые идут с выделением тепла, (положительный тепловой эффект) например, указанное выше горение водорода
эндотермические реакции в ходе которых тепло поглощается (отрицательный тепловой эффект) из окружающей среды.
По типу превращений реагирующих частиц:
соединения:
![]()
разложения:
![]()
замещения:
![]()
обмена (тип реакции-нейтрализация):
![]()
Окисли́тельно-восстанови́тельные реа́кции — это встречно-параллельные химические реакции, протекающие с изменением степеней окисления атомов, входящих в состав реагирующих веществ, реализующихся путём перераспределения электронов между атомом-окислителем и атомом-восстановителем.
Окислительно-восстановительная реакция между водородом и фтором:
![]()
Разделяется на две полуреакции:
1) Окисление:
![]()
2) Восстановление:
![]()
Уравнение Нернста — уравнение, связывающее окислительно-восстановительный потенциал системы с активностями веществ, входящих в электрохимическое уравнение, и стандартными электродными потенциалами окислительно-восстановительных пар.
![]() ,
,
Где
![]() —
электродный потенциал,
—
электродный потенциал, ![]() —
стандартный электродный потенциал,
измеряется в вольтах;
—
стандартный электродный потенциал,
измеряется в вольтах;
![]() — универсальная
газовая постоянная, равная
8.31 Дж/(моль·K);
— универсальная
газовая постоянная, равная
8.31 Дж/(моль·K);
![]() —
абсолютная температура;
—
абсолютная температура;
![]() — постоянная
Фарадея, равная
96485,35 Кл·моль−1;
— постоянная
Фарадея, равная
96485,35 Кл·моль−1;
![]() —
число моль электронов,
участвующих в процессе;
—
число моль электронов,
участвующих в процессе;
![]() и
и ![]() — активности соответственно окисленной
и восстановленной форм вещества,
участвующего в полуреакции.
— активности соответственно окисленной
и восстановленной форм вещества,
участвующего в полуреакции.
Билет№6. Комплексные соединения или координационные соединения— частицы (нейтральные молекулы или ионы), которые образуются в результате присоединения к данному иону (или атому), называемому комплексообразователем, нейтральных молекул или других ионов, называемых лигандами.
Номенклатура:
1) В названии комплексного соединения первым указывают отрицательно заряженную часть — анион, затем положительную часть — катион.
2) Название комплексной части начинают с указания состава внутренней сферы. Во внутренней сфере прежде всего называют лиганды — анионы, прибавляя к их латинскому названию окончание «о». Например: Cl− — хлоро, CN− — циано, SCN− — тиоцианато, NO3− — нитрато, SO32− — сульфито, OH− — гидроксо и т. д. При этом пользуются терминами: для координированного аммиака — аммин, для воды — аква, для оксида углерода(II) — карбонил.
3) Число монодентатных лигандов указывают греческими числительными: 1 — моно (часто не приводится), 2 — ди, 3 — три, 4 — тетра, 5 — пента, 6 — гекса. Для полидентатных лигандов (например, этилендиамин, оксалат) используют бис-, трис-, тетракис- и т. д.
4) Затем называют комплексообразователь, используя корень его латинского названия и окончание -ат, после чего римскими цифрами указывают (в скобках) степень окисления комплексообразователя.
5) После обозначения состава внутренней сферы называют внешнюю сферу.
6) В названии нейтральных комплексных частиц комплексообразователь указывается в именительном падеже, а степень его не указывается, так как она однозначно определяется, исходя из электронейтральности комплекса.
Примеры:
K3[Fe(CN)6] — гексацианоферрат(III) калия
[Li(H2O)4]NO3 — нитрат тетрааквалития
Состав:
В комплексных соединениях различают комплексообразователь, внешнюю и внутреннюю сферы. Комплексообразователем обычно является катион или нейтральный атом. Внутреннюю сферу составляет определённое число ионов или нейтральных молекул, которые прочно связаны с комплексообразователем. Их называют лигандами. Число лигандов определяет координационное число (КЧ) комплексообразователя. Внутренняя сфера может иметь положительный, отрицательный или нулевой заряд.
Остальные ионы, не разместившиеся во внутренней сфере, находятся на более далеком расстоянии от центрального иона, составляя внешную координационную сферу.
Если заряд лигандов компенсирует заряд комплексообразователя, то такие комплексные соединения называют нейтральными или комплексами-неэлектролитами: они состоят только из комплексообразователя и лигандов внутренней сфер.
Координационное числом-число лигандов, определенным образом расположенных в пространстве и непосредственно связанных с центральным ионом, называют координационным числом этого иона.
Координационная ёмкость (число мест) или дентатность- Число атомов, предоставляемых лигандами для образования координационных связей с комплексообразователем.
Пример: (во внейшней среде) K4[Fe(CN)6] + 4HCl = H4[Fe(CN)6] + 4KCl
(разбавление) K4[Fe(CN)6] + 4HCl = H4[Fe(CN)6] + 4KCl
Билет№7.
Основы химической термодинамики.
При протекании химических реакций происходит перестройка энергетических уровней. Разрушаются одни связи в молекулах и образуются другие. Все это требует определенных энергетических затрат. Превращение одних видов энергии и работы в другие, а также направление и пределы самопроизвольного протекания химических процессов изучает химическая термодинамика. Объектом изучения химической термодинамики является система.
Система – это совокупность взаимодействующих веществ, мысленно или фактически обособленная от окружающей среды (пробирка, автоклав).
Системы бывают: гомогенные – состоящие из одной фазы (однородный раствор поваренной соли) и гетерогенные – состоящие из нескольких фаз (вода со льдом).
Фаза – часть системы, однородная по составу и свойствам и отделенная от других частей системы поверхностью раздела.
Термохи́мия — раздел химической термодинамики, в задачу которой входит определение и изучение тепловых эффектов реакций, а также установление их взаимосвязей с различными физико-химическими параметрами.
Внутренняя энергия системы Uвнскладывается из энергии поступательного и вращательного движения молекул, энергии внутримолекулярного колебательного движений атомов и атомных групп, энергии, заключающейся в ядрах атомов, энергии межмолекулярного взаимодействия.
Тепловые эффекты : Раздел химической термодинамики, в котором изучают тепловые эффекты химических реакций и зависимость их от различных физико-химических параметров, носит название термохимии.В термохимии пользуются термохимическими уравнениями реакций, в которых обязательно указывают агрегатное состояние вещества, а тепловой эффект реакции рассматривают как один из продуктов взаимодействия.
Энтальпи́я— термодинамический потенциал, характеризующий состояние системы в термодинамическом равновесии при выборе в качестве независимых переменных давления, энтропии и числа частиц,проще говоря, энтальпия — это та энергия, которая доступна для преобразования в теплоту при определенном постоянном давлении.
Закон Гесса — основной закон термохимии, который формулируется следующим образом:Тепловой эффект химической реакции, проводимой в изобарно-изотермических или изохорно-изотермических условиях, зависит только от вида и состояния исходных веществ и продуктов реакции и не зависит от пути её протекания. Практическое значение закона Гесса состоит в том, что он позволяет рассчитывать тепловые эффекты самых разнообразных химических процессов; для этого обычно используют ряд следствий из него.
Параметры состояния, термодинамические параметры — физические величины, характеризующие состояние термодинамической системы: температура, давление, удельный объём, намагниченность, электрическая поляризация и др. Различают экстенсивные параметры состояния, пропорциональные массе системы:
объём,внутренняя энергия,энтропия,энтальпия,энергия Гиббса,
и интенсивные параметры состояния, не зависящие от массы системы:
давление,температура,концентрация.
Билет№8.
Химическое равновесие — состояние химической системы, в котором обратимо протекает одна или несколько химических реакций, причём скорости в каждой паре прямая-обратная реакция равны между собой.
А2 + В2 ⇄ 2AB
Константа хим.равновесия (концентрационная, термодинамическая)
Концентрация ве-в, имеющая место в системе с момента наступления равновесия, наз-ся равновесными , эти концентрации остаются неизменными столько долго, сколько не изменяется внешнее условие.
Равновесная концентр.ве-ва зависти от его исходной концентрации ве-ва и расхода ве-ва на протекание р-ции до момента установления равновесия.
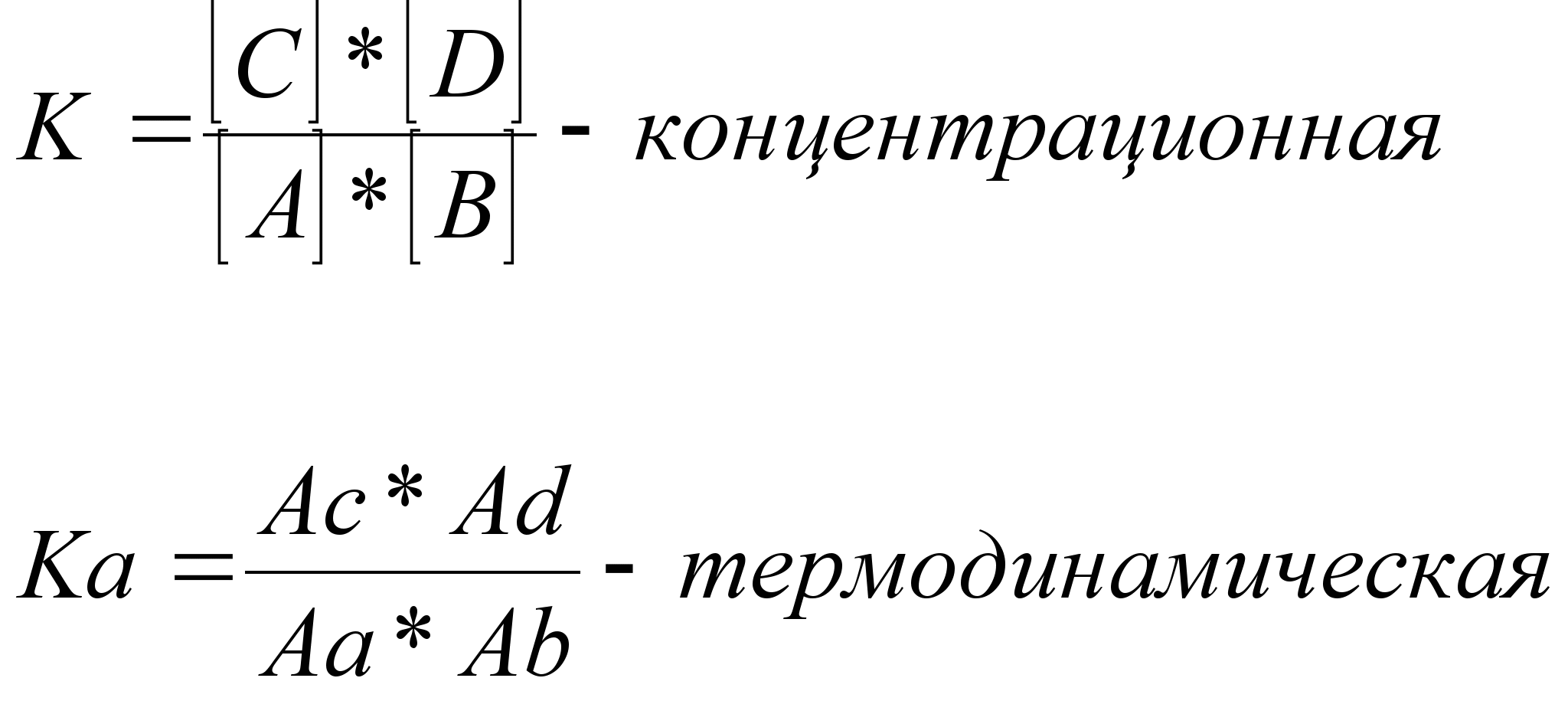
На состояние химического равновесия оказывают влияние концентрации реагирующих веществ, температура, а для газообразных веществ — и давление. При изменении одного из параметров равновесие нарушается и концентрация всех реагирующих веществ изменяется до тех пор, пока не установится новое равновесие, но уже при иных значениях равновесных концентраций. Подобный переход реакционной системы от одного состояния равновесия к другому называется смещением (или сдвигом) химического равновесия. Если при изменении условий увеличивается концентрация конечных веществ, то говорят о смещении равновесия в сторону продуктов реакции. Если же увеличивается концентрация исходных веществ, то равновесие смещается в сторону их образования.
Билет№9.
Химическая кинетика или кинетика химических реакций — раздел физической химии, изучающий закономерности протекания химических реакций во времени, зависимости этих закономерностей от внешних условий, а также механизмы химических превращений.
Кинетическое уравнение,
выражает зависимость скорости хим.
реакции от концентраций компонентов
реакционной смеси. Для простой
(одностадийной) гомогенной реакции
скорость v пропорциональна произведению
концентраций реагирующих веществ и
кинетическое уравнение записывается
в виде:
![]()
где [Ai] (i=1,2,...,l) - концентрация i-го вещества, ni-порядок реакции по i-му веществу, k-константа скорости р-ции.
Константа скорости реакции (удельная скорость реакции) — коэффициент пропорциональности в кинетическом уравнении.
Физический смысл константы скорости реакции k следует из уравнения закона действующих масс: k численно равна скорости реакции при концентрации каждого из реагирующих веществ равной 1 моль/л.
Энергия активации — минимальное количество энергии, которое требуется сообщить системе (в химии выражается в джоулях на моль), чтобы произошла реакция.
Связь констант прямой и обратной реакции с константой равновесия:
когда скорости прямой и обратной реакции становятся одинаковыми, наступает химическое равновесие.

Билет№10.
А́том — частица вещества микроскопических размеров и массы, наименьшая часть химического элемента, являющаяся носителем его свойств. (см.в тетради!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!)
Атом состоит из атомного ядра и электронов. Если число протонов в ядре совпадает с числом электронов, то атом в целом оказывается электрически нейтральным. В противном случае он обладает некоторым положительным или отрицательным зарядом и называется ионом.В некоторых случаях под атомами понимают только электронейтральные системы, в которых заряд ядра равен суммарному заряду электронов, тем самым противопоставляя их электрически заряженным ионам.
Ядро, несущее почти всю (более чем 99,9 %) массу атома, состоит из положительно заряженных протонов и незаряженных нейтронов, связанных между собой при помощи сильного взаимодействия.
Модель атома Томсона (модель «Пудинг с изюмом»). Дж. Дж. Томсон предложил рассматривать атом как некоторое положительно заряженное тело с заключёнными внутри него электронами. Была окончательно опровергнута Резерфордом .
Ранняя планетарная модель атома Нагаоки. В 1904 году японский физик Хантаро Нагаока предложил модель атома, построенную по аналогии с планетой Сатурн. В этой модели вокруг маленького положительного ядра по орбитам вращались электроны, объединённые в кольца. Модель оказалась ошибочной.
Планетарная модель атома Бора-Резерфорда. В 1911 году Эрнест Резерфорд, проделав ряд экспериментов, пришёл к выводу, что атом представляет собой подобие планетной системы, в которой электроны движутся по орбитам вокруг расположенного в центре атома тяжёлого положительно заряженного ядра («модель атома Резерфорда»).
Характеристика квантовых чисел:
-
Главное квантовое число (n) — характеризует энергию и размер орбитали. Оно принимает значения от 1 до
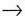 :
n = 1, 2, 3, 4, 5, 6, 7.
:
n = 1, 2, 3, 4, 5, 6, 7. -
Побочное (орбитальное) квантовое число (1) - характеризует форму орбиталей и принимает значения от 0 до (n - 1): 1 = О, 1, 2, 3, 4. Например, если n = 2, то 1 имеет 2 значения: О, 1. Значит, на 2 энергетическом уровне есть сферическая орбиталь (1 = 0) и в виде объемной восьмерки (гантелеобразная) (1 = 1).
-
Магнитное квантовое число (m) - характеризует количество орбиталей одинаковой формы и ориентацию их в электромагнитном поле ядра атома. Оно принимает значения в интервале от —1 до +1. Для каждого значения разрешено (21 + 1) значений числа m. Например, если 1 = 1, то m имеет (2 x 1 + 1) 3 значения: — 1,0, +1.
-
Спиновое квантовое число (s) - характеризует вращение электрона вокруг своей оси и принимает только 2 значения: +1/2 (
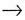 )
и -1/2 (
)
и -1/2 ( ).
(Спин электрона — свойство электрона
вести себя как крошечный магнит).
).
(Спин электрона — свойство электрона
вести себя как крошечный магнит).
Порядок заполнения атомных орбиталей электронами:
Заполнение электронами
орбиталей в атоме происходит в порядке
возрастания суммы главного и орбитального квантовых
чисел ![]() .
При одинаковой сумме раньше заполняется
орбиталь с меньшим значением
.
При одинаковой сумме раньше заполняется
орбиталь с меньшим значением ![]() .
.
Билет№11. (см. в тетради)
Периоди́ческая систе́ма хими́ческих элеме́нтов (табли́ца Менделе́ева) — классификация химических элементов, устанавливающая зависимость различных свойств элементов от заряда атомного ядра. Система является графическим выражением периодического закона.0
Период — строка периодической таблицы. В рамках периода элементы демонстрируют определенные закономерности во всех трех аспектах (атомный радиус, энергия ионизации и электроотрицательность), а также в энергии сродства к электрону. В направлении слева направо атомный радиус обычно, и параллельно с ним возрастает энергия ионизации,так же увеличивается и электроотрицательность. Что касается энергии сродства к электрону, то металлы в левой части таблицы характеризуются меньшим значением этого показателя, а неметаллы в правой, соответственно, большим — за исключением благородных газов.
В Периодической таблице каждая группа элементов подразделяется на главную подгруппу и побочную подгруппу. В главную подгруппу входят s- и p-элементы, в побочную - d-элементы.
Элементы побочных подгрупп (d-элементы) называют ПЕРЕХОДНЫМИ элементами или переходными металлами (все d-элементы - металлы).
Билет№12.

Типы химической связи.
1. Ковалентная связь – связь, осуществляемая общими электронными парами. Двуцентровая, двухэлектронная. Соединения с ковалентной связью называют атомными.
Ковалентная связь бывает:
- Неполярная ковалентная связь – то есть связь, при которой общая электронная пара принадлежит обеим атомам в ровной степени и находится симметрично относительно ядер атомов, образующих химическую связь.
- Полярная ковалентная связь – если атомы имеют различия электроотрицательности, то общая электронная пара смещается к элементу с более высокой электроотрицательностью.
2. Ионный тип связи – образование связи происходит за счёт электростатического притяжения между катионами и анионами. Соединения с таким типом химической связи называют ионными. Связь ненаправленная и ненасыщаемая, поскольку ионная связь действует сразу во всех направлениях и ионные соединения, это твёрдые тела с ионной кристаллической решеткой.
3. Металлическая связь - характерна для металлов в твёрдом и жидком состоянии. Элементы, образующие металлическую связь, имеют небольшое количество электронов на внешнем энергетическом уровне и достаточное количество свободных орбиталей. Валентные орбитали соседних атомов перекрываются и электроны свободно перемещаются по ним при образовании кристаллической решетки. Таким образом, осуществляется связь между всеми атомами металла.
Межмолекулярное взаимодействие:
Водородная связь — форма ассоциации между электроотрицательным атомом и атомом водорода H, связанным ковалентно с другим электроотрицательным атомом.
