
Симонов_Рановесная и неравновесная термодинамика
.pdf
энергий Гиббса конкурирующих фаз (например, фаз β→ж). Выписывают значения температурных интервалов устойчивых фаз. Задают температурный интервал равновесия конкурирующих фаз (с учетом данных прил. I и расчетных кривых Т0(х) для всех возможных равновесий). Устанавливают теоретически реализуемые равновесия. Для расчета возможных равновесий исходные данные подставляют соответственно в уравнения (1.12) и (1.13), (1.19) и (1.20), (1.21) и (1.22), (1.23) и (1.24), (1.25) и (1.26), (1.27) и (1.28).
В результате их решения определяют значения хi и хj — равновесные атомные составы фаз.
1.1.2.Расчет фазовых равновесий диаграмм состояния
вприближении регулярных растворов
Вприближении регулярных растворов значения L, B, Е, А отличаются от нуля, и расчеты выполняют в такой последовательности. Из прил. I выбирают температурные зависимости разности свободных энергий, а из прил. II — значения L, B, E, A конкурирующих фаз. По уравнениям (1.16), (1.29) и (1.30), (1.31) и (1.32), а также
(1.33) в результате расчета кривых Т0(х) из всех предполагаемых равновесий определяют реальные равновесия. Положение линий равновесия на диаграммах состояния определяют, подставляя ис-
ходные значения G , L, B, E, A в уравнения (1.12) и (1.13),
(1.19) и (1.20), (1.21) и (1.22), (1.23) и (1.24), (1.25) и (1.26), (1.27) и (1.28). В результате решения этих уравнений получают равновесные атомные концентрации фаз хi и хj. Расчет линий равновесия в приближении как идеальных, так и регулярных растворов осуществляется на ЭВМ.
1.1.3.Расчет диаграммы состояния системы Moi ―Ru j
вприближении идеального раствора
Из прил. I выписывают значения Tпл для возможных модификаций Mo и Ru:
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
TМо 2900; TМо 1900; TМо 1530; |
|||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
1780. |
T |
|
1420; T |
2550; T |
||||||||||
|
Ru |
|
|
Ru |
|
|
Ru |
|
|||||
11
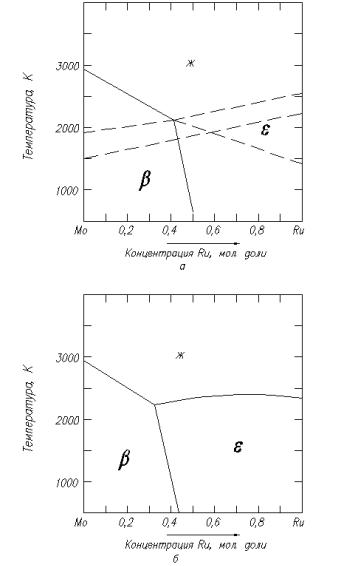
Рис. 1.1. Вспомогательная диаграмма для определения устойчивых фаз системы Mo — Ru в приближении идеальных (а)
и регулярных (б) растворов
12

По уравнениям (1.16), (1.29) и (1.30) рассчитывают кривые Т0(х) для равновесий β—ж, ε—ж, α—ж. В результате получают три кривые, причем кривая Т0(х) для равновесия α—ж при всех концентрациях находится ниже соответствующих кривых равновесий β—ж и ε—ж. Отсюда следует, что в нулевом приближении на фазовой диаграмме системы Mo — Ru отсутствует α-фаза (рис.1.1, а).
Затем для равновесия β—ε по уравнению (1.31) определяют кривую Т0(х), разделяющую области β—ε (см. рис.1.1, а). Далее рассчитывают границы двухфазных областей для равновесий β—ж, ε—ж, β—ε и проводят эвтектическую горизонталь через точку пересечения кривых ликвидуса β—ж и ε—ж.
1.1.4.Расчет диаграммы состояния системы Мо — Ru
вприближении регулярного раствора
Из приложения I выписывают значения Tпл для возможных модификаций Мо и Ru:
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
TМо 2900; TМо 1900; TМо 1530; |
|||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
1780. |
T |
|
1420; T |
2550; T |
||||||||||
|
Ru |
|
|
Ru |
|
|
Ru |
|
|||||
Из приложения II выписывают значения L, B, Е, А для систе-
мы Mo — Ru:
L –23667, B –23913, E –29431, A –31437.
По уравнениям (1.16), (1.29) и (1.30) вычисляют значения Т0(х) для равновесий β—ж, ε—ж, α—ж (рис. 1.1, б). В результате расчета кривая Т0(х) для равновесия α—ж при всех концентрациях находится ниже кривых равновесия β—ж и ε—ж. Следовательно, на фазовой диаграмме отсутствует α-фаза.
Затем по уравнениям (1.12), (1.13), (1.19), (1.20), (1.23) и (1.24)
рассчитывают границы двухфазных областей равновесия β—ж, ε—ж, β—ε и проводят эвтектическую горизонталь через точку пересечения кривых ликвидуса β—ж и ε—ж.
Расчетная диаграмма состояния системы Mo — Ru в двух приближениях изображена на рис. 1.2.
13
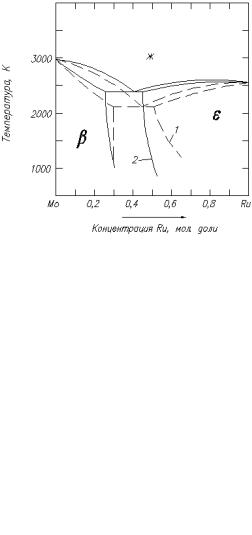
Рис. 1.2. Диаграмма состояния системы Mo — Ru:
1, 2 — в приближении идеальных и регулярных растворов соответственно
Рис. 1.3. Экспериментальная диаграмма состояния системы Mo — Ru
Система Mo — Ru характеризуется отрицательными значениями энергий смещения B, E, отражающих сильное межчастичное взаимодействие между компонентами. Вследствие этого на диаграмме, рассчитанной в приближении регулярных растворов, более
14
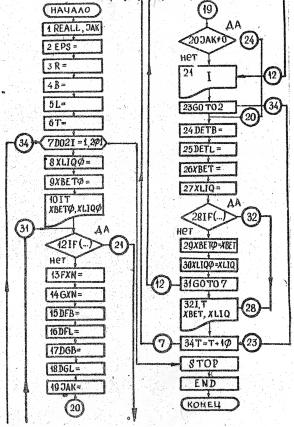
широкая область устойчивости β- и ε-фаз, чем в приближении идеальных растворов. Значительное сродство Mo и Ru приводит к образованию промежуточной фазы в этой системе (рис. 1.3). Схема алгоритма программы расчета равновесия β—ж диаграмм состояния Mo — Ru в приближении регулярных растворов приведена на рис. 1.4. Сопоставление расчетной диаграммы в приближении регулярных растворов с экспериментальной показывает соответствие расчетных и экспериментальных результатов, если не учитывать образование промежуточного соединения.
Рис. 1.4. Схема алгоритма расчета диаграммы состояния системы Mo — Ru в приближении регулярных растворов
15
1.1.5. Составление программы расчета на ЭВМ
Из сказанного выше следует, что границы фазовых областей х и х любого равновесия 72 диаграмм состояния между i-м и j-м компонентами (см. прил. II) определяются следующей системой уравнений:
G RT ln |
1 x |
x2Z |
|
x2 Z |
|
; |
|
|
|||||
|
|
|
|
||||||||||
|
i |
1 x |
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
x |
|
|
|
|
|
|
|
|
|
|
|
G RT ln |
(1 x )2 Z |
|
(1 x )2 Z |
|
, |
||||||||
|
|||||||||||||
|
j |
x |
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|||
где — обозначение конкурирующих твердых фаз , , (полярно конкурирующих между собой); — обозначение конкурирующих
фаз жидкости (ж) с твердыми фазами и ; Z (B, E, A), Z (L, B, A) — избыточные энергии образования фаз в приближении регулярных
растворов, равные нулю для идеальных растворов.
Это позволяет применить единые алгоритмы расчета линий фазового равновесия в приближении идеальных и регулярных растворов, которые будут отличаться только исходными данными.
В качестве примера на рис. 1.4 приведена схема алгоритма расчета диаграммы состояния системы Mo — Ru в приближении регулярных растворов.
Входные данные: 1) значения параметров стабильности компонентов Мо и Ru, т. е. разностей свободных энергий GМо ж,
GRu ж; 2) данные, характеризующие область температур, для ко-
торой рассчитывается равновесие β—ж; 3) температурный инкремент Т; 4) для регулярных растворов (дополнительно) значения избыточной энергии смешения L, В. На выходе машинных программ печатаются таблицы, содержащие результаты вычислений значений хβ, хж и соответствующие температуры.
16
1.1.6. Метод Ньютона для приближенного решения системы двух уравнений
Для решения систем алгебраических уравнений применяют несколько приближенных методов. В приведенной задаче приближенные значения корней находят по методу Ньютона.
Пусть xn, yn — приближенные корни системы уравнений
F(x, y) : G(x, y) 0,
где F, G — непрерывно дифференцируемые функции. Полагая x xn + hn, y yn + kn, получаем
F(xn + hn; yn + kn) 0; G(xn + hn; yn + kn) 0.
Отсюда, применяя формулу Тейлора и ограничиваясь линейными членами относительно hn и kn, имеем
F(xn, yn) + hn FxI (xn, yn) + kn FyI (xn, yn) 0;
G(xn, yn) + hn GxI (xn, yn) + kn GyI (xn, yn) 0.
Если
J(xn, yn) │FxI (xn, yn) FyI (xn, yn)│ ≠ 0,
│GxI (xn, yn) GyI (xn, yn)│,
то из данной системы уравнений находим
hn –1 / J(xn, yn)│Fx(xn, yn) FyI (xn, yn)│,
│Gx(xn, yn) GyI (xn, yn)│;
kn –1 / J(xn, yn)│FxI (xn, yn) Fy(xn, yn)│, │GxI (xn, yn)Gy(xn, yn)│.
17
Отсюда можно определить
xn + 1 xn – 1 / J(xn, yn)│Fx(xn, yn) FyI (xn, yn)│,
│Gx (xn, yn) GyI (xn, yn)│;
yn + 1 yn –1 / J(xn, yn)│FxI (xn, yn)Fy (xn, yn)│,
│GxI (xn, yn)Gy (xn, yn)│.
Начальные значения берутся приближенно.
2.1.Задание
1.Определите число стабильных фаз на диаграмме состояния.
2.Вычислите температурные интервалы существования фазовых равновесий.
3.Выполните расчет системы уравнений с получением зависимостей координат межфазных границ от температуры равновесия с помощью программы diagr-2 на ПК.
4.Полученные результаты расчетов межфазных границ различных равновесий представьте в координатах температуры, K — состав, молярные доли.
5.Проведите фазовый и структурный анализ диаграммы состояния.
6.Оформите задание в виде самостоятельного документа, включающего все пункты работы.
Работа 2. РАВНОВЕСНЫЕ И НЕРАВНОВЕСНЫЕ ТЕРМОДИНАМИЧЕСКИЕ СИСТЕМЫ
Цель работы — ознакомиться с некоторыми принципами равновесной и неравновесной термодинамики; рассмотреть примеры систем, находящихся в различных термодинамических состояниях.
18
2.1. Теоретическая часть
Известно, что классическая равновесная термодинамика изучает изолированные (замкнутые) системы, находящиеся в состоянии равновесия. Кроме того, равновесная термодинамика рассматривает общие закономерности процессов, протекающих при эволюции системы к состоянию равновесия. Под термодинамическим равновесием при этом подразумевается состояние, к которому при определенных внешних условиях (температуре, давлении и т. д.) неодолимо стремится система, так как в этом состоянии она обладает минимальной свободной энергией. После достижения термодинамического равновесия состояние замкнутой системы сохраняется постоянным во времени.
Окружающий нас мир — мир животных, растений, мир неживой природы — не является изолированной системой и не находится в состоянии термодинамического равновесия. По отношению к окружающему нас миру равновесная термодинамика есть некая абстрактная упрощенная модель. Тем не менее в преобладающем большинстве практически важных случаев (в локальных системах) использование этой модели приводит к правильным результатам.
В последние годы получили развитие новые способы сильного энергетического воздействия на вещество, в частности такие технологические процессы, как ионное и лазерное модифицирование, сильное деформирование, обработка взрывом, механоактивация, быстрая закалка из жидкого состояния и некоторые другие способы нетрадиционной обработки материалов. В результате были созданы уникальные материалы различного назначения с принципиально новыми структурами и свойствами. Эти структуры не могут быть описаны в рамках привычной равновесной термодинамики, так как они не стремятся к положению с минимальной свободной энергией, т. е. к термодинамическому равновесию. Изучением этих неравновесных состояний занимается новое научное направление, которое называет-
ся физикой открытых систем или неравновесной термодинамикой.
Переход от классической термодинамики замкнутых систем к теории неравновесных процессов — одно из важнейших физических направлений нашего времени. Основные идеи теории неравновесных процессов предложены учеными И. Пригожиным и Г. Хакеном. Равновесная термодинамика включена в эту теорию в качестве частного случая.
19
2.1.1. Основные закономерности равновесной термодинамики
Первое начало термодинамики (закон сохранения энергии)
Каждая термодинамическая система обладает характеристической функцией состояния — внутренней энергией. Эта функция состояния возрастает на количество сообщенной системе теплоты dQ и уменьшается на количество совершенной системой внешней работы dA. Для изолированной системы справедлив закон сохранения энергии
dU dQ – dA.
Данное уравнение представляет собой одну из формулировок первого начала термодинамики.
Внутренняя энергия U включает в себя энергию хаотического (теплового) движения всех микрочастиц системы и энергию взаимодействия этих частиц. Кинетическая и потенциальная энергии системы как единого целого во внутреннюю энергию не входят. Для изолированной равновесной системы, т. е. для системы, которая не обменивается ни веществом, ни энергией с окружающей средой, dU 0 и U const, т. е. выполняется закон сохранения энергии.
Второе начало термодинамики
Этот закон был в общем виде сформулирован У. Томсоном в 1852 г. В основу второго начала термодинамики положено представление о том, что единственно возможным путем эволюции системы является ее необратимое движение к положению равновесия. Движение к равновесию в изолированной гомогенной системе рассматривается как стремление к однородности, например если в системе существует некоторый градиент температуры, то с течением времени он должен выравниваться. Отсюда возникло представление о неминуемом грядущем исчезновении многообразия окружающего нас мира, о так называемой «тепловой смерти Вселенной». Будущий мир рисовался как инертная субстанция, «унылая штука без запаха, без цвета, материя, спешащая без повода и без смысла».
Для более строгого описания процессов эволюции системы к своему положению равновесия вводят еще некоторую функцию состояния — энтропию. Приращение энтропии S при переходе систе-
20
