
Замараев - часть 3
.pdf
|
Из последнего уравнения |
видно, что за короткое время |
|
t3 |
» 1/ k3 |
концентрация C ∙ |
вырастает до квазистационарно- |
|
|
RO2 |
|
го значения
C ∙
RO 2
= A ,
затем C ∙
RO2
, а значит, и скорость реакции экспоненциально
растет с постоянной времени |
|
|
t = |
1 |
. |
2 k4 × n |
При этом τ и t3 подчиняются соотношению τ >> t3 . На прак- тике τ может достигать нескольких минут или даже несколь- ких часов.
В этом состоит основное различие между цепными реак- циями с вырожденным разветвлением и разветвленными цеп- ными реакциями типа окисления H2, где характеристическое
время нарастания концентрации активных центров составляет доли секунды, и в результате реакция воспринимается как взрыв. Это различие обусловлено тем, что в реакции между H2 и O2 разветвление цепи происходит в быстрой реакции с уча-
∙
стием атома H , а в реакции между RH и O2 – в более медлен- ном акте распада относительно стабильной молекулы ROOH.
Нетрудно сообразить, что коэффициент A в выражении для
|
|
|
|
C ∙ |
равен стационарной концентрации C ∙ , которая уста- |
||
RO2 |
|
R O 2 |
|
новилась бы для неразветвленной цепной реакции, состоящей из стадий 0–3, в отсутствие реакции вырожденного разветвле- ния 4. Эту концентрацию можно найти из условия
Wo = W3 ,
ß
Wo = k3 × C ∙ ,
R O2
ß
97
|
|
|
|
|
|
∙ |
= |
Wo |
. |
|
|
||||
|
|
|
|
C |
|
||||||||||
|
|
|
|
|
|
|
|||||||||
|
|
|
|
|
RO 2 |
|
k3 |
|
|||||||
Таким образом, |
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
A = |
|
|
∙ |
= |
Wo |
|
|
|||||
|
|
|
C |
|
|||||||||||
|
|
|
k3 |
|
|||||||||||
|
|
|
|
|
|
|
R O2 |
|
|
||||||
и |
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
∙ |
= |
Wo |
|
× {1- e−k3 t }× e2k 4 νt . |
(7.58) |
||||||||
|
C |
||||||||||||||
|
k3 |
||||||||||||||
|
RO 2 |
|
|
|
|
|
|
|
|
||||||
§ 7.4. Тепловой взрыв
При выделении энергии экзотермической химической реак- ции в виде тепла реакционная смесь разогревается. При этом
возникает положительная обратная связь между разогревом и скоростью реакции: разогрев приводит к увеличению скорости,
а увеличение скорости приводит к еще большему разогреву и т. д. В результате, если не отводить тепло, произойдет быст- рый саморазогрев реагирующей системы, т. е. тепловой взрыв.
Если скорость экзотермической химической реакции пред-
ставить в виде
W = k |
o |
× e−E / RT × f(C ) |
(7.59) |
|
i |
|
(здесь f(Ci ) – некоторая функция от концентраций веществ –
компонентов реагирующей смеси), то для скорости тепловы-
деления получаем
V+ = q × W = q×k |
o |
× e−E / RT × f(C ) |
(7.60) |
|
i |
|
(здесь q – тепловой эффект реакции).
Скорость теплоотвода можно представить в виде
V− = k ×(T - T )× |
S |
, |
(7.61) |
|
V |
||||
o |
|
|
где κ – коэффициент теплопередачи (кал / см2·с); S – пло- щадь поверхности реакционного сосуда; V – его объем; T и
98
To – температура газа и стенок реакционного сосуда, соответ- ственно.
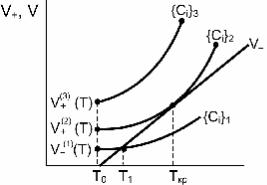
Зависимости V+ и V− от T представлены на рис. 7.3. На этом рисунке через {Ci }1,2,3 обозначена совокупность концен-
траций компонентов смеси, соответствующая кривым тепло- выделения V+(1)(T) , V+(2)(T) и V+(3)(T) . Из рисунка видно, что при концентрациях реагентов {Ci }1 саморазогрев возможен только
до T = T1 . |
|
|
|
При T < T |
выполняется условие |
V+(1) |
> V− . |
1 |
|
|
|
При T > T |
выполняется условие |
V+(1) |
< V− . |
1 |
|
|
|
При T = T |
выполняется условие |
V+(1) |
= V− , т. е. V+(1) и V− |
1 |
|
|
|
сравниваются, и процесс выходит на стационарный режим.
Рис. 7.3. Зависимости
скоростей тепловыделения и теплоотвода от темпера- туры для разных концен- траций компонентов реак-
ционной смеси
При концентрациях реагентов {Ci }3 при любой T выполня-
ется условие V+(3) > V− , что отвечает состоянию теплового са- мовоспламенения (взрыва).
Кривая V+(2)(T) отделяет семейство кривых типа V+(1)(T) , от- вечающих стационарному протеканию реакции, от семейства кривых типа V+(3)(T) , отвечающих взрывному протеканию про-
99

цесса. Для кривой V+(2)(T) в точке T = Tђр одновременно вы- полняются два условия:
V+ = V−
и
dVdT+ = dVdT− .
Подставив в эти условия выражения для скоростей тепловы- деления и теплоотвода (7.60 и 7.61) получим два уравнения:
q×k |
|
×e−E / RTкр × f(C ) = k × (T |
- T )× |
S |
; |
(7.62) |
|||||
|
V |
||||||||||
|
o |
|
i |
кр |
o |
|
|
|
|||
q×k |
|
× e−E / RTкр × f(C )× |
E |
|
= k × |
S |
|
. |
|
(7.63) |
|
|
RT2 |
V |
|
|
|||||||
|
|
o |
i |
|
|
|
|
|
|||
|
|
|
|
кр |
|
|
|
|
|
|
|
Если разделить первое уравнение на второе, то можно полу-
чить соотношение между температурами внутри сосуда и на его стенках:
RT2
Eкр = Tкр - T0 = q .
Как правило, величина E (> 20 ккал / моль) оказывается гораз- до больше произведения RTкр (Tкр < 1000 К), поэтому пред- взрывной разогрев оказывается во много раз меньше темпе-
ратуры реакции. Поэтому можно считать T2 |
» T2 |
и |
|||
|
|
|
кр |
0 |
|
|
RT2 |
|
|
|
|
|
0 |
= T |
- T = q . |
|
(7.64) |
|
|
|
|||
|
E |
кр |
0 |
|
|
|
|
|
|
|
|
Разность температур q называют предвзрывным разогревом горючей смеси.
Во многих случаях скорость экзотермической реакции при фиксированном соотношении реагентов можно представить как степенную функцию от полной концентрации горючей смеси:
f(Ci ) = cn .
100

Используя это выражение, легко получить давление, выше которого горючая смесь может взрываться. Для этого исполь- зуем приближенные оценки:
E |
|
E |
E |
æ |
|
q |
ö |
|
E E × q |
|
E |
|
|||
|
ç |
|
÷ |
|
|
-1. |
|||||||||
|
= |
|
» |
|
× ç1 |
- |
|
÷ |
= |
|
- |
|
= |
|
|
RT |
R(T + q) |
RT |
T |
RT |
RT2 |
RT |
|||||||||
кр |
|
0 |
|
0 |
è |
|
0 |
ø |
|
0 |
0 |
|
0 |
|
|
Подставляя их в формулу (7.63), находим
− |
E/ RT0 |
× e ×cкрn = k × |
RT2 |
|
S |
|
|
|
q×ko × e |
0 |
× |
|
, |
(7.65а) |
|||
E |
V |
|||||||
|
|
|
|
|
|
или, если измеряемой величиной является давление,
|
|
|
−E /RT |
|
pкрn |
|
RT2 |
|
S |
|
|
|
q×k |
o |
× e |
0 |
× e × |
|
= k × |
0 |
× |
|
. |
(7.65б) |
|
kn Tn |
E |
V |
||||||||||
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
Б 0 |
|
|
|
|
|
|
Для анализа экспериментальных результатов используют логарифмические координаты, в которых формула (7.65) име-
ет вид
æ |
p |
ö |
|
E |
|
ç |
кр |
÷ |
= |
+ const , |
|
ln |
|
|
|
||
1+2 n ÷ |
|
||||
ç |
|
nRT0 |
|
||
è T0 |
ø |
|
|
||
удобный для определения энергии активации реакции. Отме- тим, что тепловой взрыв происходит при более высоких дав- лениях, нежели цепной, поэтому давление pкр часто называют
третьим пределом самовоспламенения.
§ 7.5. Цепные реакции с энергетическим разветвлением. Химические лазеры
По цепному механизму с энергетическим разветвлением протекают реакции фторирования молекул RH, где R – атом
∙
H , углеводородный радикал или галоидзамещенный углево-
∙∙
дородный радикал (типа CH3 , CH2I и т. д.).
Для реакции фторирования RH был установлен следующий механизм:
101
|
|
¾¾® |
|
∙ |
|
|
|
0. |
F2 |
2 F |
|
– зарождение цепи; |
|||
1. |
∙ |
|
|
|
|
∙ |
– продолжение цепи; |
F + RH ¾¾® HF + R |
|||||||
2. |
∙ |
|
|
|
|
∙ |
– продолжение цепи; |
R + F |
¾¾® (RF)* + F |
||||||
|
|
2 |
|
|
|
V |
|
3. |
(RF)* |
+ F |
|
¾¾® |
∙ |
– разветвление цепи; |
|
|
RF + 2 F |
||||||
|
|
V |
2 |
|
|
|
|
4. |
(RF)* |
+ RH |
¾¾® RF + (RH)* |
– передача энергии; |
|||
|
|
V |
|
|
|
V |
|
5. |
(RH)* |
+ F |
¾¾® |
∙ |
– разветвление цепи; |
||
RH + 2 F |
|||||||
|
|
V |
|
2 |
|
|
|
|
∙ |
|
|
|
ü |
|
|
6. |
F |
¾¾® |
|
ï |
|
|
|
гибель, |
|
– обрыв цепи. |
|||||
|
∙ |
|
|
|
ý |
|
|
7. |
R |
¾¾® |
|
ï |
|
|
|
гибельþ |
|
|
|||||
Изюминкой этого механизма является образование в реак- ции 2 колебательно возбужденной молекулы продукта реакции
(RF)*V . Эта молекула имеет запас энергии, чтобы обеспечить
протекание с достаточной скоростью реакций разветвления 3 и/или 5. При этом реакция 5 осуществляется благодаря воз-
можности обмена колебательной энергией между молекулой (RF)*V и RH по процессу 4.
В ходе реакции фторирования RH вследствие разветвлен-
ного цепного механизма устанавливается очень высокая
∙
сверхравновесная концентрация как свободных радикалов R
∙
и F , так и колебательно возбужденных частиц типа (RF)*V .
Благодаря возникновению сверхравновесных концентраций возбужденных частиц, реакции фторирования можно исполь- зовать для создания химических лазеров.
Химические лазеры – это лазеры, в которых генерация сверхравновесных концентраций возбужденных частиц осуще- ствляется за счет протекания разветвленных цепных реакций.
102
Заключение
На этом автор заканчивает курс лекций по химической ки- нетике для студентов 3-го курса факультета естественных на- ук Новосибирского государственного университета. Как отме- чено в предисловии, автор ставил перед собой задачу проде- монстрировать студентам, как один из красивейших разделов современной химии – химическая кинетика – строится из про-
стейших принципов и выводов предшествующих курсов химии
ифизики.
Взаключение следует подчеркнуть, что как наука химиче- ская кинетика в настоящее время продолжает бурно разви- ваться. Нет сомнения, что в этой области нас ждет еще много удивительных открытий.
103
Лекции по химической кинетике
Ч. 3
Подписано в печать |
|
Формат 60х84/16 |
||
Печать офсетная. |
|
Уч.-изд.л. |
|
|
Тираж |
экз. |
Заказ № |
Цена |
р. |
Редакционно-издательский отдел Новосибирского университета; участок оперативной полиграфии НГУ; 630090, Новосибирск-90, ул. Пирогова, 2.
Компьютерная верстка Н. А. Чистякова
