
07. Буферні розчини
.pdf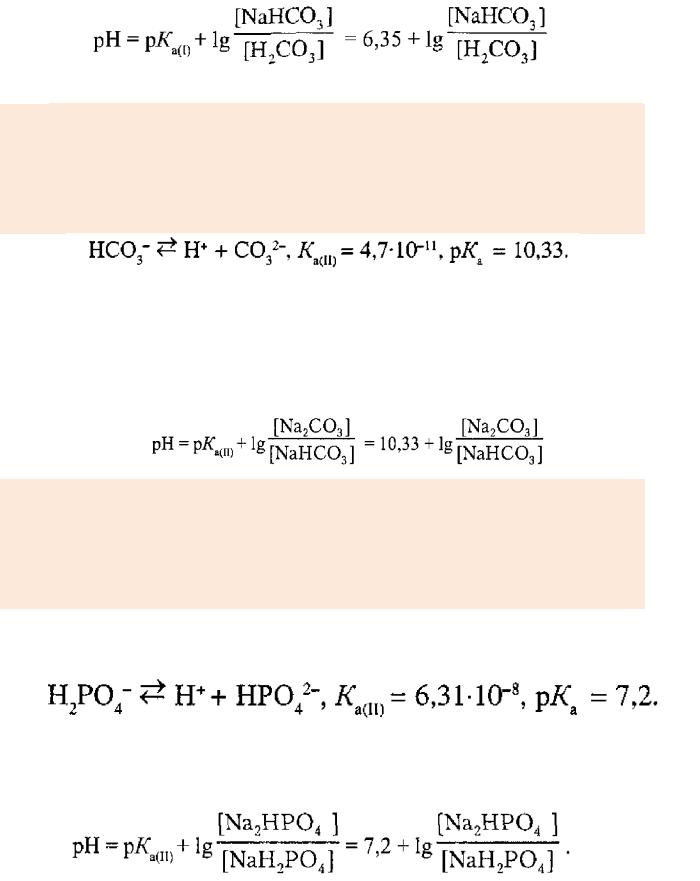
константа її дисоціації Ка(]) або відповідне значення рКа(1):
Карбонатний буферний розчин - це суміш розчинів двох солей карбонатної кислоти - гідрогенкарбонату і карбонату натрію NaНСO3 + Na2СO3. Перша сіль у цій буферній системі виконує функцію “кислоти”,
оскільки дисоціює з відщепленням йона Гідрогену:
Натрій карбонат (середня, або нормальна сіль) у буферній суміші виконує функцію “солі”. Оскільки наведене вище рівняння відповідає другій стадії дисоціації карбонатної кислоти, то у формулу для обчислення рН входить відповідна константа Ка(II) або відповідне значення рКа(1I):
Фосфатна буферна система (діапазон рН 5,9-8,0) складається з розчинів двох кислих солей фосфатної кислоти - дигідрогенфосфату натрію NaН2РO4 (у
буферній суміші виконує роль “кислоти”) та гідрогенфосфату натрію Na2НРO4
(виконує функцію “солі”).
Рівноважний процес у цьому буферному розчині виражають рівнянням,
що відповідає другій стадії дисоціації ортофосфатної кислоти:
Тому значення рН фосфатного буферного розчину обчислюють за рівнянням:
Зазначимо, що фосфатний буфер - один із важливих буферних розчинів,
що діє в біологічних системах.

Для одного і того ж буферного розчину буферна ємність тим більша, чим
вищі концентрації його компонентів.
Таким чином, можна зробити висновки:
•буферний розчин має певну буферну ємність;
•максимальну буферну ємність мають розчини, які містять рівні концентрації слабкої кислоти і її солі або слабкої основи і її солі;
•буферна ємність тим більша, чим вища концентрація компонентів буферної суміші.
ВИКОРИСТАННЯ БУФЕРНИХ РОЗЧИНІВ В АНАЛІЗІ
Часто на практиці виникає необхідність виконувати операції або реакції при певних значеннях рН. А якщо в результаті реакції виділяються Н+ або ОН
- йони, то рН мінятиметься, при цьому може змінитися кінетика, механізм процесів, розчинність осадів, йонізація речовин і т.д. В цих випадках для підтримки, певного значення рН розчину користуються буферними розчинами.
Наприклад, катіони барію відкривають дією CrO42- йонів за утворенням ВаСгО4. Але якщо як реактив застосовувати К2Сг2О7, то реакцію необхідно виконувати у присутності натрію ацетату з наступної причини:
Врезультаті реакції взаємодії Сr2О72- йонів з водою утворюються Н+ йони,
аВаСгО4 у сильних кислотах розчиняється, тому осадження його не буде повним. Щоб забезпечити повноту осадження, додають СН3СООNa.
При цьому утворюється ацетатна буферна суміш, яка підтримує постійне значення:
Вцих умовах йони Са2+ і Sr2+ не осідають, а йони барію осідають повністю.
Ця реакція використовується для виявлення і відділення йонів барію в
систематичному ході аналізу суміші катіонів.

РОЗРАХУНОК РН БУФЕРНИХ РОЗЧИНІВ
Розчини, що зберігають сталість рН при додаванні невеликих кількостей сильних кислот або основ і при розведенні, називаються буферними. Вони складаються із суміші кислоти HA і сполученої основи.
Для опису кожного буферного розчину важливі наступні характеристики:
1)рівень рН, на якому підтримується сталість цієї величини;
2)область буферування, тобто межі рН, у яких може підтримувати сталість рН дана буферна система;
3)ємність буферного розчину, тобто кількість М–еквівалентів сильної кислоти (основи), яких необхідно додати до 1 л буферного розчину, щоб рН його змінився на 1.
Для рівноваги в буферній системі HA NaA напишемо рівняння
електронейтральності:
[H3O ] [Na ] [A ] [OH ] |
|
|
|
|
(1.90) |
|
|
|
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
і рівняння матеріального балансу: |
|
|
|
|
|
|
|
|
||||||||||
[HA] [A ] C |
HA |
C |
NaA. |
|
|
|
|
|
(1.91) |
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
Після їхнього підсумовування: |
|
|
|
|
|
|
|
|
|
|||||||||
[H |
O ] [Na ] [HA] [OH ] C |
HA |
C |
NaA |
. |
(1.92) |
|
|
|
|||||||||
3 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
Але тому що |
[Na ] C |
NaA , |
те |
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
[H |
O ] [HA] [OH ] C |
HA . |
|
|
|
|
(1.93) |
|
|
|
||||||||
3 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
На практиці звичайно застосовують буферні |
розчини, |
у яких |
[H |
O ] |
і |
|||||||||||||
3 |
|
|||||||||||||||||
|
|
|||||||||||||||||
[OH ] малі в порівнянні з CHA і CNaA . Тоді [HA] CHA і |
[ A ] CNaA . |
|
|
|
||||||||||||||
Підставляючи знайдені значення у вираз для К , одержуємо: |
|
|
|
|||||||||||||||
[H 3O ] K HA |
|
CHA |
|
|
|
|
|
|
|
|
|
|
|
|||||
CNaA |
|
чи |
|
|
|
|
|
(1.94) |
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
pH pK lg |
CNaA |
. |
|
|
|
|
|
|
|
(1.95) |
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
CHA |
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
Це рівняння не виконується для кислот чи основ з константами дисоціації вище у випадку, якщо загальна концентрація кислот чи сполученої основи (чи обох компонентів кислотно-сполученої пари) дуже мала.

Для буферних |
розчинів із рН |
7 розрахунок |
простіше проводити, |
||||
використовуючи константу дисоціації основи: |
|
||||||
[H3O |
] |
KH2O |
|
CBH |
. |
|
(1.96) |
|
|
|
|||||
|
|
KB |
|
CB |
|
|
|
Приклад 1. Розрахувати рН буферного розчину, що складається з 0,4000М
мурашиної кислоти і 1,0000 М форміату натрію.
[H3O ] K HCOOH |
|
|
CHCOOH |
|
1,77 10 4 |
|
1,0000 |
7,08 10 5 |
||||||||
|
CHCOONa |
|
||||||||||||||
|
|
|
|
|
|
|
|
|
0,4000 |
, |
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
pH lg( 7,08 5 ) 4,15 |
|
|
|||||||||
Приклад 2. Розрахувати рН буферного розчину, що містить 0,2800 М |
||||||||||||||||
NH 4Cl і 0,0700 М NH 3 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
[H3O ] |
K H |
O |
|
|
CNH |
Cl |
|
|
10 14 |
|
0,2800 |
2,27 10 9 |
||||
2 |
|
|
|
4 |
|
|
|
|
|
|||||||
K NH |
|
|
CNH |
|
1,76 10 5 |
0,0700 |
||||||||||
|
3 |
|
|
3 |
|
|
|
|
, |
|||||||
pH lg( 2,27 9 ) 8,64 .
Розведення буферного розчину
Величина рН буферного розчину залишається практично постійної при розведенні, поки його концентрація не зменшиться настільки, що наближення,
допущені нами ([H3O ] і [OH ] малі в порівнянні з CHA і CNaA ), стануть недійсні.
Приклад 3. Розрахувати рН буферного розчину, отриманого розведенням за прикладом 1: а) у 50 разів; б) у 10 000 разів:
а) після розведення в 50 разів:
СHCOOH 0,4000 0,0080 М 50
СHCOONa 1,0000 0,0200 М 50
[H3O ] 1,77 10 4 0,00800,0200 7,08 10 5
pH lg( 7,08 5 ) 4,15 ;
б) після розведення в 10 000 разів:
СHCOOH 4,0 10 5 [H ]
CHCOONa 1,0 10 4 [H ] .
Тому що розчин досить розведений, то необхідно враховувати і дисоціацію води.
[HCOOH] 4,0 10 5 [H ],
[HCOO ] 1,0 10 4 [H ] .
Підставляємо у вираз для константи рівноваги:
[H |
O ](1,0 10 4 |
[H ]) |
1,77 10 4 |
|
|
3 |
|
|
|
||
|
|
4,0 10 5 [H ] |
|
||
|
|
|
|
||
[H3O ]2 2,77 10 4 [H3O ] 7,08 10 9 0 |
|||||
[H3O ] 2,36 10 5 |
|
pH 4,63 |
. |
||
|
|
|
|
|
|
Таким чином, при 50-кратному розведенні рН буферного розчину |
|||||
практично не змінився, тоді |
як при 10 000-кратному розведенні збільшився з |
||||
4,15 до 4,63. |
|
|
|
|
|
ДЖЕРЕЛА ІНФОРМАЦІЇ Основні:
1. Медична хімія (фізична, колоїдна та біонеорганична хімія) / В. I. Гомонай, Н. П. Голуб, К. Ю. Секереш, А. С. Богоста : посібник до лабораторного практикуму для студентів медичного факультету. - Ужгород, 2007. – 131 с.
2. Медична хімія : підр. для вузів / В. О. Калібабчук, Л. І. Грищенко, В.І. Галинська та ін. ; під. ред. В. О. Калібабчук. - К. :Інтермед, 2006. – 460 c.
3.Миронович Л. М. Медична хімія : навч. посібник / Л. М. Миронович, О. О. Мардашко. – К. : Каравела, 2007. – 168 с.
4.Миронович Л. М. Медична хімія : навч. посібник / Л. М. Миронович. – К. :
Каравела, 2008. – 159 с.
5.Мороз А. С. Медична хімія : підручник / А. С. Мороз, Д. Д. Луцевич, Л. П. Яворська. - Вінниця : Нова книга, 2006. - 776 с.
6.Музиченко В. П. Медична хімія : підручник / В. П. Музиченко, Д. Д. Луцевич, Л. П. Яворська ; під ред. Б. С. Зіменковського. – К. : Медицина, 2010. – 496 с.
7.Порецький А. В. Медична хімія : підручник / А. В. Порецький, О. В. БанніковаБезродна, Л. В. Філіппова. – К. : ВСВ «Медицина», 2012. – 384 с.
8.Правила роботи в хімічній лабораторії (інструкція).
9.http://moodle.tdmu.edu.ua/course/view.php?id=132#section-8
Додаткові:
1.Мороз А. С. Фізична та колоїдна хімія / А. С. Мороз, А. Г. Ковальова. – Л. : «Світ»,
1994. - 280 с.
2.Медицинская химия : учебник / В. А. Калибабчук, В. И. Галинская, Л. И. Грищенко [и др.] ; під ред. В. А. Калибабчук. - К. : Медицина, 2008. - 400 с.
3.Садовничая Л. П. Биофизическая химия : Учеб. пособие для мед. ин-тов / Л. П. Садовничая, В. Г. Хухрянский, А. Я. Цыганенко. – К. : Вища шк., 1986. – 271 с.
4.Равич-Щербо М. И. Физическая и коллоидная химия / М. И. Равич-Щербо, В. В.
Новиков. - М. : Высш. шк., 1975. - С. 256.
