
medvir_xxvii_2_2013
.pdf
60 |
Медицинскаявирусология.томXXVII(2) |
Во-первых, это отсутствие полиморфизма гепатоцитов, свойственное гепатиту В (ГВ), но наблюдаемые и при инфицировании вирусами гепатитов G и TT. Важно, что полиморфизм нарастает параллельно увеличению продолжительности анамнеза заболевания, что является диагностическим и прогностическим признаком.
Во-вторых, чаще встречаются воспалительные изменения желчных протоков.
В-третьих, отмечается незначительное количество некротизированных печеночных клеток. Морфологически чаще встречаются очаговые некрозы с локализацией в перипортальных зонах долек, отражающие слабую степень активности гепатита.
В-четвертых, обнаруживается преобладание крупных «светлых» клеток с чёткими наружными контурами, которые можно отнести к матовостекловидным гепатоцитам.
В-пятых, раннее развитие (1-2 года после инфицирования) перицеллюлярного и перисинусоидального фиброза.
Фиброгенез – важнейший вопрос гепатологии о путях и механизмах хронизации различных заболеваний печени. Фиброз – это одна из наиболее универсальных стереотипных реакций печени. Патология печени при ХГС рассматривается даже как пример фибротической реакции на повреждение. Она развёртывается последовательно по двум направлениям. В острую фазу заболевания в результате некроза и воспаления наступает коллапс ретикулиновой стромы и частичное новообразование коллагена, ведущее к организации некротических масс. При хронизации HCV-инфекции, в период затихания острого распада (некроза) ткани, хроническое воспаление продолжает стимулировать образование внутрипеченочной соединительной ткани. Подобным образом развивается цепь событий при желтушной форме заболевания и не представляет в дальнейшем никаких диагностических проблем. Однако в большинстве случаев после «спокойного» (безжелтушного) периода инфицирования и хронизации инфекции главным триггером и стимулятором фиброгенеза является иммуновоспалительная реакция.
На первых этапах хронизации пограничная пластинка остается неповрежденной. В дальнейшем происходит повреждение или гибель гепатоцитов на поверхности раздела между портальным трактом и долькой, вызывая частичный (piecemeal) некроз и нарушение целостности пограничной пластинки.Воспалительныйпроцессраспространяется на перипортальные дольки, в которых наблюдаются рассыпанные центры инфильтрации и некроза гепатоцитов. Лобулярная архитектура сохраняется, хотя, возможно, уже есть портальный фиброз и соединительнотканные перегородки, исходящие из
morphologicalfeaturescanbeindicativeofHCVinfection.
(1)The absence of hepatocyte polymorphism typical of hepatitis B (HB), but observed also in hepatitis G and hepatitis TT infections. In should be noted, that hepatocyte polymorphism increases with increasing thedurationofthedisease,whichservesasadiagnostic and prognostic sign.
(2)Inflammatorychangesinthebileductsaremore common.
(3)Relatively low number of necrotic liver cells. Focal necroses located in the periportal zones of the lobules are more often seen and reflect low activity of hepatitis.
(4)Large«light»cellswithclear-cutcontours(«hya- line» cells) predominate.
(5)Early development (within 1-2 years postinfection) of pericellular and perisinusoidal fibrosis.
Fibrogenesis is the most important question in hepatology on the pathways and mechanisms of chronization of liver diseases. Fibrosis is one of the universal stereotypic reactions of the liver. Pathological changes in the liver during CHC can be even considered as a typical fibrotic response to injury successivelyunfoldinginthetwodirections.Duringtheacute stage of the disease, necrosis and inflammation result in collapse of the reticulin stroma and partial de novo formation of collagen leading to organization of the necrotic mass. During chronization of HCV infection, theintensityofacutetissuedegradation(necrosis)decreases, but chronic inflammation still stimulates the formation of the intrahepatic connective tissue. Similarchainofeventsisobservedinthejaundicedformof the disease, which is easily diagnosed. However, after «quiet» (anicteric) period of infection and its chronization, immunoinflammatory reaction becomes the main trigger and stimulator of fibrogenesis.
During the initial stages of chronization, the limiting plate remains not damaged, but later, damage or death of hepatocytes separating the portal tract from the lobule leads to partial (piecemeal) necrosis and impairs the integrity of the limiting plate. The inflammatory process involves the periportal lobules, where scattered infiltration foci and hepatocyte necrosis foci areseen.Thelobulararchitectureispreserved,though connective tissue septa arising from the portal tract

medical virology. vol. XXVII (2) |
61 |
портального тракта, образуют перицеллюлярный
иперисинусоидальныйфиброз(1стадияфиброза). Эта гистопатология отмечается и при других заболеваниях(например,припервичномсклерозирующем холангите), и сама по себе недостаточна, чтобыдиагностироватьХГС.Припрогрессированиизаболевания фиброз распространяется до соседних портальных трактов и центральных вен, образуя портопортальные (2 стадия фиброза) и портоцентральные мосты (септы), а также мостовидные некрозы (3 стадия фиброза). Именно портовенулярный фиброз является самым важным повреждением, которое свидетельствует о формировании ЦП. Происходит нарушение лобулярной структуры печени с образованием более мелких ложных долек (4 стадии фиброза).
При фиброзе в печени всегда откладываются все известные структурные компоненты соединительной ткани, в том числе IV тип коллагена, эластин и ламинин. III тип коллагена при фиброзе создает матрикс для последующего отложения коллагенаIтипа.Тоесть,прифиброзенепроисходитколлагенизации ретикулиновых волокон, как считали ранее,иодинтипколлагенанепереходитвдругой.
Патогенез фиброза связан с накоплением вновь синтезированного коллагена. Коллагеногенез принято объяснять продукцией его фибробластами
иклетками Ито. Накапливающие жир клетки Ито имеют субмикроскопические признаки фибробластов и являются одним из наиболее активных продуцентов соединительнотканного матрикса. При фиброгенезе число этих клеток увеличивается. При всех видах фиброза основное количество коллагена синтезируют фибробласты, которые по субмикроскопическим признакам относят к миофибробластам. При постнекротическом фиброзе фибробласты могут быть «экзогенными», входящими в состав воспалительного инфильтрата. Но перипортальный фиброз считается «эндогенным» и его топография соответствует расположению соединительной ткани в печени. Однако фибробласты человека вырабатывают главным образом коллаген типа I и III, а цирротически измененная печень содержит также значительное количество коллагеновых пептидов, связанных с базальной мембраной. Такой полиморфизм коллагена можно объяснить выработкой его разными клетками, в том числе и гепатоцитами.
Впервые предположение об активном эктопическом коллагенообразовании в гепатоцитах было высказано болгарином Дамяновым Б.Д. в 1971 г. Суть гипотезы заключалась в том, что различные факторы, повреждающие печень, (в том числе вирусы) активизируют не только функцию фибробластов, но и внутригепатоцитарную индукцию ферментов, участвующих в синтезе коллагена. Под-
involved in portal fibrosis can form pericellular and perisinusoidalfibrosis(stageIoffirbosis).Thishistopathologyisalsoobservedinotherdiseases(e.g.primary sclerosing cholangitis) and is insufficient for CHC diagnosis. As the disease progresses, fibrosis involves the adjacent portal tracts and central veins forming por- to-portal (fibrosis stage 2) and porto-central bridges (septa) and bridging necroses (fibrosis stage 3). The porto-venular fibrosis is the most important sign of developing CL. The lobular structure of the liver is disordered with the formation of small false lobules (fibrosis stage 4).
Fibrosisoftheliverisalwaysassociatedwithdeposition of all structural elements of the connective tissue, includingcollagenIV,elastin,andlaminin. Collagentype III in fibrosis creates a matrix for deposition of collage type I. This means that reticulin fibers do not undergo collagenizationaswasthoughtbeforeandthatonetype ofcollageninnottransformedintoanother.
Pathogenesis of fibrosis is related to accumulation ofnewlysynthesizedcollagen.Collagenogenesisisusually explained by its production by fibroblasts and Ito cells. Fat-storing Ito cells have submicroscopic signs of fibroblasts and represent one of the most active producentoftheconnectivetissuematrix.Thenumberof these cells increases during fibrogenesis. In all types of fibrosis, the bulk of collagen is synthesized by fibroblasts that are referred to myofibroblasts by their submicroscopic structure. In postnecrotic fibrosis, fibroblasts can be exogenous, i.e. originate from the inflammatory infiltrate, but periportal fibrosis is considered endogenous and its topography corresponds to the localization of the connective tissue in the liver. However, human fibroblasts primarily produce collagen types I and III, while cirrhotic liver contains also considerable amounts of basement membrane-relat- ed collagen peptides. This collagen polymorphism can be explained by its production by various cells, including hepatocytes.
Active ectopic collagen formation in hepatocytes was first assumed in 1971 by Bulgarian researcher B. D. Damjanov, who hypothesized that different damaging factors (including viruses) activate not only fibroblasts,but also hepatocyteenzymesinvolvedintocollagen synthesis. These assumptions were confirmed by
62 |
Медицинскаявирусология.томXXVII(2) |
тверждение этому им были получены с помощью электронной микроскопии (Дамянов, 1971).
Позже в суспензии изолированных гепатоцитов и культуре непролиферирующих печеночных клетокбылаобнаруженаактивностьферментовсинтеза коллагена. Последнее не могло быть обусловлено примесью фибробластов или других клеток, вырабатывающих коллаген.
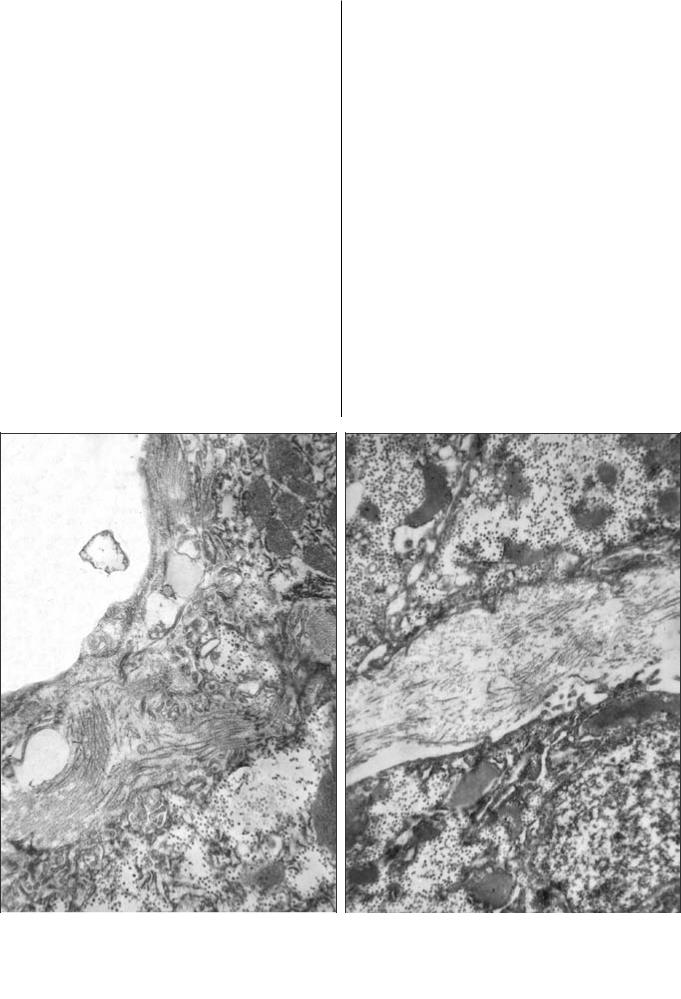
Эти эксперименты дали основание предположить, что и в условиях воспаления in vivo гепатоциты могут изменить свой фенотип и начать синтезироватьколлаген.Подобнымпутемможеттакжеосуществлятьсяколлагенизацияперисинусоидныхпространствидажеформированиефиброзныхсептпри циррозе,так как регенерирующиегепатоцитыначинают синтезировать больше коллагена. И именно начало этих процессов нам удалось наблюдать при ХГС у больных с коротким (1-2 года) точно зафиксированныманамнезомзаболевания(рис.4а).
Классификация фиброза основана на его ло-
кализации в структурах ткани печени. Различают следующие формы фиброза: очаговый, перигепатоцеллюлярный, зональный (центролобулярный, портальный, перипортальный), мультилобуляр-
electron microscopy (Damjanov, 1971).
Later, activity of collagen synthesis enzymes was shows in suspension of isolated hepatocytes and in culture of non-proliferating liver cells. The letter cannot be explained by admixture of fibroblasts or other collagen-producing cells.
These findings suggest the possibility of modulation of hepatocyte phenotype under condition of inflammation in vivo leading to collagen synthesis by these cells. The same mechanism can underlie collagenization of the perisinusoidal spaces and even formation of fibrous septa in cirrhosis, because regenerating hepatocytes produce greater amount of collagen. We observed the start of these processes in CHCpatientswith documentedshort history of the disease (Fig. 4a).
Fibrosis classification is based on its localization in liver tissue structures. The following forms of fibrosis are distinguished: focal, perihepatocellular,
КВ / CF
КВ / CF
|
А |
|
|
|
Б |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Рис. 4. Процессы фиброза у больной ХГС с коротким |
Fig. 4. Fibrosis is a female patient with a short history (2 |
||||||
(2 года) анамнезом болезни. а) Пучки коллагеновых |
years) of CHC. a) Bundles of collagen fibers (CF) in Disse space. |
|
|||||
волокон (КВ) в пространстве Диссе. х 10 000. б) |
x 10 000. b) Pericellular fibrosis: CF in the extracellular space. |
|
|||||
Перицеллюлярный фиброз: КВ в межклеточном |
x10 000. |
|
|||||
пространстве. х 10 000. |
|
|
|
|
|
||

medical virology. vol. XXVII (2) |
63 |
ный, мостовидный, а также перидуктулярный и перидуктальный и перивенулярный.
Очаговый фиброз характеризуется наличием мелкихрубцов;обычноонинтралобулярныйивозникает на месте гранулем разного происхождения. Такой фиброз может быть единственным изменением, которое указывает на ранее имевшиеся повреждения печени.
Перисинусоидальный и перигепатоцеллюляр-
ный фиброз. В норме немногочисленные коллагеновые волокна располагаются в пространствах Диссе и примыкают к синусоидальной поверхности гепатоцитов.ПриХГСуженараннихстадияхзаболевания начинается образование коллагена между гепатоцитаминетолькосостороныбилиарныхполюсов, но и синусоидального полюса, образуя как бы сетку вокруг гепатоцитов (парацеллюлярно). При световой микроскопии начальные стадии этого процесса практически не выявляются даже при специфических окрасках по Ван-Гизону. Вначале происходит увеличение количества волокон, относящихся к коллагену III типа или ретикулину. Выраженный перицеллюлярный фиброз (рис. 4б) ведет к формированию базальной мембраны, находящейся у синусоидальной поверхности гепатоцитов. При этом коллагенрасполагаетсямеждубазальноймембранойигепатоцитами. В выраженных стадиях фиброза вокруг гепатоцитов откладывается коллаген I типа. Формирование базальной мембраны и перицеллюлярный фиброз затрудняют обмен между гепатоцитамии и омывающей их кровью. В окруженных коллагеном гепатоцитахчастонаблюдаетсявнутриклеточныйхолестаз,асамиклеткимогутподвергатьсядистрофии.
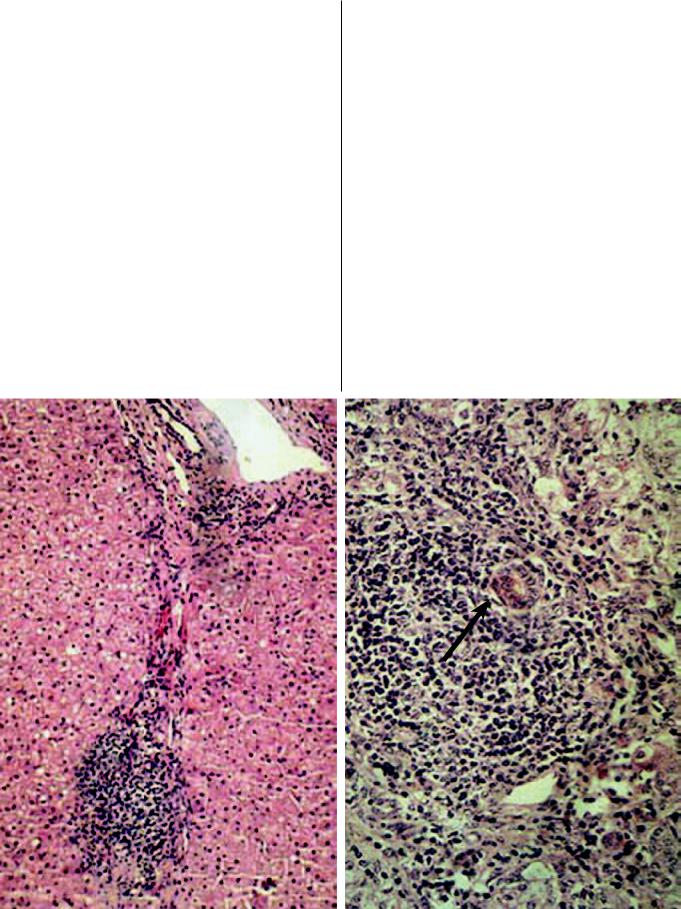
Если процесс захватывает все дольки печени или большинство из них, он обозначается как сетчатый или диффузный фиброз (рис. 5а). Подобная картина чаще всего характерна для большинства больных с безжелтушнойформойХГCминимальнойактивности.
Портальный и перипортальиый фиброз (рис. 5б) встречается наиболее часто; его можно видеть примногиххроническихзаболеванияхпечени,атакже при медикаментозных и токсических повреждениях. Наиболее часто расширение склерозированныхпортальныхтрактовявляетсярезультатомнекрозаприлежащихгепатоцитов.ПриОГСпортальныенекрозыпаренхимыведуткколлапсустромы.Вэтузону мигрируют фибробласты, проникают желчные протоки, портальные поля расширяются, приобретают звездчатую форму за счёт отхождения септ в паренхиму. Коллаген при этой форме фиброза относится к Iтипу.Портальныйфиброзслужитнередкопричиной пресинусоидальной гипертензии. Синусоидальную гипертензию связывают с отложением коллагена в пространствах Диссе. Имеется четкая коррелятивная связьмеждууровнемвнутрипеченочногодавленияи
zonal (centrolobular, portal, peroportal), multilobular, bridging, periductular, periductal and perivenular.
Focal fibrosis is presented by small cicatrices, it usually has intralobular localization and replaces granulomas of various genesis. This fibrosis sometimes is the only alteration indicating previous liver injury.
Perisinusoidal and perihepatocellular fibrosis.
Normally, scanty collagen fibers are located in Disse spaces near the sinusoidal hepatocyte surface. At the earlystagesofCHC,collagenformationbetweenhepatocytes not only at the biliary poles, but also near the sinusoidal ducts results in the formation of a kind of a net around hepatocytes (paracellular fibrosis). The initialstagesofthisprocesscannotberevealedbylight microscopy with van Gieson staining. The amount of collagentypeIIIfibersorreticulinfibersincreasesfirst. Pronounced pericellular fibrosis (Fig. 4b) leads to the formationofthebasementmembraneadjacenttothe sinusoidal surface of hepatocytes, collagen is located betweenthebasementmembraneandhepatocytesAt advancedstagesoffibrosis,collagentypeIdepositions appear around hepatocytes. The formation of the basement membrane and pericellular fibrosis impair the exchange between the blood and hepatocytes. Intracellular cholestasis in hepatocytes surrounded by collagen and their degeneration are often observed.
If the process involves all or majority of the liver lobules, it is designated as reticular or diffuse fibrosis (Fig. 5a). This pattern is typical of the majority of patients with anicteric CHC of minimum activity.
Portal and periportal fibrosis (Fig. 5b) is most prevalent; this form is observed in various chronic liver diseases and in drug-induced and toxic injuries. Dilatation of sclerosed portal tracts is usually a result of necrosis of adjacent hepatocytes. In AHC, portal necroses of the parenchyma lead to collapse of the stroma. Fibroblasts migrate to this zone and penetrate into the bile ducts, the portal fields become widerandacquirestellateshapeduetoseptathatradiate into the parenchyma. Collagen type I is formed in this type of fibrosis. Portal fibrosis often is a cause of perisinusoidal hypertension. Sinusoidal hypertension is related to collagen deposition in Disse spaces. There is a clear-cut correlation between intrahepatic

64 |
Медицинскаявирусология.томXXVII(2) |
А
Рис. 5. Процессы фиброза у больных ХГС. а) Сетчатый перицеллюлярный фиброз. Окраска по Ван-Гизону.
х 400. б) Портальный мостовидный фиброз с выраженной лимфоцитарной инфильтрацией. Окраска гематоксилином и эозином. х 200
накоплением коллагена в перисинусоидальном пространстве. Исходом развивающегося перигепатоцеллюлярногоицентральногофиброзаможетбытьЦП.
Мультилобулярный фиброз возникает как ис-
ход массивных некрозов печени, захватывающих территорию нескольких долек; остальная ткань органа сохраняет обычное строение. Пункционная биопсия выявляет фиброзную ткань, местами инфильтрированную лимфоидными клетками, дуктулярную пролиферацию. Сохранившиеся в этой зоне гепатоциты формируют тубулярные структуры, просвет которых может содержать желчные тромбы.О давности массивных некрозов, предшествующих этой форме фиброза, можно судить по формированию эластических волокон. Эластические волокнапоявляютсявцентральныхотделахдолекивдоль пластинок регенерирующих гепатоцитов только через3неделипослемассивныхнекрозовпечени,вызванныхострымвируснымгепатитом.
Мостовидный фиброз (рис. 5б,6а) характе-
ризуется образованием соединительнотканных
Б
Fig. 5. Fibrosis in CHC patients. b) Reticular pericellular fibrosis. van Gieson staining. x 400. b) Portal bridging fibrosis with pronounced lymphocyte infiltration. Hematoxylin and eosin staining, x 200
pressure and collagen accumulation in the perisinusoidal space. Progressive perihepatocellular and central fibrosis can eventuate in CL.
Multilobular fibrosis is a result of massive liver necroses involving several lobules, while the rest of the organ retains regular structure. Needle biopsy reveals fibrous tissue somewhere infiltrated with lymphoid cells and ductular proliferation. Preserved hepatocytes form tubular structures sometimes containing bile thrombi. Remoteness of massive necroses preceding this fibrosis type can be determined by the formation of elastic fibers. Elastic fibers appear in the central zone of the lobules and along the regenerating hepatocyte plates in 3 weeks or later after massive liver necroses induced by acute viral hepatitis.
Bridging necrosis (Fig. 5b, 6a) is characterized by the formation of the connective tissue septa between
medical virology. vol. XXVII (2) |
65 |
септ между сосудами печени. Кроме полных септ, встречаются и неполные септы, которые начинаются у портальных трактов или (реже) у центральных вен и слепо заканчиваются в дольке печени. Полные септы могут быть портопортальными, портоцентральными и центроцентральными. Портопортальные септы всегда «активные», они возникают при нарушениях оттока желчи, после острого гепатита. Портоцентральные развиваются после острого или хронического агрессивного гепатита. Причиной появления центроцентральных септ служит обычно нарушение венозного оттока. Соединительнотканные септы между портальными трактамии центральнымивенамисодержат анастомозы,черезкоторыепроисходитсброскрови, минующей паренхиму. Важнейшим следствием формирования полных септ является нарушение архитектоники долек вплоть до образования узелков.
Считается, что перидуктулярный, перидуктальный и перивенулярный фиброз не характе-
рен для вирусных гепатитов, в том числе и для ХГС.
hepatic vessels. Apart from full-length septa, partial septa were seen originating from the portal tracts or (rarely) from the central veins and blind ending in the liver lobule. There are porto-portal, porto-central, and centro-centralfull-lengthsepta.Porto-portalseptaare always«active»,i.e.theyariseunderconditionsofbile flow obstruction, after acute hepatitis. Porto-central septa develop after acute or chronic aggressive hepatitis as a result of venous blood outflow disturbances. The connective tissue septa between the portal tracts and central veins include anastomosis enabling blood bypassing the parenchyma. The most important result of full-length septa formation is violation of lobule architectonics up to nodule formation. Periductular, periductal, and perivenular types of fibrosis are though to be untypical for viral hepatitis, including CHC. However, inflammatory reaction around the intralobular bile ducts and in the portal tract with the
|
|
|
|
|
|
|
|
А |
|
|
|
Б |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Рис. 6. Процессы фиброза у больных ХГС. а) Мостовидный |
|
Fig. 6. Fibrosis in CHC patients. a) Bridging porto-portal |
||||
портопортальный фиброз. х 200. б) Поражение |
|
fibrosis. x 200. b) Destruction of ductal epithelium (arrow) in |
||||
протокового эпителия (стрелка) в портальном |
|
the portal tract. Hematoxylin and eosin staining, x 400 |
||||
тракте. Окраска гематоксилином и эозином. х 400 |
|
|
|
|
||

66 |
Медицинскаявирусология.томXXVII(2) |
Однако наличие воспалительной реакции вокруг желчных протоков в дольках и портальном тракте
споражением протокового эпителия (рис. 6б) позволяют усомниться в этом. За исключением последних, все остальные виды фиброза могут наблюдаться при всех вирусных гепатитах в различных сочетаниях.
Клиническое значение фиброза определяется, прежде всего, влиянием его на состояние внутрипеченочного кровообращения (в том числе микроциркуляции) и на функцию гепатоцитов. Следует заметить, что выраженность фиброза не всегда коррелирует с клинической картиной нарушения функций печени. Фиброз, даже не сочетающийся
сповреждениями паренхимы, может обусловить портальную гипертензию, и в то же время у ряда больныхдажеЦПможетпротекатьинаперцептнои явиться случайной находкой на вскрытии (12-14%).
Долгоевремясчиталось,чтопрогрессивноеразвитие фиброза при вирусных гепатитах – это путь в одну сторону, а именно в сторону цирроза и различныхегоосложнений.Однаков2000г.Wanlessи его коллеги (Wanless et al., 2000) при изучении последовательных биопсий печени установили, что успешное противовирусное лечение и устранение вирусной инфекции, приводит к уменьшению объёма рубцов, торможению развития цирроза и восстановлению в некоторой степени функциональной активности органа.
Несмотря на постоянную критику и противоречивый характер этого предложения, в последнее время в ряде клинических работ с парными биопсиями было показано, что после успешной «эрадикации» HСV на ранней стадии заболевания была показана возможность регрессии фиброза и, в некоторых случаях, регрессии цирроза. Отмечали даже процессы репаративной регенерации в виде «бутонов»гепатоцитов,которые,впрочем,неимеют никакого отношения к регрессии фиброза. Однакоиллюстративныйматериалупомянутыхстатей малоубедительный. Именно поэтому, несмотря на неопровержимое до настоящего времени положение о пожизненности инфекции парентеральных вирусов,следуетпринятьточкузренияонеобходимости быстрого (сразу после получения неоспоримого диагноза) назначения этиотропного адекватноголечениясцельюторможениявоспалительных и деструктивных процессов.
Для оценки активности и стадии патологическихпроцессовприХГСидругиххроническихзаболеваний печени разработаны полуколичественные системы (Knodell, 1981; Desmet, 1994; Ishak, 1995; Bedossa, 1996). Эти системы позволяют исключить субъективизм в оценке гистологической картины при изучении биопсийного материала. Они достаточно полно изложены в научных работах и прак-
involvement of the ductal epithelium (Fig. 6b) contradicts this accepted opinion. Except the three latter, other types of fibrosis can be found in various combinations in all viral hepatitides.
Clinical consequences of fibrosis are determined by itseffectontheintrahepaticcirculationandmicrocirculation and on hepatocyte functions. It should be noted that the severity of fibrosis not always correlates with clinical picture of liver dysfunction. In some cases, fibrosis,evenwithoutinjurytotheliverparenchyma,can causeportal hypertension,whilein some patients even CL can run an asymptomatic course and can be an in- cidentalfindingduringpostmortemautopsy(12-14%).
Progression of fibrosis in viral hepatitis is traditionally believed to be a way of no return, namely a way towards cirrhosis and its diverse complications. However, Wanless and co-workers in 2000 in their study on successive liver biopsy specimens have shown that effective antiviral therapy and eradication of the virus leadtoreductionofcicatrices,suppressionofcirrhosis development, and partial recovery of functional activity of the liver (Wanless et al., 2000).
Despite unceasing criticism and ambivalence of this assumption, the possibility of fibrosis regression, and in some cases, cirrhosis regression after successful eradication of HCV at the early stages of the disease has been demonstrated in some clinical studies on paired biopsy specimens. The processes of reparative regeneration (hepatocyte buds) were described though these phenomena have nothing to do with fibrosis regression. However, illustrative material of these publications is not convincing. That is why, despite still not disproved statement on life-long persistence of parenteral viruses, we have to admit that adequateetiotropictherapyshouldbestartedassoonas possible(immediatelyafterdefinitediagnosis)forsuppression of inflammatory and destructive processes.
Forevaluationofactivityandstageofthepathological processes in CHC and other chronic liver diseases, semiquantitative systems were developed (Knodell, 1981; Desmet, 1994; Ishak, 1995; Bedossa, 1996) that exclude subjectivism in the analysis of biopsy specimen histology. They are described at length in scientific articles and manuals and are widely used by pathologists, but do not exclude erroneous interpretations of the re-

medical virology. vol. XXVII (2) |
67 |
тических рекомендациях, широко используются врачами-патологами, но в то же время не исключаютвозможныхошибоквинтерпретации.Гораздо большее значение имеет опыт практической работы морфолога.
Считается, что характерным изменением паренхимы печени при ХГС является наличие в относительно сохраненных гепатоцитах жировой дистрофии в среднем у 40% пациентов. Клинически она проявляется гепатомегалией, а в ряде случаев — обратимой портальной гипертензией, гипербилирубинемией, гиперлипидемией.
В норме нейтральный жир составляет около 3-6% массы печени. Такое количество липидов при световой микроскопии не обнаруживается и выявляется только, когда содержание жира составляет 10-12% массы органа.
Высказывалось мнение о том, что HСV генотипа 3а стимулирует липогенез в цитоплазме гепатоцита.ОднакотакаяспособностьHCVсомнительна,поскольку частота стеатоза при этом генотипе не превышает таковой при других генотипах.
По мнению ряда авторов, нарушения жирового обмена возникают уже через 1-5 лет после инфицирования HCV (Hourigan, 1999). Вместе с тем, исследование биоптатов в ранние сроки после заражения свидетельствуют о том, что у многих больныхстеатозпечени(рис.7)присутствовалдовстречисHCVиегопричинойбылинарушениялипидного обмена, диабет или даже пищевые пристрастия.
Впрочем, использование термина «жировая дистрофия» для обозначения различного размера капель нейтральных триглицеридов, расположенных в цитоплазме гепатоцитов неправомерно, поскольку они не окружены мембраной и имеют инфильтративную природу. Для обозначения подобных процессов лучше использовать термин «липидная инфильтрация» или стеатоз.
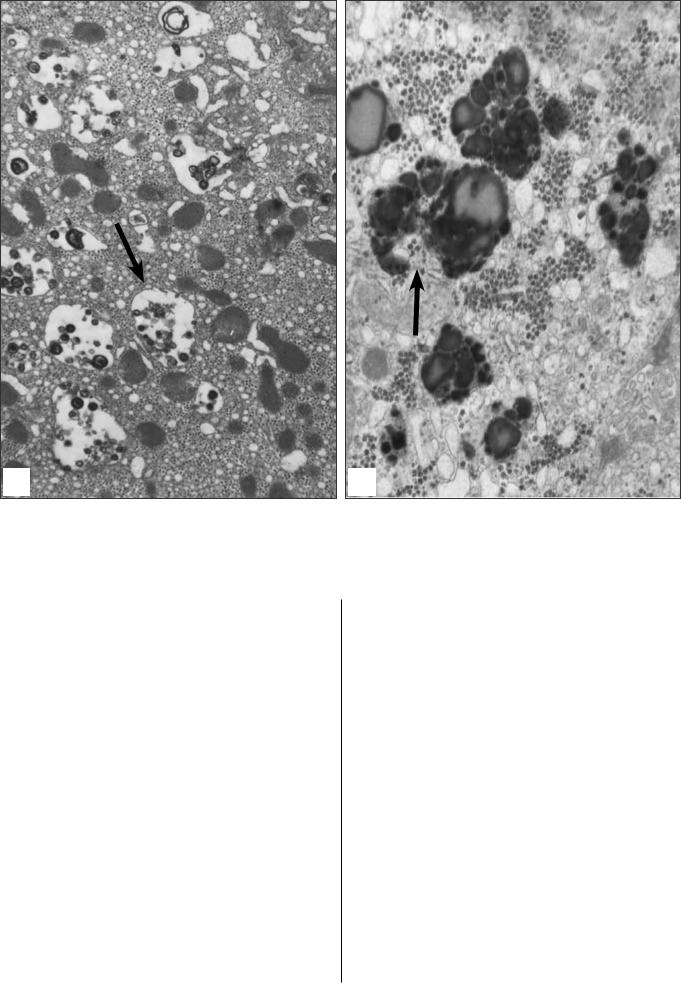
Жировой дистрофии (в истином значении этого слова) не бывает. Как правило, отмечаются последствия белково-жировой дисрофии, которая возникает при ускоренной деградации и усиленном распаделипопротеиновыхмембранразличныхвнутриклеточныхорганелл.Продуктыраспадаподвергаютсянеполномугидролизулизосомальнымиферментами, в результате чего образуются разнообразные пептиды и перекиси липидов. При гидрофобном взаимодействии они образуют миелиноподобные фигуры,априхимическом–липофусцин.
Обаэтиэлементаявляютсясоставнойчастьювторичных лизосом или цитосегресом (рис. 8а). Следует отметить, что лизосомальному гидролизу могут подвергатьсяиинфильтративныелипиды.Новэтом случае содержимое цитосегресом отличается отсутствиеммиелиноподобныхламеллиналичиемостатковнейтральногожираилипофусцина(рис.8б).
sults.Practicalexperienceismuchmoreimportant.
It is believed that fatty degeneration in relatively preserved hepatocytes observed in 40% patients is a typical abnormality of the liver parenchyma in CHC. Clinically it manifests as hepatomegaly and in some cases as reversible portal hypertension, hyperbilirubinemia, and hyperlipidemia.
Normally, neutral lipids constitute 3-6% of liver weight. This amount of lipids cannot be detected by light microscopy; they become visible when lipid content attains 10-12% of organ weight.
It was assumed that HCV genotype 3a stimulates lipogenesis in the hepatocyte cytoplasm, but this effect of HCV seems to be doubtful, because the incidence of steatosis in patients infected with this virus genotype does not exceed the corresponding parameter in diseases caused by other genotypes.
According to some reports, lipid metabolism disorders develop in 1-5 years after HCV infection (Hourigan, 1999). At the same time, analysis of biopsy specimenstakenatearlytermsafterinfectionsuggeststhat many patients had liver steatosis before HCV infection (Fig.7)anditwasprobablycausedbylipidmetabolism disorders, diabetes, or dietary habits.
However,theterm«fattydegeneration»isincorrectly used for designation of triglyceride drops of various size inhepatocytecytoplasm,becausetheyarenorsurrounded by the membrane and have infiltrative nature; the term«lipidinfiltration»ismorepreferableinthiscontext.
Lipid degeneration in the full sense of this word does not exist, but consequences of protein-lipid degeneration that develops under conditions of accelerated destruction and enhanced degradation of membranes of various intracellular organelles are often seen. Incomplete lysis of degradation products by lysosomal enzymes results in the formation of various peptidesandlipoperoxides;theirhydrophobicinteractionyieldsmyelinfigures,whiletheirchemicalinteraction yields lipofuscin.
Both elements are the components of secondary lysosomes or cytosegresomes (Fig. 8a). It should be noted that infiltrative lipids also undergo lysosomal hydrolysis, but in this case, the content of cytosegresomes is characterized by the absence of myelin figures and the presence of residual amounts of neutral

68 |
Медицинскаявирусология.томXXVII(2) |
Рис.7.Триглицеридная инфильтрация печени больного ХГС на начальном этапе формирования цирроза (пояснения в тексте). Окраска гематоксилином и эозином. х 200
Fig. 7. Triglyceride infiltration of the liver in a patient with CHC at the initial stage of cirrhosis (see text for explanation).
Hematoxylin and eosin staining, x 200
Морфологические изменения в печени при хронической HCV-инфекции могут быть подразделены на косвенные и прямые маркеры. Все изложенные выше признаки, несомненно, являются только косвенными или ориентировочными. Окончательное установлениедиагнозаХГCвозможнотолькопосле обнаружения специфических маркеров, о которых речь пойдет ниже.
Электронно-микроскопическое исследование биопсийного материала позволяет существенно углубить понимание механизмов формирования косвенныхпризнаковвирусногопораженияисутипатологическихзнаковнасубмикроскопическомуровне.
Единственными прямыми маркерами HCVинфекции, позволяющими установить этиологическую сущность заболевания, являются вирусные частицы и его антигены. Уже при светооптическом изучении биоптата печени с помощью иммуногистохимии можно точно установить наличие одного из антигенов HCV (рис. 9), и патолог в своём заключении, помимо описания наблюдаемых в биоптате признаков патологии, имеет право с учетом клинических данных поставить этиологически обоснованный диагноз.
При электронно-микроскопическом исследовании первое, на что мы обращаем внимание, – это на наличие или отсутствие вирусных частиц. При их выявлении изучаем характер их расположения
вгепатоцитах, наличие во внеклеточных пространствах(синусоидах,жёлчныхкапиллярах),поориентировочным размерам определяем наличие других (коинфицирующих) вирусов не только в гепатоцитах но и в лимфоидных элементах, находящихся
впросвете синусоидов (лимфоцитах, нейтрофилах, тромбоцитах).
lipids and lipofuscin (Fig. 8b).
Morphological changes in the liver in chronic HCV infection can be subdivided into indirect and direct markers. The above-described alterations are undoubtedly just indirect or tentative indicators. The ultimate diagnosis of CHC is possible only after detection of specific markers that will be discussed below.
Electron microscopy of biopsy specimens considerably extends our understanding of the mechanisms of the formation of indirect signs of virus-induced injury and the nature of pathological signs at the submicroscopic level.
Viral particles and antigens are the only direct markers of HCV infection indicating the etiological nature of the disease. The presence of the HCV antigen can be precisely determined by immunohistochemical assay followed by light microscopy and the pathologist can make the etiologically substantiated diagnosis based on pathological findings in the biopsy specimen and supplemented with clinical data.
During electron microscopy, the attention should bepaidfirstofallontheabsenceandpresenceofviral particles. In case of their detection, we evaluate their distribution in hepatocytes, their presence in extracellular space (sinusoids and bile capillaries), and pres- enceofotherviruses(co-infection)innotonlyhepato- cytes, but also lymphoid elements in sinusoid lumens
medical virology. vol. XXVII (2) |
69 |
А
Рис. 8. Множественные цитосегресомы (стрелки) в гепатоцитах больных ХГС: а – содержащие миелиноподобные ламеллы. х 8 000; б – содержащие
липофусцин и остатки гидолизуемых триглицеридов. х 20 000
После фотографирования вирусных частиц при стандартном увеличении в 30 000 раз проводится компьютерныйморфометрическийанализсцелью определения диаметра вириона, который непосредственно в ткани всегда на 3–5 нм больше, чем принегативномконтрастированиивыделенныхчастиц в культуре in vitro.
При ХГС в большинстве случаев вирионы расположены диффузно по всей цитоплазме большинствагепатоцитов(рис.10),создавая«эффектрассыпанного гороха». При этом вирусные частицы никогда не соприкасаются друг с другом и с внутриклеточными органеллами.
При большом увеличении вирионы HCV представляют собой округлые образования с фестончатыми краями с максимальными размерами 52-55 нм (рис. 11а). Принадлежность этих частиц доказана иммуноцитохимически при проведении реакции с антителами к белку HCV NS3 и визуализации места взаимодействия антител с антигеном с помощью конъюгата Protein A c коллоидным золотом (рис. 11б).
Б
Fig. 8. Numerous cytosegresomes (arrows) in hepatocytes of CHC patients: a – containing myelin-like lamellae. x 8 000; b – containing lipofuscin and residual hydrolyzed triglycerides. x20 000
(lymphocytes, neutrophils, platelets).
First, viral particles are photographed at standard magnification (x30 000) and then computer morphometric analysis is performed for evaluation of virion diameter (virion diameter in tissue is larger by 3-5 nm than the diameter of particles isolated from in vivo culture and stained using negative contrast technique).
In CHC, virions in most cases are diffusely spread in the cytoplasm of the majority of hepatocytes (Fig. 10)inascatteredpeamanneranddonotcontactwith each other and with intracellular organelles.
At high magnification, HCV virions look like round formation with scalloped borders and have maximum diameter of 52-55 nm (Fig. 11a). These particles were typed by immunocytochemical reaction with antibodies to HCV NS3 and visualization of the site of antigenantibody interaction using Protein A conjugated with
