
Часть 2
.PDFГлава 2. Дистрофии |
103 |
Всердце амилоид обнаруживают под эндокардом, в строме и сосудах миокарда (рис. 2-15, в), в эпикарде по ходу вен. Отложение амилоида в сердце ведет к его увеличению — амилоидная кардиомегалия. Оно становится очень плотным, миокард приобретает сальный вид.
Вскелетных мышцах, как и в миокарде, амилоид оседает по ходу межмышечной соединительной ткани, в стенках сосудов и в нервах. Периваскулярно
ипериневрально нередко образуются массивные отложения амилоидного вещества. Мышцы становятся плотными, полупрозрачными.
Влегких отложения амилоида появляются сначала в стенках разветвлений легочных артерии и вены (рис. 2-15, г), а также в перибронхиальной соединительной ткани. Позже амилоид появляется в межальвеолярных перегородках.
Вголовном мозге при старческом амилоидозе амилоид находят в сенильных бляшках коры, сосудах и оболочках.
Амилоидоз кожи характеризуется диффузным отложением амилоида в сосочках кожи и ее ретикулярном слое, в стенках сосудов и по периферии сальных и потовых желез, что сопровождается деструкцией эластических волокон и резкой атрофией эпидермиса.
Амилоидоз поджелудочной железы имеет некоторое своеобразие. Помимо артерий железы, в глубокой старости встречается и амилоидоз островков.
Амилоидоз щитовидной железы тоже своеобразен. Отложения амилоида в строме и сосудах железы могут быть проявлением не только генерализованного амилоидоза, но и медуллярного рака железы — медуллярный рак щитовидной железы с амилоидозом стромы. Амилоидоз стромы часто встречается в опухолях эндокринных органов и APUD-системы — медуллярный рак щитовидной железы, инсулома, карциноид, феохромоцитома, опухоли каротидных телец, хромофобная аденома гипофиза, гипернефроидный рак. В образовании APUD-амилоида доказано участие эпителиальных опухолевых клеток.
Исход неблагоприятный.
Функциональное значение определяется степенью развития амилоидоза. Выраженный амилоидоз ведет к атрофии паренхимы и склерозу органов, к их функциональной недостаточности — хронической почечной, печеночной, сердечной, легочной, надпочечниковой, кишечной недостаточности (синдрому нарушенного всасывания).
Стромально-сосудистая жировая дистрофия
Стромально-сосудистая жировая дистрофия — липидоз, возникает при нарушении обмена нейтральных жиров или холестерина и его эфиров.
Нарушения обмена нейтральных жиров
Нарушения обмена нейтральных жиров проявляются общим или местным увеличением их запасов в жировой ткани.
Нейтральный жир — лабильный жир, обеспечивающий энергетические запасы организма. Он сосредоточен в жировых депо — подкожной клетчат-
104 |
Общая патологическая анатомия |
ке, брыжейке, сальнике, эпикарде, костном мозге. Жировая ткань выполняет не только обменную, но и опорную, механическую функции, поэтому она способна замещать атрофированные ткани.
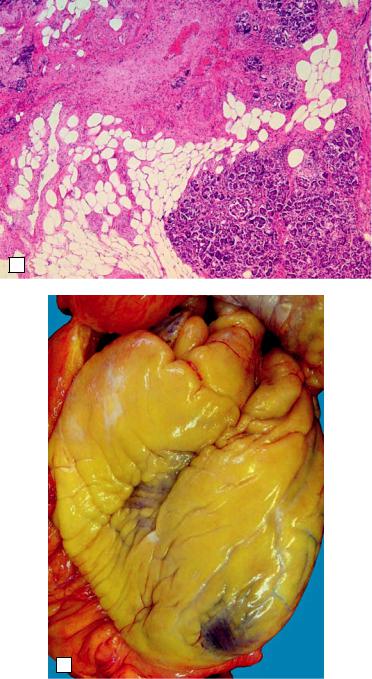
Ожирение, или тучность, — увеличение объема нейтрального жира в жировых депо, имеющее общий характер. Оно выражается в обильном отложении жира в подкожной клетчатке, сальнике, брыжейке, средостении, эпикарде. Жировая ткань появляется там, где она обычно отсутствует или имеется лишь в небольшом количестве, например в строме миокарда, поджелудочной железе (рис. 2-16, а). Большое клиническое значение имеет ожирение сердца при тучности. Жировая ткань, разрастаясь под эпикардом, окутывает сердце, как футляром (рис. 2-16, б). Она внедряется в строму миокарда, особенно в субэпикардиальных отделах, что ведет к атрофии мышечных клеток. Ожирение обычно больше выражено в правой половине сердца. Иногда вся толща миокарда правого желудочка замещена жировой тканью, в связи с чем может произойти разрыв сердца.
Классификация ожирения учитывает причину, внешние проявления (типы ожирения), степень превышения идеальной массы тела, морфологические изменения жировой ткани (варианты ожирения).
По этиологическому принципу выделяют первичное и вторичное ожирение. Причина первичного ожирения неизвестна, поэтому его называют идиопатическим.
Виды вторичного ожирения:
–алиментарное ожирение, причины которого — несбалансированное питание и гиподинамия;
–церебральное ожирение развивается при травме, опухолях мозга, ряде нейротропных инфекций;
–эндокринное ожирение — синдромы Фрелиха и Иценко–Кушинга, адипозогенитальная дистрофия, гипогонадизм, гипотиреоз;
–наследственное ожирение — синдром Лоренса–Муна–Бидля и болезнь Гирке.
По внешним проявлениям различают симметричный (универсальный), верхний, средний и нижний типы ожирения. При симметричном типе жир относительно равномерно откладывается в разных частях тела. Верхний тип — накопление жира преимущественно в области подкожной клетчатки лица, затылка, шеи, верхнего плечевого пояса, молочных желез. При среднем типе жир откладывается в подкожной клетчатке живота в виде фартука, при нижнем типе — в области бедер и голеней.
По превышению массы тела больного выделяют несколько степеней ожирения. При I степени ожирения избыточная масса тела составляет 20–29%, при II — 30–49%, при III — 50–99% и при IV — до 100% и более.
Характеристика морфологических изменений жировой ткани при ожирении учитывает количество адипозоцитов и их размер. На этом основании выделяют гипертрофический и гиперпластический варианты общего ожирения. При гипертрофическом варианте жировые клетки увеличены и содержат в несколько раз больше триглицеридов, чем обычно, при этом количество адипозоцитов не меняется. Адипозоциты мало чувствительны
Глава 2. Дистрофии |
105 |
а
б
Рис. 2-16. Ожирение: а — разрастание жировой ткани в строме поджелудочной железы (сахарный диабет); б — ожирение сердца, под эпикардом — толстый слой жира
106 |
Общая патологическая анатомия |
к инсулину, но высокочувствительны к липолитическим гормонам. Течение болезни злокачественное. При гиперпластическом варианте количество адипозоцитов увеличено, число жировых клеток достигает максимума в пубертатном периоде и в дальнейшем не меняется. Однако функция адипозоцитов не нарушена, их метаболические изменения отсутствуют, течение болезни доброкачественное.
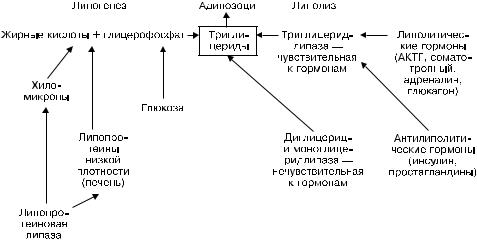
Причины и механизмы развития. Наиболее значительные причины общего ожирения — несбалансированное питание и гиподинамия, нарушение нервной и эндокринной регуляции жирового обмена, наследственные семейно-конституциональные факторы. Непосредственный механизм ожирения — нарушение равновесия липогенеза и липолиза в жировой клетке в сторону липогенеза (рис. 2-17). Как видно, усиление липогенеза, как и ослабление липолиза, связано не только с активацией липопротеиновой липазы и угнетением липолитических липаз, но и нарушением гормональной регуляции со стороны антилиполитических гормонов, состоянием жирового обмена в кишечнике и печени.
Значение. Будучи проявлением ряда заболеваний, общее ожирение определяет развитие тяжелых осложнений. Например, избыточная масса тела — один из факторов риска ишемической болезни сердца.
Исход общего ожирения редко бывает благоприятным.
Антипод общего ожирения — истощение, его основа — уменьшение объема органов и тканей. Яркое проявление истощения — кахексия (от греч. kakos — плохой, hexis — состояние), развивающаяся при голодании (алиментарная кахексия) или при злокачественных опухолях.
Увеличение объема жировой клетчатки, имеющее местный характер, — липоматоз. Наибольший интерес представляет болезнь Деркума, при кото-
Рис. 2-17. Схема липогенеза и липолиза жировой клетки
Глава 2. Дистрофии |
107 |
рой в подкожной клетчатке конечностей и туловища появляются узловатые, болезненные отложения жира, похожие на липомы. В основе заболевания лежит полигландулярная эндокринопатия. Местное увеличение объема жировой ткани — нередко проявление вакатного ожирения (жирового замещения) при атрофии ткани или органа (например, жировое замещение почки или вилочковой железы при их атрофии).
Антипод липоматоза — регионарная липодистрофия, сущность которой — очаговая деструкция жировой ткани и распад жиров нередко с воспалительной реакцией и образованием липогранулем (например, липогранулематоз при рецидивирующем ненагнаивающемся панникулите — болезни Вебера–Крисчена).
Нарушения обмена холестерина и его эфиров
Нарушения обмена холестерина и его эфиров лежат в основе тяжелого заболевания — атеросклероза. В интиме артерий крупного и среднего калибра накапливаются не только холестерин и его эфиры, но и липопротеиды низкой плотности и белки в плазме крови, чему способствует повышение сосудистой проницаемости. Накапливаемые высокомолекулярные вещества ведут к деструкции интимы, распадаются и омыляются. В результате этого в интиме образуется жиробелковый детрит (athere — «кашицеобразная масса»), разрастается соединительная ткань (sclerosis — «уплотнение») и формируется фиброзная бляшка, суживающая просвет сосуда.
Наследственная дистрофия, развивающаяся в связи с нарушением обмена холестерина, — семейный гиперхолестеринемический ксантоматоз. Его относят к болезням накопления, хотя характер ферментопатии не установлен. Холестерин откладывается в коже, стенках крупных сосудов (атеросклероз), клапанах сердца и других органах.
Стромально-сосудистая углеводная дистрофия
Стромально-сосудистая углеводная дистрофия связана с нарушением баланса гликопротеидов и гликозаминогликанов. Стромально-сосудистая дистрофия, связанная с нарушением обмена гликопротеидов, — ослизнение тканей. Сущность его в том, что хромотропные вещества высвобождаются из связей с белками и накапливаются главным образом в межуточном веществе. В отличие от мукоидного набухания при этом происходит замещение коллагеновых волокон слизеподобной массой. Собственно соединительная ткань, строма органов, жировая ткань, хрящ становятся набухшими, полупрозрачными, слизеподобными, а их клетки — звездчатыми или причудливо отростчатыми.
Причина. Ослизнение тканей происходит часто вследствие дисфункции эндокринных желез, истощения (например, слизистого отека, или микседемы, при недостаточности щитовидной железы; ослизнения соединительнотканных образований при кахексии любого генеза).
108 |
Общая патологическая анатомия |
Исход. Процесс может быть обратимым, однако прогрессирование его приводит к колликвации и некрозу ткани с образованием полостей, заполненных слизью.
Функциональное значение определяется тяжестью процесса, его продолжительностью и характером ткани, подвергшейся дистрофии.
Наследственные нарушения обмена гликозаминогликанов (мукополисахаридов) представлены большой группой болезней накопления — мукополисахаридозов. Основное клиническое значение имеет гаргоилизм, или болезнь Пфаундлера–Гурлера, для которой характерны непропорциональный рост, деформация черепа (массивный череп), других костей скелета, пороки сердца, паховая и пупочная грыжи, помутнение роговицы, гепато- и спленомегалия. Основа мукополисахаридозов — недостаточность специфического фактора, определяющего обмен гликозаминогликанов.
СМЕШАННЫЕ ДИСТРОФИИ
О смешанных дистрофиях говорят в тех случаях, когда морфологические проявления нарушенного метаболизма выявляют как в паренхиме, так и в строме, стенке сосудов органов и тканей. Они возникают при нарушениях обмена сложных белков — хромопротеидов, нуклеопротеидов и липопротеидов, а также минералов.
Нарушения обмена хромопротеидов (эндогенные пигментации)
Хромопротеиды — окрашенные белки, или эндогенные пигменты, — играют важную роль в жизни организма. Они участвуют в дыхании (гемоглобин, цитохромы), выработке секретов (желчь) и инкретов (серотонин), защите организма от действия лучевой энергии (меланин), пополнении запасов железа (ферритин), витаминов (липохромы). Обмен пигментов регулируется вегетативной нервной системой, эндокринными железами, он тесно связан с функцией органов кроветворения и системы моноцитарных фагоцитов.
Классификация. Эндогенные пигменты делят на 3 группы: гемоглобиногенные — различные производные гемоглобина; протеиногенные, или тирозиногенные, — связаны с обменом тирозина; и липидогенные, или липопигменты, — образуются при обмене жиров.
Нарушения обмена гемоглобиногенных пигментов
В норме гемоглобин проходит ряд циклических превращений, обеспечивающих его ресинтез и образование необходимых для организма продуктов. Эти превращения связаны со старением и разрушением эритроцитов (гемолиз, эритрофагия), постоянным обновлением эритроцитной массы. В результате физиологического распада эритроцитов и гемоглобина образуются пигменты ферритин, гемосидерин и билирубин. В патологических
Глава 2. Дистрофии |
109 |
условиях вследствие многих причин гемолиз резко усилен и происходит как
вциркулирующей крови (интраваскулярно), так и в очагах кровоизлияний (экстраваскулярно). В этих условиях, помимо увеличения образующихся
внорме гемоглобиногенных пигментов, появляется ряд новых пигментов — гематоидин, гематины и порфирин.
Всвязи с накоплением гемоглобиногенных пигментов в тканях возникают разные виды эндогенной пигментации, которые становятся проявлением ряда заболеваний и патологических состояний.
Ферритин — железопротеид, содержащий до 23% железа. Железо ферритина связано с белком — апоферритин. В норме ферритин обладает дисульфидной группой — неактивная (окисленная) форма ферритина — SS-ферритин. При недостаточности кислорода происходит восстановление ферритина в активную форму — SH-ферритин, который обладает вазопаралитическим и гипотензивным свойствами. В зависимости от происхождения различают анаболический и катаболический ферритин. Анаболический ферритин образуется из железа, всасывающегося в кишечнике, катаболический — из железа гемолизированных эритроцитов. Ферритин (апоферритин) обладает антигенными свойствами. Ферритин образует берлинскую лазурь (железосинеродистое железо) под действием железосинеродистого калия и соляной, или хлористоводородной, кислоты (реакция Перлса) и может быть идентифицирован специфической антисывороткой при иммунофлюоресцентном исследовании. Большое количество ферритина содержится в печени (депо ферритина), селезенке, костном мозге и лимфатических узлах, где его обмен связан с синтезом гемосидерина, гемоглобина и цитохромов.
Вусловиях патологии количество ферритина может увеличиваться как
втканях, так и в крови. Повышение содержания ферритина в тканях наблюдают при гемосидерозе, так как полимеризация ферритина ведет к образованию гемосидерина. Ферритинемией объясняют необратимость шока, сопровождаемого сосудистым коллапсом, так как SH-ферритин играет роль антагониста адреналина.
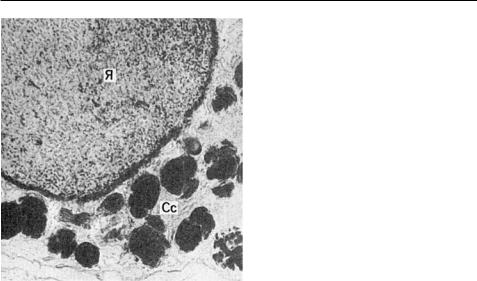
Гемосидерин — полимер ферритина, образуется при расщеплении гема, представляет коллоидную гидроокись железа, связанную с белками, гликозаминогликанами и липидами клетки. Клетки, в которых образуется гемосидерин, называются сидеробластами, которые могут быть как мезенхимальной, так и эпителиальной природы. В их сидеросомах происходит синтез гранул гемосидерина (рис. 2-18), который постоянно обнаруживают в ретикулярных и эндотелиальных клетках селезенки, печени, костного мозга, лимфатических узлах. В межклеточном веществе он подвергается фагоцитозу сидерофагами.
Присутствие в гемосидерине железа позволяет выявлять его характерными реакциями: образованием берлинской лазури (реакция Перлса), турнбулевой сини (обработка срезов сульфидом аммония, а затем железосинеродистым калием и хлористоводородной кислотой). Положительные реакции на железо отличают гемосидерин от схожих пигментов — гемомеланина, липофусцина, меланина.
Общая патологическая анатомия
В условиях патологии наблюдают избыточное образование гемосидерина — гемосидероз, который имеет как общий, так и местный характер.
Общий, или распространенный, гемосидероз наблюдают при внутрисосудистом разрушении эритроцитов — интраваскулярный гемолиз. Он встречается при болезнях системы кроветворения (анемии, гемобластозах), отравлениях гемолитическими ядами, некоторых инфекционных заболеваниях (возвратном тифе, бруцеллезе, малярии), переливаниях иногруппной крови, резусконфликте. Разрушенные эритроциты, их обломки, гемоглобин идут на построение гемосидерина. Сидеробластами становятся ретикулярные, эндотелиальные и гистиоцитарные элементы селе-
зенки, печени, костного мозга, лимфатических узлов, эпителиальные клетки печени, почек, легких, потовых и слюнных желез. Появляется большое количество сидерофагов, которые не успевают поглощать гемосидерин, загружающий межклеточное вещество. В результате этого коллагеновые и эластические волокна пропитываются железом. При этом селезенка, печень, костный мозг и лимфатические узлы становятся ржаво-коричневыми.
К общему гемосидерозу близко своеобразное заболевание — гемохроматоз, который может быть первичным (наследственный гемохроматоз) или вторичным.
Первичный гемохроматоз — самостоятельное заболевание из группы болезней накопления, передается доминантно-аутосомным путем и связано с наследственным дефектом ферментов тонкой кишки. Это ведет к повышенному всасыванию пищевого железа, которое в виде гемосидерина откладывается в органах в большом количестве. Обмен железа эритроцитов при этом не нарушен. Содержание железа в организме увеличивается в десятки раз, достигая 50–60 г. Развивается гемосидероз печени, поджелудочной железы, эндокринных органов, сердца, слюнных и потовых желез, слизистой оболочки кишечника, сетчатки глаза и даже синовиальных оболочек. Одновременно в органах увеличивается содержание ферритина, в коже и сетчатке глаз — содержание меланина, что связано с поражением эндокринной системы и нарушением регуляции меланинобразования. Основные симптомы болезни — бронзовая окраска кожи, сахарный диабет (бронзо-
Глава 2. Дистрофии |
111 |
вый диабет) и пигментный цирроз печени. Возможно развитие и пигментной кардиомиопатии с нарастающей сердечной недостаточностью.
Вторичный гемохроматоз — заболевание, развивающееся при приобретенной недостаточности ферментных систем, обеспечивающих обмен пищевого железа, что ведет к распространенному гемосидерозу. Причина этой недостаточности — избыточное поступление железа с пищей (железосодержащими препаратами), резекция желудка или тонкой кишки, хронический алкоголизм, повторные переливания крови, гемоглобинопатии (наследственные заболевания, в основе которых лежит нарушение синтеза гема или глобина). При вторичном гемохроматозе содержание железа повышено не только в тканях, но и в сыворотке крови. Накопление гемосидерина и ферритина, наиболее выраженное в печени, поджелудочной железе и сердце, приводит к циррозу печени, сахарному диабету и кардиомиопатии.
Местный гемосидероз — состояние, развивающееся при внесосудистом разрушении эритроцитов (экстраваскулярном гемолизе) в очагах кровоизлияний. Оказавшиеся вне сосудов эритроциты теряют гемоглобин и превращаются в бледные круглые тельца («тени» эритроцитов), свободный гемоглобин и обломки эритроцитов идут на построение пигмента. Сидеробластами
исидерофагами становятся лейкоциты, гистиоциты, ретикулярные клетки, эндотелий, эпителий. Сидерофаги могут долго сохраняться на месте бывшего кровоизлияния, нередко они переносятся током лимфы в близлежащие лимфатические узлы, где задерживаются, и узлы становятся ржавыми. Часть сидерофагов разрушается, пигмент высвобождается и в дальнейшем снова подвергается фагоцитозу.
Гемосидерин образуется при всех кровоизлияниях, как мелких, так
икрупных. В небольших кровоизлияниях, которые чаще имеют характер диапедезных, обнаруживают только гемосидерин. По периферии крупных кровоизлияний в живой ткани образуется гемосидерин, а в центре кровоизлияния, где аутолиз происходит без доступа кислорода и участия клеток, появляются кристаллы гематоидина.
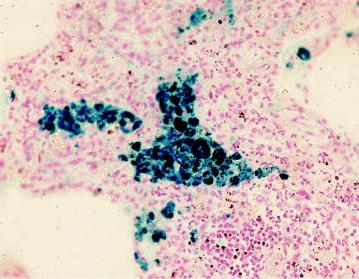
Взависимости от условий развития местный гемосидероз может возникать в пределах не только участка ткани (гематома), но и целого органа. Таков гемосидероз легких, наблюдаемый при ревматическом митральном пороке сердца, кардиосклерозе (рис. 2-19). Хронический венозный застой в легких ведет к множественным диапедезным кровоизлияниям, в связи с чем в межальвеолярных перегородках, альвеолах, лимфатических сосудах и узлах легких появляется большое количество нагруженных гемосидерином клеток.
Билирубин — желчный пигмент, образование которого начинается в гистиоцитарно-макрофагальной системе при разрушении гемоглобина и отщеплении от него гема. Гем теряет железо и превращается в биливердин, при восстановлении которого образуется билирубин в комплексе с белком. Гепатоциты захватывают пигмент, соединяют его с глюкуроновой кислотой и выделяют в желчные капилляры. С желчью билирубин поступает в кишечник, где часть его всасывается и вновь попадает в печень, другая часть выводится с калом в виде стеркобилина и с мочой в виде уроби-
112 |
Общая патологическая анатомия |
Рис. 2-19. Гемосидероз легких. Цитоплазма гистиоцитов и альвеолярного эпителия (сидеробластов и сидерофагов) нагружена зернами пигмента. Реакция Перлса
лина. В норме билирубин встречается в растворенном состоянии в желчи и в небольшом количестве в плазме крови.
Билирубин (красно-желтые кристаллы) не содержит железа. Для его выявления употребляют реакции, основанные на способности пигмента легко окисляться с образованием окрашенных продуктов. Например, реакция Гмелина, при которой под действием концентрированной азотной кислоты билирубин дает сначала зеленое, а затем синее или пурпурное окрашивание.
Нарушение обмена билирубина связано с расстройством его образования
ивыделения. Это ведет к повышенному содержанию билирубина в плазме крови и желтому окрашиванию им кожи, склер, слизистых и серозных оболочек и внутренних органов — развивается желтуха.
Механизм развития желтухи различен, что позволяет выделять три ее вида: надпеченочную (гемолитическую), печеночную (паренхиматозную)
иподпеченочную (механическую).
Надпеченочная (гемолитическая) желтуха — повышенное образование билирубина в связи с увеличенным распадом эритроцитов. Печень в этих условиях образует большее, чем в норме, количество пигмента, однако вследствие недостаточности захвата билирубина гепатоцитами уровень его в крови остается повышенным. Гемолитическую желтуху наблюдают при инфекциях (сепсисе, малярии, возвратном тифе) и интоксикациях (гемолитическими ядами), при изоиммунных (гемолитической болезни новорожденных, переливании несовместимой крови) и аутоиммун-
