
- •Термодинамика
- •Часть II
- •Оглавление
- •Уравнение Клапейрона – Клаузиуса
- •Плавление
- •Испарение (сублимация)
- •Термодинамическое равновесие. Правило фаз Гиббса
- •Определение числа независимых компонентов (кн)
- •Определение степени свободы (с)
- •Классификация систем с точки зрения правила фаз Гиббса
- •Диаграмма состояния воды в области средних давлений
- •Двухкомпонентные системы
- •Системы с полной нерастворимостью компонентов в твердом состоянии
- •Неизоморфные двухкомпонентные системы с простой эвтектикой
- •Треугольник Таммана
- •Неизоморфные двухкомпонентные системы, образующие устойчивое химическое соединение
- •Неизоморфныне двухкомпонентные системы, образующие два новых химических соединения
- •Неизоморфные двухкомпонентные системы, образующие неустойчивое химическое соединение
- •Изоморфные системы (системы с твердыми растворами)
- •Трехкомпонентные системы
- •Метод Гиббса
- •Метод Розебума
- •Термический анализ
- •План коллоквиума
- •Уравнение Шредера
- •Экспериментальная часть
- •Библиографический список
- •Колбасина Валентина Даниловна термодинамика
- •Часть II

Министерство образования и науки Российской Федерации
Государственное образовательное учреждение
высшего профессионального образования
«Пермский государственный технический университет»
Березниковский филиал
Кафедра химической технологии и экологии
Термодинамика
Часть II
ФАЗОВЫЕ РАВНОВЕСИЯ.
ТЕРМИЧЕСКИЙ АНАЛИЗ
Учебно-методическое пособие
Березники 2011
УДК 547:378
ББК 24.2
К 60
Рецензент:
кандидат технических наук, доцент кафедры ХТиЭ Дыблин Б.С.
(Березниковский филиал Пермского государственного технического университета)
Колбасина, В.Д.
К60 Термодинамика. Часть II. Фазовые равновесия. Термический анализ: учебно-метод. пособие / В.Д. Колбасина. – Березниковский филиал Пермского государственного технического университета. – Березники, 2011. – 53 с.
ISBN
Пособие полностью соответствует программам по физической химии для студентов инженерного факультета и предназначено для приобретения навыков самостоятельной работы при решении задач, а также для подготовки к лабораторному практикуму.
Пособие дает представление о фазовых составляющих термодинамических систем и сущности термического анализа, поясняет термины, используемые при их определении и основные принципы метода термического анализа термодинамических систем. В нем приводятся примеры решений примеров термодинамического равновесия и термического анализа, а также с построением диаграмм плавкости. Даются примеры оформления и выполнения расчетных работ.
Предназначено для студентов, изучающих курс «Физическая химия».
УДК 547:378
ББК 24.2
ISBN © ГОУ ВПО
«Пермский государственный
технический университет», 2011
Оглавление
1. Уравнение Клапейрона – Клаузиуса 4
2. Термодинамическое равновесие. Правило фаз Гиббса 12
3. Двухкомпонентные системы 18
4. Трехкомпонентные системы 44
5. Термический анализ 48
Библиографический список 53
Уравнение Клапейрона – Клаузиуса
Процессы, заключающиеся в превращении одной фазы вещества в другую того же вещества, протекающие без химических реакций, называются фазовыми превращениями (плавление, возгонка, испарение, полиморфные превращения).
Когда система, состоящая из нескольких фаз, достигает равновесия, то переход молекул из одной фазы в другую не прекращается. Например, в равновесной системе вода – пар молекулы все время переходят из жидкости в пар и обратно. Для равновесия характерно равенство скоростей испарения и конденсации. Равновесие, таким образом, поддерживается двумя противоположными процессами, идущими с одинаковыми скоростями.
Фазовые равновесия, разумеется, могут устанавливаться и в других системах, например, в системах жидкость – твердое тело, или твердое тело –газ и др.
Состояние равновесия
при постоянном Р
и Т
термодинамически характеризуется
равенством энергий Гиббса одной и другой
фазы:
![]() ,
т.е. изобарно-изотермические потенциалы
чистого вещества в двух фазах находящихся
в равновесии, при равенстве молекулярных
весов равны между собой.
,
т.е. изобарно-изотермические потенциалы
чистого вещества в двух фазах находящихся
в равновесии, при равенстве молекулярных
весов равны между собой.
При изменении энергии Гиббса одной фазы для сохранения равновесия в системе меняется энергия Гиббса другой фазы на ту же величину, т.е.
![]() или
или
![]() .
.
Изменение изобарно-изотермического потенциала G может происходить только за счет изменения Р и Т, т.к. G = ƒ (P, T).
Эта зависимость выражается в общем виде уравнением
![]()
Следовательно, для двух смежных фаз, находящихся в равновесии запишем
![]()
![]()
так как
![]() (условие равновесия), то
(условие равновесия), то
![]()
разделим переменные
![]()
![]()
Отсюда

где SI и SII – энтропия 1-го моля вещества в первой и во второй фазах;
VI и VII – объем 1-го моля вещества в первой и во второй фазах;
![]() –температурный
коэффициент изменения давления
насыщенного
–температурный
коэффициент изменения давления
насыщенного
пара;
![]() –энтропия фазового
перехода,
–энтропия фазового
перехода,
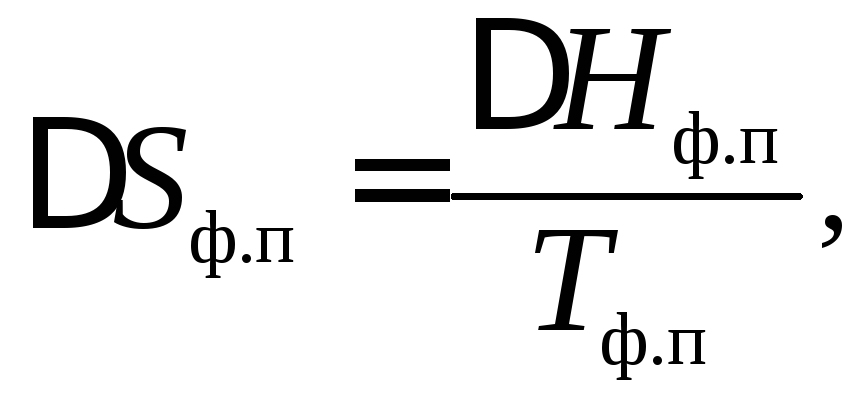
где Нф.п. – энтальпия фазового перехода;
Тф.п. – температура фазового перехода.
Тогда уравнение примет вид
 . (1)
. (1)
Эта зависимость была найдена Клапейроном еще до открытия первого закона термодинамики, а затем выведена Клаузиусом. Уравнение (1) называют уравнением Клапейрона – Клаузиуса в дифференциальной форме. Оно является общим термодинамическим уравнением, применимым ко всем фазовым переходам чистых веществ (однокомпонентных систем), т.е. к процессам плавления (равновесие твердое тело – жидкость), испарения (равновесие жидкость – пар), сублимации (равновесие твердое тело – пар), полиморфного превращения (равновесие их форм), а также и обратным им процессам.
Уравнение Клапейрона – Клаузиуса можно применить к любому количеству вещества, отнеся экстенсивные величины (Н и V) к одинаковому его количеству. Обычно эти величины относят или к молю или к грамму.
Для того чтобы воспользоваться им для нахождения одной из зависимостей, надо знать три остальные. Например, чтобы найти зависимость давления насыщенного пара от температуры, надо знать зависимость теплоты фазового перехода (Нф.п) от температуры и зависимость мольных объемов равновесных фаз (VI – VII) от температуры.
Рассмотрим применимость уравнения Клапейрона – Клаузиуса к фазовым переходам (плавление, испарение, сублимация), представляющим наиболее общий интерес.
