
ХИМИЯ 10
.pdf

|
222 |
Неметаллы |
Важным калийным удобрением является зола древесины, соломы, стеблей растений. Особенно много калия содержится в золе ботвы картофеля, томатов, стеблей подсолнечника. Калий находится в золе в виде карбоната калия (поташа) K2CO3. Это вещество хорошо растворимо в воде и легко усваивается растениями. Также в золе содержатся фосфор, кальций, железо, медь, бор и другие элементы, необходимые для развития растений. Например, потребность большинства растений в боре полностью удовлетворяется при внесении древесной золы массой 70 г на 1 м2 поверхности почвы.
Питательная ценность минеральных удобрений определяется содержанием в них питательных элементов. Питательную ценность азотных удобрений условно принято выражать через массовую долю в них химического элемента азота, фосфорных — через массовую долю оксида фосфора(V), калийных — через массовую долю оксида калия. Удобрения с высоким содержанием питательного элемента называются концентрированными.
Применение всех видов удобрений позволяет значительно увеличить урожайность сельскохозяйственных культур, поэтому производство минеральных удобрений — важнейшая задача химической промышленности. Особенно актуально увеличивать выпуск концентрированных и комплексных удобрений.
Удобрения — это вещества, которые содержат химические элементы, необходимые для питания и роста растений. Их вносят в почву для повышения урожайности.
Минеральные удобрения подразделяются на азотные, фосфорные и калийные. Различают простые и комплексные удобрения.
Вопросы и задания
1.Какие химические элементы необходимы для развития растений?
2.Запишите формулы важнейших азотных удобрений. Определите степени окисления атомов азота в каждом из приведённых вами соединений.
3.Рассчитайте массовую долю азота в чилийской селитре.
4.При действии азотной кислоты на известняк массой 160 кг получили нитрат кальция. Определите массу полученной соли, если доля примесей в известняке составляет 10 %.
5.Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
а) P → P2O5 → H3PO4 → Ca(H2PO4)2 → CaHPO4 → Ca3(PO4)2; б) N2 → NH3 → NO → NO2 → HNO3 → NH4NO3.
В окислительно-восстановительных реакциях укажите окислитель и восстановитель.
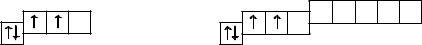
Углерод и кремний |
223 |
|
6.Рассчитайте молярную концентрацию карбоната калия в растворе, полученном при растворении данной соли массой 200 г в воде объёмом 800 см3. Плотность раствора примите равной 1,1 г/см3.
7.Почему применение комплексных удобрений перспективнее, чем удобрений, содержащих один питательный элемент? Из перечисленных ниже удобрений выпишите
втетрадь названия комплексных: чилийская селитра, кальциевая селитра, аммиачная селитра, простой суперфосфат, двойной суперфосфат, аммофос, аммофоска.
§ 46. Углерод и кремний
Углерод С и кремний Si — химические элементы группы IVA периодической системы. К этой же группе периодической системы относятся германий Ge, олово Sn и свинец Pb. Углерод и кремний относятся к элементам неметаллам, германий — полуметалл. У олова и свинца преобладают металлические свойства.
Строение атомов и степени окисления
Электронная конфигурация внешнего энергетического уровня атомов эле-
ментов группы IVA — ns2np2, например у углерода — 2s22p2, у кремния —
3s23p2:
|
2p |
|
3d |
2s |
3s |
3p |
|
↑ ↑ |
↑ ↑ |
||
6С ↑↓ |
|
14Si ↑↓ |
|
В соединениях с другими элементами атомы углерода и кремния могут проявлять степени окисления –4, +2 и +4, для элементов-полуметаллов и металлов в их соединениях с другими элементами (кроме гидридов) характерны положительные степени окисления +2 и +4.
Распространённость в природе
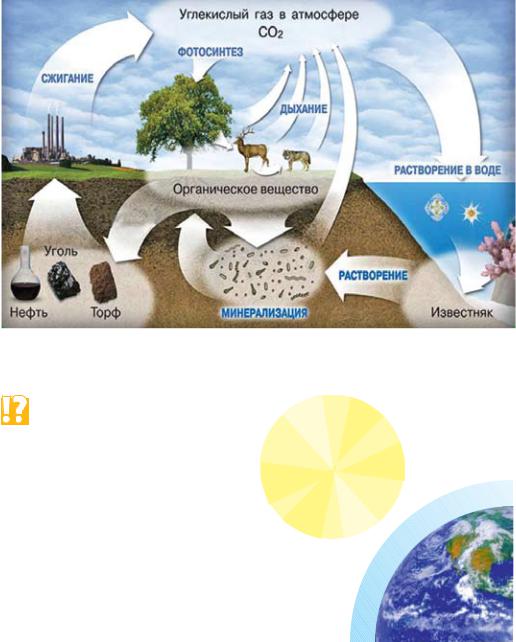
В земной коре содержится 0,093 % углерода по массе, причём он встречается как в свободном состоянии, так и в виде химических соединений с другими элементами. Углерод является основой органической жизни на Земле. Велика доля этого элемента в горючих ископаемых: угле, нефти, торфе и природном газе. В процессе жизнедеятельности происходит постоянный круговорот углерода в природе — переход углерода из органических соединений в неорганические и обратно (рис. 77).

Углерод и кремний |
225 |
|
Природные неорганические соединения углерода — карбонаты. Минерал кальцит CaCO3 является основой осадочных горных пород — известняков. Другие модификации карбоната кальция известны как
мрамор и мел.
Прозрачная разновидность кальцита — исландский шпат (рис. 79) высоко ценится в оптике из-за способности к двулучепреломлению света. Сквозь кристалл исландского шпата любой предмет видится раздвоенным. Самый большой кристалл исландского шпата длиной
около 6 метров был найден в 1669 году в Исландии и Рис. 79. Исландский шпат считался одним из чудес света.
Кремний — второй по распространённости на Земле элемент после кислорода. В земной коре он находится в виде кремнезёма SiO2 и различных силикатов. Например, гранит содержит более 60 % кремнезёма, а кристаллический кварц является самым чистым из природных соединений кремния с кислородом. Окрашенные разновидности кварца — аметист, цитрин и др. — используются в ювелирных украшениях. Кремний входит в состав растительных (хвощ, бамбук, крапива и др.) и животных (скелет, соединительные ткани) организмов.
Листья крапивы покрыты колючими волосками из чистого оксида кремния(IV), которые представляют собой полые трубочки длиной 1–2 мм. Они заполнены жидкостью, содержащей муравьиную кислоту. При лёгком прикосновении листьев крапивы к телу волоски проникают сквозь кожу и кислота попадает внутрь, вызывая жжение. При резком прикосновении хрупкие волоски обламываются и жжения не ощущается.
Простые вещества. Строение и физические свойства
Среди аллотропных модификаций углерода наиболее известны алмаз, гра-
фит и фуллерены.
В алмазе каждый атом углерода окружён четырьмя такими же атомами, расположенными в вершинах правильного тетраэдра (рис. 80). Такое строение обусловливает особые физические свойства алмаза, прежде всего его твёрдость.
а |
б |
Рис. 80. Алмаз: а — внешний вид; б — модель строения кристалла

|
226 |
Неметаллы |
Алмаз служит эталоном твёрдости, которая по десятибалльной шкале оценивается высшим баллом 10.
Внастоящее время налажено производство искусственных алмазов, в частности, в Республике Беларусь их производят на предприятии «Адамас» (г. Гомель).
Вграфите атомы углерода расположены слоями, состоящими из шестичленных колец (рис. 81). Эти слои связаны между собой гораздо слабее, чем атомы углерода в каждом слое. Слоистая структура графита обусловливает его мягкость: он легко оставляет след на бумаге. Графит хорошо проводит тепло и электрический ток. Мельчайшие кристаллы графита входят в состав сажи, образующейся при неполном сгорании органических соединений.
а |
б |
Рис. 81. Графит: а — внешний вид; б — модель строения кристалла
Фуллерены — это молекулярные вещества, шарообразные молекулы которых образованы атомами углерода, которые соединены в пяти- и шестичленные циклы (рис. 82). Внутри молекулы фуллеренов полые. В настоящее время получены фуллерены состава С60, С70 и др.
а |
б |
Рис. 82. Фуллерен: а — внешний вид; б — модель строения молекулы

Углерод и кремний |
227 |
|
К аллотропным модификациям углерода относят тубулены, которые представляют собой полые цилиндрические трубки. Стенки этих трубок состоят из одного слоя графита, а торцы представляют собой половинки молекул фуллеренов. Поэтому тубулены рассматриваются как промежуточные соединения между графитом и фуллеренами.
Известны и другие аллотропные модификации углерода. Так, Нобелевская премия 2011 года в области физики была присуждена за открытие и исследование свойств графена, структура которого представлена на рисунке 83. Существует и аморфный углерод —
стеклоуглерод.
а |
б |
Рис. 83. Структура (а) и образцы (б) графена (изображение под электронным микроскопом)
Кристаллическое строение кремния аналогично строению алмаза (см. рис. 80). Кристаллический кремний имеет серо-стальной цвет и металлический блеск. Он обладает полупроводниковыми свойствами.
Химические свойства простых веществ
Для углерода и кремния характерна невысокая химическая активность: большинство реакций с их участием протекают только при высокой температуре. Химические свойства различных аллотропных модификаций углерода сходны, отличаются лишь условия протекания реакций, потому что энергия разрыва связей между атомами в алмазе, графите и других модификациях углерода различна.
В химических реакциях с простыми веществами углерод и кремний проявляют как окислительные, так и восстановительные свойства (табл. 19). Как восстановители они взаимодействуют с кислородом и фтором.

|
228 |
|
Неметаллы |
|
|
Таблица 19. Химические свойства углерода и кремния |
|||
|
|
|
|
|
|
|
Взаимодей- |
Углерод |
Кремний |
|
|
ствие |
||
|
|
|
|
|
|
|
|
|
|
|
|
с кислородом |
горит на воздухе: |
горит при нагревании выше 400 С: |
|
|
|
C + O2 = CO2↑ |
Si + O2 =t SiO2 |
|
|
с оксидами |
при нагревании: |
при нагревании: |
|
|
металлов |
3C + 2Fe2O3 =t 4Fe + 3CO2 |
3Si + 2Fe2O3 =t 4Fe + 3SiO2 |
|
|
|
|
|
|
|
с металлами |
при нагревании: |
при нагревании: |
|
|
|
Ca + 2C =t CaC2 |
2Mg + Si =t Mg2Si |
|
|
с водородом |
при нагревании до 500 С в |
не взаимодействует |
|
|
|
присутствии катализатора: |
|
|
|
|
t, кат. |
|
|
|
|
C + 2H2 ==== CH4 |
|
В качестве окислителей углерод и кремний выступают при взаимодействии с металлами, образуя карбиды и силициды соответственно. Карбиды могут быть получены и при взаимодействии угля с оксидами:
CaО + 3C =t CaC2 + СО↑.
В реакциях со сложными веществами, например с оксидами металлов (табл. 19), углерод и кремний чаще всего проявляют восстановительные свойства.
Применение углерода и кремния
Области применения углерода представлены на рисунке 84. Углеродные материалы технического и медицинского назначения в широком ассортименте производятся на Светлогорском производственном объединении «Химволокно». Здесь выпускают углеродный медицинский сорбент, который используется для лечения ран, язв, ожогов, а также в бытовых фильтрах для воды, фильтрах в медицинской и пищевой промышленности и т. п. Широкое применение находят также выпускаемые в Светлогорске углеродные нити и ткани.
Кремний находит широкое применение в полупроводниковой технике и микроэлектронике, без него невозможно представить себе ни одно современное электронное устройство (рис. 85). Пройдя цепочку сложных химических процессов — от получения сверхчистого кремния до создания микросхемы — кремний находится в компьютерах, мобильных телефонах, плеерах, электронных книгах и других устройствах. Используется кремний и в металлургии в качестве добавки к сталям, в производстве сплавов, в батареях для преобразования энергии солнечного излучения в электрическую энергию (рис. 86).

|
230 |
Неметаллы |
В химических соединениях с другими элементами атомы углерода и кремния могут проявлять степени окисления –4, +2 и +4.
Важнейшие аллотропные модификации углерода: графит, алмаз и фуллерены.
Наиболее характерны для углерода и кремния химические реакции, в которых они проявляют себя как восстановители. В качестве окислителей углерод и кремний выступают при взаимодействии с металлами.
Вопросы и задания
1.Как доказать, что алмаз, графит и фуллерены — аллотропные модификации одного и того же элемента?
2.В одних случаях кремний является окислителем, в других — восстановителем. Объясните эти факты, основываясь на строении атома кремния. Приведите примеры химических реакций.
3.Состав полевого шпата выражается формулой K2O · Al2O3 · 6SiO2. Вычислите массовую долю кремния в полевом шпате.
4.Какое количество теплоты выделится при сгорании древесного угля массой 500 г, если тепловой эффект реакции равен 410 кДж? Считайте, что древесный уголь представляет собой чистый углерод.
5.Составьте уравнения реакций углерода и кремния со фтором. В каждой реакции укажите окислитель и восстановитель.
6.Напишите уравнение взаимодействия углерода с оксидом меди(II). Рассчитайте массу меди, которую можно получить из оксида меди(II) массой 160 г.
7.Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
а) C → CaC2 → C2H2 → CO2 → CO; б) SiO2 → Si → Ca2Si → SiH4 → SiO2.
§ 47. Оксиды углерода и кремния
Рассмотрим детальнее уже знакомые вам из |
|
курса химии 9-го класса оксид углерода(II), или |
|
угарный газ СО, оксид углерода(IV), или угле- |
|
кислый газ CO2, и оксид кремния(IV) SiO2. Окси- |
|
ды углерода являются веществами молекулярного |
|
строения, а оксид кремния(IV) SiO2 имеет атомную |
|
кристаллическую решётку, каждая структурная еди- |
|
ница которой представляет собой тетраэдр с ато- |
|
мом кремния в центре и атомами кислорода в вер- |
Рис. 87. Модель строения |
шинах (рис. 87). |
кристаллов SiO2 |
