
04_Per_zakon
.pdf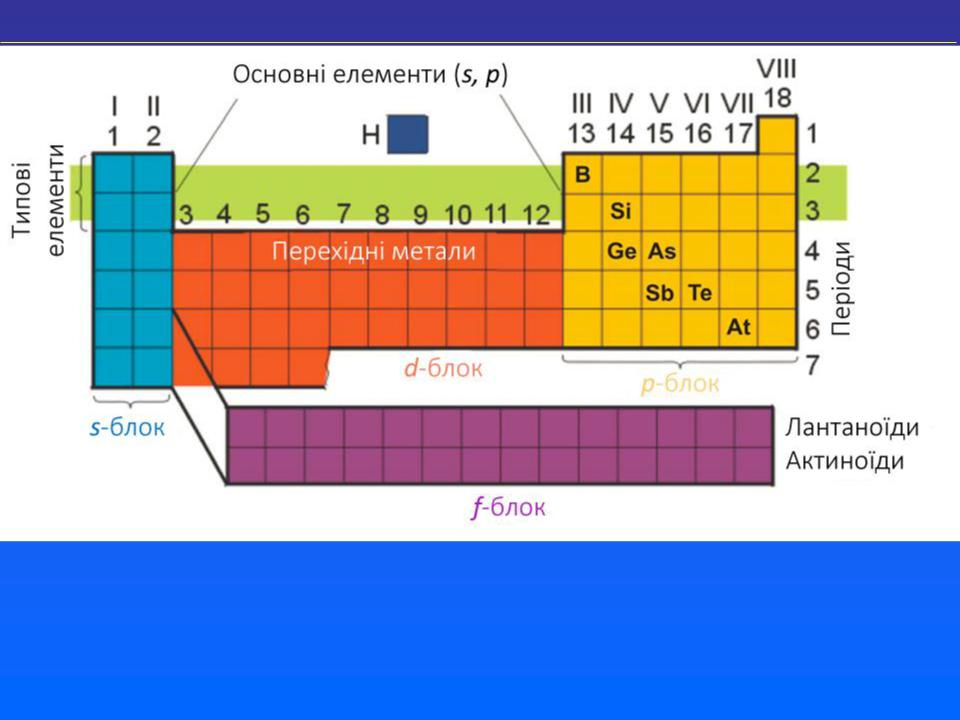
Періодична система IUPAC
|
1 період 2 елементи |
|
||
2 |
і 3 |
періоди 8 елементів |
|
|
4 |
і 5 |
періоди 18 |
елементів |
|
24.09.2013 6 |
і 7 |
періоди 32 |
елементи |
21 |

Періодичність зміни властивостей елементів
Періодично змінюються:
радіуси атомів та іонів;
енергія іонізації;
енергія спорідненості до електрона;
електронегативність;
вища валентність і вищий ступінь окиснення (чисельно рівні номеру групи);
властивості простих речовин, оксидів , гідроксидів та інших однотипних сполук.
24.09.2013 |
22 |
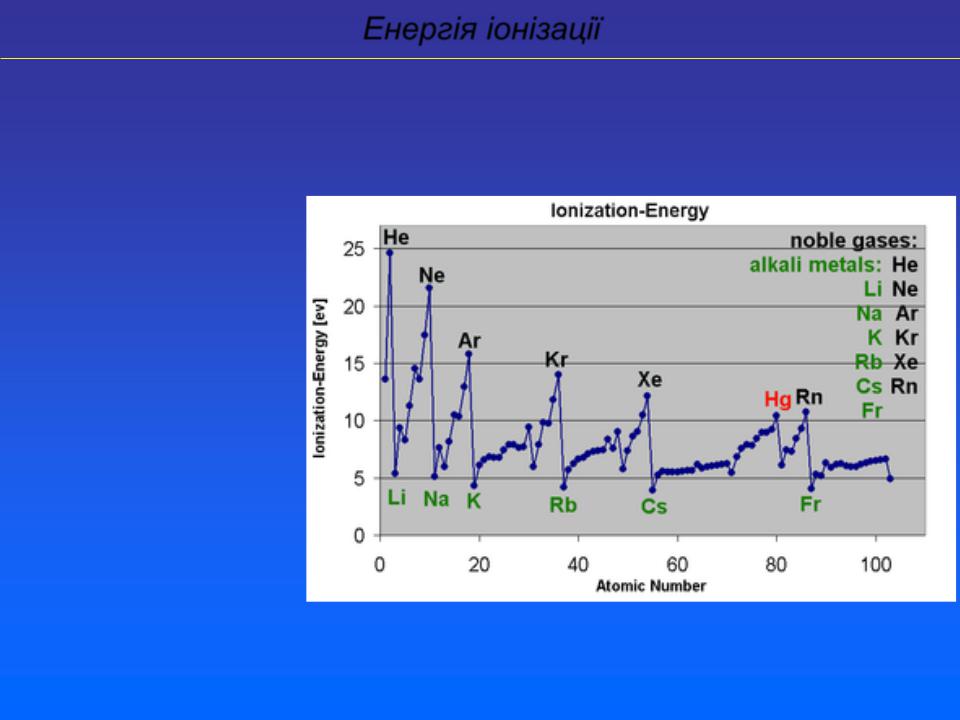
Енергія іонізації
І- енергія, яку необхідно затратити, щоб відірвати електрон від електронейтрального атома, перетворивши його в катіон:
Е+ I = Е+ +
І1 < І2 < І3 < Іn
Вимірюють: еВ/атом або Дж/моль
Від І залежать природа і міцність хімічних зв'язків, відновні властивості простої речовини.
24.09.2013 |
23 |
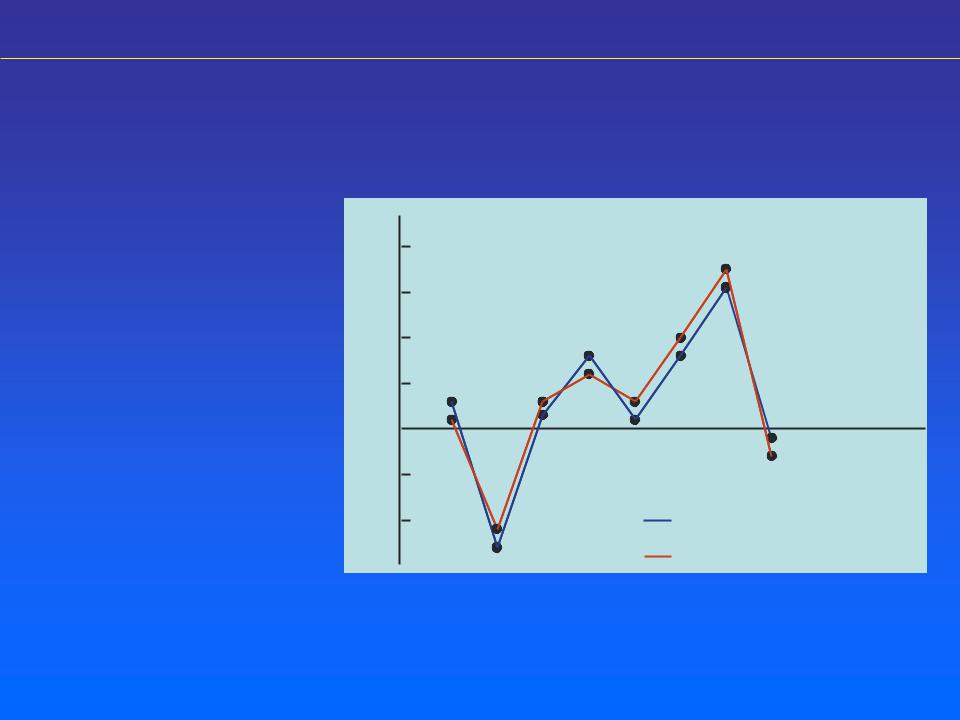
Енергія спорідненості до електрона
ε – енергія, що виділяється при приєднанні електрона до вільного атома в основному стані з перетворенням
його на негативний іон |
|
|
|
|
|
|
|
|
|
|||
Е + |
= Е– |
+ ε |
ε, кДж/моль |
|
|
|
|
|
|
|
||
400 |
|
|
|
|
|
|
|
|
|
|||
|
|
|
300 |
|
|
|
|
|
Cl |
|
|
|
ε1 < ε2< ε3 < εn |
|
|
|
|
|
|
F |
|
|
|||
|
|
|
|
|
S |
|
|
|
|
|||
|
|
|
200 |
|
|
C |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
Виражають |
100 |
|
Al |
|
P |
|
O |
|
|
|
||
|
Si |
|
|
|
|
|
||||||
у кДж/моль |
Li |
Na |
|
|
N |
|
|
Ne |
|
|||
|
|
B |
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
||
або еВ/атом |
1 |
2 |
3 |
4 |
5 |
6 |
7 |
|
8 |
група |
||
-100 |
|
|
|
|
|
|
|
Ar |
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
-200 |
|
Mg |
|
|
|
II період |
|
||
|
|
|
|
|
|
|
|
|
||||
|
- p-елементи VII групи, εBe |
|
|
III період |
|
|||||||
ε |
- s2 (Be, Mg, Zn), |
|
||||||||||
max |
|
|
|
|
min |
|
|
|
|
|
|
|
s2p6 (Ne, Ar) або p3-орбіталями (N, P, As) |
|
|
|
|
|
|||||||
|
|
При ε |
, неметалічні властивості |
|
|
|
||||||
24.09.2013 |
|
|
|
|
|
|
|
|
|
|
24 |
|
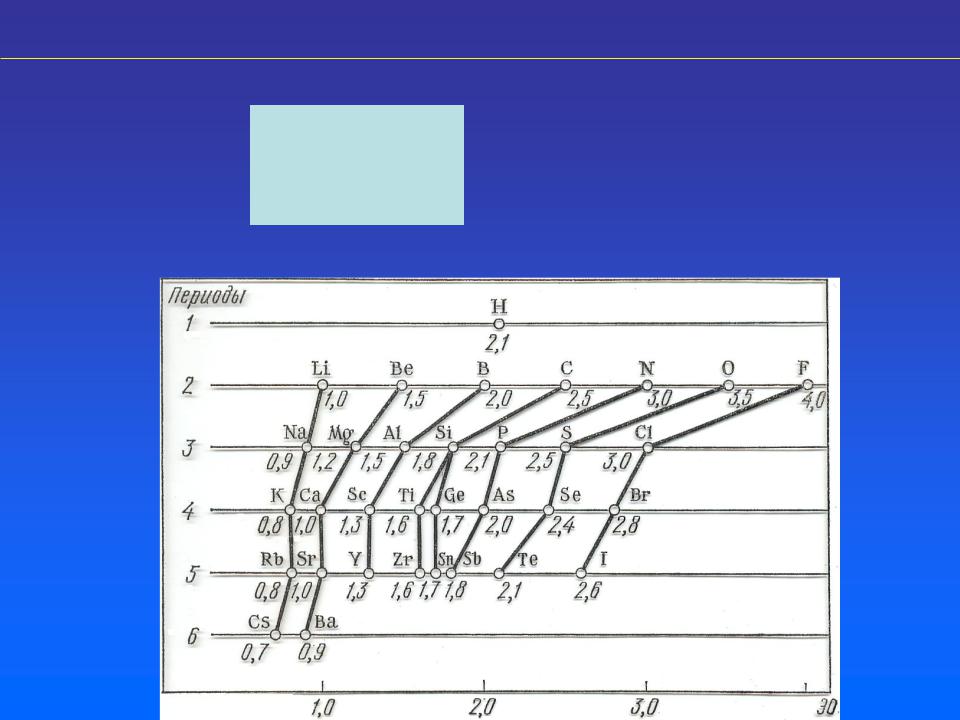
Електронегативність
– здатність атомів притягати електрони:
Маліккен: |
I1 ε1 |
- абсолютне значення |
|
2 |
|||
|
|
Л. Полінг – відносні електронегативності:
24.09.2013 |
25 |
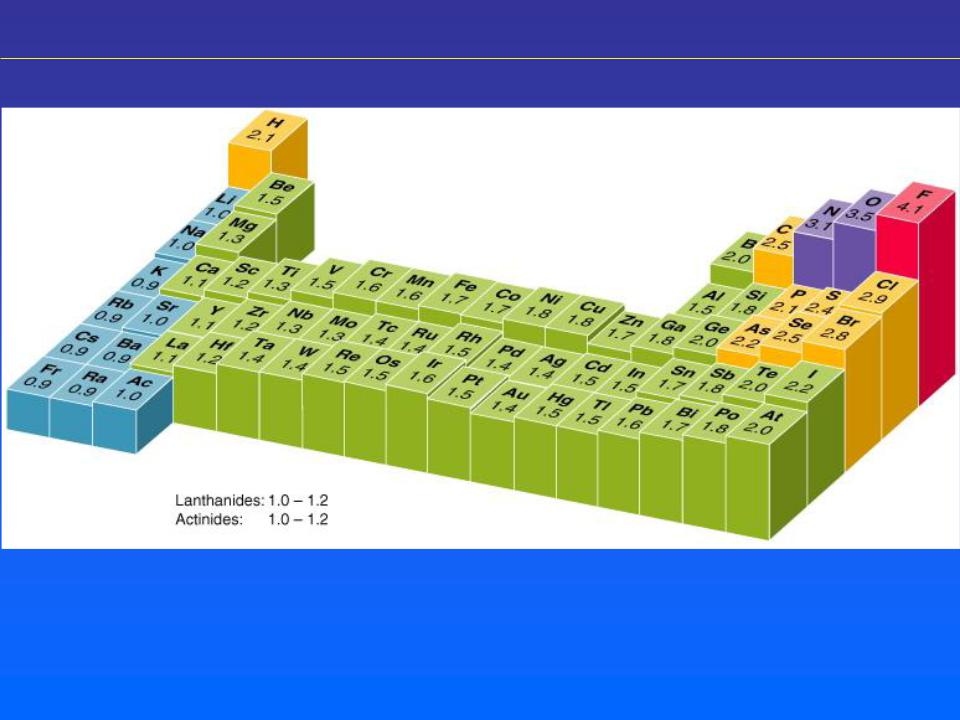
Електронегативність
24.09.2013 |
26 |

Приклади
Електронна конфігурація зовнішнього електронного рівня
3s23p5
ІІІ період (заповнюється 3 рівень)
VII група (сума електронів останнього рівня 7)
р-елемент А групи (заповнюється р-підрівень)
неметал (велика кількість валентних електронів – 5)
повна електронна структура: 1s22s22p63s23p5
заряд ядра дорівнює сумі електронів +17
елемент – Хлор (порядковий номер 17)
24.09.2013 |
27 |

Приклади
Порядковий номер 25 (Манган)
заряд ядра +25
25 електронів
електронна конфігурація:
1s22sp63s2p64s23
VII група (сума 4s- і 3d-електронів - 7)
d-елемент В групи (заповнюється d-підрівень)
3 період (валентні електрони на 3 рівні)
метал (на 4s електронному рівні мало електронів – 2)
24.09.2013 |
28 |
|
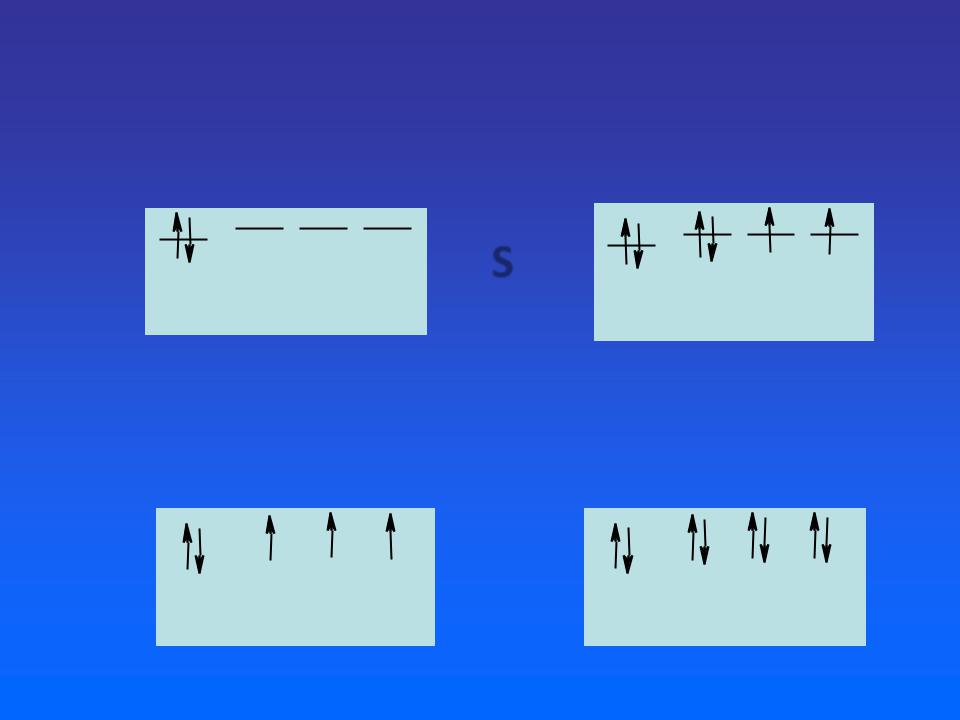
Приклади |
|
|
Атом, який у С.О. |
+4 має конфігурацію 3s23p0 |
3s23р0 |
+ 4e- 3s23р4 |
S
3s2 |
3p0 |
3 s 2 |
3 p 4 |
Електронну конфігурацію атома Р в Р–3Н3
+15 |
Р Ne 3s23р3 |
+ 3e- |
|
Р-3 |
Ne 3s23р6 |
||||||||||||
|
|
|
|
|
|
|
|
+15 |
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
3 s 2 |
3 p 3 |
3 s 2 |
3 p 6 |
24.09.2013 |
29 |

Дякую за увагу!
24.09.2013 |
30 |
