
- •Классы органических соединений
- •Изомерия
- •Номенклатура
- •Углеводороды
- •Ациклические углеводороды
- •Алициклические углеводороды
- •Ароматические углеводороды
- •Галогенпроизводные углеводородов
- •Элементоорганические соединения
- •Органические кислоты
- •Оксикислоты (гидроксикислоты)
- •2С17н35соон стеариновая кислота
- •Фосфатиды
- •Стеарины
- •Углеводы
- •Моносахариды
- •Дисахариды
- •Полисахариды
- •Азотсодержащие соединения Амины
- •Аминокислоты
- •Красители
- •Азокрасители
- •Трифенилметановые красители
- •Индигоидные красители
- •Антрахиноновые красители
- •Техническая классификация красителей
- •Гетероциклические соединения
Оксикислоты (гидроксикислоты)
Оксикислоты (спиртокислоты) – это производные карбоновых кислот, содержащие в радикале, соединенном с карбоксилом, одну, две или несколько гидроксильных групп.
В зависимости от количества карбоксильных групп оксикислоты делятся на одноосновные, двухосновные и т.д.; в зависимости от общего количества гидроксильных групп оксикислоты делятся на одно- или многоатомные.
По характеру радикала оксикислоты бывают предельные и непредельные, ациклические, циклические или ароматические.
В оксикислотах встречаются следующие виды изомерии:
структурная (изомерия цепи радикала, изомерия взаимного положения карбоксила и гидроксила);
оптическая (зеркальная), обусловленная наличием асимметричных атомов углерода.
Названия оксикислотам дают по названию кислоты с добавлением «окси» или «диокси» и т.д. Широко используется и тривиальная номенклатура.
![]()
НО–СН2–СООН
гликолевая (оксиуксусная)
молочная (α-оксипропионовая)
![]()
![]()
α-оксимасляная β-оксимасляная
(2-оксибутановая) (3-оксибутановая)
Физические свойства. Низшие оксикислоты чаще всего – это густые, сиропообразные вещества. Оксикислоты смешиваются с водой в любых соотношениях, а с ростом молекулярной массы растворимость уменьшается.
Химические свойства.
1. Кислотные свойства – оксикислоты дают все реакции, характерные для карбоксила: образование солей, сложных эфиров, амидов, галогенангидридов и т.п. Гидроксикислоты – более сильные электролиты, чем соответствующие им карбоновые кислоты (влияние гидроксильной группы).
![]()
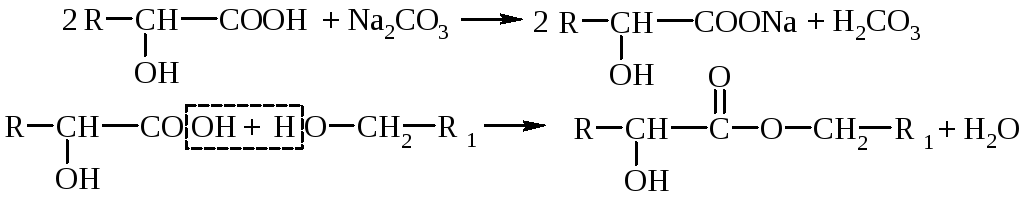
2. Спиртовые свойства – реакции замещения водорода гидроксигруппы, образование простых и сложных эфиров, замещение –OHна галоген, внутримолекулярная дегидратация, окисление.
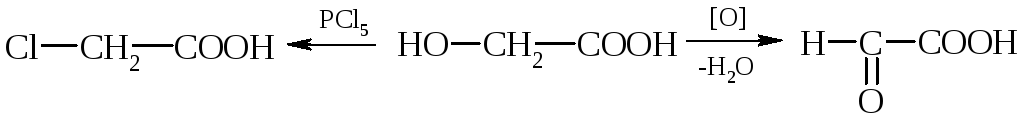
хлоруксусная гликолевая глиоксалевая
кислота кислота кислота
а) НО–СН2–СООН + СН3OH![]() НО–СН2–СО–О–СН3+ Н2О
НО–СН2–СО–О–СН3+ Н2О
сложный эфир гликолевой кислоты и метилового спирта
б) НО–СН2–СООН + 2СН3ОН![]() СН3–О–СН2–СООСН3+ 2Н2О
СН3–О–СН2–СООСН3+ 2Н2О
гликолевая метиловый метиловый эфир
кислота спирт метоксиуксусной кислоты
(полный эфир)
3. Отношение оксикислот к нагреванию – при нагревании α-оксикислоты отщепляют воду, образуя циклический сложный эфир, построенный ид двух молекул α-оксикислот:

α-оксипропионовая кислота лактид
β-Оксикислоты в тех же условиях легко теряют воду с образованием непредельных кислот.
НО–СН2–СН2–СООН![]() СН2=СН–СООН
СН2=СН–СООН
β-оксипропионовая акриловая кислота
кислота
γ-Оксикислоты тоже могут терять молекулу воды с образованием внутримолекулярных эфиров – лактонов.
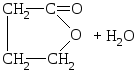
НО–СН2–СН2–СН2–СООН![]()
γ-оксимасляная кислота
γ-бутиролактон
Некоторые оксикислоты получаются из природных продуктов. Так, молочную кислоту получают при молочно-кислом брожении сахаристых веществ. Синтетические способы получения основаны на следующих реакциях:
1) Cl–СН2–СООН +
НОН![]() НО–СН2–СООН;
НО–СН2–СООН;
монохлоруксусная гликолевая
кислота кислота
2) СН2=СН–СООН + НОН![]() НО–СН2–СН2–СООН.
НО–СН2–СН2–СООН.
акриловая кислота β-оксипропионовая кислота
Представители оксикислот.
Гликолевая (оксиуксусная) кислота – кристаллическое вещество, содержащееся в незрелых фруктах, в свекловичном соке, репе и других растениях. В промышленности получается восстановлением щавелевой кислоты. Применяется при крашении (ситцепечатание).
Молочная кислота (α-оксипропионовая) – густая жидкость или легкоплавкая кристаллическая масса. Молочная кислота образуется в процессе молочно-кислого брожения сахаров, под действием молочно-кислых бактерий. Содержится в кисломолочных продуктах, квашеной капусте, силосе. Используется при протравном крашении, в кожевенном производстве, в медицине.
Мясомолочная кислота содержится в мускульном соке животных и мясных экстрактах.
Двухатомная глицериновая кислота участвует в процессах жизнедеятельности растений и животных.
![]()
Аскорбиновая кислота (витамин С) – кристаллическое вещество, содержащееся в свежих фруктах, лимонах, черной смородине, в свежих овощах – капусте, бобах. Синтетически витамин С получают окислением многоатомного спирта сорбита.
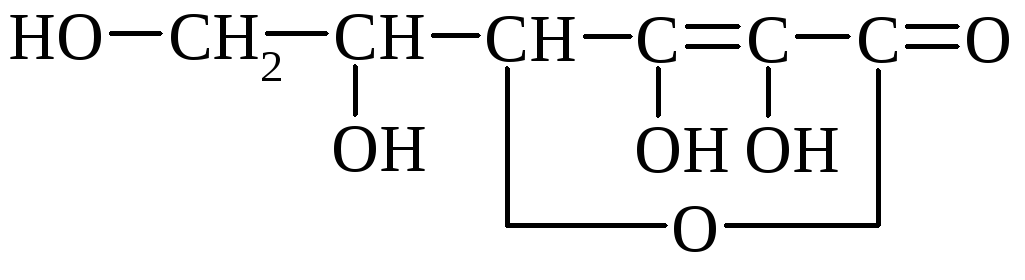 α-аскорбиновая кислота
α-аскорбиновая кислота
Аскорбиновая кислота легко разлагается кислородом воздуха, особенно при нагревании
Ациклические двух- и трехосновные оксикислоты.
Яблочная (оксиянтарная) кислота (НООС–СНОН–СН2–СООН) – это кристаллическое вещество, хорошо растворимое в воде; применяется в медицине, содержится в недозрелой рябине, барбарисе, ревене, в виноградном соке, вине.
Винная (винно-каменная, диоксиянтарная) кислота (НООС–*СНОН–*СНОН–СООН) имеет 2 асимметричных атома углерода и поэтому имеет 4 оптических изомера. Образует кислые калиевые соли, которые плохо растворяются в воде и выпадают в осадок. Кристаллы соли можно наблюдать в вине (винный камень). Смешанная калиево-натриевая соль называется сегнетовой солью. Соли винной кислоты называются тартратами.
![]()
![]()
винный камень сегнетовая соль
Винная кислота распространена в растениях (рябина, виноград и т.д.).
Лимонная кислота 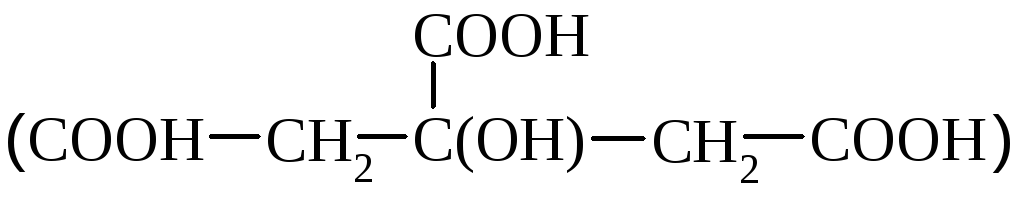 содержится в цитрусовых. В промышленности
получается из плодов лимона, окислением
сахаров плесневыми грибками, при
переработке хвои ели.
содержится в цитрусовых. В промышленности
получается из плодов лимона, окислением
сахаров плесневыми грибками, при
переработке хвои ели.
Лимонная кислота – биологически важное соединение, принимает участие в обмене веществ. Применяется в медицине, пищевой, текстильной промышленности как добавка к красителям.
Циклические одноосновные многоатомные оксикислоты входят в состав желчных кислот и других физиологически важных соединений; например, ауксин усиливает рост растений.
Ароматические оксикислоты подразделяются на фенолокислоты и жирно-ароматические кислоты, содержащие гидроксил в боковой цепи.
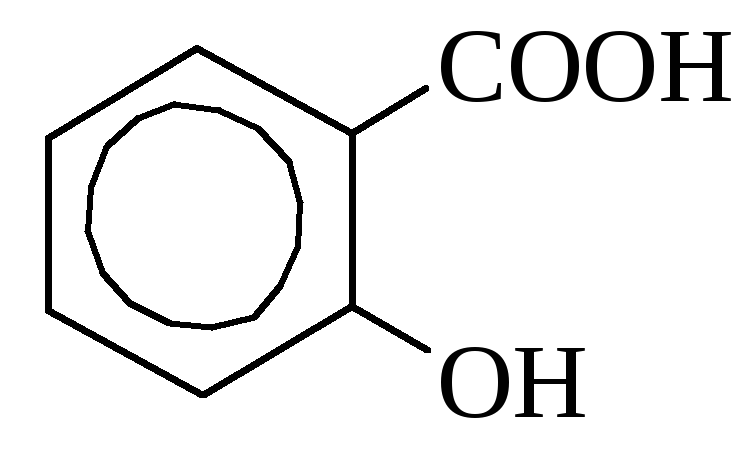
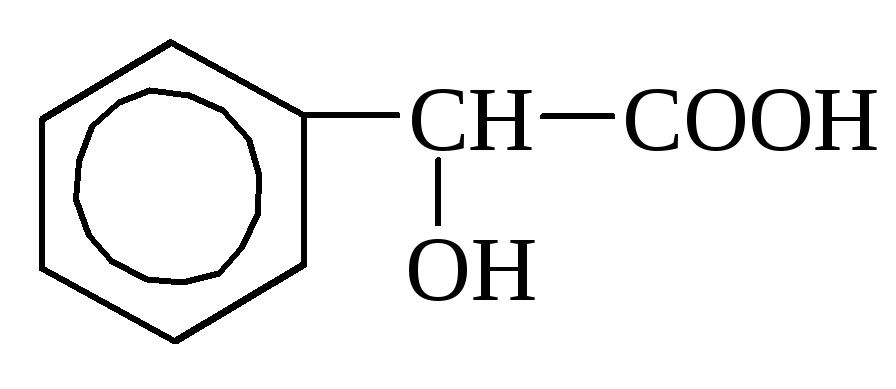
о-оксибензойная миндальная кислота
(салициловая) кислота
Салициловая кислота содержится в некоторых растениях в свободном виде (календула), но чаще в виде сложных эфиров. В промышленности получается путем нагревания фенолята натрия с углекислотой. Используется как дезинфицирующее средство и при синтезе красителей. Многие производные салициловой кислоты применяются как лекарства (аспирин, салол).
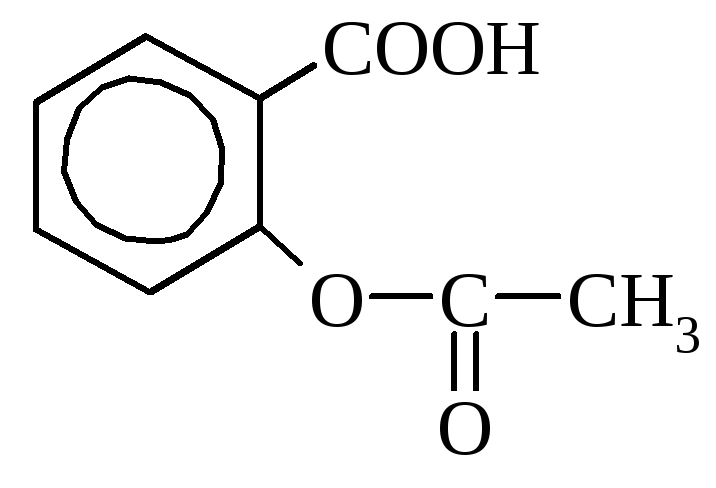
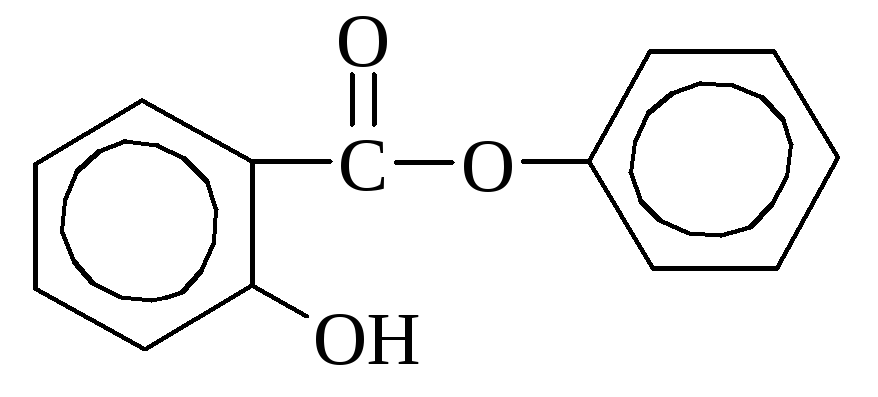
аспирин салол (фениловый эфир
(ацетилсалициловая кислота) салициловой кислоты)
Галловая кислота (3,4,5-триоксибензойная).
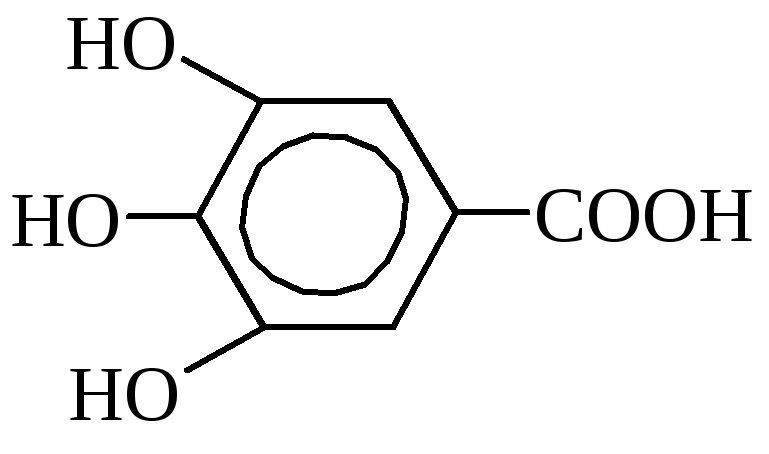
Содержится в листьях чая, дубовой коре, в гранатовом дереве. В промышленности получается из таннина кипячением с разбавленными кислотами. Применяется для изготовления чернил, в фотографии, в медицине как антисептик. Галловая кислота и её производные широко используются в качестве консервантов для многих пищевых продуктов (жиры, высокосортные мыла, молочные продукты), обладает дубильными свойствами и имеет определённое значение в производстве кожи и в протравном крашении.
Миндальная кислота относится к жирно-ароматическим кислотам (С6Н5–СН(ОН)–СООН), содержится в амигдалине, в горчице, бузине и т.д.
Дубильные вещества часто являются производными многоатомных фенолов. Они входят в состав растений и получаются из экстрактов коры, древесины, листьев, корней, плодов или наростов (галлов).
Таннины являются наиболее важными дубильными веществами. Это смесь разных химических соединений, главными из которых являются эфиры галловой и дигалловой кислот и глюкозы или многоатомных спиртов.
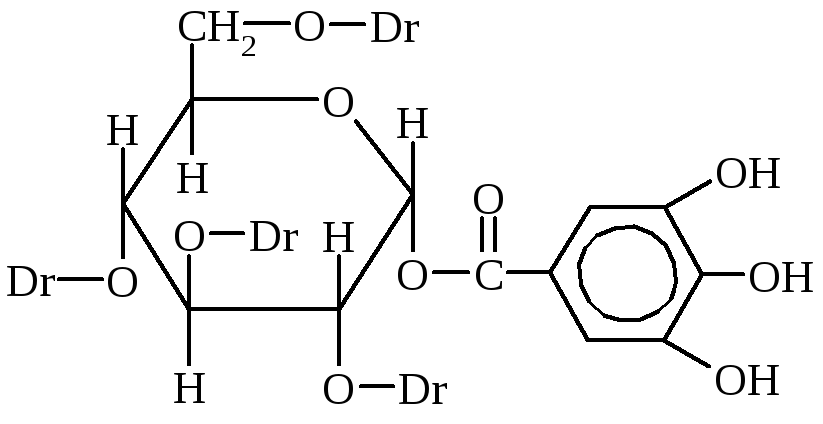
Dг-дигалловая кислота
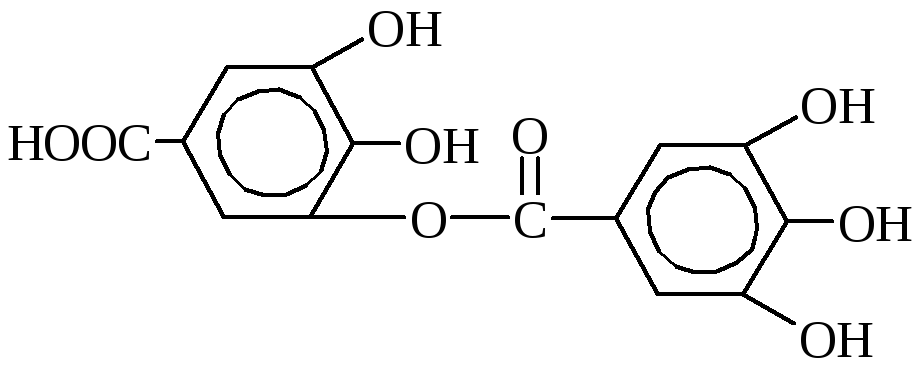
м-дигалловая кислота
Таннин проявляет свойства фенолов и сложных эфиров. С раствором хлорного железа образует комплексное соединение черного цвета. Таннины находят широкое применение как дубильные экстракты, протравы при крашении хлопчатобумажных тканей, как вяжущие вещества в медицине (обладают бактерицидными, кровеостанавливающими свойствами), являются консервантами.
ЛИПИДЫ
К липидам относятся органические вещества, многие из которых являются сложными эфирами жирных высокомолекулярных кислот и многоатомных спиртов, – это жиры, фосфатиды, воска, стероиды, жирные высокомолекулярные кислоты и др.
Липиды находятся главным образом в семенах растений, ядрах орехов, а в животных организмах – в жировой и нервной тканях, особенно в мозгу животных и человека.
Жиры
Природные жиры представляют собой смеси сложных эфиров трёхатомного спирта глицерина и высших карбоновых кислот, т.е. смеси глицеридов этих кислот.
О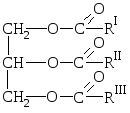 бщая
формула жира:
бщая
формула жира:
α
β
α1,
где RIRIIRIII– углеводородные радикалы высших жирных кислот нормального строения с чётным числом углеродных атомов. В состав жиров могут входить остатки как насыщенных, так и ненасыщенных кислот.
Насыщенные кислоты:
С15H31COOH– пальмитиновая;
С17Н35СООН – стеариновая;
С3Н7СООН – масляная (содержится в сливочном масле) и др.
Ненасыщенные кислоты:
С17Н33СООН – олеиновая;
С17Н31COOH– линолевая;
С17Н29СООН – линоленовая и др.
Получают жиры из природных источников животного и растительного происхождения.
Физические свойства жиров обусловлены кислотным составом. Жиры, содержащие преимущественно остатки насыщенных кислот, – твёрдые или мазеобразные вещества (бараний, говяжий жир и др.) Жиры, в составе которых содержатся главным образом остатки ненасыщенных кислот, имеют жидкую консистенцию при комнатной температуре и называются маслами. Жиры не растворяются в воде, но хорошо растворяются в органических растворителях: эфире, бензоле, хлороформе и др.
Химические свойства. Как все сложные эфиры, жиры подвергаются гидролизу. Гидролиз может протекать в кислой, нейтральной или щелочной среде.
1. Кислотный гидролиз.

