
Энзимология
.pdf
|
|
|
|
21 |
|
|
|
2. |
Зависимость начальной скорости ферментативной реакции от концентрации |
||||||
|
субстрата. Объяснение данной зависимости. |
|
|
|
|||
3. |
Константа |
Михаэлиса Km |
и |
максимальная |
скорость |
реакцииVmax, |
|
|
физический |
смысл и методы определения |
из экспериментальных данных |
||||
|
(методы Лайнуивера-Берка, |
Хейнса-Вульфа, |
Иди-Хофсти, Эйзенталя и |
||||
|
Корниш-Боуден). |
|
|
|
|
|
|
4.Понятие о константе связывания субстрата – КS.
5.Зависимости начальной скорости ферментативной реакции от концентрации субстрата, не подчиняющиеся уравнению Михаэлиса. Реакции, для которых они характерны.
6.Определение механизма и кинетических параметров многосубстратной реакции из экспериментальных данных.
7.Зависимость скорости реакции от концентрации фермента. Объяснение кинетических данных.
Расчетные задачи
1. Рассчитать значение кинетических параметров ферментативной реакции
(Km и Vmax) на основании данных, представленных в таблице 1, методами Лайнуивера-Берка (рис. 2а), Хейнса-Вульфа (рис.3), Иди-Хофсти (рис. 2б),
Эйзенталя и Корниш-Боуден (рис. 4). Решение оформить в рабочей тетради и сдать преподавателю.
Таблица 1.
So, M |
0,2 |
0,124 |
0,091 |
0,071 |
0,06 |
|
|
|
|
|
|
V, х106 М/с |
4,57 |
3,83 |
3,31 |
2,97 |
2,74 |
|
|
|
|
|
|

22
Рис. 2. Определение параметровKm и Vmax методом Лайнуивера-Берка (а) и
методом Иди-Хофсти (б) [2].
Рис. 3. Определение параметровKm и Vmax методом Хейнса-Вульфа.
23
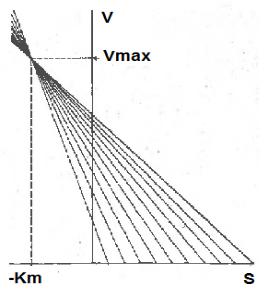
Рис. 4. Определение параметров Km и Vmax методом Эйзенталя и Корниш-
Боуден.
Прямые проходят через точки на осях х и ,усоответствующих экспериментальным данным
зависимости скорости ферментативной реакции от концентрации субстрата.
2. |
Рассчитать |
значение |
кинетических |
параметров |
ферментативной |
реакции |
||||||
|
(Km и Vmax) на основании данных, представленных в таблице 2, методами |
|||||||||||
|
Лайнуивера-Берка (рис. 2а), Хейнса-Вульфа (рис.3), Иди-Хофсти (рис. 2б), |
|||||||||||
|
Эйзенталя и Корниш-Боуден (рис. 4). |
|
|
|
|
|
|
|||||
|
Таблица 2. |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
So, M |
|
0,8 |
|
1,0 |
|
1,33 |
|
2,0 |
4,0 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
V, х106 М/с |
|
4,74 |
|
5,5 |
|
6,45 |
|
7,8 |
9,85 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
3. |
Рассчитать |
значение |
кинетических |
параметров |
ферментативной |
реакции |
||||||
|
(Km и Vmax) на основании данных, представленных в таблице 3, методами |
|||||||||||
|
Лайнуивера-Берка (рис. 2а), Хейнса-Вульфа (рис.3), Иди-Хофсти (рис. 2б), |
|||||||||||
|
Эйзенталя и Корниш-Боуден (рис. 4). |
|
|
|
|
|
|
|||||
|
Таблица 3. |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
So, х102 M |
|
0,5 |
|
0,55 |
|
0,67 |
|
0,8 |
1,0 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
V, х106 М/с |
|
2,01 |
|
2,13 |
|
2,45 |
|
2,8 |
3,25 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
24
4. Рассчитать значение кинетических параметров ферментативной реакции
(Km и Vmax) на основании данных, представленных в таблице 4, методами
Лайнуивера-Берка (рис. 2а), Хейнса-Вульфа (рис.3), Иди-Хофсти (рис. 2б),
Эйзенталя и Корниш-Боуден (рис. 4).
Таблица 4.
So, х103 M |
0,306 |
0,383 |
0,51 |
0,765 |
1,53 |
|
|
|
|
|
|
V, х107 М/мин |
2,3 |
3,0 |
3,72 |
4,25 |
4,96 |
|
|
|
|
|
|
Тема 7. Ингибирование ферментативных реакций
Ингибирование ферментативных реакций. Обратимое и необратимое ингибирование. Конкурентные, неконкурентные и бесконкурентные ингибиторы,
взаимодействие с ферментом и влияние на параметры ферментативной реакции.
Инактивация ферментов.
Необходимый исходный уровень знаний
1.Принципы структурной организации ферментов.
2.Роль подвижности конформации полипептидной цепи в проявлении активности ферментов.
3.Структура активного центра фермента, функциональные участки.
Приобретаемые компетенции (знания, умения и навыки)
1.Умение измерить, описать и объяснить зависимость начальной скорости ферментативной реакции от концентрации субстрата в присутствии ингибитора.
2.Умение определить тип ингибитора на основе кинетических данных.
Рекомендуемая литература
1.Березин, И. В. Практический курс химической и ферментативной кинетики /
И. В. Березин, А. А. Клесов. – М.: Изд-во МГУ, 1976. – 321 с.
25
2.Варфоломеев, С. Д. Химическая энзимология: Учеб. / С. Д. Варфоломеев. -
М.: Академия, 2005. – 480 c.
3.Варфоломеев, С. Д. Биокинетика: Практический курс / С. Д. Варфоломеев,
К. Г. Гуревич. – М. : ФАИР-ПРЕСС, 1999. – 720 с.
4.Корниш-Боуден, Э. Основы ферментативной кинетики / Э. Корниш-Боуден.
– М.: Мир, 1979. – 280 с.
Вопросы для самоконтроля
1.Понятие ингибитора и активатора ферментативной реакции.
2.Основные типы ингибиторов.
3.Конкурентные ингибиторы, особенности структуры, взаимодействие с
ферментом, влияние |
на |
кинетические |
параметры |
ферментативной |
реакции.
4.Неконкурентные ингибиторы, взаимодействие с ферментом, влияние на кинетические параметры ферментативной реакции.
5.Бесконкурентные ингибиторы, взаимодействие с ферментом, влияние на кинетические параметры ферментативной реакции.
6.Инактивация ферментов. Определение константы инактивации.
Расчетные задачи
1. Рассчитать значение кинетических параметров ферментативной реакции
(Km и Vmax) без ингибиторов и в присутствии ингибиторов на основании данных, представленных в таблице5, методом Лайнуивера-Берка.
Определить тип ингибиторов (рис. 5). Решение оформить в рабочей тетради и сдать преподавателю.
26
Таблица 5.
So, х105 M |
0,3 |
0,5 |
1,0 |
3,0 |
9,0 |
|
|
|
|
|
|
V реакции без |
10,4 |
14,5 |
22,5 |
33,8 |
40,5 |
ингибитора, х106 |
|
|
|
|
|
мкМ/мин |
|
|
|
|
|
|
|
|
|
|
|
V реакции в присут- |
4,1 |
6,4 |
11,3 |
22,6 |
33,8 |
ствии ингибитора 1, |
|
|
|
|
|
х106 мкМ/мин |
|
|
|
|
|
|
|
|
|
|
|
V реакции в присут- |
2,1 |
2,9 |
4,5 |
6,8 |
8,1 |
ствии ингибитора 2, |
|
|
|
|
|
х106 мкМ/мин |
|
|
|
|
|
|
|
|
|
|
|
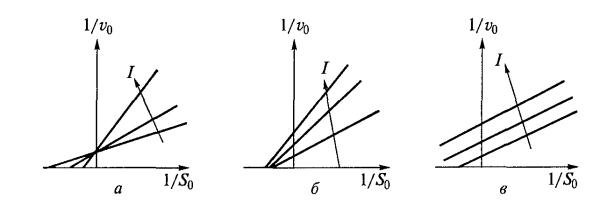
Рис. 5. Определение механизма ингибирования ферментативной реакции по
графическим |
данным в координатах Лайнуивера-Берка: ) конкурентное |
|
ингибирование; |
б) неконкурентное |
ингибирование; в) бесконкурентное |
ингибирование [2]. |
|
|
2.Рассчитать значение кинетических параметров ферментативной реакции(Km
иVmax) без ингибиторов и в присутствии ингибиторов на основании данных,
представленных в таблице6, методом Лайнуивера-Берка. Определить тип
ингибитора (рис. 5).
27
Таблица 6.
So, х105 M |
0,5 |
0,91 |
2,5 |
10,0 |
|
|
|
|
|
V реакции без |
2,09 |
2,94 |
4,45 |
5,55 |
ингибитора, х106 |
|
|
|
|
мкМ/мин |
|
|
|
|
|
|
|
|
|
V реакции в присут- |
1,49 |
2,16 |
3,18 |
4,0 |
ствии ингибитора 1, |
|
|
|
|
х106 мкМ/мин |
|
|
|
|
|
|
|
|
|
Тема 8. Влияние температуры и рН на скорость ферментативных реакций
Влияние температуры на скорость ферментативных реакций. Определение кинетических и термодинамических параметров из экспериментальных данных.
Изучение термодинамики конформационных изменений активных центров ферментов.
Влияние рН на скорость ферментативных реакций. Роль ионогенных групп в проявлении активности фермента. Определение параметров рН-зависимости ферментативной реакции из экспериментальных данных.
Необходимый исходный уровень знаний
1.Термодинамические параметры химической реакции.
2.Влияние температуры на скорость химических реакций.
3.Ионогенные группы в составе молекулы фермента.
4.Понятие о рК ионогенных групп.
Приобретаемые компетенции (знания, умения и навыки)
1.Умение определять кинетические и термодинамические парамет
ферментативной реакции из экспериментальных данных зависимости
скорости ферментативной реакции от температуры и рН.
28
2.Умение определять параметры рН-зависимости ферментативной реакции из экспериментальных данных.
Рекомендуемая литература
1.Березин, И. В. Практический курс химической и ферментативной кинетики /
И. В. Березин, А. А. Клесов. – М.: Изд-во МГУ, 1976. – 321 с.
2.Варфоломеев, С. Д. Химическая энзимология: Учеб. / С. Д. Варфоломеев. -
М.: Академия, 2005. – 480 c.
3.Варфоломеев, С. Д. Биокинетика: Практический курс / С. Д. Варфоломеев,
К. Г. Гуревич. – М. : ФАИР-ПРЕСС, 1999. – 720 с.
4.Корниш-Боуден, Э. Основы ферментативной кинетики / Э. Корниш-Боуден.
– М.: Мир, 1979. – 280 с.
Вопросы для самоконтроля
1.Влияние температуры на скорость ферментативных реакций.
2.Термоинактивация ферментов. Обратимые и необратимые стадии.
3.Определение кинетических и термодинамических параметров
экспериментальных данных зависимости скорости ферментативной
реакции от температуры.
4.Влияние рН на скорость ферментативных реакций.
5.Роль ионогенных групп в проявлении активности фермента.
6.Определение параметров рН-зависимости ферментативной реакции из экспериментальных данных.
Расчетные задачи
1. Определить константы ионизации каталитически активных ионогенных групп свободного фермента и его фермент-субстратного комплексаиз кинетических данных, представленных в таблице 7.
29
|
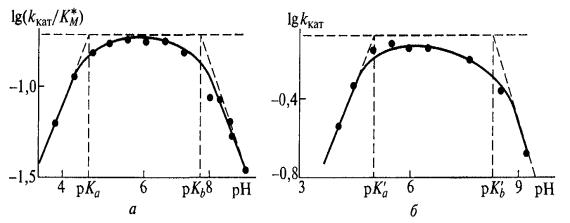
Рис. 6. |
Определение |
констант |
ионизации |
каталитически |
активных |
||||||
ионогенных |
групп |
свободного |
фермента( ) и |
его |
фермент-субстратного |
|||||||
комплекса (б) [2]. |
|
|
|
|
|
|
|
|
|
|
||
|
Таблица 7. |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
рН |
|
|
|
kкат, с-1 |
|
|
Km, х103 М |
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
3,98 |
|
|
|
0,29 |
|
|
|
4,07 |
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
4,5 |
|
|
|
|
0,47 |
|
|
|
3,23 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
4,99 |
|
|
|
0,72 |
|
|
|
3,29 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
5,49 |
|
|
|
0,76 |
|
|
|
3,17 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
5,96 |
|
|
|
0,74 |
|
|
|
2,86 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
6,49 |
|
|
|
0,73 |
|
|
|
2,95 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
7,01 |
|
|
|
0,69 |
|
|
|
3,0 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
7,48 |
|
|
|
0,63 |
|
|
|
3,18 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
7,65 |
|
|
|
0,63 |
|
|
|
3,58 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
8,28 |
|
|
|
0,53 |
|
|
|
5,06 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
8,51 |
|
|
|
0,45 |
|
|
|
4,39 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
8,82 |
|
|
|
0,4 |
|
|
|
5,47 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
8,91 |
|
|
|
0,34 |
|
|
|
5,76 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
9,25 |
|
|
|
0,21 |
|
|
|
6,06 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
30
Раздел 5. МЕХАНИЗМ ДЕЙСТВИЯ ФЕРМЕНТОВ
Тема 9. Специфичность и механизм действия ферментов
Современные представления о структуре активного |
центра фермента. |
|||||
Субстрат-связывающий |
и |
каталитический |
сайты. Методы |
идентификации |
||
функциональных групп активного центра. Методы определения концентрации |
||||||
активных центров. |
|
|
|
|
|
|
Специфичность как особое свойство ферментов. Роль групп субстрат- |
||||||
связывающего участка в обеспечении специфичности действия ферментов. |
||||||
Образование |
фермент-субстратного |
комплекса. Факторы, |
определяющие |
|||
эффективность и специфичность ферментативного катализа: эффект сближения,
ориентации, напряжения и др. Концепции стерического соответствия«ключ-
замок», индуцированного соответствия, напряжения и деформации. Стабилизация
переходного |
состояния |
ферментативной |
реакции |
в |
фермент-субстратн |
|||
комплексе. Абзимы. |
|
|
|
|
|
|
|
|
Механизмы связывания субстрата и катализа ферментативной реакции на |
||||||||
примере |
действия |
ферментов |
классов |
гидролазы(сериновые |
протеазы, |
|||
аспартильные протеазы, |
|
лизоцим), |
оксидоредуктазы (алкогольдегидрогеназа, |
|||||
лактатдегидрогеназа), изомеразы. Рибозимы. |
|
|
|
|
||||
Необходимый исходный уровень знаний
1.Структура белков
2.Классификация ферментов
Приобретаемые компетенции (знания, умения и навыки)
1.Современные представления о структуре активного центра фермента.
2. Понятие |
о |
специфичности |
действия |
ферментов |
и , |
фа |
обеспечивающих эффективность и специфичность ферментативного
катализа.
3.Механизм действия отдельных групп ферментов.
