
Пособие для БМ-2013-2 PDF
.pdf
|
1 |
|
n |
|
i |
||
|
|
|
|
|
V |
|
|
|
C |
|
i |
||
|
||
|
|
.
(4.3)
Если в реакции участвуют несколько реагентов, то скорость можно выражать через концентрацию любого из них, так как концентрации ве-
ществ связаны стехиометрическими соотношениями. Для реакций, проте-
кающих в газовой фазе, скорость также определяют через парциальные давления реагентов.
Скорость реакции зависит от природы реагирующих веществ, их концентрации, температуры и наличия катализатора. Зависимость скоро-
сти реакции от концентрации веществ является предметом изучения фор-
мальной кинетики и описывается основным её постулатом – законом дей-
ствующих масс Гульдберга и Вааге: скорость химической реакции в каждый момент времени пропорциональна концентрациям реагирующих веществ, возведенным в некоторые степени.
Так для необратимой реакции:
|
А |
В С продукты |
А |
В |
С |
(4.4)
математическое выражение закона действующих масс запишется как
k С nA C nB С nC , |
(4.5) |
А B С |
|
где k – константа скорости; nA, nB и nC – некоторые числа, которые назы-
вают частными порядками по веществам А, В и С соответственно.
По физическому смыслу величина k представляет собой удельную
скорость реакции, так как k |
при С |
|
C |
|
С |
1. Таким образом, |
|
|
А |
|
B |
С |
|
константа скорости есть скорость химической реакции при концентрациях реагирующих веществ, равных единице.
Частные порядки в общем случае не равны стехиометрическим ко-
эффициентам νА, νВ и νС в уравнении реакции (4.4), они совпадают толь-
ко для простых (одностадийных) реакций. Сумму показателей степеней
81
при концентрациях
рядком реакции |
n |
в кинетическом уравнении (4.5) называют общим по-
n |
A |
n |
n . |
|
B |
C |
Порядок реакции – эмпирическая величина и не отражает механизма реакции. Он может быть нулевым, положительным или отрицательным,
целым или дробным и устанавливается только экспериментально. Размер-
ность константы скорости также определяется порядком реакции.
Большинство химических реакций состоит из нескольких стадий,
называемых элементарными химическими реакциями (элементарными ак-
тами). Под элементарной химической реакцией понимают единичное столкновение и взаимодействие частиц реагентов, сопровождающееся раз-
рывом или образованием химических связей и приводящее к возникнове-
нию новых частиц продуктов реакции или промежуточных соединений.
Число частиц, участвующих в элементарной реакции, называют молеку-
лярностью реакции. По молекулярности различают элементарные реакции только трех типов (табл. 4.1).
|
Таблица 4.1 |
|
|
|
|
Молекулярность реакции |
Примеры реакций |
|
|
|
|
мономолекулярные |
А продукты |
|
|
|
|
бимолекулярные |
2А продукты |
|
А В продукты |
||
|
||
|
|
|
|
А В С продукты |
|
тримолекулярные |
А 2В продукты |
|
|
||
|
3А продукты |
|
|
|
Молекулярность реакции - всегда целое число. Реакции с молеку-
лярностью больше трех в природе не встречаются, поскольку согласно ки-
нетической теории газов вероятность одновременного столкновения более чем трех частиц стремится к нулю. Обычно такие реакции являются слож-
ными и состоят из нескольких элементарных стадий.
82
Для простых (одностадийных) реакций общий порядок равен моле-
кулярности, а частные порядки по веществам равны стехиометрическим коэффициентам в уравнении реакции. Порядок сложной реакции в общем случае никак не связан со стехиометрическими коэффициентами в урав-
нении реакции. Можно назвать три основных причины несовпадения мо-
лекулярности и порядка реакции. Первая причина заключается в сложном механизме реакции. Скорость и порядок сложной реакции, протекающей в несколько стадий, определяются скоростью и порядком самой медленной стадии (принцип лимитирующей стадии).
Второй причиной несовпадения молекулярности и порядка реакции является избыточное содержание одного из исходных веществ. Концен-
трация этого вещества в ходе реакции практически постоянна, и скорость реакции будет зависеть от концентрации только того реагента, который взят в недостатке.
Ассоциация (полимеризация) или диссоциация молекул участвую-
щих в реакции веществ также приводит к различиям между молекулярно-
стью и порядком реакции и является третьей причиной их несовпадения.
4.2 Кинетика необратимых химических реакций целого
порядка. Методы определения порядка реакции
Кинетические уравнения необратимых реакций целого порядка, про-
текающих в закрытых системах при постоянном объеме, можно получить сочетанием уравнений (4.2) и (4.5). Очевидно, что скорости прямой и об-
ратной реакций будут выражаться следующими уравнениями:
|
|
|
|
|
|
|
n |
(4.6) |
|
dC |
|
|
|
|
|||||
|
iисх. |
|
k |
C |
|
i |
|
||
|
|
исх. |
|||||||
|
|
d |
|
|
i |
i |
|
||
|
|
|
V |
|
|
|
|
|
|
83

|
dC |
|
|
|
iпрод. |
||
|
d |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
V |
|
|
n |
|
|
k C |
i |
|
||
|
прод. |
|||
|
i |
i |
|
|
|
|
|
|
|
,
(4.7)
где Сi – текущие концентрации веществ в момент времени τ.
Кинетические уравнения необратимых реакций нулевого, первого,
второго, третьего и n – го порядка и их решения имеют вид, представлен-
ный в таблице 4.2.
Порядок реакции является формальной величиной и не может быть рассчитан теоретически, если не известен механизм реакции. Порядок определяют, используя экспериментальные данные об изменении концен-
трации реагирующих веществ со временем. Методы определения порядка подразделяют на интегральные и дифференциальные в зависимости от то-
го, используются интегральные или дифференциальные кинетические уравнения (табл. 4.2) для обработки опытных данных. К интегральным методам относятся метод подстановки (аналитический и графический),
метод времени полупревращения и метод Оствальда-Нойеса (аналитиче-
ский).
Метод подстановки заключается в том, что экспериментальные данные последовательно подставляют в интегральные кинетические уравнения для реакций целых порядков (от первого до третьего) и рассчитывают констан-
ту скорости (аналитическая подстановка). Если для выбранного порядка рассчитанные значения k постоянны (с учетом разброса эксперименталь-
ных данных), то изучаемая реакция имеет данный порядок. Если же значе-
ния константы скорости монотонно возрастают или убывают, то расчет повторяют для другого порядка.
84

|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Таблица 4.2 |
|||||||
порядок |
|
|
Кинетическое уравнение реакции |
|
|
|
|
|
Текущие концентрации |
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Время |
|
||||
|
дифференци- |
|
интегральная форма |
|
исходного вещества |
|
|
|
|
продукта |
|
полуреакции |
|||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||||
|
альная форма |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
dС |
k |
|
k |
1 |
|
|
|
С |
|
|
|
|
|
|
|
|
|
x k |
|
|
|
|
|
|
|
|
|
С |
0 |
|
|
||
n=0 |
d |
|
|
С |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
1 |
|
|
|
|
|
||||||||||||||
|
|
|
|
|
|
0 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
2 |
|
2k |
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||
|
|
dС |
kС |
|
k |
1 |
|
C |
0 |
|
|
|
|
|
С |
exp k |
|
x С |
1 exp k |
|
|
|
|
|
ln 2 |
|
|||||||||
n=1 |
d |
|
ln |
|
|
|
|
|
С |
|
|
1 |
|
|
|
||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||
|
|
|
|
|
C |
|
|
|
|
|
|
|
0 |
|
|
|
0 |
|
|
|
|
|
|
2 |
|
k |
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
при СА=СВ |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
С |
|
|
С |
2 |
k |
|
|
|
|
|
|
|
|
1 |
|
||||
|
|
|
|
|
k |
1 |
|
1 |
|
1 |
|
|
|
С |
|
|
0 |
|
|
|
|
|
|
1 |
|
k С |
|||||||||
|
|
|
|
|
|
|
|
|
|
x |
|
0 |
|
|
|
|
|
|
|
||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
2 |
|
|||||||||||||
|
|
|
|
|
|
|
|
|
|
|
1 С k |
|
|
|
|
|
|
|
|
|
|||||||||||||||
|
|
dС |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||
|
|
|
|
C |
|
C |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
0 |
|||||||||||
|
|
kС |
2 |
|
|
|
|
|
|
|
|
|
1 С k |
|
|
|
|
|
|
|
|
|
|||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||
|
d |
|
|
|
|
|
|
0 |
|
|
|
|
|
0 |
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
0 |
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
n=2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
при СА ≠ СВ |
|
|
|
|
|
|
|
|
|
С С 0 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
12 |
|
||||||||
|
|
|
|
|
k |
1 |
|
|
|
1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
12 А |
|
|
В |
||||||
|
|
dС |
|
|
|
|
|
ln |
А |
В |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
kС С |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
С |
0 |
С |
0 |
С С |
0 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
d |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||
|
|
|
А |
В |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
А |
|
В |
|
В |
А |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
при СА = СВ = СС |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
1 |
|
|
|
|
|
1 |
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
1 |
1 |
|
1 |
|
|
|
|
С |
2 |
|
|
|
|
|
С |
2 |
|
|
|
|
|
3 |
|
1 |
|||||
n=3 |
|
dС |
|
|
k |
|
|
|
|
|
|
|
|
|
2 |
|
|
|
2 |
1 |
|
|
|
С 2 |
|||||||||||
|
|
|
3 |
|
|
|
|
|
|
|
|
С |
|
|
0 |
|
x С |
|
|
0 |
|
|
|
2 |
|
2k |
|
||||||||
|
d |
kС |
|
|
2 |
C |
2 |
|
C |
2 |
|
|
|
1 |
2 С 2 k |
0 |
|
|
1 2 |
С 2 k |
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
0 |
|
|
|
|
|
|
0 |
|
|
|
|
|
|
0 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
85 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Если ни одно из кинетических уравнений не дает удовлетворитель-
ного результата, то есть порядок реакции не является целым, это означает,
что реакция протекает по более сложному механизму.
Графический вариант метода подстановки заключается в представ-
лении экспериментальных данных в соответствующих координатах с це-
лью получения линейной зависимости текущей концентрации от времени.
Линейные формы кинетических уравнений и соответствующие им графические зависимости представлены на рис. 4.1 (а, б, в).
Если в координатах, соответствующих одному из порядков, получа-
ется линейная зависимость от времени, то изучаемая реакция имеет дан-
ный порядок. Одновременно из тангенса угла наклона прямой в этом слу-
чае можно получить значение константы скорости (рис. 4.1 а, б, в).
Если же все построенные зависимости криволинейны, то реакция протекает по более сложному механизму и имеет дробный порядок.
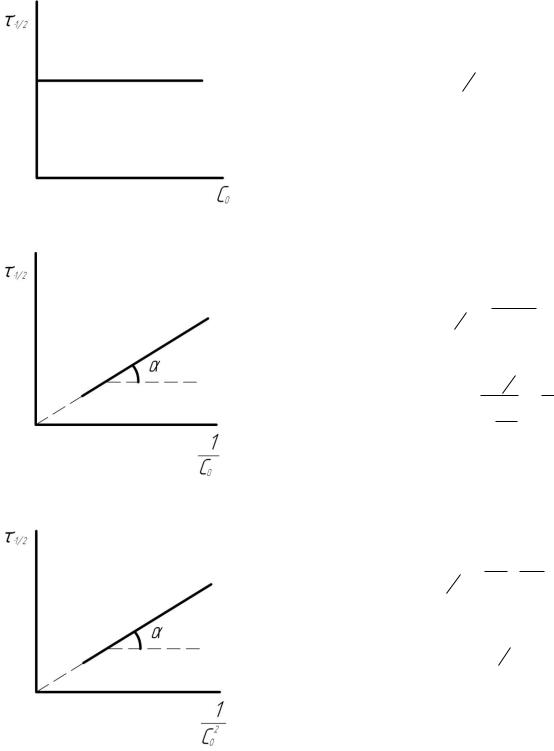
Метод времени полупревращения. Период полупревращения τ1/2 для реакций n-го порядка по-разному зависит от начальной концентрации реа-
гентов (таблица 4.2). Для реакции нулевого порядка τ1/2 прямо пропорцио-
нален начальной концентрации С0, для реакции первого порядка – не зави-
сит от С0, для реакции второго порядка – обратно пропорционален С0, а
для реакции третьего порядка – обратно пропорционален С02. Для опреде-
ления порядка реакции этим методом проводят несколько (не менее трех)
параллельных опытов с различными начальными концентрациями реаги-
рующих веществ, определяют в каждом случае τ1/2 и строят графические зависимости τ1/2 = f(С0) в соответствующих координатах. Линейный харак-
тер зависимости свидетельствует о том, что реакция имеет данный поря-
док, а угловой коэффициент прямой позволяет найти константу скорости реакции (рис. 4.2 а, б, в).
86

ln C |
ln C |
|
k |
||
|
|
0 |
|
|
|
|
|
|
|
||
tg |
ln C |
|
k |
||
|
|
||||
|
|
|
|
|
|
а)
1 |
|
1 |
k |
||
С |
С |
||||
|
|
|
|||
|
|
0 |
|
|
|
|
|
|
|
||
|
ln |
1 |
|
||
|
С |
|
|||
tg |
|
|
k |
||
|
|
|
|||
|
|
|
|
||
б)
1 |
|
1 |
|
2k |
2 |
|
2 |
||
|
|
|
||
С |
|
С |
|
|
|
|
0 |
|
|
|
ln |
1 |
|
|
|
2 |
|
|
|
С |
|
tg |
|
2k |
|
|
|
||
|
|
|
|
в)
Рис.4.1 Линеаризация кинетических уравнений
а) первого порядка, б) второго порядка, в) третьего порядка.
87
Если порядок реакции равен дробной величине, то его можно опре-
делить графически по времени полураспада реакции n-го порядка.
|
1 |
|
|
|
2 |
k
2 |
n 1 |
1 |
|
||
n 1 С n 1 |
||
|
|
0 |
.
(4.8)
Логарифмируя это уравнение, получим уравнение прямой линии:
lg 1 |
lg |
2n 1 1 |
n 1 lg C |
|
|
(4.9) |
k n 1 |
0 |
. |
||||
2 |
|
|
|
|
||
|
|
|
|
|
|
|
По экспериментальным данным о τ1/2 и С0 |
строят график в коорди- |
|||||
натах lgτ1/2 – lg(С0), получают прямую линию, тангенс угла наклона ко-
|
|
|
lg |
1 |
n 1 |
|
|
|
tg |
|
|
||||
торой к оси абсцисс |
|
|
2 |
. Очевидно, что искомый по- |
|||
|
|
|
|
|
|||
|
|
lg C |
|
|
|||
|
|
|
0 |
|
|
||
|
|
|
|
|
|
|
|
рядок определится как |
n tg 1 |
|
|
||||
|
|
|
. |
|
|
||
В методе Оствальда-Нойеса используют зависимость времени пре-
вращения τα от начальной концентрации исходного вещества, где α -
определенная глубина протекания реакции (α = 1/2, 1/3, 1/4 и т. д.), кото-
рая должна быть одинакова для всех параллельных опытов.
Порядок реакции рассчитывают по следующему уравнению:
|
ln |
2 |
|
|
||
n 1 |
( )1 |
. |
(4.10) |
|||
|
|
C1 |
|
|||
|
|
|
|
|||
|
ln |
|
|
|||
|
C2 |
|
|
|||
88
|
|
|
ln 2 |
|
1 |
k |
|||
|
|
|||
|
2 |
|
||
tg 0 |
||||
а)
|
|
|
1 |
|
1 |
k С |
|||
|
|
|||
|
2 |
|
||
|
|
|
0 |
|
|
1 |
|
1 |
||
tg |
|
|
|
|||
|
|
|
2 |
|
||
|
|
|
|
|
|
|
|
|
|
1 |
|
k |
|
|
|
|
|
|
|
|
|
|
С |
0 |
|
|
|
|
|
|
|
|
|
|
б)
|
|
|
3 |
|
1 |
|
1 |
2k |
|
|
|||
|
|
|
|
2 |
||
|
2 |
|
|
С |
||
|
|
|
|
|
|
|
|
|
|
|
|
|
0 |
tg |
12 |
|
|
3 |
|
|
1 |
|
2k |
||
|
|
|
|||
|
С 2 |
|
|
|
|
|
|
0 |
|
|
|
в)
Рис. 4.2 Зависимость времени полураспада от начальной концентрации для реакций а) первого порядка,б) второго порядка, в) третьего порядка.
89
Частным случаем метода Оствальда-Нойеса является метод опреде-
ления порядка реакции по периоду полупревращения:
|
|
|
|
|
|
|
|
n 1 |
|
|
12 2 |
ln |
|
|
|
|
|
|
|
|
|
|
12 1 |
C
ln 1 . (4.11)
C
2
Методы Оствальда-Нойеса и времени полураспада позволяют опре-
делять любые порядки реакций, включая дробные и отрицательные.
К дифференциальным методам определения порядка относятся ме-
тод избытка или изоляции (графический метод Оствальда-Нойеса) и метод Вант-Гоффа.
Если кинетическое уравнение бимолекулярной реакции имеет вид
k С |
n |
A |
|
||
|
|
|
|
А |
|
С |
n |
|
B |
||
|
||
|
В |
,
(4.12)
то для определения частного порядка по одному из веществ используют метод избытка или изоляции. Суть метода состоит в том, что зависимость скорости реакции от начальной концентрации одного из реагентов (напри-
мер, вещества А) изучают при большом избытке второго реагента В. В
этом случае концентрация вещества В остается в течение реакции практи-
чески постоянной, и уравнение (4.12) преобразуется следующим образом:
где
|
* |
|
|
B |
|
k |
|
k С |
|
n |
. |
|
В |
|
|||
|
|
|
|
||
|
|
|
|
|
k |
* |
|
С |
n |
A |
|
||
|
|
|
|
А |
|
,
(4.13)
Логарифмируя уравнение (4.13), получим уравнение прямой линии
lg lg k* n lg С , |
(4.14) |
A А
из тангенса угла наклона которой определяют порядок реакции, а из отсе-
каемого на оси ординат отрезка – константу скорости (рис. 4.3).
90
