
постулаты Бора
.docПланетарная модель атома. Опыты Резерфорда. Постулаты Бора.
Еще в античные времена возникла идея о том, что Вселенная состоит из маленьких неделимых частиц — атомов. Это представление о строении вещества сохранилось до конца XIX столетия, когда к началу XX века достоверно было установлено, что в состав каждого атома входят электроны. Приоритет в открытии электрона принадлежит английскому физику Дж. Томсону. Вместе с тем тогда же было известно, что атом электрически нейтрален. Следовательно, отрицательный заряд электронов должен компенсироваться положительным зарядом неизвестных частиц, входящих в заряд атома.
В 90-х годах XIX века получила широкое распространение модель атома Дж. Томсона в виде однородной, положительной сферической среды, в которой, как изюминки в булке, рассредоточены отрицательно заряженные электроны. Атомная модель Дж. Томсона подобна кексу. Однако вскоре автор «кексовой» модели высказал предположение о нестатическом положении электронов в атоме.
Наиболее реальной представлялась ядерная или планетарная модель атома Э. Резерфорда, предложенная английским физиком в 1911г. Планетарная модель явилась результатом выполненных Э. Резерфордом и его сотрудниками экспериментов по рассеянию α-частиц. Опыты состояли в следующем. Пучок положительно заряженных α-частиц направляется на тонкий, в виде фольги, золотой лист. За фольгой находился экран, покрытый сцинтиллятором — веществом, которое испускает свет в той точке, в которую ударялась α-частица. Исходя из модели Дж. Томсона, следовало ожидать, что α-частицы не будут отклоняться на большие углы, так как электроны гораздо легче α-частиц. И, действительно, опыты показали, что большинство α-частиц свободно проходили сквозь лист фольги, как если бы он представлял собой в основном пустое пространство. И все же часть α-частиц отклонялась на небольшие углы, что являлось, как можно было предположить, следствием взаимодействия с положительным зарядом атома. Но неожиданным и ошеломляющим оказалось то, что небольшое количество α-частиц рассеивалось на большие углы, достигающие 180°. Такое могло происходить только в том случае, если положительно заряженные α-частицы испытали отталкивание массивного положительного заряда, сконцентрированного в малой области пространства.
По модели Э. Резерфорда атом состоит из массивного, положительно заряженного ядра, в котором сосредоточено 99,94 % массы атома. Величина положительного заряда оценивается произведением ze, где z — порядковый атомный номер химического элемента в таблице Д. Менделеева; е — элементарный заряд. Вокруг ядра внутри сферы с наружным диаметром ~10-10 м по замкнутым эллиптическим орбитам вращается z электронов, образуя электронную оболочку атома. Электроны не могут покоиться в атоме, так как в этом случае они упали бы на ядро под действием кулоновского притяжения. По оценкам Э. Резерфорда, размеры ядра должны быть порядка 10-15—10-14 м. Сравнивая размеры ядра и атома, приходим к выводу о том, что электроны должны находиться от ядра на расстоянии в (10—100) • 103 больше, чем размер ядра. И отсюда второй вывод: основную часть атома составляет пустое пространство.
Недостаток модели Э. Резерфорда состоит в невозможности объяснить факт исключительной устойчивости атома: во-первых, при столкновениях с другими атомами; во-вторых, по законам классической физики вращение электронов вокруг ядра не может быть устойчивым, так как оно должно сопровождаться электромагнитным излучением, как всякое ускоренное движение заряженных частиц. А по законам классической физики электроны, двигаясь по окружности, обладают центростремительным ускорением. Центростремительная, сила, удерживающая электрон на орбите радиусом г, представляет кулоновскую силу притяжения электрона к ядру:
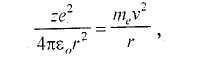
где εо = 8,85 • 10-12 Ф/м — электрическая постоянная; mе — масса электрона, кг; v — скорость электрона на орбите, м/с. На создание электромагнитного поля расходуется энергия. Энергия электрона должна постепенно убывать, а вместе с ней и скорость вращения электрона вокруг ядра. Электрон в конце концов должен упасть на ядро. Однако атомы — достаточно устойчивые образования и могут существовать миллиарды лет. В-третьих, по модели Э. Резерфорда спектр излучения атома должен быть сплошным. Опыты же показали, что спектр излучения конкретного атома является дискретным.
Н. Бор пришел к убеждению в том, что планетарная модель атома в основном верна и что законы классической физики неприменимы к внутриатомным процессам. Усовершенствовав модель Э. Резерфорда, Н. Бор создал квантовую теорию строения атома, в основу которой положены три постулата, названные постулатами Бора.
1-й постулат Бора: электроны в атоме могут вращаться вокруг ядра не по любым, а только по разрешенным орбитам, вполне определенного радиуса, определяемого для атома водорода по формуле
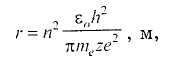
где n — целое положительное число, называемое главным квантовым и обозначающее номер электронной оболочки, n = 1, 2, 3,...; h — постоянная Планка, Дж·с;
2-й постулат Бора: электрон на каждой орбите обладает определенной энергией. Такие орбиты называются стационарными. Движение электронов по стационарным орбитам не сопровождается излучением или поглощением энергии атомом;
![]()
 щением
атомом кванта энергии.
щением
атомом кванта энергии.
где Ев и Ен — энергия электрона соответственно на верхней и нижней стационарных орбитах, Дж. Очевидно, что частота излучаемых или поглощаемых атомом электромагнитных волн зависит не от частоты вращения электрона в атоме, а от разности энергий разрешенных состояний атома
![]()
Постулаты Н. Бора излагаются также общей формулировкой: атом устойчив только в стационарных состояниях, соответствующих дискретным разрешенным значениям энергии E1, Е2, Е3, ... Переход атома из одного устойчивого энергетического состояния в другое сопровождается излучением или поглощением кванта энергии, определяемого условием частот.
23.2. Атом водорода. Дискретность энергетических состояний. Энергетический спектр атомов и молекул
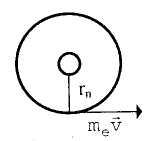
Орбиты или оболочки, которые занимает электрон в атоме, обозначают прописными буквами латинского алфавита, начиная от К, затем L, М, N и т. д. Поэтому электрон, расположенный на ближайшей к ядру оболочке, называют К-электроном. Кроме этого, оболочки нумеруют числами 1, 2, 3... Эти числа, как известно, называют главными квантовыми и обозначают символом n.

![]()
Момент импульса электрона относительно центра ядра атома равен rnwn (рис. 23.1). Момент импульса электрона — дискретная характеристика. Ее величина устанавливается условием квантования Н. Бора
одесь i п —
радиус /г-й разрешенной орбиты, м.
![]()
![]()
Н. Для атома
водорода
![]()



 Из
изложенного вытекает равенство
Из
изложенного вытекает равенство
![]()
Подставив в него значение скорости электрона на п-й орбите из формулы (23.2) v =nh/(2jim/n), получим

Это соотношение позволяет рассчитать любой из радиусов разрешенных орбит в боровской модели атома водорода.
Ближайшей к ядру орбите соответствует главное квантовое число п = 1, и наименьший радиус первой орбиты равен:
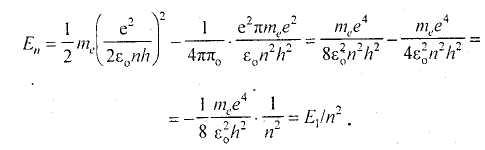
Вычислим величину энергии электрона на самой низкой орбите в атоме водорода
![]()
С учетом полученного значения Et формулу (23.6) можно переписать в виде
![]()
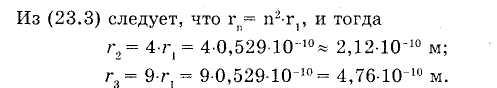
![]()
Знак «минус» присутствует в этой формуле потому, что за ноль потенциальной энергии принята энергия такого состояния атома, когда э'лектрон удален от ядра на бесконечное расстояние, то есть атом ионизирован. Преобразуем выражение для скорости с использованием (23.3)
![]()
![]()
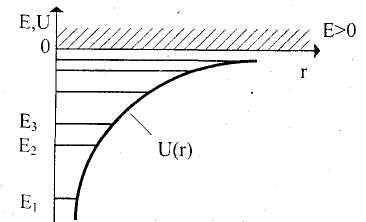
Набор дискретных
отрицательных значений энергии
изображают на схеме энергетических
уровней горизонтальными линиями (рис.
23.3). Этот рисунок может быть дополнен
по

 тенциальной
компонентой U(r)
от полной энергии электрона в атоме,
где г — расстояние между электроном и
ядром. Функция Щг) графически изображена
кривой, неограниченно убывающей при
уменьшении г, то есть при приближении
электрона к ядру и наоборот. Еще раз
обратим внимание на то, что величины
гп,
v
и Еп
квантуются, то есть они могут принимать
только дискретные разрешенные значения.
Электрон не может долго находиться в
возбужденном 'СОСТОЯНИИ. Он стремится
вернуться в свое основное состояние,
соответствующее минимальному значению
энергии атома. При возвращении на
прежнюю орбиту электрон испускает тот
же квант энергии — фотон в виде
электромагнитного излучения. Подобные
переходы в атоме могут происходить и
между другими орбитами. Получается
серия частот — линейчатый спектр
излучения или поглощения. Атом любого
из химических элементов имеет свой,
строго определенный спектр частот.
Чем сложнее атом химического элемента,
тем сложнее его спектр. Этими переходами
и обусловлены спектры испускания
газов.
тенциальной
компонентой U(r)
от полной энергии электрона в атоме,
где г — расстояние между электроном и
ядром. Функция Щг) графически изображена
кривой, неограниченно убывающей при
уменьшении г, то есть при приближении
электрона к ядру и наоборот. Еще раз
обратим внимание на то, что величины
гп,
v
и Еп
квантуются, то есть они могут принимать
только дискретные разрешенные значения.
Электрон не может долго находиться в
возбужденном 'СОСТОЯНИИ. Он стремится
вернуться в свое основное состояние,
соответствующее минимальному значению
энергии атома. При возвращении на
прежнюю орбиту электрон испускает тот
же квант энергии — фотон в виде
электромагнитного излучения. Подобные
переходы в атоме могут происходить и
между другими орбитами. Получается
серия частот — линейчатый спектр
излучения или поглощения. Атом любого
из химических элементов имеет свой,
строго определенный спектр частот.
Чем сложнее атом химического элемента,
тем сложнее его спектр. Этими переходами
и обусловлены спектры испускания
газов.
Знание значений
энергии Еп
и Ет
позволяет рассчитать частоту (длину
волны) излучения атома в данном случае,
при переходе электрона с орбиты п на
орбиту т:
(23.6)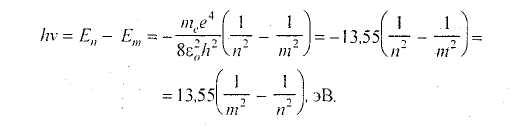
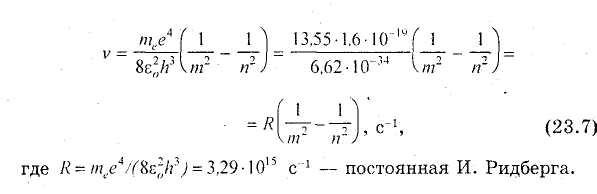 ормулу
(23.7) называют обобщенной формулой И.
Бальмера. С помощью этой формулы было
дано объяснение ранее открытым
эмпирическим спектральным линиям серии
Т\ Лай-мана (ультрафиолетовая часть
спектра), которые соответствуют
излучению водорода при переходе электрона
со 2-й, 3-й, 4-й и других более удаленных
орбит на первую (т = 1, п = 2, 3, 4,...); линиям
серии И. Бальмера (видимый свет), которые
соответствуют излучению при переходе
электрона с 3-й, 4-й, 5-й и других более
удаленных орбит на вторую (т = 2, п = 3, 4,
5,...); линиям серии Пашена (инфракрасная
часть спектра), которые соответствуют
излучению при переходе электрона с
4-й,.5-й, б-й и других более удаленных орбит
на третью (т = 3, п = 4, 5, 6,...), а также
спектральным линиям последующих серий:
Брэкета (т = 4, п = 5, 6,. 7,...), Пфунда (т = 5, п
= 6, 7, 8,...), Хемфри (т = 6, п = 7, 8, 9,...).
ормулу
(23.7) называют обобщенной формулой И.
Бальмера. С помощью этой формулы было
дано объяснение ранее открытым
эмпирическим спектральным линиям серии
Т\ Лай-мана (ультрафиолетовая часть
спектра), которые соответствуют
излучению водорода при переходе электрона
со 2-й, 3-й, 4-й и других более удаленных
орбит на первую (т = 1, п = 2, 3, 4,...); линиям
серии И. Бальмера (видимый свет), которые
соответствуют излучению при переходе
электрона с 3-й, 4-й, 5-й и других более
удаленных орбит на вторую (т = 2, п = 3, 4,
5,...); линиям серии Пашена (инфракрасная
часть спектра), которые соответствуют
излучению при переходе электрона с
4-й,.5-й, б-й и других более удаленных орбит
на третью (т = 3, п = 4, 5, 6,...), а также
спектральным линиям последующих серий:
Брэкета (т = 4, п = 5, 6,. 7,...), Пфунда (т = 5, п
= 6, 7, 8,...), Хемфри (т = 6, п = 7, 8, 9,...).
