
сборник ДСТ_3 выпуск_2013
.pdf
 Раздел 4
Раздел 4  СЕРДЕЧНО-СОСУДИСТАЯ СИСТЕМА
СЕРДЕЧНО-СОСУДИСТАЯ СИСТЕМА
Рис. 2. Моноцитарная ауторозетка без лизиса эритроцитов. Окраска по Романовскому-Гимзе. Ув. х 100 (микрофото).
Результаты и обсуждение: у лиц с ПМК на фоне ДСТ выявлено увеличение количества ауторозеток (особенно с экзоцитарным лизисом эритроцитов) в периферической крови по сравнению со здоровыми людьми (33,7±15,3 на 100 лейкоцитов против 0,75±0,7 на 100 лейкоцитов; р<0,05). Причем, ауторозетки в количестве от 10 до 20 на 100 клеток обнаружены лишь у 14,5% обследованных, а у 85,5% больных с ДСТ зарегистрировано 20 ауторозеток и более, с заметным преобладанием (79,6%) нейтрофильных ауторозеток, большинство которых представляют нейтрофильные ауторозетки (НАР) с экзоцитарным лизисом.
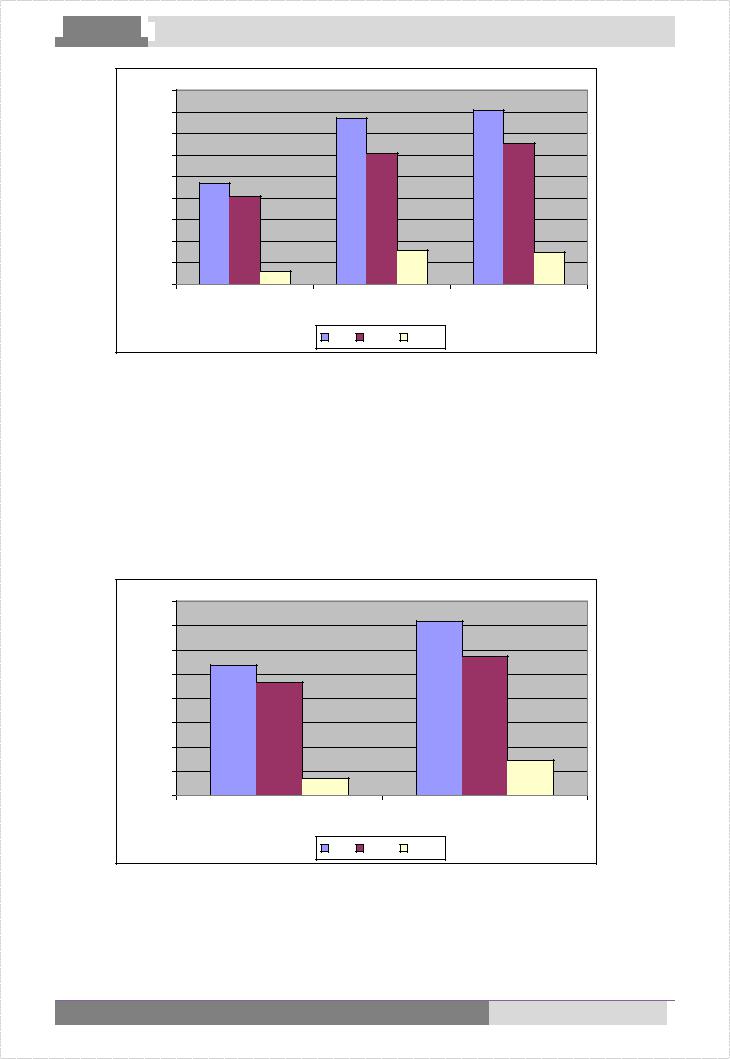
Лица с ПМК были разделены на три группы в зависимости от степени пролабирования митрального клапана: 1-ю группу составили больные с I степенью ПМК, 2-ю – больные со II степенью ПМК, 3-ю – больные с III степенью пролабирования створок митрального клапана. В каждой группе проводился подсчет РОК на 100 лейкоцитов. Оказалось, что с увеличением степени пролабирования митральных створок увеличивается количество ауторозеток в периферической крови. Причем, среднее количество РОК у больных с ПМК II степени (2-я группа) превышает таковое у больных с ПМК I степени (1-я группа) в 1,6 раза, а у больных с ПМК III степени (3-я группа) ауторозеток больше, чем у лиц 2-й группы на 3%. Полученные данные отображены на рис. 3.
Синдром ДСТ предполагает наличие у больных, кроме ПМК, других проявления нарушения соединительнотканных структур сердца. Исследователями получены данные, указывающие на взаимосвязь ПМК с другими малыми аномалиями сердца (МАС), такими как пролапс трикуспиального клапана (ПТК), пролабирование клапанов аорты и легочного ствола, дилатация правого атриовентрикулярного отверстия, ствола легочной артерии и синусов Вальсальвы, неправильное распределение хорд передней митральной створки [3].
211
 Раздел 4
Раздел 4  СЕРДЕЧНО-СОСУДИСТАЯ СИСТЕМА
СЕРДЕЧНО-СОСУДИСТАЯ СИСТЕМА
число РОК
45 |
|
|
|
40 |
|
|
|
35 |
|
|
|
30 |
|
|
|
25 |
|
|
|
20 |
|
|
|
15 |
|
|
|
10 |
|
|
|
5 |
|
|
|
0 |
|
|
|
ПМК 1 ст. |
ПМК 2 ст. |
ПМК 3 ст. |
|
АР |
НАР |
МАР |
|
Рис. 3. Активность процесса АРО у больных с различной степенью ПМК (I – III).
В связи с этим представляет интерес определение интенсивности АРО у больных с ПМК (1-я группа) и у больных с ПМК в сочетании с другими МАС, в том числе с ПТК, открытым овальным окном, аномально расположенными хордами левого желудочка (2-я группа). Установлено, что у пациентов 2-й группы среднее количество РОК на 100 лейкоцитов достоверно выше (35,19±15,6), чем у лиц 1-й группы (26,9±8,5), при р<0,05 (рис. 4).
число РОК
40 |
|
|
35 |
|
|
30 |
|
|
25 |
|
|
20 |
|
|
15 |
|
|
10 |
|
|
5 |
|
|
0 |
|
|
ПМК |
|
ПМК и МАС |
АР |
НАР |
МАР |
Рис. 4. Выраженность процесса эндогенного АРО у больных с ПМК и у больных с ПМК в сочетании с другими МАС.
Заключение: в результате проведенного исследования обнаружено, что у лиц с ДСТ интенсивность эндогенного ауторозеткообразования значительно пре-
212

 Раздел 4
Раздел 4  СЕРДЕЧНО-СОСУДИСТАЯ СИСТЕМА
СЕРДЕЧНО-СОСУДИСТАЯ СИСТЕМА
вышает нормальные значения (р<0,05). При этом среди общего количества ауторозеткообразующих лейкоцитов преобладают нейтрофильные ауторозетки с экзоцитарным лизисом, свидетельствуя о высокой активности процесса. Кроме того, выявлена зависимость интенсивности эндогенного АРО от степени пролабирования створок митрального клапана и от сочетания ПМК с другими МАС, что, в свою очередь, отражает выраженность соединительнотканной дисплазии. На основании полученных результатов предполагается, что феномен ауторозеткообразования можно рассматривать в качестве дополнительного неспецифического признака дисплазии соединительной ткани.
Список литературы
1.Наследственные нарушения соединительной ткани. Российские рекомендации // Дисплазия соединительной ткани. – 2009. – №2. – С. 18–20.
2.Аникин В.В. Нарушения сердечного ритма при синдроме пролабирования митрального клапана // Кардиология. – 1989. – №7. – С. 106–108.
3.Гнусаев С.Ф., Белозеров Ю.М., Виноградов А.Ф. Клиническое значение малых аномалий сердца // Медицинский вестник Северного Кавказа. – 2008. – №2. – С. 39–43.
4.Баркаган З.С., Суханова Г.А. Геморрагические мезенхимальные дисплазии: новая классификация нарушений гемостаза // Тромбоз, гемостаз и реология. – 2004. – №1. – С. 14–16.
5.Бельченко Д.И., Есипова А.В., Кривошеина Е.Л. Патогенетическое значение интенсификации образования ауторозеток и тромбоцитарных агрегатов в циркулирующей крови // Успехи современного естествознания. – 2006. – №1. – С. 13–17.
6.Бельченко Д.И., Кривошеина Е.Л.Влияние полихимиотерапии различной интенсивности на состав и характер костно-мозговых эритроклазических кластеров и ауторозеткообразование в периферической крови при остром лимфобластном лейкозе // Педиатрия. – 2001. – №2. – С. 22–25.
7.Волкова, О.В., Бельченко Д.И. Эндогенное ауторозеткообразование в периферической крови при экспериментальных острых постгеморрагической и гемолитической анемии // Патологическая физиология экспериментальной терапии. – 1994. – №2. – С. 10–12.
8.Герасимова, О.Н. Клинико-функциональная характеристика сердечнососудистой системы, ее вегетативной регуляции, особенности гемостаза и межклеточных взаимодействий у детей с иммунокомплексными заболеваниями: автореф. дис. … канд.мед.наук. – Тверь, 2011. – 26 с.
9.Коричкина Л.Н. Эндогенное ауторозеткообразование в периферической крови и его клиническое значение при заболеваниях сердечно-сосудистой системы: автореф. дис. … д-ра мед. наук. – Тверь, 2010. – 41 с.
213

 Раздел 4
Раздел 4  СЕРДЕЧНО-СОСУДИСТАЯ СИСТЕМА
СЕРДЕЧНО-СОСУДИСТАЯ СИСТЕМА
10. Шубич М.Г., Авдеева М.Г., Мойсова Д.Л. Взаимосвязь цитохимической активности лейкоцитов с феноменом ауторозеткообразования и его клиническое значение у больных лептоспирозом // Клиническая лабораторная диагностика. – 1997. – №1. – С. 13–14.
А.В. Чурилина, О.Н. Москалюк, Л.Ф. Чалая
ФЕНОТИПИЧЕСКИЕ ПРОЯВЛЕНИЯ ДИСПЛАСТИКОЗАВИСИМОГО ТОРАКОДИАФРАГМАЛЬНОГО СИНДРОМА У ДЕТЕЙ Донецкий национальный медицинский университет им.М.Горького, Донецк
Резюме: изложены результаты клинического и инструментального обследования 126 детей с недифференцированной дисплазией соединительной ткани, имеющих пролапс митрального клапана. Выявлены фенотипические особенности торакодиафрагмального синдрома дисплазии соединительной ткани у детей с пролапсом митрального клапана.
Ключевые слова: дети, недифференцированная дисплазия соединительной ткани, торакодиафрагмальный синдром.
Введение: деформации позвоночника и грудной клетки – одни из наиболее частых диспластикозависимых изменений у пациентов с недифференцированной дисплазией соединительной ткани (НДСТ). У детей с НДДСТ сколиоз выявляется в 27,3-67,9% [1, 2, 3], деформации грудной клетки – в 46,3-49,4% случаев [2]. У детей с пролапсом митрального клапана (ПМК) изменения скелета обнаруживаются еще чаще: деформации позвоночника у 66,5%, грудной клетки – 62,8% [4]. Нечаева Г.И. предложила выделять торакодиафрагмальный синдром (ТДС) дисплазии соединительной ткани (ДСТ), который включает астеническую форму грудной клетки, деформации грудной клетки и позвоночника, изменение высоты стояния и экскурсии диафрагмы. Проявления ТДС уменьшают объем грудной клетки, нарушают нормальные взаимоотношения между сердцем и грудной клеткой, оказывают механическое воздействие на внутригрудные органы [5].
Цель: изучить фенотипические проявления торакодиафрагмального синдрома у детей с недифференцированной дисплазией соединительной ткани, имеющих пролапс митрального клапана.
Материалы и методы: на базе кардиоревматологического отделения городской детской клинической больницы № 1 г.Донецка было обследовано 126 детей с НДСТ и ПМК в возрасте 7-17 лет. Девочек было 59/126 (46,8±4,5%),
214

 Раздел 4
Раздел 4  СЕРДЕЧНО-СОСУДИСТАЯ СИСТЕМА
СЕРДЕЧНО-СОСУДИСТАЯ СИСТЕМА
мальчиков – 67/126 (53,2±4,5%). Диагноз ДСТ устанавливался на основании критериев Кадуриной Т.И. [6], ПМК – Фремингемского исследования (1986).
Результаты и их обсуждение: основные жалобы у детей с НДСТ были связанны с дисфункцией вегетативной нервной системы – у 90/126 (71,4±4,0%): кардиалгии, повышенная утомляемость, головные боли, головокружение. Боли в животе наблюдались у 45/126 (35,7±4,3%) пациентов. Жалобы, обусловленные изменениями костно-суставного аппарата (артралгии, боли в позвоночнике), имели место в 26/126 (20,6±3,6%) случаях.
Так как по условиям выборки все дети имели НДСТ, то количество внешних фенотипических признаков ДСТ у них было 5 и более [7]. Критический уровень стигматизации имели только 45/126 (35,7±4,3%) детей; у остальных 81/126 (64,3±4,3%) в среднем было 7-8 внешних фенотипических проявлений ДСТ. Наиболее частыми внешними фенотипическими проявлениями ДСТ у детей с НДСТ были астеническое телосложение – у 85/126 (67,5±4,2%), сколиоз – 82/126 (65,1 ± 4,3%), деформация грудной клетки – 64/126 (50,8 ± 4,5%), плоскостопие –
63/126 (50,0 ± 4,5%), гипермобильность суставов – 62/126 (49,2 ± 4,5%).
ТДС был выявлен у 85/126 (67,5 ± 4,2%) больных. Основными внешними фенотипическими проявлениями ТДС были: деформация позвоночника – у 82/85 (96,5±2,0%) пациентов, деформация грудной клетки – 64/85 (75,3±7,1%), астеническая форма грудной клетки – 29/85 (34,1±5,1%). Деформация позвоночника проявлялась в форме сколиоза, который у 17/85 (20,0±4,3%) детей сочетался с кифозом. У 76/85 (89,4±3,3%) больных имел место сколиоз I степени, у 6/85 (7,1±2,7%) – II. Признаки сколиоза определялись уже при внешнем осмотре: асимметричное положение плечей и лопаток, отклонение остистых отростков позвонков, асимметрия треугольников талии. Деформация грудной клетки имела место у 64/85 (75,3±7,1%) детей, в том числе воронкообразная – у 42/85 (49,4±5,4%) обследованных, килевидная – у 16/85 (18,8±4,2%), у остальных вид деформации (передний реберный горб) определялся сопутствующим сколиозом. Воронкообразная деформация грудной клетки во всех случаях была I степени, то есть не превышала 2 см. Астеническая форма грудной клетки имела свои особенности: она была удлиненной, узкой (значение периметра грудной клетки ниже 25-го центиля), с острым эпигастральным углом.
При рентгенологическом обследовании позвоночника у детей с ТДС выявлена следующая патология: искривление позвоночного столба – у 82/85 (96,5±2,0%), ротация тел позвонков – 82/85 (96,5±2,0%), торсия тел позвонков 6/85 (7,1±2,8%), спондилолистез – 27/85 (31,8±5,1%), деформирующий спондилоартроз – 6/85 (7,1±2,8%), юношеский остеохондороз – 9/85 (10,6±3,3%), аномалии дуг позвонков – 4/85 (4,7±2,3%), грыжи Шморля – 6/85 (7,1±2,8%). Морфофункциональные особенности шейного отдела позвоночника у 25/85
215

 Раздел 4
Раздел 4  СЕРДЕЧНО-СОСУДИСТАЯ СИСТЕМА
СЕРДЕЧНО-СОСУДИСТАЯ СИСТЕМА
(29,4±4,9%) пациентов сопровождались недостаточностью вертебробазилярной артериальной системы.
При рентгенологическом обследовании органов грудной клетки у 29/85 (34,1±5,1%) детей с ТДС выявлено «капельное» сердце с уменьшением поперечных размеров (кардиоторакальный индекс менее 40,0%). Указанные изменения характерны для истинного малого сердца, которое является результатом дезорганизации роста тканевых структур миокарда, обусловленных соединительнотканной дисплазией [8]. Диспластическое малое сердце наблюдалось у пациентов с типичным астеническим телосложением (высоким ростом, низкой массой тела, сниженным массо-ростовым коэффициентом, узкой удлиненной грудной клеткой).
Выводы: наиболее часто встречаемыми внешними проявлениями ДСТ у детей с НДСТ и ПМК являлись морфофункциональные изменения опорнодвигательного аппарата, при этом торакодиафрагмальный синдром имел место в
67,5±4,2% случаев.
Внешними фенотипическими особенностями ТДС были: сколиоз, деформации грудной клетки (воронкообразная, килевидная, сколиотическая), астеническая форма грудной клетки.
У пациентов с астенической формой грудной клетки при рентгенологическом исследовании выявлялось диспластическое малое сердце.
Таким образом, оценка комплекса внешних фенотипических проявлений ДСТ дает возможность заподозрить соединительнотканную дисплазию сердца уже на стадии клинического обследования больного. Особого внимания требуют дети с ПМК, имеющие деформации позвоночника и/или грудной клетки, так как последние могут влиять на выраженность морфофункциональных изменений сердца.
Список литературы
1.Викторова И. А. Клинические признаки и особенности вегетативного статуса у детей и подростков с дисплазией соединительной ткани / И. А. Викторова, Д. С. Киселева, И. Г. Калицкая // Вопр. современной педиатрии. –
2008. – Т. 7, № 5. – С. 27 – 33.
2.Ткаченко Ю. П. Возрастная динамика клинических проявлений синдрома недифференцированной дисплазии соединительной ткани / Ю. П. Ткаченко, Е. И. Подлианова // Врачебная практика. – 2003. – № 2. – С. 95 – 101.
3.Евтушенко С. К. Дисплазия соединительной ткани в неврологии и педиатрии (клиника, диагностика, лечение) / Евтушенко С. К., Лисовский Е. В., Евтушенко О. С. – Донецк : Издатель Заславский А. Ю., 2009. – 372 с.
216

 Раздел 4
Раздел 4  СЕРДЕЧНО-СОСУДИСТАЯ СИСТЕМА
СЕРДЕЧНО-СОСУДИСТАЯ СИСТЕМА
4.Чуриліна А. В. Пролапс мітрального клапана у дітей : механізми розвитку та підходи до реабілітації : автореф. дис. на здобуття наук. ступеня доктора мед. наук : спец. 14.01.10 «Педіатрія» / Чуриліна А. В. – К., 2004. – 30 с.
5.Нечаева Г. И. Дисплазия соединительной ткани: основные клинические синдромы, формулировка диагноза, лечение / Г. И. Нечаева, В. М. Яковлев, В. П. Конев // Лечащий врач. – 2008. – № 2. – С. 22-28.
6.Кадурина Т. И. Дисплазия соединительной ткани (руководство для врачей) / Кадурина Т. И. – СПб.: Элби-СПб, 2009. – 704 с.
7.Дорофеева Г. Д. Недифференцированные синдромы дисплазии соединительной ткани и внутренняя патология / Дорофеева Г. Д., Чурилина А. В., Дорофеев А. Э. –Донецк : ООО «Лебедь», 1998. – 144 с.
8.Классификация и клиническая характеристика основных синдромов при дисплазиях соединительной ткани / Г. И. Нечаева, В. М. Яковлев, В. П. Конев [и др.] // Кадуриной Т. И. Дисплазия соединительной ткани : руководство для врачей / Т. И. Кадуриной, В. Н. Горбуновой. – СПб. : СПб. - ЭЛБИ, 2009. – С. 523 – 561.
М.Ю. Галактионова
ПОЛИМОРФИЗМ ПРОЯВЛЕНИЙ СИНДРОМА ДИСПЛАЗИИ СОЕДИНИТЕЛЬНОЙ ТКАНИ СЕРДЦА У ДЕТЕЙ:
ТАКТИКА ВРАЧА ПЕДИАТРА ГБОУ КрасГМУ им. проф. В.Ф. Войно-Ясенецкого, Красноярск
Проблема дисплазии соединительной ткани (ДСТ) является одной из актуальных и вместе с тем спорных и недостаточно изученных проблем педиатрии и терапии. Дисплазия соединительной ткани представляет наследственные нарушения соединительной ткани мультифакторной природы, объединенные в синдромы и фенотипы на основе общности внешних и/или висцеральных признаков и характеризующиеся многообразием клинических проявлений от доброкачественных субклинических форм до полиорганной и полисистемной патологии с прогредиентным течением [1, 2].
В последние десятилетия увеличивается число детей с недифференцированной дисплазией соединительной ткани (НДСТ), что связывают не только с неблагоприятными воздействиями на плод в фетальном периоде развития, но и экологическим неблагополучием, инфекционными заболеваниями, неадекватным питанием, витаминной и минеральной недостаточностью, стрессами [3, 4, 5, 6].
217

 Раздел 4
Раздел 4  СЕРДЕЧНО-СОСУДИСТАЯ СИСТЕМА
СЕРДЕЧНО-СОСУДИСТАЯ СИСТЕМА
Классификация дисплазии соединительной ткани подразумевает выделение конкретных синдромов (астенический, вертеброгенный, клапанный, сосудистый, торакодиафрагмальный, мышечный, бронхолегочный, аритмичный, суставной, висцеральный, геморрагический, синдромы патологии зрения и стопы, неврологических нарушений, малых аномалий сердца и др.), каждый из которых включает ряд симптомов [7, 8].
Пациенты, имеющие те или иные признаки НСДТ, с многочисленными и разнообразными жалобами, нередко встречаются в практике врача педиатра. Практический врач нередко затрудняется объединить множество симптомов воедино и увидеть за частной симптоматикой системную патологию, обусловленную ДСТ, в связи с чем тактика по ведению детей с этой патологией не всегда адекватна.
Целью нашей работы явилось изучение выраженности внешних и внутренних маркеров недифференцированной дисплазии соединительной ткани у детей, часто болеющих острыми респираторными заболеваниями и особенностей анамнеза.
Материал и методы: нами наблюдались 158 детей (90 мальчиков и 68 девочек) в возрасте от 4-х до 11-ти лет, наблюдающиеся в детских поликлиниках Городской детской больницы №8 г. Красноярска. Основную группу составили 108 детей с различными проявлениями недифференцированной соединительнотканной дисплазией. Критериями включения в данную группу служили наличие клинико-морфологических признаков НДСТ (нарушение физического развития, скелетные аномалии, признаки поражения кожи и ее придатков, органа зрения, мышечной и сердечно-сосудистой систем), частые обращения за медицинской помощью, в том числе по поводу острых респираторных заболеваний 5 и более раз в год и добровольное информированное согласие на участие в исследовании. Контрольная группа включала 50 детей без признаков НДСТ, аналогичного возраста, I-II групп здоровья; частота заболеваний ОРЗ составила до 3-х раз в год.
Всем детям было проведено комплексное клиникоинструментальное обследование, включающее определение фенотипических особенностей с использованием модифицированной фенотипической карты M.J. Glesby, проведение эхокардиографии в одном- и двухмерном режимах, ЭКГ покоя в 12 общепринятых отведениях с оценкой по стандартным критериям, суточное мониторирование ЭКГ, исследование вариабельности ритма сердца.
Статистическую обработку полученных данных проводили после создания компьютерных баз данных с помощью программы Microsoft Office Excel 2007. Для проведения статистического анализа данных использовали пакет программ Biostat 4.0 и Microsoft Office Excel 2007.
Результаты и обсуждение: при анализе анамнестических данных у 71,3% матерей пациентов основной группы регистрировались ранние и поздние
218

 Раздел 4
Раздел 4  СЕРДЕЧНО-СОСУДИСТАЯ СИСТЕМА
СЕРДЕЧНО-СОСУДИСТАЯ СИСТЕМА
гестозы (p<0,05), нефропатия беременных имела место у 29,6% (р<0,05). В анамнезе у матерей, дети которых имели НДСТ, также достоверно чаще в сравнении с контролем наблюдались хронические очаги инфекции (у 12,1%), ОРВИ во время беременности (у 56,9%), рождение недоношенных детей (у 9,3%). Хроническая внутриутробная гипоксия плода наблюдалась у 27,7% детей с НДСТ.
Изучение анамнестических данных выявило наличие фенотипических признаков ДСТ в семьях большинства детей основной группы. Отягощенность по сердечно-сосудистым заболеваниям, болезням пищеварительного тракта регистрировалась в 2,5 раза чаще в основной группе. Среди факторов риска развития СДСТ, кроме наследственной отягощенности, у пациентов основной группы достоверно чаще имели место неблагополучие перинатального периода (80,6%, p<0,05); патологические состояния в раннем возрасте (перинатальные поражения ЦНС, нарушения психомоторного развития, соматические и инфекционные заболевания) (57,1%, p<0,05); наличие хронических очагов инфекции. Из социаль- но-гигиенических факторов необходимо отметить достоверную частоту встречаемости указаний на неблагоприятные условия проживания (32,3%, р<0,05); психоэмоциональный дискомфорт в семье и в школе(27,7%, р<0,05); переутомление в школе (длительная неудобная поза, умственное перенапряжение) (29,6%, р<0,05). В таблице 1 представлена характеристика фенотипических маркеров НДСТ у родственников 1-2 степени родства.
Таблица 1
Характеристика клинических маркеров НДСТ у родственников детей обследованных групп (%)
Факторы риска ДСТ |
Основная |
Контрольная |
р |
|
группа |
группа |
|
|
n=108 |
n=50 |
|
Астенический тип конституции |
47,2 |
28,0 |
<0,02 |
Нарушение осанки, сколиоз, плоскостопие |
57,1 |
22,0 |
<0,02 |
Челюстно-лицевые дизморфии |
71,3 |
28,0 |
<0,01 |
Заболевания сердечно-сосудистой систе- |
64,3 |
22,0 |
<0,02 |
мы, из них: |
|
|
|
МАРС |
30,4 |
12,0 |
<0,01 |
НЦД, СВД |
40,2 |
18,0 |
<0,01 |
Заболевания пищеварительной системы |
42,4 |
16,0 |
<0,03 |
Болезни почек и мочевыводящих путей, в |
14,8 |
6,0 |
<0,05 |
том числе: |
|
|
|
нефроптоз |
4,1 |
- |
|
Геморрагический синдром (носовые крово- |
15,3 |
4,0 |
<0,05 |
течения, кровоточивость десен) |
|
|
|
Миопия, астигматизм |
29,6 |
12,0 |
<0,05 |
Частые респираторные заболевания (более |
32,3 |
- |
|
5 раз в год) |
|
|
|
219

 Раздел 4
Раздел 4  СЕРДЕЧНО-СОСУДИСТАЯ СИСТЕМА
СЕРДЕЧНО-СОСУДИСТАЯ СИСТЕМА
Дети основной группы предъявляли многообразные жалобы при обращении за медицинской помощью и имели более одного из десяти больших критериев (костно-скелетные, суставные, кожно-мышечные) и несколько малых аномалий развития.
В клинике пациентов с недифференцированной соединительной дисплазией отмечено существенное превышение частоты кардиалгий (в 3,25 раз) (табл. 2). Боли в области сердца характеризовались как «колющие», «ноющие» и ощущались в левой половине грудной клетки без какой-либо иррадиации. Как правило, боли в сердце продолжались в течение 5-20 мин, возникали обычно при беге, быстром подъеме по лестнице, в связи с эмоциональным напряжением и сопровождались вегетативными нарушениями: похолоданием конечностей, сердцебиением, потливостью, тревожностью. Жалобы на перебои в работе сердца и сердцебиение предъявляли 43,5% пациентов с ДСТ, из них у 29,6% инструментально подтверждены нарушения ритма сердца и проводимости. Предобморочные и обморочные состояния наблюдались только у пациентов с синдромом дисплазии соединительной ткани (12,1%), чаще при пролапсе митрального клапана с регургитацией, и были обусловлены ортостатическим снижением артериального давления.
Таблица 2
Характеристика жалоб детей обследованных групп при обращении за медицинской помощью (%)
Жалобы |
Основная |
Контрольная |
р |
|
группа |
группа |
|
|
n=108 |
n=50 |
|
Кардиалгии |
27,7 |
8,0 |
<0,05 |
Перебои в сердце, сердцебиения |
16,7 |
4,0 |
<0,05 |
Головные боли |
43,5 |
14,0 |
<0,05 |
Головокружения |
19,4 |
6,0 |
<0,05 |
Нарушение терморегуляции |
14,8 |
4,0 |
<0,05 |
Обмороки |
12,1 |
- |
|
Боли в животе |
40,7 |
12,0 |
<0,03 |
Снижение работоспособности |
37,9 |
10,0 |
<0,05 |
Эмоциональная лабильность |
47,2 |
18,0 |
<0,05 |
В основной группе детей существенно чаще, чем у детей контрольной группы, отмечались метеозависимые цефалгии, головокружения, снижение работоспособности, нарушения процессов засыпания. Жалобы на периодические боли в животе предъявляли 40,7% детей основной группы, у 2/3 из них подтверждены дискинезии желчного пузыря и желчевыводящих путей.
Среди признаков соединительнотканной дисплазии у детей основной группы часто встречались челюстно-лицевые дизморфии (диспластические ушные раковины – у 71,3%, готическое небо – у 29,6%, голубые склеры- 8,3%, нарушения прикуса - у 14,8%) и патология опорно-двигательного аппарата (сколи-
220
