
МЕДИЦИНСКАЯ ХИМИЯ
.pdf
91
(частичный агонист).
H2N |
|
|
|
|
|
|
|
|
|
O |
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
||
|
|
|
|
HO |
||||||
CАСА (цис-аминокротоновая кислота) |
||||||||||
Антагонисты ГАМКС рецепторов: пикротоксинин, ТМРА, ТНIР, изогувацин. |
||||||||||
|
|
|
|
|
|
CH3 |
||||
|
|
|
|
|
|
|||||
HN |
|
|
|
|
|
P |
|
O |
||
|
|
|
|
|
|
|||||
|
|
|
|
|
||||||
|
|
|
|
|
|
|||||
OH
TMPA
Различают также ГАМК Р, имеющие высокое и низкое сродство к ГАМК. В мозге существует по крайней мере 2 типа связывания 3Н-ГАМК с константами диссоциации лиганд-рецепторного комплекса 9 и 218 нМ.
Максимальная плотность высокоаффинных ГАМК Р – в мозжечке, минимальная – в спинном мозге.
Высокоаффинные места связывания 3Н-ГАМК, по-видимому, локализованы на постсинаптических мембранах.
На основании анализа отношений 3Н-бикукуллина и ГАМК Мёллер и Окада пришли к выводу о существовании 2-х конформаций ГАМК рецепторов, ответственных за связывание агонистов и антагонистов, соответственно.
Наиболее изучены ГАМКА Р.
10.2. Структура ГАМКА рецепторов.
Места связывания ГАМК и 1,4-бенздиазепинов находятся на субъединицах рецептор- но-ионофорного ансамбля - ГАМКА рецепторного канала, часто именуемого просто ГАМКА рецептором. Последний является лиганд-управляемым анионным каналом, принадлежащим к классу ионотропных рецепторов.
ГАМКА рецептор представляет собой гетеропентамерный ансамбль, пронизывающий биологическую мембрану и образующий анионный (для ионов Cl- и НСО3-) канал. В его состав входят α-, β-, γ-, δ- и ε-типы субъединиц. α-, β- и γ-Типы в свою очередь, могут быть представлены несколькими вариантами (изоформами). Общее число вариантов субъединиц, входящих в ГАМКА рецептор, вероятно, доходит до 20.
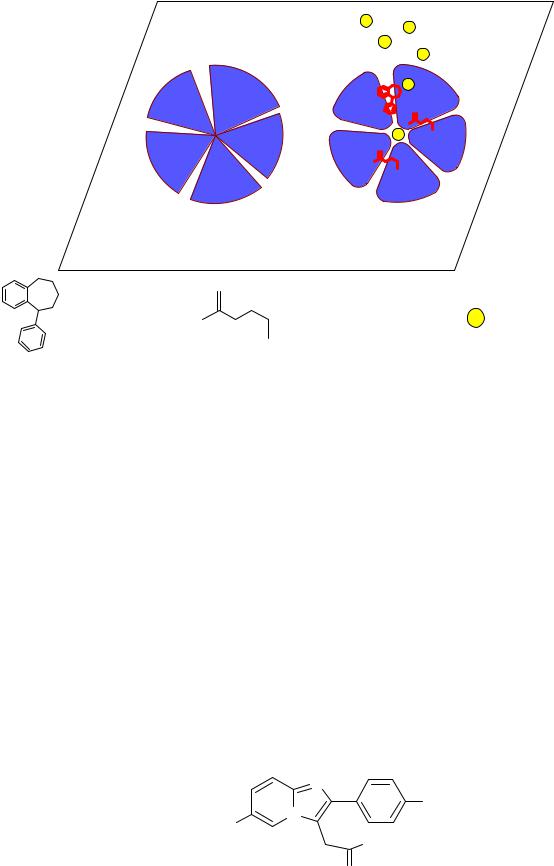
92
- БД |
- ГАМК |
- Cl - |
Рис. 20. Схема ГАМКА рецепторного комплекса: слева – в состоянии покоя, анионный канал закрыт;
справа – в активированном состоянии, анионный канал открыт.
Вследствие множества вариантов состава комплекса в настоящее время невозможно создать классификацию типов ГАМКА рецепторов на базе композиций субъединиц и фармакологических характеристик.
Рецепторы, содержащие α1-, α2-, α3- или α5-субъединицы совместно с β- и γ- субъединицами распознаются “классическими” бенздиазепинами. Некоторые лиганды распознают рецепторы, содержащие композиции изо-форм субъединиц. Гипнотик золпидем имеет высокий аффинитет к рецепторам, содержащим α1-субъединицу, более низкий – к
рецепторам, содержащим α2- или α3-субъединицы, очень низкий аффинитет – к рецепторам,
содержащим α5-субъединицу и вообще не распознает рецепторы, содержащие α4- субъединицы.
|
N |
|
|
CH3 |
|
H3C |
N |
|
N(CH3)2 |
||
|
O
Золпидем
Диаметр ГАМКА рецептора в плоскости мембраны – около 8 нм.
Субъединицы рецептора располагаются псевдосимметрично вокруг анионного
93
канала. Архитектура Н-ацетилхолинового и ГАМК рецептора сходна.
Связывание ГАМК с рецептором осуществляется в области взаимодействия α-β- и γ-
β-субъединиц. Идентифицированы фрагменты β-субъединиц, ответственные за высокоаффинное связывание агонистов.
Связывание бенздиазепинов осуществляется в области взаимодействия α- и γ- субъединиц.
В отсутствие ГАМК конформации субъединиц ГАМКА Р таковы, что анионный канал закрыт. При взаимодействии ГАМК с местами её связывания осуществляется изменение конформаций субъединиц. При этом архитектура ансамбля обеспечивает ионный ток через канал.
ГАМК вызывает гиперполяризацию мембран нейронов коры головного мозга. На этих мембранах находятся постсинаптические ГАМКА Р. Деполяризацию мембран ГАМК вызывает при взаимодействии с постсинаптическими ГАМКА Р окончаний нейронов спинного мозга.
Рецептор ГАМК из мозга различных позвоночных впервые выделил Барнард. Белок с массой 220 кD содержал места связывания с агонистами и антагонистами ГАМК, бенздиазепинами, барбитуратами и хлоридзависимыми конвульсантами. Была установлена его четвертичная структура. м-РНК, кодирующая этот белок, была выделена из мозга и транслирована в ооцитах Xenopus.
ГАМКА Р присутствуют во всех областях ЦНС и в некоторых эффекторных органах. Молекулярная масса ГАМКА рецепторов, выделенных из различных тканей
млекопитающих, 220-270 кD.
После солюбилизации рецептора его свойства по отношению к лигандам сохраняются. Связывание ГАМК усиливается в присутствии диазепама как в случае синаптосомальных мембран, содержащих ГАМКА Р, так и в случае солюбилизированных ГАМКА Р.
По данным математического моделирования экспериментальным данным лучше соответствует 2-х центровая модель связывания 3Н-ГАМКА, в сравнении с одно- и 3-х центровыми моделями.
Пресинаптические ГАМКА Р, модулирующие высвобождение ГАМК (ауторецепторы), блокируются бикукуллином.
Места связывания ГАМК аллостерически связаны с местами связывания барбитура-
тов, пикротоксинина, бенздиазепинов, β-карболинов, антигельминтного средства авемерктина В1а.
Барбитураты значительно увеличивают связывание 3Н-ГАМК с синаптическими мембранами мозга. В высоких концентрациях барбитураты способны непосредственно

94
открывать канал, что не свойственно бенздиазепинам.
С высоким аффинитетом распознают ГАМКА рецепторы некоторые стероиды, способные увеличивать длительность и интенсивность открытия анионного канала.
Важную роль играют ГАМКА рецепторы в реализации эффектов общих анестетиков. Последние включаются в гидрофобные “карманы” рецепторного белка.
Некоторые биологически активные вещества (особенно - психотропные) могут влиять на параметры связывания с ГАМКА Р их лигандов (ГАМК, мусцимола и др.). Так, обнаружено увеличение величины В*max мусцимола с мембранами коры головного мозга умерших алкоголиков. У крыс - ″наркоманов″ уменьшается Вmax ГАМК с низкоаффинными ГАМКА Р.
Барбитураты значительно увеличивают Na+-независимое Cl--зависимое связывание 3Н-ГАМК с синаптическими мембранами мозга быка и крыс.
При хроническом введении солей лития уменьшается связывание 3Н-ГАМК с рецепторами полосатого тела и гипоталамуса.
При болезни Паркинсона изменения наблюдаются как в дофаминергической, так и в ГАМК-ергической системе. У больных имеет место снижение связывания 3Н-ГАМК с мембранами нейронов гиппокампа и черной субстанции.
При болезни Хантингтона повышено связывание 3Н-ГАМК с рецепторами клеток полосатого тела, но ослаблено взаимодействие 3Н-ГАМК с мембранами клеток коры переднего мозга людей.
Высказывалось предположение, что маниакальные состояния связаны с нарушениями в ГАМК-ергической передаче нервного импульса.
10.3.Лиганды ГАМКА рецепторов как лекарственные средства.
Влечении нервно-психических заболеваний могут быть использованы
агонисты и антагонисты ГАМК Р, проникающие через гематоэнцефалический барьер.
Мусцимол обладает такой способностью. Однако он довольно токсичен. THIP и прогабид находят применение в клинике заболеваний ЦНС.
Прогабид дал положительные результаты при лечении хореи Хантингтона на начальных стадиях.
Баклофен обладает анальгетической активностью, независимо от опиатных рецепторов. Это свидетельствует о перспективности поиска ненаркотических анальгетиков среди лигандов ГАМК Р.
* - Максимальное количество мест связывания лиганда с рецептором.
95
В экспериментах на животных выявлены противосудорожные свойства баклофена, прогабида, THIP, мусцимола и амида коджиновой кислоты.
10.4. ГАМКВ и ГАМКС рецепторы.
Эти рецепторы пока ещё недостаточно изучены. ГАМКВ рецептор, в отличие от ГАМКА и ГАМКС рецепторов, относится к метаботропным рецепторам. Он представляет со-
бой гетеродимер, образующийся в результате гетеродимеризации ГАМКβ1- и ГАМКβ2-
субъединиц за счёт взаимодействия их С-терминалей. Рецептор относится к семейству 7- трансмембранных рецепторов. Агонисты этого рецептора могут найти применение в качестве анальгетиков, антиконвульсантов, стимуляторов когнитивных функций и ингибиторов влечения к наркотикам.
ГАМКС рецептор, подобно ГАМКА рецептору, - гетеропентамерный рецепторно-
ионофорный ансамбль, лигандуправляемый анионный канал. Содержит ρ1- и ρ2-субъеди- ницы, не входящие в состав ГАМКА рецептора. Влияние на него ГАМК более сильное, чем на ГАМКА рецептор. цис-Аминокротоновая кислота (САСА) – частичный агонист, не распознающийся другими (ГАМКА и ГАМКВ) рецепторами. Блокатором этого рецептора является пикротоксинин, селективным ингибитором – ТРМА. ГАМКС рецептор не распознаёт бенздиазепины, барбитураты и нейростероиды.
11. БЕНЗДИАЗЕПИНОВЫЕ РЕЦЕПТОРЫ И ИХ ЛИГАНДЫ.
В начале 70-х годов было показано, что психофармакологические эффекты 1,4-бенз- диазепинов реализуются через систему главного тормозного медиатора центральной нервной системы - γ-аминомасляной кислоты (ГАМК).
С 1977 г. исследуются молекулярные механизмы действия этих препаратов. Это стало возможным благодаря открытию в мозге млекопитающих высокочувствительных мест связывания 1,4-бенздиазепинов (бенздиазепиновых рецепторов, БДР). Вскоре стало известно, что рецепторы ГАМК (ГАМК Р) и бенздиазепинов (БДР) взаимосвязаны. Более того, места связывания ГАМК и БД находятся на субъединицах рецепторно-ионофорного ансамбля - ГАМКА рецепторного канала. Последний является лиганд-управляемым анионным каналом, принадлежащим к классу ионотропных рецепторов.
11.1. Лиганды бенздиазепиновых рецепторов.
Места связывания 1,4-бенздиазепинов находятся на α-субъединице ГАМКА Р. Для эффективного связывания лиганда с бенздиазепиновым рецептором необходимо присутствие в его составе γ-субъединицы. Лиганды БДР выполняют роль аллостерических модуляторов

96
ГАМКА Р. Вероятно, взаимодействие с БДР их лигандов приводит к конформационному переходу ГАМКА Р благоприятствующему (а случае позитивной модуляции) либо препятствующему (в случае отрицательной модуляции) его связыванию с ГАМК.
Лиганды БДР - это представители в основном 6 химических классов:
CH3
N  O
O
- бенздиазепины |
Cl |
|
N |
|
|
|
|
|
Диазепам |
|
|
||
|
|
|
|
|
||
|
|
|
C6H5 |
|
|
|
|
|
|
|
O |
|
|
H5C6 |
O |
|
|
CH(CH |
) |
2 |
- β-карболины |
|
|
|
3 |
|
|
|
|
N |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
H |
|
|
|
|
|
Абекарнил |
|
|
|
|
|
|
O |
|
|
|
|
|
N |
|
N |
|
|
|
|
|
|
N |
Cl |
|
|
- циклопирролоны |
N |
|
|
|
|
|
|
O |
N |
N CH3 |
|
|
|
|
|
|
|
|||
|
|
|
|
|
||
|
|
|
O |
|
|
|
|
|
Зопиклон |
|
|
|
|
-имидазопиридины
-имидазопиримидины
-пиридоны
N
H3C |
N |
CH3 |
|
||
|
N(CH3)2 |
|
|
|
|
Золпидем |
O |
|
|
||
OMe |
N N O |
|
OMe |
N |
C6H5 |
|
||
|
CH3 |
Диваплон |
|
|
|
|
|
Cl |
H5C2O |
N |
O |
|
||
H5C6 |
N |
|
|
O |
Ro 41-3696 |
|
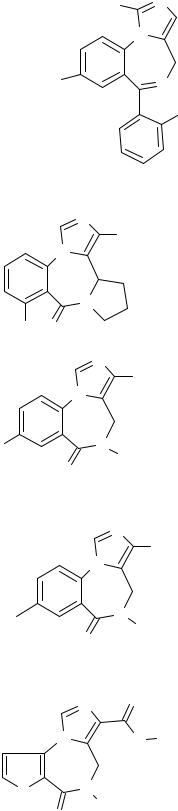
Лиганды БДР в зависимости от их роли подразделяются на агонисты, частичные агонисты, антагонисты, частичные инверсные агонисты и инверсные агонисты:
97
H3C |
N |
|
|
N |
|
Cl |
N |
Мидaзолам, |
агонист |
||
|
|
F |
N
N |
|
COOC(CH3)3 |
|
||
|
|
Бретазенил, (Ro 16-6028) |
|||
|
|
|
|||
|
N |
|
частичный агонист |
||
|
|
|
|
||
Br O |
|
|
|
|
|
|
N |
|
COOC2H5 |
|
|
|
N |
|
|
||
|
|
|
|
||
|
|
|
Флумазенил, (Ro 15-1788) |
||
F |
N |
|
антагонист |
||
CH3 |
|
||||
O |
|
|
|||
|
|
|
|
||
|
|
N |
COOC2H5 |
||
|
N |
|
|||
|
|
|
|
||
|
|
|
|
Ro 15-4513 |
|
N3 |
|
N |
частичный инверсный |
||
O |
CH3 |
агонист |
|||
|
|
||||
|
|
|
|
||
|
N |
|
O |
|
|
|
|
|
|
||
N |
|
|
O C(CH3)3 |
Ro 19-4603 |
|
|
|
|
|
инверсный агонист |
|
S N
O CH3
Предполагается, что БДР имеют 2 конформации. Одна из них способствует открытию ионного канала (конформация положительной модуляции), а другая - препятствует (конформация отрицательной) модуляции. Эти конформации находятся в состоянии равновесия.
Агонисты БДР могут селективно связываются с конформацией положительной модуляции и сдвигают равновесие в сторону этой же конформации. Лиганды, селективно

98
связывающиеся с конформацией отрицательной модуляции, сдвигают равновесие в сторону этой же конформации. Такие лиганды ведут себя как инверсные агонисты БДР. Лиганды, имеющие одинаковый аффинитет к обеим конформациям, не влияют на равновесие и, как следствие, на состояние ионного канала. Эти лиганды являются антагонистами БДР, поскольку они препятствуют взаимодействию с местами связывания агонистов и инверсных агонистов. Промежуточные положения между описанными вариантами имеют место в случае частичных агонистов и частичных инверсных агонистов.
Связывание бенздиазепинов с БДР характеризуется обратимостью, быстрой кинетикой, специфичностью (включая стереоспецифичность), ограниченностью мест связывания, ГАМК потенцирует связывание бенздиазепинов с БДР.
11.2. Периферические бенздиазепиноновые рецепторы
Особый класс бенздиазепиновых рецепторов – периферические бенздиазепиновые рецепторы (ПБДР). Они были обнаружены вначале в почках, а затем во многих органах и тканях, в том числе и в ЦНС.
С высоким аффинитетом они связываются с низкоаффинным по отношению к центральным БДР (ЦБДР) лигандом Rо5-4864. И, на оборот, высокоаффинные к ЦБДР лиганды флумазенил и клоназепам обладают слабым сродством к ПБДР.
Специфическими лигандами ПБДР являются производные изохинолина (РК 11195),
индола (FGIN 1-43).
Эндогенными лигандами ПБДР считаются полипептид DBI (ингибитор связывания диазепама) и протопорферин IX.
|
CH3 |
O |
O |
CH3 |
O |
|
N |
|
|
||
|
|
|
N C2H5 |
|
|
|
|
|
|
(C6H13)2 |
|
Cl |
N |
|
N |
CH3 |
|
|
|
||||
|
|
|
N |
||
|
|
|
Cl |
|
|
|
|
|
|
|
|
|
|
|
|
|
Cl |
|
Cl |
|
PK-11195 |
|
FGIN 1-43 |
|
Ro 5-4864 |
|
|
||
|
|
|
|
99
CH2 |
|
CH3 |
|
|
|
H3C |
N |
|
NH |
CH2 |
|
|
|
|
N |
HN |
CH3 |
H3C |
|
O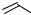 OH O
OH O OH
OH
Протопорфирин IX
ПБДР преимущественно локализованы на внешних мембранах митохондрий. Возможна локализация ПБДР и в других отделах клеток.
ПБДР – полипептид, состоящий из 169 аминокислотных остатков и характеризующийся высоким содержанием остатков триптофана.
Полипептид включает 5 трансмембранных доменов.
Рецептор взаимодействует с рядом митохондриальных и цитозольных белков: потенциалзависимым анионным каналом, VDAC (32000 D), переносчиком аденина ANC (30000 D) и др.
По-видимому, VDAC участвует в переносе метаболитов и других малых молекул между цитоплазмой и внутренней митохондриальной мембраной. ANC локализован на внутренней митохондриальной мембране и ассоциирован с ПБДР.
Установлено участие ПБДР в различных биохимических и физиологических процессах (табл. 14), а также в генезе различных патологий (табл. 15)
|
|
Таблица 14 |
|
|
Основные функции ПБДР в организме. |
ЦНС |
1. Синтез нейростероидов |
|
Почки |
1. |
Регуляция биосинтеза стероидов |
|
2. |
Влияние на синтез электролитов |
|
3. |
Связь с пируватдегидрогеназным комплексом, рост и |
|
|
дифференцировка клеток |
Сердце |
1. |
Угнетение кардиальной сократимости мышцы |
|
2. |
Связь с Са2+-каналами |
100
Эндокринная |
1. |
Модуляция выработки гормона роста |
система |
2. |
Синтез АКТГ |
|
3. |
Синтез пролактин |
|
4. |
Синтез лютропина |
Тимус |
1. Стимуляция гормональных ответов |
|
Тромбоциты |
1. |
Ингибитор FAT |
|
2. |
Регуляция внутриклеточного поступления Са2+ |
Лимфоциты |
1. |
Хемотаксис |
|
2. |
Выработка лимфокинина |
Таблица 15 Патологические состояния, в механизме возникновения которых принимают участие ПБДР
Инсульты, инфаркты, ишемическая болезнь сердца Эндокринные нарушения Иммунологические нарушения Гипертензия Стресс Опухоли ЦНС Алкоголизм
Нейрональные повреждения: болезнь Паркинсона, болезнь Хантингтона Эпилепсия Нарушение репродуктивных функций женщин
Перспективы создания эффективных профилактических и терапевтических средств обуславливают большой интерес исследователей к этой группе рецепторов и их лигандам.
11.3. Пространственная форма 1,2-дигидро-3Н-1,4-бенздиазепин-2-онов
Установление ″биологически активной″ конформации лигандов рецепторов ЦНС является одной из центральных задач медицинской химии психотропных веществ. Решение этой задачи необходимо для построения адекватной модели рецептора, а также для конструирования молекул оптимальных лигандов данного рецептора.
Уже в первых работах, посвящённых геометрии и внутримолекулярной подвижности бенздиазепинов указывалось, что молекулы 1,2-дигидро-3Н-1,4-бенздиазепин-2-онов имеют конформацию псевдолодки и пребывают в состоянии инверсии.
Методом динамического ЯМР изучена кинетика инверсии различных производных
