
Fizika 10 klas - Goncharenko S.U
..pdfколи сталим є його тиск р. З рівняння Клапейрона випливає, що в цьому випадку сталим буде відношення об'єму газу до його температури
V |
т |
р |
я = соп8І |
(11.2) |
Т |
М |
|
V / |
тобто за незмінної маси газу і сталого тиску об'єм газу прямо пропорційний абсолютній температурі. Цей закон було встановлено дослідним шляхом у 1802 р. французьким фізиком Ж. Гей-Люссаком. Формулу закону Гей-Люссака можна переписати у такому вигляді:
\ = \ або У = У 0 £ . |
(11.3) |
Таким чином, за незмінної маси газу і сталого тиску його об'єм з підвищенням температури на 1 градус збільшується на ^/273 частину того об'єму, який газ займав за температури 273 К (0 °С).
Цей закон можна експериментально перевірити за допомогою раніше описаної установки (с.36). Для цього циліндр змінного об'єму поміщають у посудину з водою, температуру якої (а значить, і повітря в циліндрі) можна змінювати. З підвищенням температури тиск повітря збільшується. За допомогою гвинта 4 змінюють об'єм газу так, щоб тиск залишився попереднім. Вимірюючи об'єм повітря в циліндрі і його температуру, встановлюють, що відношення об'єму газу до абсолютної температури за сталого тиску — величина стала.
Досить просто закон Гей-Люссака можна проілюструвати за допомогою колби із зігнутою трубкою (мал. 19). У горизонтальній частині трубки є крапля рідини, яка відокремлює газ у колбі від атмосферного повітря. Якщо підігрівати колбу (навіть руками), то крапля рідини зміститься вправо, тобто об'єм газу, який знаходиться в колбі, збільшиться, а тиск так само дорівнюватиме атмосферному.
Перехід газу з одного стану в інший за сталого тиску
називають ізобарним процесом. Графічно такий процес |
в коор- |
|||
|
динатних осях V, Т зображується |
|||
|
прямою, продовження якої прохо- |
|||
|
дить |
через |
початок координат,— |
|
|
ізобарою. Кут її нахилу а до осі |
|||
|
температур |
залежить від |
тиску |
|
і. |
газу: чим більший тиск, тим мен- |
|||
|
ший кут нахилу (на малюнку 20, а |
|||
——^ |
маємо |
рл |
р2 > Рі). Справді, з |
|
формули (11.2) дістаємо рівняння |
||||
Мал. 19 |
ізобари: |
|
|
|
|
р2 |
|
|
РЗ |
Рз |
|
|
|
Р2 |
Р2 |
|
|
|
|
|
||
|
Рз |
|
|
Рі |
Рі |
А Ж |
|
|
|
||
т о |
|
|
Т О |
\/ |
|
|
|
б |
|||
|
|
|
|
|
|
|
|
Мал. 20 |
|
|
|
|
Т7 |
|
171 Я пп |
|
|
|
|
~м'р |
' |
|
|
тп Я
де ^ • ~ — стала величина (тим більша, чим менший тиск р).
Отже, за однієї і тієї самої температури газ займатиме тим більший об'єм, чим менший його тиск. На діаграмах з координатними осями р, Т або р, V ізобари мають вигляд прямих, паралельних осі Т чи відповідно осі 1^(мал. 20, б і в).
Ізохорний процес. Розглянемо випадок, коли об'єм V газу залишається сталим. З рівняння Клапейрона випливає, що за цих умов сталим буде відношення тиску газу до його температури:
Р - т .і? _ | (11.4)
тобто за сталого об'єму тиск газу прямо пропорційний його абсолютній температурі.
Цей закон експериментально встановив французький учений Ж. ПІ а р л ь. Закон можна також перевірити експериментально за допомогою установки (див. мал. 17).
Перехід газу з одного стану в інший за сталого об'єму називають ізохорним процесом. Графік цього процесу в координатах р, Т — пряма лінія, продовження якої проходить через початок координат (мал. 21, а); її називають ізохорою. Кут нахилу а ізохори до осі температур тим більший, чим
менший об'єм газу |
(на мал. |
21, а маємо |
У3 > У2 > УА). В |
||||
|
|
V^ |
Р 1 |
|
|
V |
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
У2 |
|
|
|
|
|
|
|
V. |
|
|
|
|
|
|
\\ |
|
|
|
|
V |
0 |
|
|
Т |
0 |
|
б |
||
|
|
а |
|
|
|
|
|
Мал, 21
41
системах координат р, У і V, Т ізохора має вигляд прямої, паралельної осі р або відповідно Т (мал. 21, б і в).
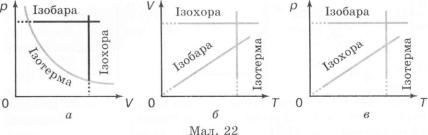
Таким чином, ми переконалися, що основні газові закони (Бойля—Маріотта, Гей-Люссака і Шарля) — це окремі випадки рівняння Клапейрона.
Цікаво зіставити графіки всіх ізопроцесів у різних системах координат (мал. 22).
Задача 1. У балоні об'ємом 100 л міститься газ під тиском 4,9 *105 Па. Який об'єм займе газ за нормального атмосферного тиску (1,01 • 10} ГІа)?
Температура газу не змінюється.
Р о з в ' я з а н н я . В умові задачі йдеться про ізотермічну зміну стану газу, яка описується законом Бойля—Маріотта:
|
|
Р\уі = Р2У2 > |
|
|
|
звідси У2 |
= —— , або У2 |
4,9 105 Па ОД м3 , |
0,48 м" |
||
1,01 105 |
Па |
||||
|
Р 2 |
|
|||
Задача 2. До якої температури треба ізобарно охолодити певну масу газу, початкова температура якого 37 °С, щоб його об'єм зменшився при цьому на одну чверть?
Р о з в ' я з а н н я . Температуру Т2 знайдемо із закону Гей-Люссака:
|
звідси Т2 = тЛ^, або |
Т2 - 310 |
232,5К, або £ = - 4 0 , 5 С. |
Задача 3. За температури 5 °С тиск повітря в балоні дорівнює 104 Па. За якої температури тиск у ньому буде 2,6 • 104 Па?
Р о з в' я з а н н я. Із закону Шарля
Рі _ Ті
|
|
|
|
Р 2 |
2 |
|
знайдемо температуру: Т2 |
Рі ТІ, або |
|||||
Т2 |
= 278 К |
2,6 101 |
Па |
722,8 К, або і = 449,8 С. |
||
101 Па |
||||||
|
|
|
|
|||
42
Задача 4. Манометр, встановлений на балоні із стиснутим киснем, показував за температури -З °С тиск 1,8* 106 Па, а за температури 27 °С — тиск 2 - Ю 6 Па. Чи відбувалося витікання газу з балона?
Р о з в ' я з а н н я . Щоб з'ясувати, чи витікав газ із балона, обчислимо, яким повинен бути тиск р2 кисню за температури Т2. Якщо він дорівнюватиме р2, то витікання не буде. Оскільки об'єм балона не змінюється, то йдеться про ізохорну зміну стану газу, яка описується законом Шарля:
Рі |
= |
Р2 звідси р2 |
= рг т2 |
, або р2 = 2 • 106 |
Па. |
||||
Ч |
|
Т2 |
|
|
|
|
|
|
|
Отже, витікання кисню не було. |
|
|
|
|
|||||
Задача 5. На малюнку 23 зобра- |
|
|
> к |
р2 |
|||||
|
|
||||||||
жено дві |
ізобари: |
рх = |
сопві |
і |
|
|
|||
V, |
|
|
|||||||
р2 = сопзі. Який тиск більший? |
на |
|
|
|
|||||
|
|
|
|||||||
Р о з в ' я з а н н я . |
Проведемо |
|
|
|
Рі |
||||
графіку будь-яку ізотерму. Вона |
|
|
|
||||||
|
|
|
|
||||||
перетне ізобару р2 - сопзі при біль- |
|
|
|
|
|||||
шому значенні об'єму У2, ніж ізо- |
|
|
|
|
|||||
|
|
|
|
||||||
бару рі = соп8І. Але за однієї і тієї |
|
|
|
|
|||||
самої температури тиск газу тим |
|
|
7і |
Т |
|||||
більший, чим менший його об'єм, |
0 |
|
|
|
|||||
|
|
|
|||||||
що випливає із закону Бойля— |
|
|
Мал. 23 |
||||||
Маріотта: |
|
|
|
|
|
|
|
|
|
Рі |
|
; отже, р2< рг. |
|
|
|
|
|
||
— = |
|
|
|
|
|
|
|||
Р 2 У1 |
|
|
|
|
|
|
|
|
|
? 1. Що таке ізопроцеси? 2. Як можна експериментально перевірити закони Бойля—Маріотта, Гей-Люссака і Шарля? 3. Накресліть, користуючись координатними осями р, V, ізотерму, ізохору й ізобару.
Вправа 4 у кисневій системі літака міститься 2,8 • 10~3 м3 кисню під тиском 2 • 107 Па. На максимальній висоті підйому пілот з'єднує за допомогою крана цю систему з порожнім
балоном об'ємом 5 • 10 2 м3. Який тиск встановиться в ній? Процес розширення газу відбувається за сталої температури.
2. Тиск у кабіні космічного корабля за температури 290 К дорівнює 9,7 • 104 Па. Р Як зміниться тиск повітря з підвищенням температури на 8 К?
3. Чому балони зі стиснутими газами |
|
|
|
(киснем, воднем, ацетиленом) не мож- |
|
|
|
на нагрівати вище 35 С? |
|
|
|
4. На графіку (мал. 24) зображено за- |
|
|
|
лежність тиску газу від температури. |
|
|
|
Як змінювався об'єм даного газу під |
|
|
|
час переходу його із стану 1 у стан 2? |
0 |
Мал 24 |
|
Маса газу не змінювалася. |
|||
|
13
5. Манометр на балоні із стиснутим газом за температури Ті = 300 К показав тиск рі = 1,52 • 106 Па, а під час зниження температури до Т2 = 280 К тиск р2 = 1,42 • 10б Па. Визначте за цими даними, чи витікав газ із балона.
6. Газопроводом подається вуглекислий газ під тиском р = 3,9 • 105 Па
іза температури Т = 280 К. Яка швидкість проходження газу в трубі
зплощею поперечного перерізу каналу труби 8 = 5 см2, якщо за х = 10 хв проходить 2 кг вуглекислого газу? Молярна маса вуглекислого газу М = 0,44 кг/моль.
§ 12Застосування стиснутих і розріджених газів у техніці
Велика стисливість газу, залежність тиску і об'єму газу від температури, легкість регулювання тиску роблять газ незамінним робочим тілом у теплових двигунах і двигунах, що працюють на стиснутому газі. Він є одним з найдосконаліших амортизаторів, що застосовуються в ряді пристроїв.
Умеханічних майстернях і цехах заводів широко використовують пневматичні інструменти ударної дії: молоти, вібратори, трамбовки, палебої і т. д., а також пневматичні свердлильні і шліфувальні машини, гайковерти тощо. Використання цього обладнання приблизно у 6 раз підвищує продуктивність праці порівняно з роботою ручним, немеханізованим інструментом. Під час виконання різноманітних операцій на металорізальних верстатах застосовують пневматичні затискні пристрої: пневматичні патрони, пневматичні слюсарні лещата тощо. Вони створюють великі сили для затискання деталей і дають змогу регулювати їх у широких межах, забезпечуючи задану послідовність дії затискних механізмів.
Уцехах машинобудівних заводів з великосерійним виробництвом впроваджені пневматичні вантажопідйомні пристрої: крани, підіймальні столи, штовхачі тощо. Пневматичні пристрої дедалі ширше використовують для автоматизації виробничих процесів, які успішно конкурують з механічними, електричними та іншими системами. Це пояснюється їх економічністю і простотою конструкції.
Для виконання ряду допоміжних робіт у машинобудуванні (піскоструминне очищення поверхонь від іржі й окалини, видалення стружки з верстатів, нашарування розпилюванням металу, нанесення захисного шару на поверхню готових деталей під час їх консервації тощо) створено пневматичний інструмент, який працює від струмини стиснутого повітря.
Найбільшим споживачем стиснутого повітря є гірничорудна промисловість. Так, добування кам'яного вугілля і руди здійснюється за допомогою пневматичних відбійних молот-
44
ків, перфораторів, машин для буріння отворів під час підривних робіт і багатьох інших пневматичних інструментів.
Цікавий приклад використання стиснутого повітря — застосування його в апаратах на повітряній подушці. Принцип їх дії дуже простий. У простір між днищем апарата і поверхнею, над якою він рухається, за допомогою потужних компресорів нагнітають повітря, утворюючи ніби подушку зі стиснутого повітря, яка трохи піднімає апарат над поверхнею. Щоб такий апарат рухався в горизонтальному напрямі, використовують гвинтові або турбореактивні двигуни. В багатьох країнах світу сконструйовано сотні різноманітних машин на повітряній подушці: мотоцикл і моторолери, автомобілі, катери тощо. Особливо інтенсивно ведуться роботи над створенням потягів на дуже тонкій повітряній подушці (повітряному змащенні),
що |
дає можливість досягти швидкостей руху близько |
400 |
км/год. |
Пневматичні вимірні прилади дають змогу вимірювати в найкоротший час розміри з точністю до 10 8 м, допускаючи при цьому мінімальні похибки. Завдяки високій точності вимірювань за допомогою пневматичних приладів стало можливим створення автоматичних методів контролю і сортування виробів масового виробництва за розмірами.
Не менш важливі і різноманітні застосування розріджених газів або газів у стані вакууму. Вакуумні установки широко використовують у кондитерській і харчовій промисловості, на тваринницьких фермах (пневматичні вакуумні годівниці та доїлки для худоби), для пресування пластмас і зварювання металів. Високий вакуум потрібен в електричних і багатьох електронних лампах, рентгенівських і телевізійних трубках, лічильниках і прискорювачах елементарних частинок. Але особливо важливе застосування вакууму в металургії. Без нього не можна було б спікати заготовки із твердосплавних порошків, вести рафіноване очищення ртуті, цинку, магнію, барію, виготовляти деталі з танталу і ніобію, відновлювати метали з руд і хімічних сполук, добувати високоякісні сталі і сплави (вакуумні печі, камери вакуумування, розливання у вакуумі тощо).
§13. Насичена і ненасичена пара
Уприроді, техніці і побуті ми часто спостерігаємо перетворення рідких і твердих речовин у газоподібний стан. В ясний літній день швидко висихають мокра білизна, калюжі, які залишилися після дощу. З часом зменшуючись, зникають шматки сухого льоду, зменшуються розміри шматочків нафталіну, яким пересипають вовняні речі тощо. У всіх цих випадках спо
стерігається процес перетворення речовин у газоподібний стан — у пару.
Пароутворення відбувається двома способами — випаровуванням і кипінням. Розглянемо спочатку випаровування, яке можна визначити як пароутворення, що відбувається лише з поверхні рідини.
Цей процес відбувається за будь-якої температури, що легко пояснюється молекулярно-кінетичною теорією. Молекули рідини, як і газу, мають різні швидкості. Деякі з них мають достатню кінетичну енергію для того, щоб відірватися від поверхні і вийти із сфери дії молекулярних сил. Тому над рідиною завжди є її вільні молекули, які утворюють пару.
Оскільки відриваються і вилітають з рідини найшвидкіші молекули, середня кінетична енергія молекул, які залишилися, зменшується. Внаслідок цього рідина під час випаровування охолоджується. Це явище використовують у техніці, зокрема побутовій. Так, шафа електричного холодильника охолоджується завдяки тому, що рідина, яка випаровується в холодильному агрегаті, поглинає енергію з навколишнього середовища. Щоб температура рідини у процесі випаровування залишалася сталою (тобто щоб не змінювалася її внутрішня енергія), треба безперервно підводити до неї енергію, яка дорівнює роботі, виконуваній проти сил зчеплення молекул і проти сили зовнішнього тиску.
У результаті хаотичного руху над поверхнею рідини молекули пари можуть повертатися в неї. Цей процес називають конденсацією пари. З наближенням до поверхні рідини сили притягання прискорюють молекулу, надаючи їй додаткової кінетичної енергії, такої, яку затрачено на подолання цих сил, і, повернувшись, молекула має таку саму кінетичну енергію, яку мала під час випаровування. Тому в процесі конденса-
ції |
пари |
виділяється стільки ж енергії, скільки було затра- |
чено |
на |
її утворення. |
Якщо рідина перебуває у відкритій посудині, то випаровування її відбувається доти, поки вся вона не перетвориться в пару. З курсу фізики 8-го класу і повсякденного життя ви знаєте, що швидкість випаровування тим більша, чим вища температура рідини, чим більша її поверхня, чим швидше видаляється пара, яка утворилася над поверхнею, і чим менший зовнішній тиск. Швидкість випаровування залежить також від природи речовини, яка випаровується. Так, ефір випаровується швидше за воду, а вода — швидше за олію, що пояснюється різними силами взаємодії між молекулами цих речовин.
Дещо інша картина випаровування спостерігається тоді, коли рідина перебуває в закритій посудині і займає лише
частину її об'єму. На початку процесу кількість молекул, які вилітають з рідини, перевищує кількість молекул, які знову повертаються в неї, і концентрація молекул пари зростає. Але чим більше стає молекул, які вилетіли з рідини, тим більше їх потрапляє назад у рідину. Нарешті настає такий момент, коли кількість молекул, які вилітають з рідини за одиницю часу, виявляється такою самою, як і кількість молекул, що повертаються в неї за той самий час. Очевидно, починаючи з цього моменту, концентрація молекул пари буде сталою. Такий стан називають динамічною рівновагою рідини і пари. Пару, яка
перебуває в динамічній рівновазі зі своєю рідиною, називають насиченою.
Таким чином, можна зробити висновок, що насичена пара має за даної температури найбільшу кількість молекул в одиниці об'єму (або, інакше кажучи, максимальну густину) і чинить найбільший тиск.
У різних рідин динамічна рівновага з парою настає за різної густини пари (концентрації молекул). Причина цього полягає в неоднаковості сил молекулярної взаємодії. З рідин, в яких сили взаємного притягання частинок великі, наприклад із ртуті, можуть вилітати лише найшвидші молекули, кількість яких незначна. З рідин з малими силами притягання, наприклад із ефіру, за тієї самої температури вилітає багато молекул, і динамічна рівновага настає тільки за умови значної їх концентрації в парі.
Пару, яка не перебуває в динамічній рівновазі зі своєю рідиною (не досягла насичення), називають ненасиченою. Іншими словами, ненасиченою буде пара над поверхнею рідини, коли випаровування переважає над конденсацією. Очевидно, що густина ненасиченої пари менша за густину насиченої пари.
Властивості ненасиченої пари можна описувати газовими законами для ідеального газу: Бойля—Маріотта, Шарля, Гей-Люссака, Клапейрона. Властивості пари тим точніше відповідають цим законам, чим менш насиченою є пара, тобто чим менша її густина.
Залежність між тиском і температурою насиченої пари не підлягає закону Шарля, тобто закон Шарля до насиченої пари незастосовний. Розглянемо причину цього. Нагрівання ідеального газу за сталого об'єму приводить до підвищення його тиску внаслідок зростання середньої кінетичної енергії молекул (частішими стають їх удари об стінку посудини, і тим більший імпульс передають вони під час кожного удару). В результаті нагрівання насиченої пари зростає не лише середня кінетична енергія молекул, а й кількість цих молекул (внаслідок інтенсивнішого випаровування зростає маса пари). Тому тиск насиченої пари з підвищенням температури зростає
Л 7

р,106Па |
|
швидше, ніж тиск ідеального газу. |
||
т |
|
На малюнку 25 зміну тиску ідеаль- |
||
40 . |
|
ного газу |
показано |
пунктирною |
|
лінією. |
|
|
|
ЗО . |
|
|
|
|
|
? 1. Що відбувається з насиченою |
|||
|
|
|||
20 . |
|
парою у разі ізотермічного зменшення |
||
10 . |
|
(збільшення) |
її об'єму? |
2. Що треба |
|
зробити для підвищення тиску насиче- |
|||
|
|
|||
о |
{о 20~30~40 |
ної пари? 3. Чи застосовні закони іде- |
||
^ ального газу до насиченої пари? Чому? |
||||
|
|
Як змінюється тиск насиченої пари зі |
||
Мал. 25 |
зміною її об'єму? |
|
§ 1 4 . ІСритмчна температура
Спробуємо зобразити графічно перехід ненасиченої пари в рідину під час зменшення її об'єму без зміни температури. В цьому випадку тиск пари зростатиме доти, поки не досягне тиску насиченої пари за даної температури. Ділянка графіка АВ (мал. 26) є гілкою ізотерми; точка В відповідає утворенню насиченої пари. З цього моменту за подальшого зменшення об'єму починається конденсація пари, а тиск її залишається сталим. Відповідна гілка ВС ізотерми (разом з тим і ізобари, окрім крайніх точок) характеризує стан речовини, який існує одночасно у вигляді рідини і насиченої пари. Потім настає момент, коли вся пара перетворюється в рідину, об'єм речовини в цьому стані зображається точкою С. Оскільки рідина майже нестискувана, то частина ізотерми СО, яка відповідає ізотермічному стисканню рідини, майже паралельна осі ординат. Криву АВСО називають ізотермою пари і рідини.
|
|
|
Густина рідини звичайно знач- |
||||||
р, Па |
|
|
но більша за густину її пари, тому |
||||||
|
|
чітко |
видно |
межу |
поділу |
між |
|||
V о |
|
|
|||||||
|
|
ними. |
|
|
|
|
|
||
у- |
|
|
|
|
|
|
|
||
|
|
Під |
час |
нагрівання |
густина |
||||
1їй |
|
|
насиченої пари зростає, а густина |
||||||
Насичена |
|
рідини |
зменшується |
(на |
мал. |
27 |
|||
уб- |
показано залежність густини рід- |
||||||||
пара і |
|
||||||||
с рідина |
• |
|
кого ефіру та його пари від темпе- |
||||||
|
|
|
ратури). Тобто зі зростанням тем- |
||||||
і: Ч ператури їх густини зближаються
лі за деякої температури Тк стають однаковими. В цей момент між
|
рідиною і парою зникає межа по- |
Мал. 26 |
ділу, теплота пароутворення пере- |
48
творюеться на нуль, пару і рідину |
р,кг/м3 |
|
не можна розрізнити. Температуру |
4 |
|
Тю за якої відбувається таке явище, |
0,08 |
|
називають критичною температу- |
|
|
рою, а стан речовини, за якого |
|
|
зникає відмінність між фізичними |
0,04 |
|
властивостями її рідини і пари, на- |
|
|
зивають критичним станом. Можна |
|
|
сказати, що за критичної темпе- |
"0 273 373 473 |
Т |
ратури спостерігається не два стани |
речовини — газоподібний і рідкий, а один. Під час дальшого нагрівання речовина залишається га-
зом за будь-якого тиску, і розділити її на пару і рідину за допомогою стискання неможливо.
Тиск насиченої пари речовини за її критичної температури називають критичним тиском. Він є найбільшим із можливих значень тиску насиченої пари цієї речовини. Для води, наприклад, критичний тиск дорівнює 2,2 • 107 Па (225,6 атм), для оксиду карбону (вуглекислий газ) — 7,35 • 106 Па (75 атм), а для гелію — всього 0,23 • 106 Па (2,3 атм). Об'єм, що його займає речовина у критичному стані, називають критичним об'ємом. Він відповідає найбільшому значенню об'єму, який може займати дана маса речовини у рідкому стані.
Якщо запаяти в тонкостінній скляній ампулі таку кількість ефіру, щоб його критичний об'єм дорівнював внутрішньому об'єму ампули, то можна продемонструвати перехід ефіру у критичний стан. Будемо рівномірно нагрівати таку ампулу з ефіром. Спочатку межа між рідиною і парою чітка, поверхня рідини увігнута (мал. 28, а). З нагріванням рідина розширюється, її густина зменшується, і поверхня стає плоскою (мал. 28, б). Потім ефір починає бурхливо випаровуватися (мал. 28, в), але густина його продовжує зменшуватися,
оскільки він розширюється; густи- |
|
|
на ж його насиченої пари зростає. |
Г\ |
дГ\ |
За температури 194 °С видима межа |
||
поділу рідкого ефіру і його пари |
|
|
розпливається (мал. 28, г), насиче- |
|
|
ну пару і рідину неможливо від- |
|
|
різнити одну від одної, їх власти- |
|
|
вості стають однаковими. За темпе- |
|
|
ратури вище 194 °С вся ампула |
|
|
заповнюється однорідною прозорою |
|
|
речовиною. |
и V/ ЧУ |
V/ |
Якщо ампулу охолоджувати, всі |
|
|
процеси відбуваються в ній у зво~ |
Мал. 28 |
|
|
|
49 |
