
Модуль 2.22
Глава 15 Предпосылки квантовой теории
15. 1 Спектральные закономерности
Излучение невзаимодействующих друг с другом атомов состоит из отдельных спектральных линий. В соответствии с этим спектр испускания атомов называется линейчатым.
Изучение атомных спектров послужило ключом к познанию внутренней структуры атомов. Прежде всего было замечено, что спектральные линии расположены не беспорядочно , а образуют серии линий. Изучая линейчатый спектр атомарного водорода, Бальмер (1885) установил следующую закономерность. Она выглядит так:
 (15.1)
(15.1)
где
 – длина волны спектральной линии
– длина волны спектральной линии ,
, – постоянная Ридберга:
– постоянная Ридберга:
 м-1 . (15.2)
м-1 . (15.2)
Формулу (15.1) называют формулой Бальмера, а соответствующую серию спектральных линий – серией Бальмера. Основные линии этой серии находятся в видимой части спектра.
Дальнейшие исследования спектра водорода показали, что имеется еще несколько серий. В ультрафиолетовой части спектра – серия Лаймана:
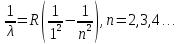 (15.3)
(15.3)
В инфракрасной области были найдены три серии спектральных линий водорода:
- серия Пашена:
 (15.4)
(15.4)
- серия Брэкета:
 (15.5)
(15.5)
- серия Пфунда:
 (15.6)
(15.6)
Все эти серии можно представить в виде обобщенной формулы Бальмера-Ритца:
 (15.7)
(15.7)
где
 для серии Лаймана,
для серии Лаймана, для серии Бальмера и т.д. Для данной
серии
для серии Бальмера и т.д. Для данной
серии .
.
C
увеличением
 спектральные линии серии сближаются
друг с другом. Граница каждой серии
определяется длиной волны
спектральные линии серии сближаются
друг с другом. Граница каждой серии
определяется длиной волны ,
при которой
,
при которой .
За границей серии спектр не обрывается,
а становится сплошным. Это присуще не
только всем сериям водорода, но и атомам
других элементов.
.
За границей серии спектр не обрывается,
а становится сплошным. Это присуще не
только всем сериям водорода, но и атомам
других элементов.
Формула (15.7) подтвердилась на опыте с большой спектроскопической точностью.
15.2 Постулаты Бора. Боровская модель атома водорода
Закономерности, наблюдаемые в спектре атомарного водорода, находят свое объяснение в полуклассической теории атома, развитой Нильсом Бором в 1913 году.
Бор
построил теорию, сохранившую черты
классической механики, но дополненную
условиями квантования. Она развивалась
им для атома водорода и водородоподобных
ионов, состоящих из ядра с зарядом
 и одного электрона, движущегося вокруг
ядра. Примерами таких ионов являютсяHe+
(
и одного электрона, движущегося вокруг
ядра. Примерами таких ионов являютсяHe+
( ),Li++
(
),Li++
( ),Be+++
(
),Be+++
( )
и другие ионы.
)
и другие ионы.
Для
атома водорода
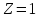 .
Для водородоподобных ионов все формулы
для спектральных серий, в частности
формула (1) , вместо
.
Для водородоподобных ионов все формулы
для спектральных серий, в частности
формула (1) , вместо содержат произведение
содержат произведение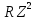 .
.
В теории Бора основное место занимают три постулата квантовой физики, называемые постулатами Бора.
Постулат стационарных состояний
Атом
может длительное время находиться
только в определенных, так называемых
стационарных
состояниях,
которые характеризуются дискретными
значениями энергии
 . В этих состояниях атом не излучает
электромагнитных волн (света).
. В этих состояниях атом не излучает
электромагнитных волн (света).
Это утверждение противоречит выводам классической электродинамики об излучении энергии ускоренно движущимся зарядом.
Стационарным состояниям атома соответствуют стационарные орбиты, по которым могут двигаться электроны.
Несмотря на то, что электроны движутся ускоренно, они не излучают энергию.
Второй постулат Бора называется правилом квантования круговых орбит
Момент
импульса электрона, вращающегося вокруг
ядра, может принимать только дискретный
ряд значений
 и т.д., то есть
и т.д., то есть
 (15.8)
(15.8)
где
 – масса электрона,
– масса электрона, – его скорость,
– его скорость, – радиус круговой орбиты,
– радиус круговой орбиты, – постоянная Планка. Число
– постоянная Планка. Число называетсяглавным
квантовым числом.
Таким образом, из всех орбит электрона,
вращающегося вокруг ядра, возможны
только те, для которых момент импульса
электрона равен целому кратному от
величины
называетсяглавным
квантовым числом.
Таким образом, из всех орбит электрона,
вращающегося вокруг ядра, возможны
только те, для которых момент импульса
электрона равен целому кратному от
величины
 .
.
Третий постулат Бора, или правило частот, утверждает, что при переходе атома из стационарного состояния с большей энергией
 в стационарное состояние с меньшей
энергией
в стационарное состояние с меньшей
энергией происходит излучение кванта света
(фотона) с энергией
происходит излучение кванта света
(фотона) с энергией :
:
 (15.9)
(15.9)
Такое
же соотношение выполняется и в случае
поглощения, когда падающий фотон
переводит атом с нижнего энергетического
уровня
 на более высокий
на более высокий ,
а сам исчезает.
,
а сам исчезает.
С помощью правила квантования (15.8) можно найти радиусы боровских орбит водородоподобных ионов и энергию ионов на этих орбитах.
Итак,
рассмотрим электрон, движущийся вокруг
ядра с зарядом
 по круговой орбите радиуса
по круговой орбите радиуса .
На такой траектории его удерживает
кулоновская сила притяжения к ядру,
играющая роль центростремительной
силы.
.
На такой траектории его удерживает
кулоновская сила притяжения к ядру,
играющая роль центростремительной
силы.
Согласно 2-му закону Ньютона
 , (15.10)
, (15.10)
где
 – коэффициент в законе Кулоне в СИ.
– коэффициент в законе Кулоне в СИ.
Решая совместно уравнения (15.8) и (15.10), получим, что радиусы стационарных орбит в атоме могут принимать ряд дискретных значений:
 (15.11)
(15.11)
Радиус
первой стационарной орбиты электрона
в атоме водорода ( )
равен
)
равен
 (15.12)
(15.12)
Его называют боровским радиусом, он определяет размер атома.
Полная
энергия
 электрона в атоме водорода (или
соответствующем ионе) складывается из
кинетической энергии
электрона в атоме водорода (или
соответствующем ионе) складывается из
кинетической энергии и потенциальной энергии электрона
и потенциальной энергии электрона в кулоновском поле ядра:
в кулоновском поле ядра:
 .
.
Из (15.10) следует, что
 .
.
Следовательно,
 .
.
Подставляя
значения
 из формулы (15.11), получим энергию
из формулы (15.11), получим энергию электрона на n-ой стационарной орбите:
электрона на n-ой стационарной орбите:
 (15.13)
(15.13)
Эта формула описывает уровни энергии стационарных состояний электрона в водородопободном ионе.
Для
атома водорода ( )
)
 , (15.14)
, (15.14)
где
 = 13,6 эВ.
= 13,6 эВ.
Схема энергетических уровней атома водорода изображена на рис. 1.
Состояние
атома с наименьшей энергией ( называютосновным.
называютосновным.
Для
атома водорода
 эВ.
Эта энергия (по модулю) являетсяэнергией
связи
электрона в основном состоянии:
эВ.
Эта энергия (по модулю) являетсяэнергией
связи
электрона в основном состоянии:
 .
Именно такую энергию надо сообщить
электрону в основном состоянии (
.
Именно такую энергию надо сообщить
электрону в основном состоянии ( ),
чтобы удалить его из атома водорода. По
этой причине ее называют еще иэнергией
ионизации:
),
чтобы удалить его из атома водорода. По
этой причине ее называют еще иэнергией
ионизации:
 =13,6
эВ.
=13,6
эВ.
Это значение, полученное из боровской теории атома, находится в хорошем согласии с результатами эксперимента.

Рис. 1
Согласно
третьему постулату Бора атом излучает
квант света при переходе из некоторого
стационарного состояния с большей
энергией
 в стационарное состояние с меньшей
энергией
в стационарное состояние с меньшей
энергией .
При этом излучаются электромагнитные
волны с частотой
.
При этом излучаются электромагнитные
волны с частотой
 , (15.15)
, (15.15)
где
 .
.
Так
как
 ,
то из (15.15) получаем
,
то из (15.15) получаем
 ,
,
или
 , (15.16)
, (15.16)
где
 (15.17)
(15.17)
- постоянная Ридберга.
Таким
образом, мы пришли к обобщенной формуле
Бальмера-Ритца (15.7), установив при этом,
от каких величин зависит постоянная
Ридберга. Подстановка в выражение
(15.17) числовых значений
 дает величину, хорошо согласующуюся с
экспериментальным значением постоянной
Ридберга (15.2).
дает величину, хорошо согласующуюся с
экспериментальным значением постоянной
Ридберга (15.2).
Формулы (15.13) и (15.17) позволяют записать выражение для энергии стационарных состояний водородоподобных ионов в более удобном виде:
 (15.18)
(15.18)
Теория Бора проста и наглядна. Однако ее не удалось распространить даже на простейший после водорода атом гелия, содержащий два электрона. Кроме того, теория Бора позволила вычислить только длины волн спектральных линий, но не их интенсивность. Планетарную модель атома нельзя считать серьезной теорией. Тот факт, что модель приводит к очень хорошим результатам в случае атома водорода по существу случайный. Сам Бор рассматривал свою теорию как переходный этап в поисках верной теории. Такой последовательной теорией явилась квантовая физика.
