
Posob_2012_Ok
.pdf
достижении равновесия судят по постоянной величине физического свойства жидкой фазы гетерогенных смесей).
H2O
RA |
G' |
Q' |
RB |
|
|
E |
|
|
F |
H |
Q |
J |
|
|
G |
|
|
||
F" |
|
H" |
|
Q" |
J" |
G" |
|
|
|
|
|
0 |
20 |
40 |
60 |
80 |
100 |
A |
|
|
|
|
B |
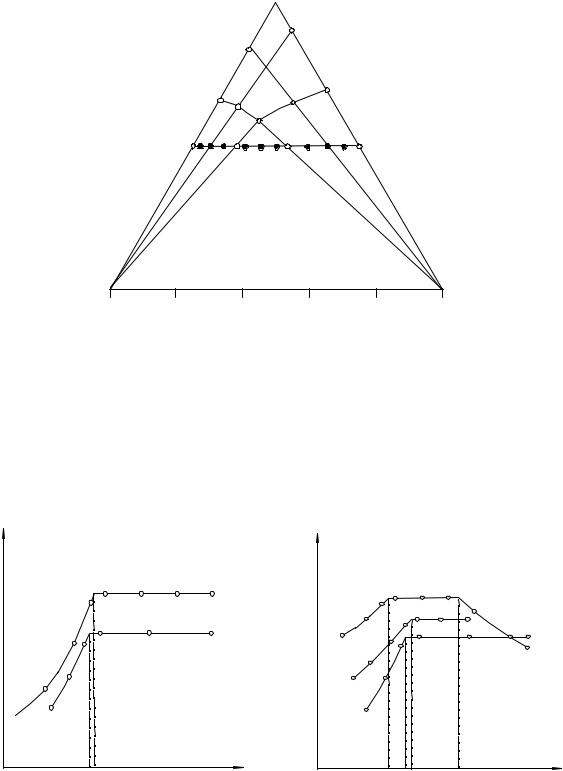
Рис. 13. 1. Исследование изотермы растворимости методом остатков Схрейнемакерса и видоизмененным методом остатков
По данным о величине физического свойства и о составе смесей в данном сечении строят график, связывающий эти величины. Поскольку сечение в треугольнике проведено таким образом, чтобы оно проходило через несколько полей фазовых равновесий, то на графике получим систему взаимно пересекающихся линий, число которых равно числу полей, рассекаемых избранным сечением. Каждому виду равновесия на графике соответствует определенная функциональная линия, а точки пересечения линий однозначно указывают на состав системы, лежащей в данном сечении на границе полей с разным фазовым состоянием.
Определив по графику состав, изображаемый каждой из таких точек, их переносят на соответствующее сечение треугольника состава, а располагая некоторой серией исследованных сечений, нетрудно построить изотерму растворимости в целом. Выбор направления и число сечений определяются характером взаимоотношения компонентов системы.
Рассмотрим применение метода сечений к тройной водно-солевой системе эвтонического типа. Изотерма растворимости системы приведена
на рис. 13. 2, где А - Н2О; В - Н2О; А - Х; В - У; К - К - сечения, выявляющие положения линий насыщенных растворов и предельных нод.
141
H2O
|
|
Y |
|
|
X |
|
|
|
|
|
|
|
|
|
|
|
|
a x1 |
E |
y1 |
b |
|
|
|
|
|
|
|
|
||
K |
1 |
2 |
5 |
6 K |
7 |
9 |
K |
|
3 K |
4 |
2 |
8 |
|
||
|
|
1 |
|
|
|
|
|
0 |
20 |
40 |
60 |
80 |
100 |
A |
|
|
|
|
B |
Рис. 13. 2. Исследование изотермы растворимости методом сечений
Прежде всего исследуются двойные оконтуривающие системы А - Н2О и В - Н2О. В этих сечениях набирается 6-8 смесей, половина из которых лежит в гомогенной части системы, а вторая половина - в гетерогенной. Проводится термостатирование приготовленных навесок, определяется физическое свойство жидкой фазы и строится функциональная зависимость физического свойства от состава, изображенная на рис. 13. 3, 4.
nD |
|
|
|
|
n |
D |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
5 |
6 |
A-H2O |
|
|
4 |
K-K |
|
||
4 |
7 |
8 |
|
3 |
5 |
6 |
7 |
|||
|
|
|
|
|
|
|
A-X |
|||
|
|
|
B-H2O |
|
|
2 |
|
|
|
|
3 |
4 |
5 |
6 |
|
1 |
|
|
B-Y |
8 |
|
|
|
|
|
|
9 |
|||||
|
|
|
|
|
|
|||||
3 |
|
|
|
|
|
|
|
|
||
2 2
1  1
1
ba % соли K1 y1x1 K2 % соли
Рис. 13. 3. Изотермы показателя пре- |
Рис. 13. 4. Изотермы показателя пре- |
ломления насыщенных растворов в се- |
ломления насыщенных растворов в |
чениях А-Н2О и В-Н2О системы А-В- |
сечениях К-К и В-Y системы А-В- |
Н2О |
Н2О |
142 |
|
Всечении А - Н2О смеси с 1-й по 4-ю представляют собой гомогенные системы, физическое свойство в которых монотонно возрастает. Смеси 5-8 являются гетерогенными системами, но поскольку состав насыщенного раствора в них остается постоянным, равным растворимости соли А, физическое свойство жидкой фазы этих систем одинаково. Точка пересечения функциональных зависимостей гомогенных и гетерогенных систем отвечает составу насыщенного раствора - а. Этот состав наносится на соответствующую сторону треугольника состава.
Для приготовления исходных смесей в сечении А - Х готовят раствор В в воде состава Х и к этому раствору добавляют различные количества соли А. Таким образом готовят 6-8 смесей, половина из которых являются гомогенными системами, а половина - гетерогенными.
После проведения термостатирования, определения физического свойства и построения функциональной зависимости "состав - свойство", изображенной на рис. 13.3, находят точку на линии насыщенных растворов относительно соли А. Изучая другие сечения направления А - Х, можно получить желаемое количество точек на ветви растворимости соли А.
Направление сечений В - У позволяет выявить ход линии моновариантных равновесий соли В и насыщенных растворов. Функциональная зависимость "состав - свойство" в сечении В - У, изображенная на рис. 13.
4, аналогична таковым в сечениях направления А - Н2О; В - Н2О; А - Х. Для уточнения положения двойной эвтонической точки изучают се-
чения, составленные гетерогенными системами с постоянным содержанием воды, например сечение К - К. Функциональная зависимость величины физического свойства жидкой фазы от состава в данном сечении приведена на рис 13. 4. Так как сечение пересекает три фазовые области, то на графике функциональной зависимости имеются три пересекающиеся в двух точках линии.
Точка К1 находится на границе полей кристаллизации соли А и совместной кристаллизации солей А и В - предельной ноде А - Е.
Точка К2 находится на границе полей кристаллизации соли В и совместной кристаллизации солей А и В - предельной ноде В - Е. Проведя
прямые АК1 и ВК2 до пересечения друг с другом, можно легко установить положение эвтонической точки Е. Таким образом, изучая сечения направления А - Х; В - У; К - К, не прибегая к химическому анализу, можно изучить изотерму растворимости.
Взаключение выскажем несколько замечаний. В качестве физического свойства целесообразно использовать показатель преломления жидких фаз. Изломы на функциональных кривых можно определять на ЭВМ. Метод сечений требует кропотливого труда по взвешиванию веществ при приготовлении исходных смесей, а время, затрачиваемое на это, не всегда меньше времени, затрачиваемого на химический анализ насыщенных рас-
143
творов. Другими словами, метод сечений особенно эффективен, когда затруднено проведение химического анализа насыщенного раствора.
13.2. Новые методы изучения водно-солевых сисетм
13.2.1. Расчетные методы
Наиболее распространенным является термодинамический подход к исследованию растворов, обладающий строгостью и общностью получаемых выводов, отсутствием концентрационных ограничений.
Для насыщенных равновесных растворов химический потенциал соли в растворе и твердой фазе (µs) равны:
µs = µ°+ RT ln a |
(13.1) |
Здесь µ° − постоянная, характеризующая стандартное состояние растворенного вещества; a – его активность в данном растворе (a = mγ, где γ − коэффициент активности вещества).
Из уравнения (13. 1) следует, что при постоянных температуре и давлении активность соли в ее насыщенных растворах любого состава остается постоянной.
Так, если в тройной водно-солевой системе S1 – S2 – H2O на ветви растворимости кристаллизуется безводная соль S1, то по условиям фазового и химического равновесия, вдоль нее выполняется равенства:
ln a = ln a1 = const |
(13.2) |
a1 = m1 γ1(2) |
(13.3) |
γ1(2) = f (m1, m2 ) |
(13.4) |
Определив значение функции «ln a» в точке растворимости соли S1 в воде, по условию ее постоянства (2) рассчитывается положение ветви изотермы растворимости. Здесь a1 и a2 – активности солей S1 и S2; m – моляльные концентрации солей; γ – коэффициенты активности солей, насыщающих раствор; первый индекс без скобок при γ показывает какой солью насыщен раствор, второй индекс в скобках – другую соль, присутствующую в растворе.
Большинство методов расчета коэффициентов активности γ либо содержат значительное число варьируемых параметров (до 18 у Скетчерда), не имеющих определенного физического смысла и неудобных из-за усложненной формы расчетных уравнений, либо носят оценочный характер и имеют ограниченную по концентрации область применения.
В 1973 г. Питцером предложена система уравнений, которые имеют простую форму для описания как бинарных, так и многокомпонентных систем, включают небольшое число параметров, имеющих определенный физический смысл, и воспроизводят термодинамические свойства растворов в широкой области концентрация.
144
К недостаткам метода Питцера следует отнести его применимость лишь в области невысоких температур (справочные данные приводятся в литературе, как правило, только для температуры 25°C), хотя и для достаточно высоких концентраций. Кроме того, в исходном виде уравнения Питцера не позволяют учесть влияния сильных взаимодействий ионов в растворе, таких как комплексообразование. Термодинамические расчеты в достаточно сложных системах не только с большим числом компонентов, а, прежде всего, в системах, со сложной химической природой взаимодействия компонентов, носят пока приближенный характер.
Использование только термодинамических моделей для описания фазовых равновесий в водно-солевых системах невозможно. При всей их привлекательности, точность определения границ фазовых областей на диаграмме в ряде случае не удовлетворяет требованиям, предъявляемой химической технологией. В тоже время, термодинамические модели могут оказаться незаменимыми для предварительной оценки системы.
13.2.2. Изопиестический метод
Исследование фазовых равновесий изопиестическим методом осуществляется следующим образом. В замкнутом изолированном пространстве концентрации исследуемого и стандартного растворов изменяются так, что давления пара над растворами выравниваются. Изменение состава раствора при этом происходит вдоль луча испарения, направленного из точки состава растворителя. Зная состав исходных смесей и определяя убыль воды в конечных смесях взвешиванием, находят составы конечных смесей, находящиеся на изотерме растворимости.
При определении составов на предельных нодах в качестве стандартного используется эвтонический раствор. Вода из исследуемого раствора будет испаряться до тех пор, пока активность воды в них не будет равна активности воды в эвтоническом растворе, а состав ИСК достигнут предельных нод.
Этот метод позволяет определить с большой точностью состав твердых фаз без отбора проб. К достоинствам изопиестического метода изучения растворимости в водно-солевой системе можно отнести его простоту, возможность изучения составов граничных состояний системы. Метод отличается большой точностью, определяемой взвешиванием и чистотой реактивов. Изопиестический метод особенно удобен в том случае, когда компоненты системы имеют не очень большую и не очень маленькую растворимость.
Недостатком этого метода является значительная продолжительность эксперимента, время которого для установления равновесия может варьироваться от суток до нескольких месяцев. Метод хорошо работает на трехкомпонентных системах. Литературных данных об изученных четы-
145
рех- и более компонентных системах изопиестическим методом нами не обнаружено.
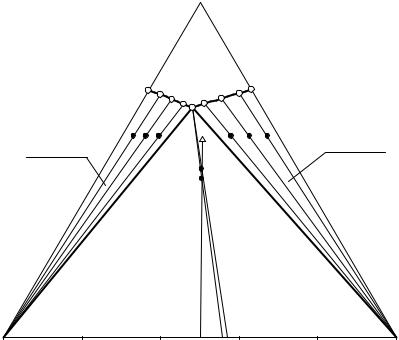
13.2.3. Прогностический способ исследования растворимости (видоизмененный метод остатков)
Прогностический метод, как и метод остатков Схрейнемакерса, относится к изотермическим и использует химический анализ для определения состава насыщенного раствора. Равновесные твердые фазы определяются сходящимися лучами кристаллизации, построенными по данным о составах насыщенных растворов и ИСК (видоизмененный метод остатков).
Особенностями прогностического метода являются: планирование исследования путем приблизительного предсказания составов насыщенных растворов (прогностический метод); вычисление оптимальных составов ИСК; вычисление соотношения солевых компонентов в донной фазе по аналитически установленным составам жидких фаз и соответствующих им ИСК.
Рассмотрим применение прогностического метода на примере тройной водно-солевой системы NaCl – NH4Cl – H2O при 25°С, изотерма растворимости которой имеет простой эвтонический тип
(см. рис. 13. 5).
|
|
H2O |
|
|
|
|
||
|
|
|
L |
|
|
|
|
|
R1 |
3''4'' |
|
|
6'' |
7" 8" |
|
R |
2 |
|
5'' |
|
|
|
|
|||
|
|
E |
|
|
|
|
|
|
3 4 5 |
|
|
|
6 |
7 |
8 |
||
L+NaCl |
|
|
|
|
|
|
|
L+NH4Cl(s) |
(s) |
|
|
|
Epr |
|
|
|
|
|
|
|
|
|
|
|
||
|
|
2 |
|
1 |
|
|
|
|
|
|
|
E(L)+NH4Cl(s)+NaCl(s) |
|
|
||
|
|
|
|
|
|
|
|
0 |
20 |
2' |
1' |
80 |
100 |
||
40 % мас. |
60 |
||||||
NaCl |
|
|
|
|
NH4Cl |
||
Рис. 13. 5. Планирование исследования изотермы растворимости прогностическим методом
146
Вычисление оптимального состава ИСК производят, используя наилучшие соотношения твердых и жидких фаз, по предполагаемому (прогнозируемому) составу жидкой фазы исходя из следующих условий: состав ИСК должен находиться в исследуемой фазовой области системы; в процессе термостатирования распадаться на жидкие и твердые фазы в количествах, позволяющих легко производить перемешивание системы (10–30% донной фазы); количества твердых фаз в донной фазе должны быть приблизительно одинаковыми.
Применение указанных выше условий определяется конкретной исследовательской задачей. Например, оптимальный состав ИСК для определения двойного эвтонического раствора вычисляем по уравнению прямой, задаваемой координатами предполагаемого состава двойного эвтонического раствора и оптимального соотношения твердых фаз (по 50% каждой):
x −x1 |
= |
y − y1 |
= |
z −z1 |
=... = k . |
(13.5) |
||||||||
|
|
|
||||||||||||
x |
2 |
−x |
1 |
|
y |
2 |
− y |
|
z |
2 |
−z |
1 |
|
|
|
|
|
|
1 |
|
|
|
|
|
|||||
Коэффициент прямой задают оптимальным соотношением жидкой и донной фаз, который должно быть в интервале от 0,1 до 0,20. Таким образом, содержание любого компонента в оптимальном составе ИСК (xИСК) можно вычислить по следующей формуле:
xИСК = k·( xДф−xПСНР)+xПСНР, |
(13.6) |
где xПСНР – содержание компонента в предполагаемом составе насыщенного раствора, массовые доли; xДФ – содержание компонента в донной фазе, массовые доли; k – коэффициент, показывающий желаемое соотношение твердой и жидкой фаз после установления равновесия.
Для определения состава эвтонического раствора оптимальные ИСК с двумя различными содержаниями донной фазы термостатируют и после установления равновесия экспериментально определяют состав равновесной жидкой фазы методами химического анализа. Если данные аналитических определений компонентов равновесных жидких фаз в обоих опытах отличаются друг от друга не более чем в пределах ошибок определения компонентов то считаем, что состав эвтонического раствора установлен. Вычисляем соотношения исходных компонентов в донной фазе по составам насыщенного раствора и ИСК вместо остатка и убеждаемся, что содержания обоих исходных солевых компонента в ней достаточно велики.
Далее изучают линии моновариантного равновесия (ветви растворимости солей). Составы предполагаемых растворов (x) рассчитывают по уравнению прямой, соединяющей соответствующие состав насыщенных растворов и экспериментально найденного двойного эвтонического раствора системы, задавая коэффициенты промежуточных точек (kПСНР):
x = kПСНР·(x2−x1)+x1, |
(13.7) |
147
где x – содержание компонента в предполагаемом составе моновариантного раствора; x1 – растворимость компонента; x2 – содержание данного компонента в эвтоническом растворе.
Коэффициент (kПСНР) в уравнении (13.7) вычисляют в соответствии с количеством необходимых экспериментальных составов (N), находящихся на линиях моновариантных равновесий между растворимостями компонентов и эвтоникой системы, вычисляемый по формуле: kПСНР = =n/(N+1), где N – необходимое количество точек, а n – целое число, изменяющееся от 1 до N.
Оптимальные составы ИСК для исследования линий моновариантных равновесий вычисляют по уравнению (13.6), задаваемому координатами предполагаемого состава моновариантного раствора, твердой фазы и оптимального соотношения твердой и жидкой фаз (10÷20% донной фазы).
Несмотря на то что прогностический метод дает возможность сократить аналитические определения вдвое, быстро и надежно устанавливать составы эвтонических растворов, он не позволяет определять фигуративные (репéрные, см. ниже) точки на предельных нодах (границах фазовых областей) и, следовательно, вычислять основные коэффициенты и устанавливать истинность использованной системы координат, составы твердых фаз, равновесных нонвариантному раствору.
13.2.4. Оптимизированный метод сечений
Использование метода сечений в практике исследования многокомпонентных водно-солевых систем потребовало его усовершенствования. Найдены новые приемы исследований, позволяющие проще, быстрее и точнее изучать фазовые равновесия:
−прогнозирование и вычисление предполагаемых составов нонвариантных растворов;
−определение составов смесей компонентов на нонвариантных фазовых границах (репéрных точек) при помощи сечений оптимальных направлений;
−определение истинности системы координат по составам репéрных точек и вычисление составов нонвариантных равновесных фаз.
Сущность оптимизации метода состоит в применении только таких сечений, в которых функциональные зависимости показателя преломления равновесной жидкой фазы от состава ИСК имеют горизонтальный участок. Точки излома на этих изотермах функциональных зависимостях определяются максимально точно. Составы ИСК в этих сечениях готовятся двумя или тремя взвешиваниями.
Последовательность применения оптимизированного метода сечений для исследования тройных водно-солевых систем складывается из следующих этапов:
148

1)определяют растворимость компонентов методом сечений, их чистоту и возможность использования для дальнейших исследований;
2)определяют составы репéрных точек на всех нонвариантных фазовых границах сечениями оптимальных направлений. Вычисляя основные коэффициенты, доказывают истинный способ выражения концентраций репéрных точек, находят составы нонвариантных равновесных фаз;
3)исследуют все линии моновариантных равновесий, используя сечения оптимальных направлений;
4)обобщают результаты исследований: экспериментальные данные сводят в итоговые таблицы и изображают на соответствующих рисунках.
13.2.4, 1). Изучение растворимости в оконтуривающих системах
Рассмотрим применение метода сечений к изучению тройной вод- но-солевой системы NaCl – Na2CO3·2Na2SO4 – Н2О при 50°С простого эвтонического типа, являющейся разрезом четверной системы Na+ // Cl−, CO32−, SO42− – H2O. В ней образуется химическое соединение состава Na2CO3·2Na2SO4 (беркеит), которое при 50°С конгруэнтно растворяется в воде.
Исследование двойных оконтуривающих систем проводят при помощи сечений: Na2CO3·2Na2SO4 – Н2О и NaCl – Н2О. В этих сечениях, опираясь на литературные данные по растворимости компонентов, набирают смеси, часть которых равномерно распределяют во всей гомогенной части сечения, а другую (2 – 3 смеси) – глубоко в гетерогенной части. При этом функциональная зависимость гомогенных составов послужит в дальнейшем для уточнения концентраций растворов индивидуальных компонентов по их показателю преломления.
Пример функциональной зависимости показателя преломления жидкой фазы от состава ИСК при изучении растворимости беркеита (сечение Na2CO3·2Na2SO4-Н2О) приведен на рис. 13.6.
|
nD50 |
|
|
|
|
6 |
7 |
8 |
9 |
1,38 |
|
|
|
|
|
|
|
|
|
1,37 |
|
|
|
|
5 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
4 |
|
|
|
|
|
1,36 |
|
|
|
|
|
|
|
|
|
|
|
|
3 |
|
|
|
|
|
|
1,35 |
|
2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
1,34 |
1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
1,33 |
|
|
|
|
|
|
R2 35 |
|
|
0 |
5 |
10 |
15 |
20 |
25 |
30 |
40 |
45 |
|
|
|
|
|
|
|
2Na2SO4·Na2CO3, % мас. |
|||
Рис. 13. 6. Функциональная зависимость показателя преломления жидкой фазы в сечении Na2CO3·2Na2SO4
– Н2О при 50°С
n 50 |
|
|
|
|
5 |
|
|
|
|
|
D |
|
|
|
4 |
|
6 |
7 |
|
|
|
|
|
|
|
|
|
|
||||
1,381 |
3 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
1,380 |
2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
1,379 |
|
|
|
|
|
|
|
|
|
|
|
1 |
|
|
|
|
|
|
|
8 |
|
1,378 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
9 |
1,377 |
|
f |
|
|
|
|
g24 |
|
|
|
0 |
4 |
8 |
12 |
16 |
20 |
28 |
32 |
36 |
||
|
|
|
|
|
|
|
2Na2SO4·Na2CO3, % мас. |
|||
Рис. 13. 7. Изотерма показателя преломления насыщенных растворов в изогидрическомсечении FG системы NaCl – Na2CO3·2Na2SO4 – Н2О при 50°С
149
В сечении Na2CO3·2Na2SO4-Н2О смеси с 1-й по 6-ю являются гомогенными, в которых физическое свойство монотонно возрастает. ИСК 7–9 являются гетерогенными, в которых состав равновесной жидкой фазы остается постоянным, соответствующим растворимости соли (R2). Равенство физического свойства жидкой фазы гетерогенных смесей с высоким содержанием твердой фазы однозначно указало на чистоту взятого для опытов беркеита, что позволило использовать его в дальнейших экспериментах.
Точка излома функциональной зависимости отвечает составу насыщенного раствора беркеита (R2), который переносят на соответствующую сторону треугольника состава.
Растворимость NaCl в воде изучают при помощи сечения NaCl-Н2О, функциональная зависимость которого выглядит аналогично рис. 13. 6. Определенную растворимость (R1) переносят на треугольник состава системы.
13.2.4, 2). Определение состава нонвариантного двояконасыщенного раствора
Для выяснения состава нонвариантного раствора в системе NaCl – Na2CO3·2Na2SO4 – Н2О при 50°С выдвигаем гипотезу, что этот раствор является эвтоническим, насыщенным индивидуальными исходными солями и имеет следующий состав (Еpr, % мас.): 7,4 – Na2CO3·2Na2SO4; 22,9 – NaCl; 69,7 – Н2О. Приведенный состав является производным от состава тройного эвтонического раствора насыщенного хлоридом натрия, беркеитом и сульфатом натрия, имеющегося в справочнике по растворимости. Небольшое содержание сульфата натрия в трояконасыщенном растворе заменено на воду.
Изотерма растворимости в разрезе NaCl – Na2CO3·2Na2SO4 – Н2О при 50°С и основные типы оптимальных сечений для ее исследования приведены на рис. 13. 8.
Общим свойством любых составов на предельных нодах является постоянство отношений содержаний отсутствующих в данной вершине компонентов друг к другу (Na2CO3·2Na2SO4/Н2О и NaCl/Н2О, см. выше о свойствах концентрационных треугольников). Репéрные точки, находящиеся на предельных нодах также подчиняются этому правилу. Таким образом, в точках f и h на ноде E-NaCl отношения {Na2CO3·2Na2SO4}/{Н2О} должны быть одинаковы, как и {NaCl}/{Н2О} в точках b и g ноде Е- Na2CO3·2Na2SO4. Данный факт подтверждает или опровергает гипотезу о том, что нонвариантный раствор насыщен исходными солевыми компонентами, а способ выражения составов репéрных точек является истинным или аналитическим.
150
