
Курс лекций Ашуйко
.pdf
|
|
|
+6 |
|
+3 |
|
|
||
Cr |
O |
2− (K |
Cr O ) + Восстановитель + H+ |
|
|
Cr3+ (Cr (SO ) ) |
|||
|
|||||||||
2 |
7 |
2 |
2 |
7 |
2 |
4 |
3 |
||
|
|
+6 |
|
|
|
|
+3 |
|
|
CrO42− (K2CrO4) + Восстановитель + OH− |
|
|
CrO2− (KCrO2) |
||||||
|
|
||||||||
Окислительные свойства азотной кислоты. Окислителем в молекуле азотной кислоты является ион NO3– (N+5), который в зависимости от концентрации HNO3 и активности восстановителя (например, металла) принимает от 1 до 8 электронов, образуя:
+4 |
|
+2 |
+1 |
|
0 |
|
−3 |
|
NO2 |
; |
NO ; |
N2 |
O ; |
N2 |
; |
NH3 |
(NH4NO3); |
уменьшение концентрации кислоты уменьшение активности восстановителя
Ряд напряжений металлов:
Li K Ba Sr Ca Na Mg Al MnCr Fe Cd Co Ni Sn |
Sb |
Bi Cu Ag |
|
|
Zn |
Pb |
H Hg |
|
Pt Au |
I |
II |
II |
|
IV |
активные |
средней активно- |
неактивные |
|
|
|
сти |
|
||
|
|
|
|
|
Схемы процессов взаимодействия азотной кислоты с металлами можно представить следующим образом:
|
|
|
|
|
|
I |
+1 |
0 |
|
|
|
|
|
|
|
|
|
Нитрат Me + N2O (N2) + H2O |
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
II |
+4 |
+2 |
|
+5 |
|
|
|
|
|
|
|
Нитрат Me + NO2 (NO) + H2O |
|
|
|
|
|||||||
HNO3(конц) + Me |
|
|
|
|
III |
+4 |
|
||
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
Нитрат Me + NO2 + H2O |
|
|
|
|
|
|
|
IV |
|||
|
|
|
|
|
|
|
не взаимодействуют |
||
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
I |
|
−3 |
−3 |
|
|
|
|
|
|
|
|
Нитрат Me + NH4NO3 (NH3) + H2O |
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
II |
0 |
|
|
+5 |
|
|
|
|
|
|
|
Нитрат Me + N2 |
+ H2O |
|
|
|
|
|
|
|
|||
HNO3(разб) + Me |
|
|
III |
+2 |
|
||||
|
|
||||||||
|
|
|
|
|
|
|
|
Нитрат Me + NO + H2O |
|
|
|
|
|
|
|
|
|
||
IV |
не взаимодействуют |
|
Al, Cr, Fe не реагируют без нагревания с HNO3(конц) ввиду пассивации. Неметаллы восстанавливают концентрированную азотную кислоту до
NO2 или NO, при этом сами окисляются, как правило, до своей кислоты в высшей степени окисления:
+5 |
|
Кислота неметалла |
+4 +2 |
HNO3(конц) + Неметалл |
|
в высшей степени |
+ NO2(NO) + H2O |
|
|||
|
|
окисления неметалла |
|

Окислительные свойства серной кислоты. В зависимости от концен-
трации серная кислота ведет себя различным образом. В разбавленных растворах серной кислоты окислителем является катион водорода (Н+). При этом образуется соль и выделяется водород.
В концентрированных растворах серной кислоты окислителем является S+6. Продукты восстановления серной кислоты определяются активностью взаимодействующих с ней металлов, согласно ряду напряжений.
Схемы процессов взаимодействия серной кислоты с металлами можно представить следующим образом:
+1 |
|
I, II |
0 |
|
|||
H2SO4(разб) + Me |
|
|
|
Сульфат Me + H2 |
|
||
|
|
|
|
||||
|
|
|
|
|
I |
-2 |
|
|
|
|
|
|
|
Сульфат Me + H2S + H2O |
|
|
|
|
|
|
|
||
|
|
|
|
|
II |
0 |
|
+6 |
|
|
|
|
|
Сульфат Me + S + H2O |
|
|
|
|
|
|
|||
H2SO4(конц) + Me |
|
|
|
|
III |
+4 |
|
|
|
|
|
|
|||
|
|
|
|
|
|
Сульфат Me + SO2 |
+ H2O |
|
|
|
|
|
|
||
IV |
не взаимодействуют |
|
Исключением из приведенной схемы являются Al, Cr, Fe, которые не реагируют без нагревания с H2SO4(конц) ввиду пассивации.
Некоторые неметаллы взаимодействуют с концентрированной серной кислотой, при этом они восстанавливают ее до SO2:
+6 |
Неметалл |
|
Кислота неметалла |
+4 |
|
H2SO4(конц) + |
|
в высшей степени |
+ SO2 |
+ H2O |
|
|
|||||
|
(P, As, C, B) |
|
окисления неметалла |
|
|
|
|
|
|
|
P окисляется до H3PO4; As – до H3AsO4; C – до H2CO3 (H2O + CO2).
Пример. Запишите уравнение реакции взаимодействия концентрированной HNO3 с фосфором и уравняйте электронным и ионно-электронным способом. Вычислите молярную массу эквивалента окислителя.
Фосфор (неметалл) восстанавливает HNO3(конц) до NO, а сам окисляется до кислоты в максимальной степени окисления (H3PO4):
+1 +5 −2 |
0 |
+1 |
+5 −2 |
+2 −2 |
H NO3 (конц) |
+ P → H3 |
P O4 |
+ NO |
|
Электронный баланс.
P0 – 5e– →
P+5
N+5 + 3e– →
N+2
Mетод полуреакций.
Схема реакции в ионно-молекулярной форме:
H+ + NO3− + P → H3PO4 + NO
Записываем полуреакции как описано выше: |
|
|||||
|
NO− + 4H+ |
+3e− = NO + 2H O |
|
3 |
|
5 |
|
|
|||||
14243 |
14243 |
|
|
|
|
|
+3 |
0 |
|
|
15 |
|
|
P + 4H O − |
5e− = H3PO +5H+ |
|
5 |
3 |
||
|
|
|||||
14243 |
1442443 |
|
|
|
|
|
0 |
+5 |
|
|
|
|
|
|
|
|
|
|
|
|
5NO3− + 20H+ +3P +12H2O =5NO +10H2O +3H3PO4 +15H+
Приводим подобные и получаем сокращенное уравнение:
5NO3− +5H+ +3P + 2H2O =5NO +3H3PO4 .
Окончательное уравнение в молекулярной форме имеет вид:
5HNO3 +3P + 2H2O =3H3PO4 +5NO .
ЭЛЕКТРОДНЫЕ ПОТЕНЦИАЛЫ. ГАЛЬВАНИЧЕСКИЕ ЭЛЕМЕНТЫ. НАПРАВЛЕНИЕ ПРОТЕКАНИЯ ОКИСЛИТЕЛЬНОВОССТАНОВИТЕЛЬНЫХ РЕАКЦИЙ
Электродные потенциалы
Электрохимия представляет собой область химии, которая изучает реакции, протекающие с подводом и отводом электрической энергии; такие процессы называются электрохимическими. При электрохимических реакциях происходит превращение химической энергии в электрическую и, наоборот, электрической энергии в химическую.
Для проведения электрохимической реакции необходима электрохимическая цепь, существенными элементами которой являются электроды. Рассмотрим простейший электрод, представляющий собой металлическую пластинку, опущенную в раствор соли этого же металла, например, цинковая пластинка, опущенная в раствор ZnSO4.
При погружении цинка в водный раствор его соли под действием молекул воды часть ионов металла переходит с поверхности пластинки в раствор:
Zn – 2e– = Zn2+
При этом металлическая пластинка заряжается отрицательно, так как электроны, образовавшиеся в процессе перехода металла в раствор, осаждаются на поверхности металла, поскольку раствор не обладает электронной проводимостью. Гидратированные ионы металла притягиваются к отрицательно заряженной пластинке, образуя на границе металл – раствор двойной электрический слой.
Количественной характеристикой этого процесса является электродный потенциал Е – потенциал, возникающий на границе раздела двух фаз (металла и водного раствора электролита). Абсолютное значение электродного потенциала экспериментально определить невозможно. Можно определить только разность потенциалов между двумя электродами, одним из которых является электрод сравнения. В качестве электрода сравнения, по отношению к которому определяют потенциалы других электродов, принят стандартный водородный электрод.
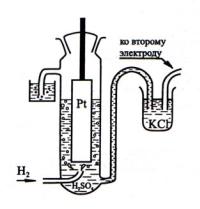
Стандартный водородный электрод
Стандартный водородный электрод представляет собой стеклянный

сосуд, в котором находится платиновая пластинка, покрытая черненой платиной (рыхлой пористой платиной с большой поверхностью для сорбции газообразного водорода). Сосуд заполняется раствором серной кислоты с концентрацией ионов водорода 1 моль/л. Через сосуд пропускают очищенный газообразный водород под давлением 1 атм при температуре 298 К. На границе платины и раствора серной кислоты устанавливается равновесие между ионами водорода в растворе и газообразным водородом, адсорбированным платиной:
{Н+}aq + 2e– = ½(Н2)
Стандартный электродный потенциал такого электрода принят равным нулю:
EH0 + H2 = 0 В.
H2 = 0 В.
Электродные потенциалы металлов, измеренные по отношению к стандартному водородному электроду при стандартных условиях (концентрация ионов металла 1 моль/л, Т = 298 К, р = 1 атм), называются стандартным
электродным потенциалом:
Еоox/red
Величины стандартных электронных потенциалов располагают в ряд по мере их увеличения и называют электрохимическим рядом напряжений металлов:
Li K Ba Ca Na Mg Al Zn Cr Fe Cd Co Ni Sn Pb H2 Bi Cu Ag Hg Au Pt
Ряд напряжений характеризует следующие химические свойства метал-
лов:
-чем отрицательнее значение стандартного электродного потенциала (чем левее расположен металл в ряду напряжений), тем сильнее его восстановительная способность и тем слабее окислительная способность его иона в растворе;
-каждый металл способен вытеснять из растворов солей те металлы, которые стоят в ряду напряжений правее его;
-металлы, стоящие в ряду напряжений левее водорода, способны вытеснять его из растворов кислот (кроме азотной кислоты).
Уравнение Нернста
Величина электродного потенциала зависит от природы электрода, концентрации электролита и температуры. Эта зависимость выражается уравнением Нернста, которое для простых полуреакций:
Mez+ + Zē = Me0
имеет вид
EMez+ Me = EMe0 z+ Me + Rz FT ln CMez+ ,

где EMez+ Me – электродный потенциал полуреакции, В; EMe0 z+ Me – стандарт-
ный электродный потенциал полуреакции, В; R – универсальная газовая постоянная, равная 8,31 Дж/(моль К); T – абсолютная температура, К; F – постоянная Фарадея, равная 96 484 Кл/моль; z – число электронов, участвующих в электродном процессе; CMez+ – концентрация (активность) ионов металла в
растворе, моль/л.
При стандартной температуре 298 К после подстановки в уравнение постоянных и после перехода от натурального логарифма к десятичному уравнение Нернста примет следующий вид:
EMez+ Me = EMe0 z+ Me + 0,059z lgCMez+ .
Значения стандартных электродных потенциалов для полуреакций относительно стандартного водородного электрода приводятся в справочных таблицах.
По значениям стандартных электродных потенциалов полуреакций можно сравнивать окислительно-восстановительные свойства веществ, составляющих полуреакцию. Чем меньше E0, тем сильнее выражены восстановительные свойства вещества, а чем больше E0, тем сильнее выражены окислительные свойства вещества.
Пример 1. Рассчитайте потенциал серебряного электрода, опущенного в насыщенный раствор хлорида серебра.
Решение. Потенциал серебряного электрода, на котором устанавливается электродное равновесие
Ag + + ē = Ag
находим по уравнению Нернста. Для серебряного электрода уравнение Нернста будет иметь следующий вид:
EAg+ Ag = EAg0 + Ag + 0,0591 lgCAg+ .
В насыщенном растворе хлорида серебра устанавливается равновесие между осадком и ионами в растворе.
Записываем выражение для произведения растворимости AgCl:
ПР =CAg+ CCl− =1,77 10−10 .
Концентрация ионов серебра в насыщенном растворе равна концентрации ионов хлора:
CAg+ =CCl− .
Тогда из выражения для ПР находим концентрацию ионов серебра:
(CAg+ )2 =1,77 10−10 ,

CAg+ = 1,77 10−10 =1,33 10−5 моль/л.
Значение стандартного электродного потенциала берем из справочника и вычисляем значение потенциала:
EAg+ Ag = 0,8 +0,059 lg(1,33 10−5 )= 0,8 +0,059 (−4,87)= 0,512 В.
Ag = 0,8 +0,059 lg(1,33 10−5 )= 0,8 +0,059 (−4,87)= 0,512 В.
ГАЛЬВАНИЧЕСКИЕ ЭЛЕМЕНТЫ
Устройства, которые обеспечивают превращение энергия химической реакции в электрическую работу, называются гальваническими элементами. Они должны иметь в своем составе два электрода – металлы, погруженные в растворы электролитов, которые содержат соответственно окислитель и восстановитель. Растворы должны сообщаться друг с другом пористой перегородкой, которая обеспечивает прохождение через электролиты электрического тока и препятствует непосредственному взаимодействию окислителя и восстановителя.
Электрод, находящийся в контакте с окислителем и на котором происходит процесс восстановления, называется катодом, а электрод, находящийся в контакте с восстановителем и на котором происходит процесс окисления, называется анодом. Электроны во внешней цепи будут двигаться от анода к катоду. Поэтому в гальваническом элементе анод будет иметь отрицательный потенциал или «–», а катод – положительный потенциал или «+». Разность потенциалов катода Eк и анода Eа называется электродвижущей силой (ЭДС) гальванического элемента:
∆E = Eк − Eа .
Рассмотрим гальванический элемент, состоящий из цинкового и медного электродов (элемент Даниэля – Якоби).
Гальванический элемент
Поскольку самопроизвольно электроны могут переходить только от электрода с большей концентрацией электронов к электроду с меньшей концентрацией, то в процессе действия рассматриваемого гальванического элемента электроны во внешней цепи движутся от цинка к меди. На цинковом электроде происходит процесс окисления. Медь в данном случае играет роль

инертного электрода, который передает электроны, поступившие от цинка, ионам меди, находящимся в растворе сульфата меди. Таким образом, на медном электроде происходит восстановление катионов меди.
Во внутренней цепи сульфат-ионы, оказавшиеся в избытке в катодном пространстве, переходят через пористую перегородку или через солевой мостик в анодное пространство, где компенсируют заряды образовавшихся при окислении ионов цинка.
В основе работы данного гальванического элемента лежит реакция: Zn + CuSO4 = Cu + ZnSO4
Элемент будет работать до тех пор, пока цинковый анод полностью не раствориться или не восстановиться вся медь из раствора сульфата меди.
Zn – 2e– = Zn2+ - процесс окисления на аноде
Cu2+ + 2e– = Cu - процесс восстановления на катоде Zn + Cu2+ = Zn2+ + Cu - суммарная реакция
При схематическом изображении гальванического элемента граница раздела между металлом и раствором электролита изображается вертикальной чертой, а граница между растворами электролитов – двойной вертикальной чертой. Например, схема гальванического элемента, в основе работы которого лежит реакция
Zn + 2AgNO3 = Zn (NO3 )2 + 2Ag
изображается следующим образом:
! Zn Zn (NO3 )2 
 AgNO3 Ag
AgNO3 Ag
Эта же схема может быть изображена в ионной форме: ! Zn Zn2+ 
 Ag+ Ag
Ag+ Ag
Знаки «–» и «+» электродов и, соответственно, анод и катод находим из сравнения стандартных электродных потенциалов:
E0 |
2+ |
Zn |
= −0,76 В E0 |
+ |
Ag |
= 0,80 В. |
Zn |
|
Ag |
|
|
Стандартный потенциал цинка много меньше, чем серебра, поэтому цинковый электрод будет иметь знак «–» и будет анодом, на котором идет полуреакция окисления металлического цинка:
А! : Zn −2e− = Zn2+
а серебряный электрод будет иметь знак «+» и будет катодом, на котором идет полуреакция восстановления ионов серебра:
К : Ag+ +e− = Ag
Иногда на схеме указывают концентрацию электролитов в растворе:

! Zn 0,1 н. Zn (NO3 )2 
 0,1 M AgNO3 Ag
0,1 M AgNO3 Ag
Для реакции
Zn + 2HCl = ZnCl2 + H2
схема гальванического элемента будет иметь следующий вид: ! Zn ZnCl2 
 HCl Pt (H2 )
HCl Pt (H2 )
где Pt(H2) обозначает водородный электрод, состоящий из инертного металла Pt, выполняющего здесь роль катода, на котором идет полуреакция восстановления катионов водорода:
К : H+ +e− = 0,5H2
На аноде протекает полуреакция окисления цинка А! : Zn −2e− = Zn2+
Эта же схема элемента в ионной форме будет иметь следующий вид: ! Zn Zn2+ 
 H+ Pt (H2 )
H+ Pt (H2 )
Пример. Гальванический элемент состоит из металлического цинка, погруженного в 0,1 н. раствор нитрата цинка, и металлического свинца, погруженного в 0,02 М раствор нитрата свинца. Вычислите ЭДС элемента, напишите уравнения электродных процессов, составьте схему элемента.
Дано: |
Решение. Чтобы определить, какой из |
С(1z Zn(NO3 )2 )= 0,1 моль/л |
электродов будет катодом, а какой – |
анодом, рассчитаем и сравним элек- |
|
С(Pb(NO3)2) = 0,02 моль/л |
тродные потенциалы цинкового и |
∆E – ? |
свинцового электродов. Расчет прове- |
|
дем по уравнению Нернста. |
Вычисляем электродный потенциал цинкового электрода. На цинковом электроде устанавливается электродное равновесие
Zn2+ + 2ē = Zn
Уравнение Нернста для цинкового электрода будет иметь вид:
EZn2+ Zn = EZn0 2+ Zn + 0,0592 lgCZn2+ .
Находим концентрацию ионов цинка в растворе:
Zn(NO3 )2 → Zn2+ + 2NO3− (α = 1, сильный электролит)
CZn2+ = α n C0 =1 1 C0 =C0 =
=C (Zn (NO3 )2 )= 1z C (1z Zn(NO3 )2 )= 12 0,1 = 0,05 моль/л.
Рассчитываем потенциал цинкового электрода:

EZn2+ Zn = −0,76 + 0,0592 lg0,05 = −0,76 + 0,0592 (−1,301)= −0,80 В.
Zn = −0,76 + 0,0592 lg0,05 = −0,76 + 0,0592 (−1,301)= −0,80 В.
Вычисляем электродный потенциал свинцового электрода:
Pb2+ + 2 ē = Pb
EPb2+ Pb = EPb0 2+ Pb + 0,0592 lgCPb2+ .
Pb(NO3 )2 → Pb2+ + 2NO3− (α = 1, сильный электролит)
CPb2+ = α n C0 =1 1 C0 =C0 =C (Pb(NO3 )2 )= 0,02 моль/л.
Находим потенциал свинцового электрода:
EPb2+ Pb = −0,13 + 0,0592 lg0,02 = −0,13 + 0,0592 (−1,699)= −0,18 В.
Pb = −0,13 + 0,0592 lg0,02 = −0,13 + 0,0592 (−1,699)= −0,18 В.
Сравниваем электродные потенциалы цинкового и свинцового электро-
дов:
EZn2+ Zn = −0,80 В EPb2+ Pb = −0,18 В.
Значит, цинковый электрод будет иметь знак «–» и будет анодом, на котором идет полуреакция окисления металлического цинка:
А! : Zn −2e− = Zn2+
а свинцовый электрод будет иметь знак «+» и будет катодом, на котором идет процесс восстановления ионов свинца:
К : Pb2+ + 2e− = Pb
Схема гальванического элемента будет иметь следующий вид: ! Zn 0,1н. Zn(NO3 )2 
 0,02 M Pb(NO3 )2 Pb
0,02 M Pb(NO3 )2 Pb
ЭДС элемента равна:
∆E = Eк − Eа = EPb2+ Pb − EZn2+ Zn = −0,18 −(−0,80)= 0,62 В.
НАПРАВЛЕНИЕ ПРОТЕКАНИЯ ОВР
Понятие электродного потенциала применимо не только к паре Меn+|Мео,
но и к любой сопряженной системе окисленная форма/восстановленная форма. Его называют окислительно-восстановительным потенциалом. Окис- лительно-восстановительный потенциал, измеренный при стандартных условиях, называется стандартным окислительно-восстановительным потенциалом. В электрохимии принято все электродные равновесия записывать в направлении процесса восстановления, то есть присоединения электронов:
Zn2+ + 2e– = Zn , Ео= - 0,76 В
Значения стандартных окислительно-восстановительных потенциалов
