
общая и неорганическая химия
.pdf51
ды – можно получить непосредственным взаимодействием металлов с серой. Ма- лорастворимые сульфиды можно получить, действуя сероводородом на растворы солей соответствующих металлов:
CuSO4 + H2S ® CuS¯ + H2SO4 .
Протекание этой реакции возможно потому, что произведение растворимости об- разующегося сульфида меди меньше общей константы диссоциации сероводо-
родной кислоты: ПР(CuS) = 6×10–36 << Kобщая(H2S) = K1×K2 =6×10–22.
Однако, сульфид железа (II) таким способом получить не удаётся:
ПР(FeS) = 6×10–18 > Kобщая(H2S) = K1 × K2 = 6×10–22.
Невозможно также получить обменной реакцией в водном растворе сульфиды алюминия и хрома (III) из-за необратимо протекающего гидролиза:
3 S2– + 2 Al3+ + 6 H2O ® 2 Al(OH)3¯ + 3 H2S- .
Сера способна растворяться в растворах сульфидов щелочных металлов с образованием полисульфидов: Na2S + (x–1)S ® Na2Sx ; 2 ≤ x ≤ 5.
При увеличении содержания серы окраска полисульфидов изменяется от жёлтой до красной.
Получены многочисленные полисульфиды водорода H2Sx (2 ≤ x ≤ 23), назы- ваемые сульфанами. Это – жёлтые маслянистые жидкости, образующиеся при действии кислот на полисульфид натрия:
Na2Sx + 2 HCl ® 2 NaCl + H2Sx .
Сульфаны неустойчивы и легко распадаются с выделением сероводорода и серы:
H2Sx ® H2S- + (x–1) S¯ .
Графическая формула дисульфида водорода: H–S–S–H. Железный колчедан, или пирит FeS2, применяемый в производстве серной кислоты, представляет собой ди- сульфид железа (II).
4.3.3 Диоксид серы. Сернистая кислота
Оксид серы (IV) образуется при горении серы на воздухе:
S+ O2 ® SO2 .
Впромышленности SO2 получают при обжиге сульфидов и полисульфидов метал-
лов, а также термическим разложением сульфатов (в частности CaSO4):
4 FeS2 + 11 O2 ® 2 Fe2O3 + 8 SO2- 2 CaSO4 ® 2 CaO + 2 SO2- + O2-.
Диоксид серы – бесцветный газ с запахом жжёной серы. SO2 хорошо рас- творяется в воде, образуя сернистую кислоту:
SO2 + H2O H2SO3 .
На обратимости этой реакции основан лабораторный способ получения сернисто-
го газа: Na2SO3 + H2SO4 ® Na2SO4 + SO2- + H2O .
Сернистая кислота – слабая двухосновная кислота (К1=1,6×10–2, К2=6×10–8). H2SO3 и её соли являются хорошими восстановителями и окисляются до серной
кислоты или сульфатов: |
2 H2SO3 + O2 ® 2 H2SO4 ; |
|
Na2SO3 + Cl2 + H2O ® Na2SO4 + 2 HCl . |
52
Однако, атом серы в молекуле H2SO3 находится в промежуточной степени окис- ления (+4), поэтому при взаимодействии с сильными восстановителями сернистая кислота может выступать и в роли окислителя:
H2SO3 + 2 H2S → 3 S + 3 H2O.
Сульфиты наиболее активных металлов при прокаливании диспропорционируют:
4Na2SO3 → Na2S + 3 Na2SO4 .
4.3.4Триоксид серы. Серная кислота
При высокой температуре в присутствии катализатора (V2O5, сплавы на ос- нове платины) диоксид серы окисляется кислородом до триоксида:
2 SO2 + O2 → 2 SO3 .
Оксид серы (VI) – это ангидрид серной кислоты: SO3 + H2O → H2SO4 .
Схему промышленного получения серной кислоты контактным способом можно представить в виде следующей последовательности химических превраще-
ний: FeS2 (CuS, другие сульфиды) → SO2 → SO3 → H2SO4 .
Существует также нитрозный способ получения серной кислоты:
|
SO2 + NO2 + H2O → H2SO4 + NO. |
Образующийся NO далее взаимодействует с кислородом воздуха, окисляясь |
|
до NO2: |
2 NO + O2 → 2 NO2 . |
Диоксид азота вновь идёт на окисление SO2 . Таким образом, диоксид азота не расходуется в реакции и является гомогенным катализатором.
В газообразном состоянии оксид серы (VI) состоит из молекул SO3, постро- енных в форме правильного треугольника. При конденсации паров SO3 образуется летучая жидкость (t кипения = +44,8 °C), состоящая преимущественно из тримерных циклических молекул. При охлаждении до +16,8 °C она затвердевает, и образуется так называемая льдовидная модификация SO3 . При хранении она постепенно превращается в асбестовидную модификацию SO3, состоящую из полимерных молекул.
твёрдое вещество
газ жидкость
Концентрированная серная кислота, особенно горячая, – энергичный окис- литель. Она окисляет бромид- и иодид-ионы до свободных галогенов, уголь – до углекислого газа, серу – до SO2. При взаимодействии с металлами концентриро- ванная серная кислота переводит их в сульфаты, восстанавливаясь до SO2, S или H2S. Чем более активен металл, тем более глубоко восстанавливается кислота.

53
Например, при взаимодействии концентрированной серной кислоты с медью пре- имущественно выделяется SO2; при взаимодействии с цинком может наблюдаться одновременное выделение и оксида серы (IV), и свободной серы, и сероводорода:
Cu + 2 H2SO4 (конц.) → CuSO4 + SO2− + 2 H2O;
Zn + 2 H2SO4 (конц.) → ZnSO4 + SO2− + 2 H2O;
3 Zn + 4 H2SO4 (конц.) → 3 ZnSO4 + S↓ + 4 H2O;
4 Zn + 5 H2SO4 (конц.) → 4 ZnSO4 + H2S− + 4 H2O.
H2SO4 – сильная двухосновная кислота, диссоциированная по первой стадии практически нацело; диссоциация по второй стадии протекает в меньшей степени, однако в разбавленных водных растворах серная кислота диссоциирована практи- чески нацело по схеме: H2SO4 → 2 H+ + SO42–.
Большинство солей серной кислоты хорошо растворимо в воде. К практиче- ски нерастворимым относятся BaSO4 , SrSO4 , PbSO4; малорастворим CaSO4. Ка- чественная реакция на ионы SO42– обусловлена образованием малорастворимых сульфатов. Например, при введении ионов бария в раствор, содержащий сульфат- ионы, выпадает белый осадок сульфата бария, практически нерастворимый в воде и разбавленных кислотах: Ba2+ + SO42– → BaSO4↓ .
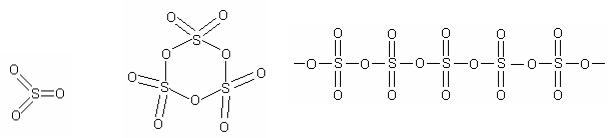
4.3.5 Олеум. Дисерная кислота
Олеум – это раствор SO3 в концентрированной серной кислоте. В олеуме часть молекул SO3 соединяется с серной кислотой. При этом получается смесь по- лисерных кислот, представителем которых является дисерная кислота H2S2O7 :
SO3 + H2SO4 → H2S2O7.
Другое название этой кислоты – пиросерная кислота. Её соли – дисульфаты (или пиросульфаты) – можно получить прокаливанием гидросульфатов:
2 KHSO4 → K2S2O7 + H2O .
При нагревании выше температуры плавления дисульфаты разлагаются с выделением SO3, переходя в сульфаты:
K2S2O7 → SO3− + K2SO4 .
4.3.6 Мононадсерная и пероксодисерная кислоты Кислоты, в молекулах которых существует пероксидная группировка
–O–O– получили общее название пероксокислот (надкислот).
Строение мононадсерной (H2SO5) и пероксодисерной (H2S2O8) кислот мож- но представить следующими графическими формулами:

54
Таким образом, надкислоты можно рассматривать как производные пероксида во- дорода.
Пероксодисерную кислоту H2S2O8 получают окислением на аноде гидро- сульфат-ионов при электролизе 50 % раствора серной кислоты или растворов гид-
росульфатов: 2 HSO4– → 2 H+ + S2O82– + 2 e– .
Пероксодисерная кислота, образующаяся в результате электролиза раствора сер- ной кислоты, быстро гидролизуется по реакции:
H2S2O8 + H2O → H2SO4 + H2SO5 .
Затем медленно разлагается и мононадсерная кислота:
H2SO5 + H2O H2SO4 + H2O2 .
Таким образом, конечными продуктами гидролиза H2S2O8 являются серная кис-
лота и пероксид водорода: H2S2O8 + 2 H2O → 2 H2SO4 + H2O2 .
Эта реакция является промышленным способом получения H2O2 . Пероксид водо- рода отгоняют из реакционной смеси под уменьшенным давлением.
Мононадсерную кислоту можно получить взаимодействием H2S2O8 с кон- центрированным раствором H2O2: H2S2O8 + H2O2 → 2 H2SO5 .
Соли пероксодисерной кислоты – персульфаты (пероксодисульфаты), как и сама кислота, являются сильными окислителями и восстанавливаются до сульфат-
ионов: |
S2O82– + 2 e– → 2 SO42– |
ϕo |
|
2 − |
|
2 − |
= + 2,0 В. |
|
|
S |
O |
/ 2 SO |
|
||
|
|
8 |
4 |
|
|||
|
|
2 |
|
|
|
Мононадсерная кислота является ещё более сильным окислителем, чем пе- роксодисерная; со многими органическими веществами она реагирует со взрывом.
4.3.7 Тиосерная кислота и тиосульфаты
Тиосерная кислота H2S2O3 в свободном состоянии не полу- чена, но её соли – тиосульфаты – устойчивы. Например, тиосуль- фат натрия применяется в фотографии в качестве фиксажа.
Тиосульфат натрия получается при взаимодействии мелкодис- персной серы с кипящим раствором сульфита натрия:
Na2SO3 + S → Na2S2O3 .
Так как один атом серы в тиосульфат-ионе находится в высшей степени окисле- ния +6, а другой – в низшей – минус 2, тиосульфаты в кислой среде претерпевают реакцию внутримолекулярного окисления-восстановления:
Na2S2O3 + 2 HCl → SO2− + S↓ + 2 NaCl + H2O .
Хлор, бром и другие сильные окислители окисляют тиосульфат-ионы до сульфатов. Под действием менее сильных окислителей, например, йода, образу- ются тетратионаты – соли тетратионовой кислоты H2S4O6, которая является
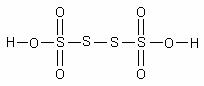
55
представителем политионовых кислот H2SxO6 :
I2 + 2Na2S2O3 ® 2NaI + Na2S4O6 (тетратионат натрия).
4.4 Селен. Теллур
Всвободном состоянии селен, подобно сере, образует несколько аллотроп- ных видоизменений, из которых наиболее известны аморфный селен в виде по- рошка красно-бурого цвета и серый селен, образующий хрупкие кристаллы с ме- таллическим блеском.
Теллур также известен в виде аморфной модификации и в виде кристаллов тёмно-серого цвета, обладающих металлическим блеском.
Селен и теллур, а также селениды и теллуриды некоторых металлов обла- дают полупроводниковыми свойствами.
SeO2 и TeO2 образуются при сжигании селена и теллура на воздухе или в кислороде. SeO2 и TeO2 – твёрдые вещества – ангидриды селенистой и теллури- стой кислот.
Вотличие от соединений серы (IV), соединения четырёхвалентных селена и теллура проявляют окислительные свойства, легко восстанавливаясь до простых
веществ:
SeO2 + 2 SO2 + 2 H2O ® Se + 2 H2SO4 .
Лишь действием очень сильных окислителей диоксиды селена и теллура можно перевести в селеновую и теллуровую кислоты.
Безводная селеновая кислота H2SeO4 – кристаллическое вещество. Высшая степень окисления +6 для селена менее устойчива, чем для серы, поэтому селено- вая кислота является более сильным окислителем, чем серная. Расплавленная се- леновая кислота способна растворять даже золото. Селеновая кислота – сильная кислота, её соли – селенаты – по своим свойствам похожи на сульфаты.
Теллуровая кислота, в отличие от серной и селеновой, – слабая кислота. Она выделяется из раствора в ортоформе H2TeO4×2H2O, т.е. H6TeO6 и является шести- основной кислотой. При нагревании ортотеллуровая кислота отщепляет две моле- кулы воды и переходит в двухосновную кислоту H2TeO4 .
4.5Сравнение свойств водородных соединений p-элементов VI группы
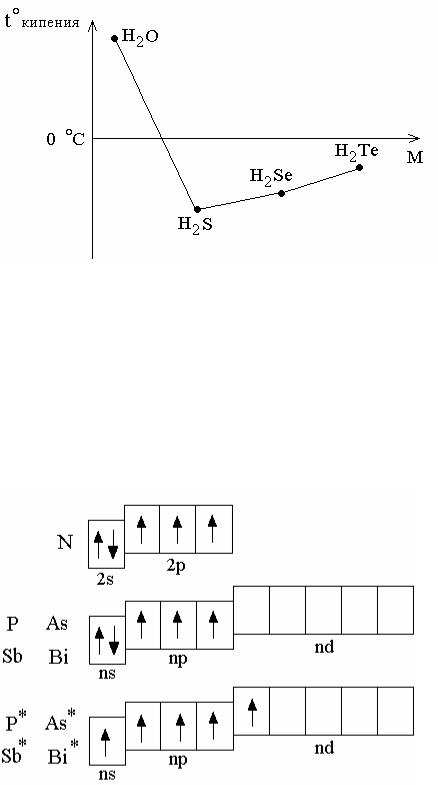
Вряду H2Te – H2Se – H2S с уменьшением молекулярных масс соединений температуры кипения закономерно уменьшаются; при переходе от H2S к H2O на- блюдается аномальное повышение температуры кипения, как и в ряду галогено- водородов (рисунок 4.1; см. также раздел 3.5 «Водородные соединения галогенов» лекции 3).
В химическом отношении селеноводород и теллуроводород похожи на серо- водород. Селеноводород и теллуроводород представляют собой газы с отврати-
тельным запахом. Водные растворы H2Se и H2Te – это кислоты, несколько более сильные, чем сероводородная кислота. Они обладают сильными восстановитель-
56
ными свойствами. При нагревании оба газа разлагаются. При этом H2Te менее ус- тойчив, чем H2Se: в ряду H2O – H2S – – H2Se – H2Te с увеличением радиусов атомов элементов умень- шается прочность хими- ческой связи. Селениды и
теллуриды также сходны с сульфидами. Получить H2Se и H2Te можно, дей- ствуя на селениды и тел- луриды сильными кисло- тами.
Рисунок 4.1 – Зависимость температуры ки- пения водородных соединений p-элементов VI
группы от молекулярной массы
Л Е К Ц И Я 5 P-ЭЛЕМЕНТЫ V ГРУППЫ
5.1 Введение
Главную подгруппу V группы образуют элементы: азот, фосфор, мышьяк, сурьма и висмут. На внеш-
нем энергетическом уровне атомов этих элементов на- ходятся пять электронов;
сокращённая электронная формула атомов – ns2np3.
Атом азота отличается от атомов других p-элементов V группы отсутствием d-
подуровня во внешнем электронном слое, поэтому валентность азота, т.е. число химических связей не может превышать 4 (три связи
могут быть образованы по обменному механизму и одна – по донорно- акцепторному). Атомы остальных элементов подгруппы могут образовывать до
57
пяти химических связей. Высшая положительная степень окисления у всех эле- ментов подгруппы равна +5. Низшая – минус 3. Кроме того, для всех рассматри- ваемых элементов характерна также степень окисления +3. Атом азота может иметь все степени окисления от минус 3 до +5:
–3; –2; –1; 0; +1; +2; +3; +4; +5.
В подгруппе с увеличением порядкового номера уменьшаются неметалли- ческие свойства и усиливаются металлические. Последние заметны уже у мышья- ка; сурьма в равной степени обладает и теми и другими свойствами, а у висмута металлические свойства преобладают над неметаллическими. Поскольку для ме- таллов нехарактерны отрицательные степени окисления, то устойчивость соеди- нений с атомом в низшей степени окисления уменьшается по мере нарастания ме- таллических свойств элементов в ряду N – P – As – Sb – Bi.
5.2 Азот
5.2.1 Свойства азота – простого вещества Молекулярный азот – газ без цвета и запаха, плохо растворимый в воде.
Молекулы азота двухатомны (N2). Азот – главная составная часть воздуха (78 % по объёму). В промышленности азот получают ректификацией жидкого воздуха; лабораторный способ – термическое разложение нитрита аммония:
NH4NO2 ® N2- + 2 H2O .
Азот – малоактивное вещество; это объясняется большой прочностью моле- кул N2 с тройной связью.
5.2.2 Аммиак и соли аммония. Гидразин. Гидроксиламин Азот образует несколько соединений с водородом. Важным в практическом
отношении водородным соединением азота является аммиак (NH3) – бесцветный газ с резким запахом. При температуре минус 33,4 °C и атмосферном давлении аммиак переходит в жидкое состояние.
Атом азота в молекуле аммиака имеет одну неподелённую электронную па- ру и может участвовать в образовании связи по донорно-акцепторному механизму, например, с ионом водорода, который имеет свободную орбиталь. В результате этого взаимодействия образуется ион аммония (см. раздел 1.5.1 «Механизмы об- разования ковалентной связи» лекции 1).
Соли аммония образуются при реакции аммиака с кислотами:
NH3 + HCl ® NH4Cl |
2 NH3 + H2SO4 ® (NH4)2SO4 . |
Аммиак хорошо растворяется в воде. Водный раствор аммиака называют нашатырным спиртом. Взаимодействие аммиака с водой приводит к образованию гидроксида аммония; гидроксид аммония – слабое основание (К = 1,8×10–5):
NH3 + HOH NH4OH.
На обратимости этой реакции основан лабораторный способ получения аммиака:
58
t°
2 NH4Cl + Ca(OH)2 → CaCl2 + 2 NH3− + 2 H2O .
В промышленности аммиак получают прямым синтезом из азота и водорода:
N2 + 3 H2 2 NH3 .
Синтез ведут при высоких температуре и давлении (500 °C; 300 атм.).
Другой промышленный способ получения аммиака – цианамидный – в на- стоящее время имеет историческое значение. Этот способ основан на способности азота взаимодействовать с карбидом кальция (CaC2) при высокой температуре с образованием цианамида (CaCN2):
CaC2 + N2 → CaCN2 + C .
Под действием водяного пара цианамид легко разлагается с образованием аммиа-
ка: CaCN2 + 3 H2O → CaCO3 + 2 NH3 .
Атом азота в молекуле аммиака имеет низшую степень окисления и поэтому проявляет только восстановительные свойства, окисляясь обычно до свободного азота. Например, аммиак горит в атмосфере кислорода:
4 NH3 + 3 O2 → 2 N2 + 6 H2O .
В присутствии катализатора (сплавы на основе платины) аммиак окисляется до
NO: 4 NH3 + 5O2 → 4 NO + 6 H2O .
Эта реакция имеет промышленное значение в производстве азотной кислоты. Атомы водорода в молекуле аммиака находятся в высшей степени окисле-
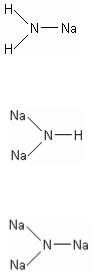
ния и проявляют свои окислительные свойства при взаимодействии аммиака со щелочными металлами: 2 NH3 + 2 Na (расплавленный) → 2 NaNH2 + H2.
При замещении на металл одного атома водорода в молекуле NH3 образуются со- единения, называемые амидами.
NaNH2 – амид натрия
Соединения, которые можно рассматривать как продукт замещения двух атомов водорода в молекуле NH3 на атомы металла, называются имидами.
Na2NH – имид натрия
При полном замещении атомов водорода в молекуле аммиака атомами ме- талла образуются нитриды.
Na3N – нитрид натрия
Нитриды активных металлов (щелочных, щелочноземельных) получают не- посредственным взаимодействием металлов и азота при нагревании:
6 Na + N2 → 2 Na3N .
Амиды, имиды и нитриды наиболее активных металлов полностью гидроли-

59
зуются водой с образованием аммиака и гидроксида металла: NaNH2 + HOH ® NaOH + NH3-;
Mg3N2 + 6 HOH ® 3 Mg(OH)2 + 2 NH3- .
Соли аммония термически неустойчивы и при нагревании они разлагаются; при этом возможны 2 различных типа реакций термического разложения солей аммония.
1) При разложении солей аммония, анион которых не проявляет ярко выра- женных окислительных свойств (NH4Cl, (NH4)2SO4, (NH4)3PO4) выделяется амми-
ак: (NH4)2SO4 ® NH4HSO4 + NH3- (NH4)3PO4 ® NH4H2PO4 + 2 NH3-.
2) При разложении солей аммония, анион которых проявляет окислительные свойства (NH4NO2, NH4NO3, (NH4)2Cr2O7), протекает реакция внутримолекулярно- го окисления-восстановления, при этом восстановителем является атом азота в ионе аммония: NH4NO2 ® N2- + 2 H2O;
NH4NO3 ® N2O- + 2 H2O; (NH4)2Cr2O7 ® Cr2O3 + N2- + 4 H2O .
Наибольшее применение соли аммония находят в качестве минеральных удобрений: сульфат, нитрат и фосфаты аммония.
Другими представителями водородсодержащих соединений азота являются гидразин N2H4 и гидроксиламин NH2OH.
Гидразин – бесцветная жидкость; при взаимодействии с кислотами образует твёрдые вещества – соли гидразония (аналогия – соли аммония). Например, N2H4×HCl (или N2H5Cl) – хлорид гидразония; N2H5+ – ион гидразония. Гидразин и
его соли являются сильными восстановителями
N2H4 ® N2 + 4 H+ + 4e– |
jo |
|
|
|
, 4 H+ / N |
H |
|
= – 0,23 В |
||||
|
N |
2 |
4 |
|
|
|||||||
|
|
|
|
2 |
|
|
|
|
||||
N2H4 + 4 OH– ® N2 + 4 H2O + 4e– |
jo |
|
|
, 4 H |
O / N |
|
H |
|
, 4 OH |
− = – 1,16 В |
||
|
N |
2 |
|
4 |
|
|||||||
|
|
|
2 |
2 |
|
|
|
|
||||
и окисляются обычно до свободного азота:
N2H4 + 2 I2 ® N2- + 4 HI.
Гидроксиламин – бесцветное твёрдое вещество, хорошо растворимое в воде. Подобно аммиаку и гидразину образует с кислотами соли гидроксиламмония: NH2OH×HCl (или NH3OHCl) – хлорид гидроксиламмония; NH3OH+ – ион гидро- ксиламмония.
Гидроксиламин обладает окислительно-восстановительной двойственно- стью; с одной стороны – это сильный восстановитель, который обычно окисляется до свободного азота:
60
2 NH2OH → N2 + 2 H2O + 2 H+ + 2 e– |
ϕo |
|
, 2 H |
O, 2 H+ |
/ 2 NH |
|
= – 1,87 В |
||||
|
|
|
N |
2 |
OH |
||||||
|
|
|
|
|
2 |
|
|
2 |
|
|
|
2 NH2OH + 2 OH– → N2 + 4 H2O + 2 e– |
ϕo |
|
, 4 H |
O / 2 NH |
|
OH, 2 OH |
− = – 3,04 В |
||||
|
N |
2 |
2 |
|
|||||||
|
|
|
|
2 |
|
|
|
|
|
||
10 NH2OH + 2 KMnO4 + 3 H2SO4 → 5 N2− + 2 MnSO4 + K2SO4 + 18 H2O; |
|||||||||||
2 NH2OH + I2 + 2 KOH → N2− + 2 KI + 4 H2O. |
|
|
|||||||||
С другой стороны, гидроксиламин в кислой среде проявляет достаточно сильные окислительные свойства, восстанавливаясь при этом до иона аммония:
NH2OH + 3 H+ + 2 e– → NH4+ + H2O ϕo |
OH, 3H |
+ / NH |
+ |
, H |
= + 1,35 В. |
NH |
O |
||||
2 |
|
|
4 |
2 |
|
В кислой среде гидроксиламин способен окислить соединения железа (II) до со-
единений железа (III) (ϕo |
3 + |
|
2 + |
= + 0,77 В): |
Fe |
/Fe |
|
||
|
|
|
2 NH2OH + 4 FeSO4 + 3 H2SO4 → 2 Fe2(SO4)3 + (NH4)2SO4 + 2 H2O.
5.2.3 Оксиды азота
Азот образует с кислородом следующие оксиды: N2O, NO, N2O3, NO2, N2O5. N2O и NO – несолеобразующие оксиды; N2O3 и N2O5 – ангидриды азотистой и азотной кислот соответственно; NO2 – смешанный ангидрид азотистой и азотной
кислот.
Из всех оксидов азота только NO можно получить непосредственным взаи- модействием азота и кислорода при температурах 3000 – 4000 °C по обратимой
реакции: |
N2 + O2 2 NO . |
Большинство оксидов азота получают косвенным путём. |
|
Оксид азота (I) N2O получается термическим разложением нитрата аммо- |
|
ния: |
NH4NO3 → N2O− + 2 H2O. |
N2O – это бесцветный газ со слабым запахом и сладковатым вкусом, малораство- римый в воде. При нагревании выше 500°С N2O разлагается:
2 N2O → 2 N2 + O2.
Поэтому при высоких температурах N2O проявляет свойства окислителя, напри- мер, тлеющая лучинка вспыхивает в атмосфере N2O. Раньше оксид азота (I) ис- пользовался в медицине для наркоза.
Оксид азота (II) NO – бесцветный газ, плохо растворимый в воде. В лабора- тории его получают взаимодействием меди с разбавленной (30 – 35%) азотной ки-
слотой: 3 Cu + 8 HNO3 → 3 Cu(NO3)2 + 2 NO− + 4 H2O .
В промышленности NO получают каталитическим окислением аммиака (см. раздел 5.2.2 «Аммиак и соли аммония. Гидразин. Гидроксиламин» данной лек- ции). Оксид азота (II) является промежуточным продуктом при производстве азотной кислоты.
