
Лаб.практикум Химия
.pdf
31
KMnO4+KOH+ Na2SO3 → Na2SO4
+ K2MnO4 + H2O
1.Налейте в три пробирки примерно по 5 капель раствора перманганата калия КMnO4.
2.В первую добавьте около 5 капель разбавленного раствора H2SO4, во вторую - воды, в третью - раствора КОН.
3.В каждую из пробирок прибавьте немного кристаллического сульфита натрия Na2SO3, взболтайте.
4.Заполните таблицу 1.
5.Сделайте вывод об окислительной способности марганца в зависимости от среды
Опыт 4. Получение и свойства гидроксидов железа (II) и (III).
1.Возьмите 2 пробирки. В первую налейте в пробирку 5 капель раствора хлорного железа (III) FeCl3, во вторую - FeSO4
2.Прибавьте немного раствора щелочи NaOH в обе пробирки. Отметьте цвет и вид осадка.
3.Отметьте цвет осадка в обеих пробирках и наблюдайте через несколько минут побурение осадка во второй пробирке вследствие образования гидроксида железа (III).
4.Напишите уравнения реакций.
Вопросы для защиты лабораторной работы
1.Какие простые вещества называются металлами?
2.Что такое металлическая связь?
3.Где в периодической системе элементов Д.И.Менделеева расположены металлические элементы?
4.Какие физические свойства характерны для металлов?
6. Какие элементы называются d-элементами?
7.Напишите формулы оксидов и гидроксидов хрома, проявляющих: а) основные свойства; б) амфотерные свойства; в) кислотные свойства.
32
Лабораторная работа № 5
Окислительно-восстановительные процессы
Цель Работы:
1.Ознакомление с окислительно-восстановительными свойствами металлов, неметаллов и их соединений, освоение методики составления уравнений окислительно-восстановительных процессов.
2.Изучение химической активности некоторых металлов в связи с их положением в ряду напряжений.
Реактивы и оборудование: дихромат калия (K2Cr2O7), соляная кислота (HCl), хлорид олова (II) (SnCl2), гидроксид калия (KOH), йодид калия (KJ), серная кислота (H2SO4), пероксид водорода (H2O2), перманганат калия (KMnO4), цинк (Zn), магний (Mg), медь (Cu), хлорид алюминия (AlCl3), нитрат свинца (Pb(NO3)2), сульфат меди (CuSO4), нитрат магния (Mg(NO3)2), пробирки, штатив для пробирок.
Теоретические сведения
Окислительно-восстановительными реакциями называются реакции,
сопровождающиеся изменением степени окисления атомов, входящих в состав реагирующих веществ.
Степень окисления – это условный заряд атома в молекуле, вычисленный исходя из предположения, что молекула состоит только из ионов. Степень окисления (С.О.) может быть положительной, нулевой и отрицательной.
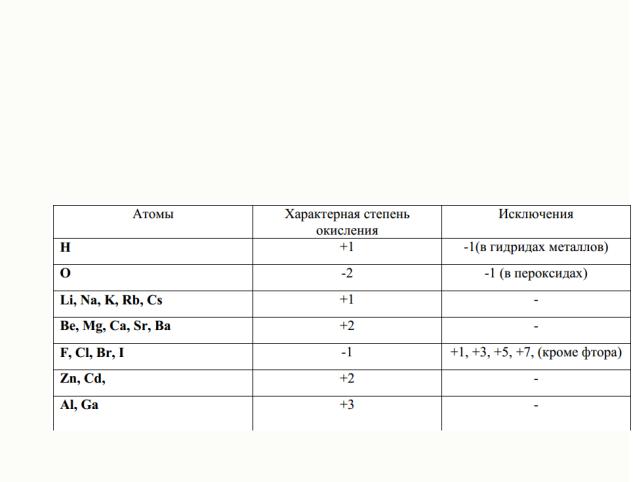
При определении степени окисления атомов в соединении, необходимо учитывать следующее:

33
1.Водород в большинстве соединений (за исключением гидридов
металлов NaH, KH, CaH2 - она равна -1 и т.д.) проявляет степень окисления +1.
2.Кислород во всех соединения (за
исключением пероксидов H2O2, BaO2 и др. – она равна -1, и фторида кислорода OF2 – она равна +2) обладает степенью окисления -2.
3.Степень окисления атомов в простом веществе равна нулю: Ho2, O o2, Feo, Zno и др.
4.При подсчете степеней окисления атомов необходимо учитывать, что алгебраическая сумма всех степеней окисления
в электронейтральной молекуле равна нулю. Например, подсчитаем степень окисления серы в серной
кислоте H2SO4. Сначала поставим известные нам степени окисления водорода и кислорода +1H2SO-24. Обозначив степень окисления серы через х, составим уравнение:
(+1) ·2 + х + (-2) · 4 = 0,
отсюда х = -2 + 8 = +6.
Окислением называется процесс отдачи электронов атомом или ионом, при этом степень окисления повышается. Вещество, атомы или ионы
которого |
в |
процессе |
реакции |
отдают |
электроны, |
называется восстановителем. |
Восстановлением |
называется |
процесс |
||
присоединения электронов атомом или ионом, при этом степень окисления понижается. Вещество, атомы или ионы которого в процессе реакции принимают электроны, называется окислителем. В зависимости от степени
окисления атомы являются окислителями или восстановителями.
Наиболее распространенные окислители и восстановители (рекомендуется запомнить!)
Окислители: галогены, O2, O3, H2O2,H2SO4 (конц.), HNO3, Ag2O, PbO2, KMnO4, K2MnO4, K2Cr2O7, ионы Au+3, Ag+, гипохлориты, хлораты царская водка, электрический ток на аноде.
Восстановители: металлы, водород, углерод, СО, H2S, SO2, HI, HBr, HCl,
H2SO3SnCl2, FeSO4, MnSO4, NH3, NO, альдегиды, спирты муравьиная и щавелевая кислота, глюкоза, электрический ток на катоде.
Составление уравнений окислительно-восстановительных реакций производится методом электронного баланса и методом полуреакций (ионноэлектронный метод). Обычно различают три типа ОВР:
34
межмолекулярные ОВР – реакции, в которых элемент-окислитель и элемент-восстановитель находятся в разных веществах;
внутримолекулярные – реакции, в которых элемент-окислитель и элемент-восстановитель находятся в молекуле одного вещества;
самоокисления-самовосстановления (диспропорционирования) - молекулы одного и того же вещества реагируют друг с другом как окислитель и как восстановитель.
Мерой окислительно-восстановительной способности веществ служат
их |
окислительно-восстановительные |
потенциалы. |
Чем |
больше |
алгебраическая величина стандартного окислительно-восстановительного потенциала данного атома или иона, тем больше его восстановительные свойства.
ПРИМЕР. Составьте уравнения окислительно-восстановительных реакций, идущих по схеме:
H2S + KMnO4 + H2SO4 S + MnSO4 + K2SO4 + H2O
Решение. Применим метод электронного баланса. Он основан на сравнении степеней окисления атомов в исходных и конечных веществах. В основе метода лежит правило: число электронов, отданных восстановителем, должно равняться числу электронов, присоединенных окислителем, следовательно, в первую очередь определяем изменение степеней окисления атомов до и реакции в написанной схеме.
H2S-2+ KMn+7O4 + H2SO4 S0 + Mn+2SO4 + K2SO4 + H2O
Далее составляем электронные уравнения
Восстановитель S־2 - 2е- → S0 |
|
5 ----- процесс окисления |
|
|
|||
Окислитель |
Mn+7+ 5e- → Mn+2 |
|
2 ----- процесс восстановления |
И, наконец, находим коэффициенты при окислителе и восстановителе, а затем при других реагирующих веществах.
Окончательное уравнение реакции будет иметь вид:
5H2S + 2KMnO4 +3H2SO4 → 3S + 2MnSO4 + K2SO4 + 8H2O
Правильность написания уравнения подтверждается подсчетом атомов кислорода: в левой части –2·4 + 3·4 = 20 и в правой –2·4 + 4 +8 = 20. В этом примере имеем дело с межмолекулярной ОВР, так как элемент –

35
восстановитель (S-2) и элемент-окислитель (Mn+7) находятся в разных веществах.
Металлы при химических реакциях проявляют только восстановительные свойства (отдают электроны). Располагая металлы по мере возрастания их стандартных электродных потенциалов, получают ряд напряжений. Положение металла в ряду стандартных электродных потенциалов указывает на его восстановительную способность. Чем меньше стандартный электродный потенциал (Е°), тем больше восстановительная способность металла в водных средах. В ряду напряжений помещен и водород, так как он, подобно металлам, образует свободные положительные ионы. Положительно заряженные ионы металлов способны принимать электроны, т.е. служить окислителями. В ряду напряжений с увеличением алгебраической величины стандартного электродного потенциала металла ослабляются восстановительные свойства атомов и усиливаются окислительные свойства ионов металлов.
Каждый металл приведенного ряда напряжений вытесняет (восстанавливает) все следующие за ним металлы из растворов солей. В свою очередь, сам он может быть вытеснен (восстановлен) любым из металлов, стоящих впереди него.
Только те металлы, которые в ряду напряжений стоят до водорода, могут вытеснять водород из растворов кислот (например, Zn, Fe, Sn, но не
Cu, Hg, Ag).
Экспериментальная часть
Опыт 1. Окислительные свойства дихромат-иона Cr2O72-
1.В две пробирки налейте по 1 мл раствора дихромата калия К2Сr2O7.
2.В первую пробирку добавьте 1 мл раствора НСl и раствора хлорида
олова(II) SnCl2 до изменения окраски раствора, связанного с восстановлением иона Cr2O72- до Cr3+.
3.Во вторую пробирку добавьте 1 мл концентрированного раствора гидроксида калия КОН. Обратите внимание на изменение окраски
раствора, которое объясняется переходом дихромат-иона Cr2O72- в щелочной среде в хромат-ион CrO42-.
4.Затем к раствору хромата калия К2СrO4 добавьте кристаллический нитрит калия КNO2.
5.Запишите наблюдения.
36
6.Уравняйте реакции методом электронного баланса:
K2Cr2O7 + SnCl2 + HCl CrCl3 + H2[SnCl6] + KCl + H2O K2CrO4 + KNO2 + H2O K[Cr(OH)4] + KNO3 + KOH
Опыт 2. Окислительно-восстановительные свойства пероксида водорода
1.К 4-5 каплям раствора йодида калия KJ добавьте 6-10 капель 2 н раствора серной кислоты.
2.Затем до изменения цвета раствора добавьте 3-4 капли перекиси водорода H2O2.
3.Запишите наблюдения.
4.Уравняйте реакцию методом электронного баланса:
KJ + H2SO4 + H2O2 J2 + K2SO4 + Н2О
Опыт 3. Окислительно-восстановительные свойства пероксида водорода.
1.К 2-3 каплям перманганата калия добавьте 3-4 капли раствора перекиси водорода.
2.Запишите наблюдения.
3.Уравняйте реакцию методом электронного баланса:
КМnО4 + Н2O2 МnО2 + О2 + КОН + Н2О
4.По результатам опытов 2 и 3 сделайте вывод о окислительновосстановительных свойствах пероксида водорода.
Опыт 4. Вытеснение одних металлов другими.
1.В четыре пробирки опустите по кусочку цинка.
2.Налейте по 5 - 10 капель растворов следующих солей: АlСl3,
Рb(NO3)2, CuSO4, Hg(NO3)2.
3.Запишите наблюдения.
4.Напишите уравнения реакций.
5.Сделайте вывод о том, какие металлы цинк вытесняет из растворов их солей.
Опыт 5 . Вытеснение водорода из кислот металлами.
1.В четыре пробирки поместите порознь по кусочку магния, алюминия, цинка, меди.
2.Затем в каждую пробирку налейте по 5 капель соляной кислоты.
3.Запишите наблюдения.
37
4.Напишите уравнения реакций.
5.Сделайте вывод о том, какие металлы могут вытеснять водород из растворов кислот.
Вопросы для защиты лабораторной работы
1.Какие реакции называются окислительно-восстановительными?
2.Что такое окислитель и, что такое восстановитель, и как меняются их степени окисления в окислительно-восстановительной реакции?
3.Как классифицируются окислительно-восстановительные реакции?
4.Какие методы уравнивания окислительно-восстановительных реакций вы
знаете?
5.Подберите коэффициенты методом электронного баланса в уравнениях реакций, укажите окислитель и восстановитель.
1.K2MnO4 + H2O = KMnO4 +MnO2 +KOH
2.PbS + H2O2 = PbSO4 + H2O
3.NaBrO3 +NaBr + H2SO4 = Br2 + Na2SO4 + H2O
4.CuI +H2SO4 +KMnO4 = CuSO4 + I2 +MnSO4 +K2SO4 +H2O
5.CaH2+ H2O = Ca(OH)2 + H2
6.Na3[Cr(OH)6] + NaOH +PbO2 = Na2CrO4 +H2O + Na2[ Pb(OH)4]
7.Cr(NO3)3 = Cr2O3 + NO2 + O2
8.Fe2O3 + KNO3 + KOH = K2FeO4 + KNO2 +H2O
9.Cr2O3 + Na2CO3 + O2 = Na2CrO4 + CO2
10.Na2SO3 = Na2S + Na2SO4
11.Cr2O3 + NaNO3 + NaOH = Na2CrO4 + NaNO2 + H2O
12.K2Cr2O7 +H2S + H2SO4 = Cr2(SO4)3 + S + K2SO4 + H2O
13.Br2 + SO2 + H2O = HBr + H2SO4
14.H2S + H2SO3 = S + H2O
15.KMnO4 + NaNO2 + H2O = MnO2 + NaNO3 + KOH
16.NaBr + NaBrO3 + H2SO4 = Na2SO4 + Br2 + H2O
17.As + Cl2 + H2O = H3AsO4 + HCl
38
18.K2Cr2O7 + HBr = Br2 + CrBr3 + KBr + H2O
19.KClO3 + HCl = KCl + Cl2 + H2O
20.FeCl2 + KClO3 + HCl = FeCl3 + KCl + H2O
21.Cr2(SO4)3 + H2O2 + NaOH = Na2CrO4 + Na2SO4 + H2O
22.Mg + HNO3 = Mg(NO3)2 + N2 + H2O
23.KMnO4 + H2S + H2SO4 = MnSO4 + S + K2SO4 + H2O
24.Zn + H2SO4 = H2S + ZnSO4 + H2O
25.KMnO4 + H3PO3 + H2SO4 = MnSO4 + H3PO4 + K2SO4 + H2O
Список литературы
1.Коровин Н. В. Лабораторные работы по химии : Учебное пособие для технических направлений и специальностей вузов / Н. В. Коровин, Э. И. Мингулина, Н. Г. Рыжова . – 3-е изд., испр . – М. : Высшая школа,
2001 . – 256 с.
2.Лабораторные работы по химии: учебно-методическое пособие для студентов дневной и заочной форм обучения / Г.С. Варакин, И.Н. Лысякова - Саранск: «Рузаевский печатник», 2005. – 46 с.
3.Васильева З.Г. Лабораторные работы по общей и неорганической химии. - М.: Высш. шк. 1986.
4.Глинка Н.Л. Общая химия. / Н.Л. Глинка. М.: Химия, 1985. 740 с.
5.Ахметов Н.С. Общая и неорганическая химия./ Н.С.Ахметов. М.: Высшая школа, 1988. 446 с.
6.Степин Б.Д. Неорганическая химия. / Б.Д. Степин, А.А. Цветков. М.: Высшая школа, 1994. 608 с.
7.Потапова С.А. Окислительно-восстановительные реакции: – учеб. пособие по химии для слушателей фак-та довузовской подготовки. Саратов: изд-во СГТУ, 1997. 23 с.
8.Коровин Н.В. Учебник для технич. направл. и спец. вузов – 6-е изд.,
испр. – М.: Высш. шк., 2005. – 557 с.
