
6 курс / Эндокринология / Лекция_Надпочечниковая_недостаточность_ОГМА
.pdfЛекция для 4 курса медико-профилактического факультета
План лекции
1.Определение
2.Этиология надпочечниковой недостаточности
3.Классификация надпочечниковой недостаточности
4.Патогенез и клинические проявления надпочечниковой недостаточности
5.Болезнь Аддисона: клинические проявления
6.Диагностика первичной и вторичной надпочечниковой недостаточности.
7.Лечение надпочечниковой недостаточности.
Цель: научиться диагностировать и лечить надпочечниковую недостаточность.
Задачи:
1.Изучить этиологию, патогенез и классификацию надпочечниковой недостаточности.
2.Изучить клинические проявления и методы диагностики надпочечниковой недостаточности.
3.Изучить подходы к лечению и профилактики надпочечниковой недостаточности.
Надпочечниковая недостаточность
Надпочечниковая недостаточность (недостаточность коры надпочечников, гипокортицизм, НН) – клинический синдром, обусловленный недостаточной секрецией гормонов коры надпочечников в результате нарушения функционирования одного или нескольких звеньев гипоталамо- гипофизарно-надпочечниковой системы (ГГНС).
Согласно начальной локализации патологического процесса, НН подразделяют на первичную (поражение самой коры надпочечников, 1-НН) и центральные формы: вторичную, являющуюся результатом нарушения секреции адренокортикотропного гормона (АКТГ) и третичную, развивающуюся при дефиците кортикотропин-рилизинг-гормона (КРГ). Вторичную и третичную НН объединяют в центральные формы в связи со сложностью их дифференциальной диагностики в клинической практике. Нередко их обозначают “вторичная НН” (2-НН).
Зоны в надпочечнике: Клубочковая: минералокортикоиды Пучковая: глюкокортикоиды Сетчатая: андрогены
Мозговой слой: катехоламины
Причинами 1-НН:
1.Аутоиммунная деструкция коры надпочечников (80–85% всех случаев 1-НН):
изолированная 1-НН аутоиммунного генеза;
1-НН в рамках аутоиммунных полигландулярных синдромов.
2.Туберкулезное поражение надпочечников (5–10 %).
3.Адренолейкодистрофия (около 6% всех случаев 1-НН).
4.Метастатическое поражение коры надпочечников.
5.Поражение надпочечников при диссеминированных грибковых инфекциях.
6.ВИЧ-ассоциированный комплекс.
7.Ятрогенная 1-НН (двусторонняя адреналэктомия по поводу болезни Иценко – Кушинга, двустороннее кровоизлияние в надпочечники на фоне терапии антикоагулянтами).
Центральные формы надпочечниковой недостаточности: гипоталамо-гипофизарные заболевания (пангипопитуитаризм, опухоли гипофиза, оперативные вмешательства на гипофизе, травмы, некроз вследствие тромбоза сосудов гипофиза при ДВС-синдроме, сепсисе и др.).
1-НН является относительно редким заболеванием – от 40–60 новых случаев на 1 млн взрослого населения в год. Истинная частота центральных форм НН неизвестна, но ее наиболее частой причиной является подавление ГГНС на фоне хронической терапии глюкокортикоидами. Клиническая картина заболевания, связанного с деструкцией надпочечников патологическим процессом, впервые достаточно полно была описана в 1855 г. английским врачом Томасом Аддисоном (1793–1860). С тех пор 1-НН туберкулезной и аутоиммунной этиологии обозначается как болезнь Аддисона.
Этиология первичного гипокортицизма
Аутоиммунное поражение коры надпочечников
Аутоиммунная деструкция коры надпочечников (аутоиммунный адреналит) в настоящее время является основной причиной 1-НН. На ее долю в развитых странах приходится до 90% и более случаев 1-НН. Следует отметить, что если во второй половине XIX и начале XX века аутоиммунная деструкция составляла не более 15-20% от всех случаев болезни Аддисона, то на протяжении XX столетия соотношение этиологических факторов первичного гипокортицизма постепенно изменялось в сторону преобладания аутоиммунной деструкции над туберкулезной. Так, в 40–50-е годы на долю туберкулеза надпочечников приходилось 48% случаев 1-НН, тогда как в 80–90-е годы этот показатель уменьшился до 15%. В ближайшем будущем в связи со значительным ростом заболеваемости туберкулезом можно ожидать некоторого увеличения частоты 1-НН туберкулезной этиологии. Результатами исследований начала 90-х годов было показано, что специфическими иммунологическими маркерами аутоиммунной деструкции коры надпочечников являются антитела к ферментам надпочечникового стероидогенеза 21гидроксилазе (P450c21), 17a-гидроксилазе (P450c17) и ферменту отщепления боковой цепи (P450scc). При изолированной 1-НН наибольшее значение имеют антитела к 21-гидроксилазе.
Аутоиммунные полигландулярные синдромы
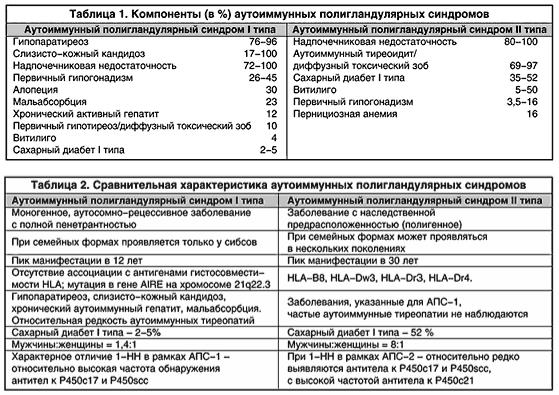
Принципиальным аспектом при обсуждении этиологии 1-НН являются аутоиммунные полигландулярные синдромы (АПС). АПС представляют собой первичное аутоиммунное поражение двух и более периферических эндокринных желез, приводящее, как правило, к их недостаточности, часто сочетающееся с различными органоспецифическими неэндокринными заболеваниями аутоиммунного генеза. В настоящее время на основании клинических и иммуногенетических особенностей выделяют АПС 1-го и 2-го типов (АПС-1 и АПС-2).
АПС-2 – наиболее распространенный, но менее изученный вариант АПС. В свою очередь самым частым вариантом АПС-2 является синдром Шмидта, представляющий собой сочетание 1-НН и аутоиммунных тиреопатий (аутоиммунный тиреоидит или диффузный токсический зоб). Реже встречается сочетание 1-НН с сахарным диабетом I типа (синдром Карпентера). АПС-2 примерно в 8 раз чаще встречается у женщин, манифестирует в среднем возрасте (между 20 и 50 годами), при этом интервал между клиническим дебютом его отдельных компонентов может составить более 20 лет. У 40–50% больных с исходно изолированной хронической НН (1-ХНН) рано или поздно развивается другая аутоиммунная эндокринопатия В большинстве случаев АПС-2 встречается спорадически, однако описано немало случаев
семейных форм, при которых заболевание наблюдается у разных членов семьи в нескольких поколениях.
АПС-1 (APECED-Autoimmune polyendocrinopathy-candidiasis-ectodermal-dystrophy, MEDAC-
Multiple Endocrine Deficiency Autoimmune Candidiasis, кандидо-полиэндокринный синдром) –
редкое заболевание с аутосомно-рецессивным типом наследования (или встречающееся реже спорадически), для которого характерна классическая триада, описанная Уайткером: слизистокожный кандидоз, гипопаратиреоз, 1-ХНН. АПС-1 дебютирует, как правило, в детском возрасте.
Вподавляющем большинстве случаев первым проявлением является слизисто-кожный кандидоз, развивающийся в первые 10 лет жизни, чаще в возрасте около 2 лет, при этом наблюдается поражение слизистых оболочек полости рта, гениталий, а также кожи, ногтевых валиков, ногтей, реже встречается поражение желудочно-кишечного тракта (ЖКТ), дыхательных путей. На фоне слизисто-кожного кандидоза у 84% пациентов появляется гипопаратиреоз, который у 88% больных развивается в первые 10 лет.
Вотношении АПС-1 мы имеем дело с единственным известным в патологии человека (!) аутоиммунным заболеванием с моногенным, характером наследования, когда аутоиммунный процесс в большинстве эндокринных желез и многих других органах обусловлен мутацией одного единственного гена (на хромосоме 21q22.3 и получил название AIRE-1).
Туберкулез надпочечников
Как уже указывалось, деструкция коркового вещества надпочечников туберкулезным процессом занимает второе место в ряду этиологических факторов 1-НН. Туберкулез надпочечников развивается вследствие гематогенного распространения микобактерий. Обычно в процесс вовлекается как корковое, так и мозговое вещество (последний феномен клинического значения, по-видимому, практически не имеет). Как и в случае аутоиммунного поражения, при туберкулезном процессе НН клинически манифестирует только при разрушении 90% коркового вещества обоих надпочечников. При туберкулезе надпочечников в большинстве случаев у больных имеются следы ранее перенесенного туберкулеза или активный процесс.
Адренолейкодистрофия
Адренолейкодистрофия (АЛД, болезнь Зимерлинга–Крейтцфельдта, меланодермическая лейкодистрофия) – является наиболее распространенным наследуемым пероксисомным заболеванием с Х-сцепленным рецессивным типом наследования, которое характеризуется избыточным накоплением предельных длинноцепочечных жирных кислот (ДЖК), как правило, в миелине, проявляющееся в преимущественном поражении белого вещества ЦНС, коры надпочечников и яичек. Болезнь обусловлена генетически: делецией гена ALD на длинном плече Х-хромосомы (Хq28), проявляющейся недостаточностью лигноцероил-КоА-синтетазы. Это в свою очередь ведет к нарушению -окисления насыщенных ДЖК (имеющих 24–32 углеродных атома) в пероксисомах и последующему их накоплению вместе с эфирами холестерина в клетках нервной системы и коркового вещества надпочечников. Предположительная распространенность заболевания составляет 1 на 100–150 тыс. мужчин.
Выделяется по меньшей мере 6 клинических фенотипов АЛД, которые отличаются по форме: от тяжелой детской церебральной формы до бессимптомного течения. В одной и той же семье, как
правило, встречаются различные фенотипы АЛД. Детская церебральная форма является фенотипически наиболее тяжелым вариантом течения АЛД. Пациенты практически здоровы до возраста 2–10 лет, когда манифестирует надпочечниковая недостаточность и тяжелая прогрессирующая неврологическая дисфункция. После манифестации симптоматика быстро прогрессирует и наступает смерть через 2–4 года. Аналогичным образом, но в более позднем возрасте протекают подростковая церебральная и взрослая церебральная формы.
Метастатическое поражение надпочечников
Само по себе поражение надпочечников метастазами опухолей встречается достаточно часто. Так, отмечено, что метастазы рака молочной железы поражают надпочечники в 58% случаев, бронхогенного рака легкого – в 36–40%, меланомы – в 33% случаев. Вместе с тем 1-НН при этом развивается очень редко, поскольку, как указывалось, для этого необходимо разрушение 90% коры обоих надпочечников. Наиболее часто опухолью, метастазы которой вызывают развитие клинической картины гипокортицизма, является неходжкинская крупноклеточная лимфома, несколько реже причиной заболевания являются метастазы бронхогенного рака легкого.
Поражение надпочечников при ВИЧ-инфекции
Субклиническая 1-НН выявляется у 8–12 % больных ВИЧ-инфекцией. Наиболее часто она развивается в результате поражения ткани надпочечников инфильтративным процессом с последующей ее деструкцией (цитомегаловирусная инфекция, грибковые инфекции, саркома Капоши, лимфома и т.д.). Применение различных медикаментозных препаратов, влияющих на стероидогенез (кетоконазол, рифампицин, фенитоин), также может стать причиной 1-НН.
Патогенез и клинические проявления надпочечниковой недостаточности
Первичная надпочечниковая недостаточность
В основе 1-НН лежит абсолютный дефицит кортикостероидов. Дефицит альдостерона приводит к потере через почки и ЖКТ натрия и воды с развитием дегидратации, гиповолемии, гипотонии, а также прогрессирующей гиперкалиемии. Дефицит кортизола – основного адаптогенного гормона человеческого организма – приводит к снижению сопротивляемости к различным эндо- и экзогенным стрессорам, на фоне которых (чаще всего на фоне инфекций) и происходит декомпенсация НН. Принципиальное значение играют выпадение такой функции кортизола, как стимуляция глюконеогенеза и гликогенолиза в печени, а также пермиссивные эффекты кортизола в отношении тиреоидных гормонов и катехоламинов.
Клиническая картина 1-НН была достаточно полно описана самим Томасом Аддисоном. В этом плане за последние 150 лет к этому описанию прибавились лишь незначительные дополнения. 1-НН манифестирует в среднем возрасте (между 20 и 50 годами). В настоящее время заболевание достоверно чаще встречается у женщин, что связывают с преобладанием 1-НН аутоиммунного генеза. Болезнью Аддисона туберкулезной этиологии мужчины и женщины болеют одинаково часто.
Гиперпигментация кожи и слизистых – наиболее известный и типичный симптом 1-НН, который патогенетически связан с тем, что при 1-НН имеется гиперсекреция не только АКТГ, но его предшественника – пропиомеланокортина, из которого, помимо АКТГ, в избытке образуется меланоцитстимулирующий гормон. Гиперпигментация наиболее заметна на открытых частях тела (лицо, руки, шея), в местах трения (кожные складки, места трения одеждой), местах естественного скопления меланина. Принципиальное значение имеет гиперпигментация слизистых (полость рта, десны, слизистая щек на уровне зубов, места трения зубных протезов). Это достаточно специфические признаки. Гиперпигментация соответствует тяжести и давности процесса.
На фоне пигментации часто обнаруживаются витилиго, очаги алопеции.
Похудание – типичный симптом НН; прогрессирующее увеличение массы тела пациента практически исключает диагноз. Потеря массы, как правило, значительная, достигает 5–20 кг и связано с выпадением анаболическрго эффекта глюкокортикоидов и андрогенов.
Общая и мышечная слабость – в начале заболевания может быть выражена умеренно (снижение работоспособности) и достигает значительных степеней при декомпенсации заболевания (вплоть до адинамии). Характерным симптомом 1-НН является психическая депрессия. Эти изменения связаны с электролитными нарушениями и с нейротоксическим эффектом АКТГ и его метаболитов (проопиомеланокортина – ПОМК).
Кардинальный симптом 1-НН – артериальная гипотензия, вследствие обезвоживания, снижения ОЦК, а также выпадения пермиссивных эффектов кортизола в отношении тиреоидных гормонов и катехоламинов. Выраженная систолическая и диастолическая гипертензия в большинстве случаев позволяет исключить диагноз. Однако, если НН развилась на фоне существующей артериальной гипертензии, то АД может быть (то есть стать) нормальным или АГ приобрести гораздо более мягкое течение.
Той или иной выраженности диспепсические расстройства имеются практически всегда. Эта симптоматика связана с электролитными нарушениями и токсическим действием метаболитов АКТГ на ЦНС. Чаще это плохой аппетит и тошнота, периодически возникающие разлитые боли в животе, реже – рвота, расстройство стула. Характерный симптом 1-НН, патогенетически связанный с выраженной потерей натрия, – пристрастие к соленой пище.
Гипогликемические приступы – редкий симптом 1-НН, чаще они возникают при 2-НН и связан с выпадением контринсулярного эффекта глюкокортикоидов. Принципиально можно отметить, что почти ни один из отдельно взятых перечисленных симптомов 1-НН не является специфичным для этого заболевания. Значение имеет лишь сочетание этих симптомов.
Вторичный гипокортицизм
Важнейшим патогенетическим отличием 2-НН является отсутствие дефицита альдостерона. Дефицит АКТГ в данном случае приводит к недостаточности кортизола и андрогенов (секреция в пучковой и сетчатой зоне), но не затрагивает практически независимую от аденогипофизарных влияний продукцию альдостерона, секреция которого в клубочковой зоне регулируется ренин– ангиотензиновой системой. В этой связи симптоматика 2-НН будет достаточно бедной. Не будут выражены такие симптомы, как артериальная гипотензия, диспепсические расстройства, пристрастие к соленой пище. Принципиальным клиническим отличием 2-НН является отсутствие гиперпигментации кожи и слизистых. На первый план в клинической картине выступают общая слабость, похудание, реже гипогликемические эпизоды. Облегчает диагностику наличие анамнестических или клинических данных о гипофизарной патологии, операциях на гипофизе, длительном приеме кортикостероидов.
Диагностика
Косвенные лабораторные данные
Косвенная оценка надпочечниковой функции, а в клинической практике - ориентировочная оценка адекватности заместительной терапии, может производиться исходя из минералокортикоидных эффектов кортикостероидов и их препаратов. Кортизол (не говоря уже об альдостероне, а в той или иной степени, о большинстве синтетических стероидов), действуя на уровне почечных канальцев повышает задержку в организме натрия и экскрецию калия с мочой. Таким образом, для гипокортицизма характерны гиперкалиемия и гипонатриемия той или иной степени выраженности. Результатом глюкокортикоидной недостаточности является гипогликемия. Кроме того, в крови часто отмечаются нормохромная или гипохромная анемия, умеренная лейкопения, относительный лимфоцитоз и эозинофилия. СОЭ возрастает лишь при сопутствующем воспалительном процессе.
Исследования уровня гормонов
На протяжении многих десятилетий глюкокортикоидная функция надпочечников оценивалась по уровню суточной экскреции 17-оксикортикостероидов с мочой (реакция Портера-Зильбера). Несмотря на то, что 70-80% экскретируемых метаболитов кортизола относится к фракции 17-ОКС,
11-ОКС и 17-КС (17-кетостероиды), в их состав входят и продукты метаболизма других биологически активных веществ (например, катехоламинов, андротенов). В норме уровень экскреции 17-ОКС у взрослых составляет примерно 8,2-22 мкмоль (3-8 мг) в сутки. Еще менее информативна оценка суточной экскреции 11-оксикортикостероидов, выделение которых с мочой в норме составляет 250-830 нмоль в сутки. Следует подчеркнуть, что определение уровней 17ОКС и 11-ОКС - малоинформативные методы, которые на сегодняшний день как в диагностике патологии надпочечников, так и в клинической медицине в целом, использоваться не должны.
Утренний кортизол крови
Нормальная продукция кортизола осуществляется благодаря координированному функционированию всей ГГН оси. На протяжении суток высвобождение гормона происходит в пульсирующем режиме и наиболее высокого уровня достигает в ранние утренние часы. Продукция кортизола корой надпочечников активизируется при падении уровня гормона в плазме, а также в ответ на физиологические стрессоры, такие как гипогликемия. В качестве самостоятельного теста, уровень кортизола исследуется между 6 и 8 часами утра. Необходимо иметь в виду, что ряд препаратов глюкокортикоидов, в частности гидрокортизон (кортизол), кортизон и метилпреднизолон (медрол, урбазон) дают перекрестную реакцию с эндогенным кортизолом, что требует их отмены как минимум за 24 часа до исследования. Дексаметазон такой перекрестной реакции не дает, однако, следует иметь в виду, что он является наиболее мощным ингибитором секреции АКТГ гипофизом. В плазме крови большая часть кортизола (80%) связана со специфическим кортикостероидсвязывающим глобулином - транскортином, колебание уровня которого также может сказаться на результатах определения уровня кортизола. Эстрогены (в том числе входящие в контрацептивные препараты) стимулируют продукцию транскортина печенью, в результате чего увеличивается и общий уровень кортизола. При циррозе печени, нефротическом синдроме, тиреотоксикозе и ряде других состояниях, содержание транскортина в плазме уменьшается, однако на плазменном уровне кортизола это сказывается далеко не всегда, хотя и содержание общего кортизола может уменьшиться.
Итак для оценки функционального состояния коры надпочечников уже длительное время используется определение уровня кортизола плазмы в утренние часы. Однако, нормальный уровень кортизола - 9-25 мкг% (0,24 - 0,69 мкмоль/л) может определяться и при наличии НН. Приводить оторванную от конкретной лаборатории пограничную цифру не целесообразно, однако, можно с уверенностью сказать, что уровень утреннего кортизола плазмы выше 19 мкг% (0,53 мкмоль/л) исключает НН и такие пациенты в дальнейшем обследовании на этот счет не нуждаются. Большинство исследователей утверждает, что уровень кортизола менее 3 мкг% (0,08 мкмоль/л) является абсолютно диагностичным в отношении НН. Таким образом, у многих пациентов с НН уровент кортизола крови будет иметь пограничные значения, то есть примерно между 3 и 19 мкг%, что требует дальнейшего обследования.
Экскреция свободного кортизола с мочой
Использование высокоспециффических антител, которые связываются исключительно с D- кольцом кортизола, исключает перекрестную реакцию с другими стероидами. Экскреция свободного кортизола составляет менее 1% от объема его суточной секреции надпочечниками, однако вполне адекватно отражает последнюю. На фоне развернутой клинической картины болезни Аддисона, низкое содержание свободного кортизола в суточной моче (норма: 55-250 нмоль (20-90 мкг) в сутки), свидетельствует о НН и диктует необходимость начала заместительной терапии.
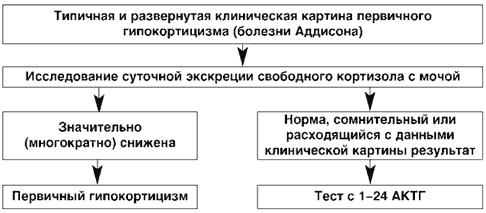
В реальной работе практического врача диагностический поиск очень часто этими исследованиями и ограничивается. Такая ситуация возможна только в случае яркой, классической клинической картины, которой соответствуют выраженные и типичные лабораторные сдвиги. При развернутой клинической картине первичного гипокортицизма обнаружение значительного снижения суточной экскреции свободного кортизола с мочой позволяет поставить диагноз и приступать к лечению.
Тест с Синактеном (аналог АКТГ) является «золотым стандартом» в диагностике 1-НН и проводится при сомнительных результатах обследования. Синактен (кортрозин, 1-24- кортикотропин) представляет собой соединение, состоящее из первых 24-х от всего 39аминокислотного состава природного АКТГ, и обладает всеми его фармакологическими свойствами, то есть, при нормальном функциональном состоянии коры надпочечников, он стимулирует биосинтез кортикостероидов. Стимуляционный тест с исследованием уровня кортизола в плазме крови через 30 и 60 мин после внутривенного введения 250 мг (25 ЕД) Синактена на 5 мл физиологического раствора – классическое исследование в диагностике первичного гипокортицизма.
Подъем кортизола до уровня 18-20 мкг/дл (550 нмоль/л) в тесте с синактеном принято считать критерием нормального надпочечникового ответа на стимуляцию. При небольшом снижении этого уровня - до 13-17 мкг% (0,36-0,47 мкмоль/л), тест следует повторить. Решение вопроса о необходимости начала заместительной терапии решается индивидуально, в зависимости от весомости подозрения на НН.
Определена уровня АКТГ крови.
В клинической практике возникает необходимость дифференцировать с помощью лабораторных методов 1-НН и 2-НН. Для этого может быть использовано определение уровня АКТГ, который будет повышен при 1-НН (более 100 пг/мл) и снижен при 2-НН. Следует отметить, что определение уровня АКТГ собственно для диагностики НН самостоятельного значения не имеет и используется в комплексном обследовании.
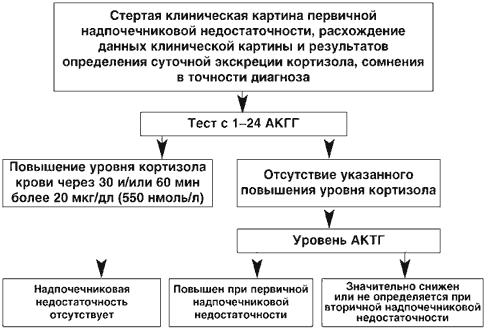
Кроме того, для 1-НН будет характерно повышение активности ренина в плазме крови (по системе обратной связи: мало альдостерона – усиливается выброс ренина), что связано с развивающимся при 1-НН дефицитом альдостерона. Этого не наблюдается при 2-НН.
Стимулирующие функциональные пробы позволяют оценить целостность всей гипоталамо- гипофизарно-надпочечниковой оси. Кроме того, с их помощью можно провести дифференциальную диагностика первичной и вторичной надпочечниковой недостаточности. В целом наибольшее значение в диагностике 2-НН имеют тесты с инсулиновой гипогликемией и метирапоном (метопироном).
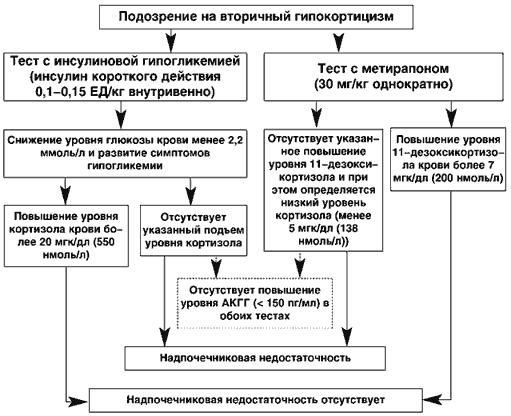
Тест с инсулиновой гипогликемией
ТИГ - один из самых старых, однако до сегодняшнего дня не потерявших своего значения в диагностике НН тестов, который позволяет исследовать интегративную целостность сразу всей ГГНС. Гипогликемический стресс является сильным непрямым стимулятором секреции кортизола, которая опосредуется через активацию гипоталамических центров и выброс АКТГ.
Инсулин короткого действия вводится внутривенно в дозе 0,1-0,15 Ед/кг. Если у пациента имеет место инсулинорезистентность того или иного генеза (например, при акромегалии), дозу инсулина можно повысить. Следует иметь в виду, что доза инсулина менее 0,1 Ед/кг не приведет к достаточной активации ГГНС. После достижения гипогликемии (2,2 ммоль/л) забирается кровь на кортизол, АКТГ и вводится глюкоза (без АКТГ нельзя судить об уровне повреждения). Нормальную надпочечниковую функцию отражает подъем уровня кортизола на протяжении теста выше 18 мкг% (0,5 мкмоль/л). НН диагносцируется если пиковый уровень кортизола не достигает 18 мкг% и при этом развивается гипогликемия (40 мг% = 2,2 ммоль/л). Основным недостатком ТИГ является его потенциальная опасность в плане развития при имеющейся НН тяжелых гипогликемий, которые могут сопровождаться сосудистым коллапсом, то есть может быть спровоцирован аддисонический криз. Пожилым пациентам, а также при имеющейся сердечнососудистой патологии, аритмиях, нарушении мозгового кровообращения инсулинотолерантный тест противопоказан.
Интерпретация: АКТГ , кортизол - ГГН ось бес патологии АКТГ , кортизол - 1-НН
АКТГ , кортизол - 2-НН
Метирапоновый тест
Тест с метирапоном (метапироном) является очень чувствительным и ценным тестом, который используется для оценки состояния всей гипоталамо-гипофизарно-надпочечниковой оси и дифференциальной диагностики 1-НН и 2-НН. Метирапон подавляет надпочечниковый фермент 11 -гидроксилазу, который обеспечивает превращение 11-дезоксикортизола (вещество S) в кортизол, что является конечным этапом надпочечникового стероидогенеза. В норме при приеме метирапона блокада продукции кортизола приведет к стимуляции секреции АКТГ, которая, в свою очередь, активизирует стероидогенез проксимальнее ферментного блока и приведет к накоплению избытка 11-дезоксикортизола. При НН этого не произойдет. Эта проба проводится при наличии противопоказаний к тесту с инсулиновой гипогликемией.
Препарат в дозе 30 мг/кг выпивается пациентом одномоментно ночью в 24.00. На следующее утро в 8.00 производится забор крови для определения в ней содержания кортизола и 11дезоксикортизола [37]. Поскольку метирапон потенциально может спровоцировать острую НН, тест проводится только у госпитализированных пациентов. После забора крови, пациентам с вероятной НН профилактически вводится преднизолон или гидрокортизон.
Нормальную функцию ГГНС отражает уровень 11-дезоксикортизола более 7 мкг% (0,19 мкмоль/л). Уровень АКТГ повышается более чем до 150 пг/дл. 2-НН диагносцируется если 11дезоксикортизол не достигает уровня 7 мкг% и при этом определяется низкий уровень кортизола (2-5 мкг% = 0,06-0,14 мкмоль/л). Последний свидетельствует об адекватной блокаде 11 - гидроксилазы. Если уровень 11-гидроксикортизола ниже 7 мкг%, а уровень кортизола превышает 5 мкг% - никакого заключения по результатам теста сделать нельзя, т.к. блокада 11 -гидроксилазы не была достигнута (без АКТГ нельзя судить об уровне повреждения).
Результаты метирапонового теста могут быть искажены приемом глюкокортикоидов, фенитоина дифенина, фенобарбитала, рифампицина. Последние два препарата усиливают метаболизм метирапона, снижая таким образом его плазменный уровень и делая неадекватной блокаду 11 - гидроксилазы.
Интерпретация: АКТГ , 11-гидроксикортизола - ГГН ось бес патологии АКТГ , 11-гидроксикортизола - 1-НН АКТГ , 11-гидроксикортизола - 2-НН
Схематичная интерпритация теста с инсулиновой гипогликемией и теста с метирапоном (метапироном) показана ниже.
Определение уровня поражения ГГНСи этиологии
После того, как с помощью описанных исследований диагноз НН установлен, на следующем этапе необходимо выявить уровень поражения ГГНС. Это во многом определяет тактику лечения. Так пациентам с 2-НН нет необходимости назначать препараты минералокортикоидных гормонов (кортинефф), поскольку при этой форме клубочковая зона коры надпочечника интактна и продолжает функционировать автономно в системе ренин-ангиотензин-альдостерон. При 1-НН в деструктивный процесс вовлекается вся кора надпочечника, что в большинстве случаев требует дополнительного назначения минералокортикоидов. Информативность инструментальных методов обследования (прежде всего КТ и МРТ), УЗИ варьирует в зависимости от предполагаемого уровня повреждения ГГНС и его характера. Указанные визуализирующие методы более ценны в плане выявления гипоталамо-гипофизарной патологии, чем в диагностике 1-НН (за исключением случаев поражения надпочечников объемным процессом, и возможного обнаружения калицинатов при туберкулезе). Таким образом, целесообразность использования визуализирующих методов будет определяться исходя из данных клинической картины и лабораторных исследований.
Так же могут использоваться в комплексном обследовании следующие методы:
1.Определение уровня АКТГ
2.Определение уровня кортикотропин-релизинг гормона
3.Определение циркулирующих антител к 21-гидроксилазе (P450c21). Указанные антитела являются высокочувствительным и специфичным маркером 1-НН аутоиммунного генеза.
4.Определение содержания длинноцепочечных жирных кислот. Это исследование особенно показано при сочетании 1-НН с различного рода неврологической симптоматикой.
5.Определенное значение имеют тест с инсулиновой гипогликемией и тест с метирапоном (метапироном).
Лечение надпочечниковой недостаточности
