
6 курс / Медицинская реабилитация, ЛФК, Спортивная медицина / Биохимия_двигательной_деятельности_Учебник_С_С_Михайлов_2016
.pdf
Часть 1. Биохимия человека |
С.С. Михайлов |
|
|
|
|
тативной реакции, затем скорость реакции достигает максимума, и при дальнейшем увеличении температуры скорость реакции снижается вплоть до ее прекращения. Температура, при которой отмечается наибольшая скорость реакции, называется температурным оптимумом реакции – tºopt.
Рис. 4. Зависимость скорости ферментативной реакции от температуры
Возрастание ферментативной активности при повышении температуры от низких величин до температурного оптимума (левая ветвь кривой на рис. 4) объясняется увеличением среднего энергетического уровня и числа столкновений реагирующих молекул с ростом температуры. Согласно правилу Вант-Гоффа повышение температуры на 10º вызывает увеличение скорости химической реакции в 2–4 раза. Это правило относится ко всем химическим реакциям, в том числе к ферментативным.
Снижение активности ферментов при повышении температуры выше температурного оптимума (правая ветвь кривой на рис. 4) объясняется тепловой денатурацией ферментного белка, которая при высоких температурах (80–100ºС) вызывает полную потерю каталитической активности фермента.
Для большинства ферментов температурный оптимум равен 37–40ºС, т.е. соответствует температуре тела. В очень коротких опытах температурный оптимум может быть более высоким, так как за очень малое время денатурация фермента произойти не успевает.
Как видно из рис. 4, при очень низких (ниже 0ºС) и высоких (80–100ºС) температурах активность ферментов равна нулю. Однако при низких температурах ферменты сохраняют свою нативность, и при повышении температуры у них вновь появляется каталитическая активность. В настоящее время ферменты выделяют из растворов путем лиофильной сушки, т.е. сушки в замороженном состоянии при очень низком давлении. Полученные
60
Глава 8 |
Ферментативный катализ |
|
|
|
|
таким образом лиофилизированные ферментные препараты хорошо сохраняются в течение длительного времени даже при комнатной температуре.
Действие же высоких температур приводит к необратимой потере ферментами способности ускорять химические реакции, так как в этом случае происходит их необратимая денатурация. Поэтому на практике для подавления ферментативной активности (например, ферментов микробов, вызывающих порчу пищевых продуктов) обычно используется термическая обработка.
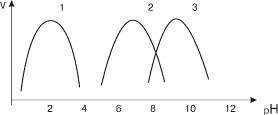
Зависимость скорости ферментативной реакции от рН
Скорость ферментативных реакций значительно зависит от кислотности среды, в которой они протекают. Для каждого фермента имеется определенное значение рН, при котором наблюдается наибольшая скорость реакции – рН-оптимум. При отклонении в любую сторону от этого значения рН резко уменьшается ферментативная активность. Важно подчеркнуть, что величина рН-оптимума у разных ферментов колеблется в большом диапазоне значений рН, в то время как температурный оптимум для большинства ферментов составляет 37–40ºС. В качестве примера (см. рис. 5) можно привести значения рН-оптимума следующих ферментов:
пепсин желудочного сока – 1,0–2,0; амилаза слюны – 6,8–7,0;
щелочная фосфатаза плазмы крови – 9,0–10,0.
Рис. 5. Зависимость скорости ферментативной реакции от рН
(1 – пепсин, 2 – амилаза, 3 – щелочная фосфатаза )
Влияние кислотности среды на скорость ферментативных реакций обусловлено тем, что при изменении кислотности меняется конформация всей белковой молекулы фермента, в том числе изменяется конформация активного центра и способность его осуществлять катализ. При рН-оптимуме фермент находится
61
Книга рекомендована к покупке и прочтению разделом по профилактике заболеваний сайта https://meduniver.com/

Часть 1. Биохимия человека |
С.С. Михайлов |
|
|
|
|
в оптимальной для проявления каталитических свойств конформации. При небольшом отклонении величины кислотности от рН-оптимума наблюдается незначительное изменение конформации, носящее обратимый характер. При значительном отклонении от рН-оптимума (в сильно кислой и сильно щелочной среде) происходит необратимая денатурация ферментного белка, приводящая к полной утрате каталитической активности.
При работе с ферментами в лабораторных условиях в реакционную среду вводят буферные растворы, рН которых соответствует рН-оптимуму изучаемых ферментов.
8.6. ИНГИБИТОРЫ ФЕРМЕНТОВ
Скорость ферментативной реакции существенно зависит от присутствия ингибиторов и активаторов.
Ингибиторы (I) – это химические соединения (обычно низкомолекулярные), которые, находясь в низких концентрациях, избирательно тормозят определенные ферментативные реакции. При этом ингибитор всегда присоединяется к ферменту с образованием фермент-ингибиторного комплекса. Фермент, связанный с ингибитором, теряет свою каталитическую активность.
Если связи между ферментом и ингибитором прочные, то действие ингибитора носит необратимый характер, и торможение нарастает во времени вплоть до полного прекращения ферментативной реакции:
E + I  EI
EI
Такие ингибиторы называются необратимыми. Примером необратимых ингибиторов являются фосфорорганические соединения (табун, зарин, дихлофос, карбофос и др.), избирательно и необратимо угнетающие важнейший фермент организма холинэстеразу, участвующую в передаче нервных импульсов.
Если ингибитор присоединяется к ферменту за счет непрочных связей, то торможение фермента является обратимым и не зависит от времени:
E + I  EI
EI
Ингибиторы такого типа называются обратимыми.
В свою очередь, обратимые ингибиторы делятся на две разновидности: конкурентные и неконкурентные.
62

Глава 8 |
Ферментативный катализ |
|
|
|
|
Конкурентные ингибиторы присоединяются к активному центру фермента, т.е. к тому же участку поверхности фермента, что и субстрат. Поэтому между ингибитором и субстратом идет конкуренция за присоединение к активному центру. Занимая активный центр, ингибитор тем самым препятствует образованию фермент-субстратного комплекса – первой стадии ферментативного катализа. Конкурентные ингибиторы обычно по строению похожи на субстрат.
Неконкурентные ингибиторы присоединяются к ферменту вне активного центра. Этот участок поверхности фермента называется аллостерический центр (т.е. находящийся в другом месте по сравнению с активным центром).
Присоединение неконкурентного ингибитора к аллостерическому центру вызывает неблагоприятное изменение пространственной структуры (конформации) всей молекулы фермента, в том числе и активного центра. В результате каталитические свойства фермента снижаются.
Неконкурентные ингибиторы участвуют в регуляции скорости ферментативных реакций, протекающих в организме. В роли неконкурентных ингибиторов могут быть гормоны, конечные и промежуточные продукты ферментативных реакций, ионы металлов, лекарственные вещества.
8.7. АКТИВАТОРЫ ФЕРМЕНТОВ
Активаторы – вещества, избирательно повышающие скорость определенных ферментативных реакций. Активаторы, подобно неконкурентным ингибиторам, присоединяются обратимо к аллостерическому центру фермента. Но в этом случае изменение конформации фермента будет благоприятным для функционирования активного центра, что приводит в итоге к повышению скорости ферментативной реакции. В организме активаторами являются некоторые гормоны, промежуточные продукты метаболических процессов, ионы металлов, а также лекарственные препараты.
8.8.РЕГУЛЯЦИЯ СКОРОСТИ ФЕРМЕНТАТИВНЫХ РЕАКЦИЙ
Особенностью ферментативных реакций является наличие механизмов регуляции их скорости. Благодаря регуляторным механизмам ферментативные реакции протекают со скоростями,
63
Книга рекомендована к покупке и прочтению разделом по профилактике заболеваний сайта https://meduniver.com/
Часть 1. Биохимия человека |
С.С. Михайлов |
|
|
|
|
соответствующими потребностям организма. Например, при выполнении мышечной работы резко повышается скорость реакций окисления, сопровождающихся выделением энергии, и одновременно снижается скорость реакций синтеза, потребляющих энергию. Во время отдыха после работы наблюдается возрастание скорости реакций синтеза химических соединений, использованных при выполнении физических нагрузок.
К основным механизмам регуляции скорости ферментативных реакций можно отнести следующие:
Изменение скорости синтеза ферментов. Ферменты, являясь белками, постепенно разрушаются, и поэтому в клетках постоянно синтезируются новые ферментные белки. При повышении скорости образования новых ферментов их содержание в клетках возрастает. При этом скорость ферментативных реакций увеличивается, так как зависимость скорости реакции от концентрации фермента носит прямолинейный характер. При уменьшении выработки ферментов их концентрация в клетках постепенно снижается, что сопровождается падением скорости катализируемых ими реакций.
Изменение скорости синтеза ферментов обычно происходит под влиянием гормонов, которые ускоряют или замедляют первый этап синтеза ферментных белков – считывание генетической информации – транскрипцию. Поэтому данный механизм регуляции часто называется регуляцией на генетическом уровне.
Модификация ферментов. Под модификацией понимается незначительное изменение химического состава молекулы фермента, приводящее к изменению каталитической активности.
Модификация может быть обратимой и необратимой.
Впервом случае изменение строения фермента носит обратимый характер и фермент может многократно менять свою активность. Например, некоторые ферменты содержат в своей молекуле остаток фосфорной кислоты. При отщеплении фосфатного остатка у одних ферментов каталитическая активность снижается; при включении его снова в состав ферментов активность их возрастает. У других же ферментов фосфорилированная форма (содержащая фосфат), наоборот, малоактивна. Отщепление фосфорной кислоты от таких ферментов ведет к повышению их активности.
Примером необратимой модификации служит активация пищеварительных ферментов, действующих на пищевые белки. Так,
всоставе желудочного сока содержится белок пепсиноген, не обладающий каталитической активностью. В полости желудка под
64

Глава 8 |
Ферментативный катализ |
|
|
|
|
действием соляной кислоты от этого белка отщепляется небольшой полипептид и образуется очень активный фермент, расщепляющий в пищевых белках пептидные связи, – пепсин. (Белки, являющиеся предшественниками ферментов, называются проферментами.)
Изменение конформации ферментов. Изменение конформации, т.е. пространственного строения ферментного белка происходит под действием неконкурентных ингибиторов и активаторов, которыми могут быть гормоны, промежуточные и конечные продукты ферментативных реакций, ионы металлов, лекарства (см. выше). Изменение конформации ферментов возможно и при изменении условий среды, например, при повышении или снижении кислотности.
8.9. КЛАССИФИКАЦИЯ И ИНДЕКСАЦИЯ ФЕРМЕНТОВ
Современная классификация ферментов основывается на характере химической реакции, катализируемой ферментом. Все ферменты делятся на шесть классов в зависимости от типа катализируемой реакции:
I класс – оксидоредуктазы – ферменты, катализирующие окислительно-восстановительные реакции.
Схематично действие ферментов I класса можно записать:
A + B  C + D
C + D
II класс – трансферазы – ферменты, катализирующие перенос химических группировок с молекулы одного вещества на молекулу другого:
AB + C  A + BC
A + BC
III класс – гидролазы – ферменты, расщепляющие химические связи путем присоединения воды, т.е. путем гидролиза:
AB + H2O  A–H + B–OH
A–H + B–OH
IV класс – лиазы – ферменты, катализирующие расщепление химических связей без присоединения воды:
AB  A + B
A + B
V класс – изомеразы – ферменты, катализирующие изомерные превращения, т.е. перенос отдельных химических групп в пределах одной молекулы:
A  B
B
65
Книга рекомендована к покупке и прочтению разделом по профилактике заболеваний сайта https://meduniver.com/

Часть 1. Биохимия человека |
С.С. Михайлов |
|
|
|
|
VI класс – синтетазы – ферменты, катализирующие реакции синтеза, протекающие за счет энергии гидролиза АТФ:
A
Каждый класс, в свою очередь, делится на подклассы, внутри подклассов выделены подподклассы. Каждый подподкласс содержит список индивидуальных ферментов в строго определенной последовательности, которая не изменяется, а лишь продлевается по мере открытия новых ферментов.
В основе подразделения ферментов на подклассы и на подподклассы лежит тип химической связи или химическое строение группировки субстрата, на которую действует фермент.
С классификацией ферментов тесно связана их индексация (нумерация). Индекс (шифр) каждого фермента состоит из четырех чисел, разделенных точками, и составляется по следующему принципу: первая цифра индекса указывает, к какому из шести классов принадлежит данный фермент. Второе и третье числа индекса обозначают соответственно порядковые номера подклассов и подподклассов. Четвертое число индекса – порядковый номер индивидуального фермента внутри своего подподкласса.
Например, фермент слюны – амилаза, расщепляющий крахмал, имеет индекс 3.2.1.1, что свидетельствует о принадлежности этого фермента к классу гидролаз.
8.10. НОМЕНКЛАТУРА ФЕРМЕНТОВ
Название фермента, как правило, состоит из двух частей. Первая часть является названием субстрата, превращения которого катализируется данным ферментом. Вторая часть названия, имеющая окончание «-аза», указывает природу реакции. Например, фермент, отщепляющий от лактата (молочная кислота) атомы водорода, называется лактатдегидрогеназа; фермент, катализирующий изомеризацию глюкозо-6-фосфата в фруктозо-6- фосфат, имеет название глюкозофосфат-изомераза; а фермент, участвующий в синтезе гликогена, – гликогенсинтетаза.
66

Глава 8 Ферментативный катализ
Тесты для самоконтроля:
1. |
Ферменты в организме выполняют функцию: |
|
а) каталитическую |
в) транспортную |
|
б) структурную |
г) энергетическую |
|
2. |
По строению ферменты являются: |
|
а) белками |
б) углеводами |
|
б) нуклеотидами |
г) липидами |
|
3. |
Активный центр ферментов – простых белков состоит из: |
|
а) аминокислот |
в) нуклеотидов |
|
б) аминокислот и липоидов |
г) олигосахаридов |
|
4. Первой стадией ферментативного катализа является:
а) возвращение фермента в исходное состояние б) образование фермент-субстратного комплекса в) освобождение продукта реакции
г) химическое преобразование фермент-субстратного комплекса
5. Ферменты проявляют оптимальную активность при темпе-
ратуре: |
|
|
|
а) 0–10ºС |
б) 35–40ºС |
в) 55–75ºС |
г) 90–100ºС |
67
Книга рекомендована к покупке и прочтению разделом по профилактике заболеваний сайта https://meduniver.com/

Глава 9
ОБМЕН БЕЛКОВ
9.1.ПЕРЕВАРИВАНИЕ И ВСАСЫВАНИЕ БЕЛКОВ
Всутки с пищей поступает около 100 г белков. Переваривание белков осуществляется протеолитическими
ферментами желудочного, поджелудочного и кишечного соков. Расщепление пищевых белков начинается в полости желудка под воздействием желудочного сока. Вырабатывается желудочный сок железами стенки желудка, причем его компоненты образуются разными клетками. Так, главные клетки синтезируют пепсиноген – белок, являющийся предшественником фермента пепсина (т.е. проферментом); обкладочные клетки осуществляют выработку соляной кислоты, а добавочные клетки выделяют в полость желудка белок муцин, который в форме вязкой слизи покрывает стенку желудка и защищает ее от соляной кислоты
и пепсина.
Попадая в полость желудка, пепсиноген под влиянием соляной кислоты превращается в активный протеолитический фермент пепсин. При этом от пепсиногена отщепляется небольшой полипептид, экранирующий (закрывающий) активный центр. Образовавшийся пепсин подобно соляной кислоте вызывает быстрое превращение остальных порций пепсиногена в активную форму. Такой механизм активации пепсина называется аутокатализом. Образование активного пепсина в полости желудка, т.е. во внешней среде, предупреждает нежелательное воздействие этого фермента на белки клеток желудка, где происходит его образование. Муцин, покрывающий защитным слоем поверхность пищеварительного тракта, к действию пепсина устойчив.
Под воздействием образовавшегося пепсина в пищевых белках расщепляются пептидные связи, находящиеся в глубине их молекул. В результате такого действия пепсина белковые молекулы превращаются в смесь полипептидов различной длины, которую иногда называют пептоном. Тепловая обработка пищи, вызывающая денатурацию белков, облегчает переваривание белков пищи, так как денатурация вызывает изменение пространственной формы белковой молекулы, и внутренние пептидные связи становятся доступными для пепсина и других протеолитических ферментов.
68
Глава 9 |
Обмен белков |
|
|
|
|
Соляная кислота, входящая в состав желудочного сока, кроме активации пепсина, еще создает в полости желудка оптимальную для действия пепсина сильнокислую среду (рН 1–2). Соляная кислота также вызывает денатурацию пищевых белков, что способствует лучшему их расщеплению пепсином. Кроме того, соляная кислота, являясь сильной кислотой, обладает бактерицидным действие и обезвреживает микробы, поступающие с пищей в желудок.
Дальнейшее переваривание белков протекает в тонкой кишке, куда из желудка поступает смесь полипептидов различной длины. В составе поджелудочного сока, поступающего в тонкую кишку, содержатся проферменты – трипсиноген, химотрипсиноге и проэластаза, которые синтезируются в поджелудочной железе.
Превращение проферментов в активную форму происходит в тонкой кишке. Вначале под действием фермента энтерокиназы, встроенного в мембрану клеток тонкой кишки, трипсиноген становится трипсином. Далее образовавшийся трипсин активирует переход остальных проферментов – химотрипсиногена и проэластазы – соответственно в химотрипсин и эластазу, причем трипсин путем аутокатализа также стимулирует превращение бóльшей части трипсиногена в трипсин.
Образовавшиеся трипсин и химотрипсин расщепляют полипептиды, поступившие в тонкую кишку из желудка, до олигопептидов, состоящих из нескольких аминокислот, преимущественно ди- и трипептидов.
Эластаза предназначена для расщепления прочных белков соединительной ткани – коллагена и эластина. Под ее действием эти белки тоже превращаются в олигопептиды.
Завершается переваривание белков в тонкой кишке под действием ферментов кишечного сока. Эти ферменты встроены в стенку микроворсинок и не выделяются в полость кишки. Поэтому расщепление ранее образовавшихся олигопептидов происходит на поверхности микроворсинок и называется пристеночным, или мембранным, пищеварением. Аминокислоты, возникающие на поверхности микроворсинок, сразу же всасываются и по системе воротной вены поступают в печень и далее в большой круг кровообращения. Незначительная часть аминокислот всасывается в лимфатическую систему. Всасывание аминокислот, сопровождающееся переносом их через мембраны, требует энергии АТФ.
69
Книга рекомендована к покупке и прочтению разделом по профилактике заболеваний сайта https://meduniver.com/
