
5 курс / Госпитальная педиатрия / Особенности_метаболического_синдрома_у_женщин_в_различные_периоды
.pdfКоличество инсулина и лептина в циркуляторном русле прямо пропорционально массе жировых отложений, и их называют «сигналами ожирения» Повышенный уровень лептина при лептинорезистентности и МС обусловливает развитие гормональной дисфункции и висцерального ожирения. Глюкокор-тикоидная нестабильность (внутриклеточный гиперкортицизм) при метаболическом синдроме и инсулинорезистентности так же приводит к развитию висцерального ожирения [51].
В транспорте половых стероидов активную роль играет циркулирующий ГСПС (глобулин, связывающий половые стероиды, или тестостерон-эстрадиол связывающий глобулин). Установлено, что количество ГСПС определяется как наследственными факторами, так и наличием некоторой экстрагенитальной и генитальной патологии. Наличие положительной корреляции между уровнем ГСПС и ХС ЛПВП и обратной между ГСПС и ХС ЛПНП и ЛПОНП обуславливает наследование данного глобулина как генетического фактора риска развития атеросклероза сосудов головного мозга, ИБС и АГ [19]. Установлена прямая корреляция между содержанием эстрона, 17β-эстрадиола и индексом массы тела, обратная корреляция существует между последним показателем и уровнем ГСПС в сыворотке крови, что особенно характерно для пациенток в периоде постменопаузы [38]. Снижение уровня ГСПС в постменопаузе приводит к росту концентрации свободного тестостерона, относительной гиперандрогении и вносит определенный вклад в формирование абдоминального ожирения. Отмечено, что у женщин с гиноидным типом распределения жировой клетчатки уровень ГСПС выше, чем у таковых с андро-идным типом [48].
При исследовании сыворотки крови пациенток, страдающих сахарным диабетом, было установлено, что нарастание уровня глюкозы и повышение уровня инсулина ведут к увеличению свободного тестостерона и понижению уровня ГСПС [11].
Есть данные о том, что у женщин с анамнестически ранним менархе (до 13 лет), в репродуктивном возрасте уровень ГСПС в сыворотке крови более низкий по сравнению с женщинами с поздним менархе [2].
Ключевым моментом в первичных метаболических нарушениях является формирование инсулинорезистентности. Под ИР в настоящее время понимают первичное, селективное и специфическое нарушение
биологического действия инсулина, сопровождающееся снижением потребления глюкозы тканями (преимущественно скелетными мышцами) и приводящее к хронической ГИ. Селективный характер ИР означает, что отдельные эффекты инсулина сохраняются, например, реабсорбция натрия в почечных канальцах или влияние на симпатический отдел нервной системы (схема 1).
10
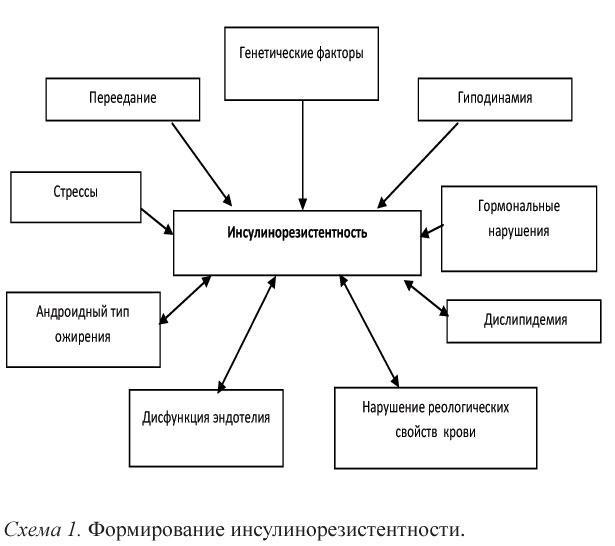
Практически все составляющие МС являются факторами риска развития сердечно-сосудистых заболеваний, а в сочетании многократно ускоряют их развитие. Причем сочетания отдельных компонентов могут рассматриваться в рамках МС только при наличии ИР. Разумеется, не все компоненты метаболического синдрома встречаются одновременно. Каким фенотипом проявится метаболический синдром, зависит от взаимодействия факторов генетических и внешней среды.
Патогенез дислипидемии при метаболическом синдроме
Наиболее частым вариантом дислипидемии при метаболическом синдроме является липидная триада: сочетание гипер-триглицеридемии, низкого уровня ХС ЛПВП и повышения фракции мелких плотных частиц ХС ЛПОНП, переносчиков тригли-церидов, что является результатом их повышенной печеночной продукции и сниженной элиминации. Механизм влияния ИР на развитие липидных нарушений представлены на схеме 2.
11

Гиперинсулинемия способствует увеличению пролиферации гладкомышечных клеток и фибропластов, увеличению активности рецепторов ХС ЛПНП и синтезу эндогенного ХС в клетках сосудистой стенки, коллагена, стимуляции выработки ИПФР.
Патогенез развития артериальной гипертензии при метаболическом синдроме
Механизм развития АГ при МС многогранен и неоднозначен. Общее влияние инсулина на АД представляет собой равновесие между прямым вазодилататорным и непрямым вазокон-стрикторным эффектами. При хронической ГИ возникает парадоксальная реакция со стороны сосудов в связи с преобладанием митогенного и симпатикостимулирующего компонентов (схема 3).
С другой сторон, возможен механизм, посредством которого АГ может сама способствовать ИР. Увеличение активности симпатической нервной системы, возникающей при АГ, вызывает понижение объемного кровотока в капиллярах скелетной мускулатуры в результате их вазоконстрикции, что увеличение пути диффузии глюкозы к клеткам и приводит к инсулинорезистент-ности.
Эндотелий сосудов обладает метаболической и секреторной активностью и играет ключевую роль в регуляции тонуса и проницаемости сосудов. Уникальное положение клеток эндотелия на границе между циркулирующей кровью и тканями делает их наиболее уязвимыми для различных патогенных факторов, находящихся в системном и тканевом кровотоке.
12

В настоящее время есть две основные точки зрения относительно формирования эндотелиопатии. Первая, что при синдроме ИР развивается дисфункция эндотелия сосудов и, в частности, нарушается синтез оксида азота в сосудистой стенке (оксид азота является мощным вазодилататором). Он оказывает сдерживающее влияние на пролиферацию гладкомышечных клеток, тормозит адгезию моноцитов к эндотелию сосудистой стенки, снижает перекисное окисление липидов, т.е. предохраняет стенки сосудов от повреждения. Существует также мнение, что дисфункция эндотелия является не следствием, а причиной в развитии ИР, одним из первичных дефектов, лежащих в основе ее развития. В случае первичного дефекта эндотелиальных клеток трансэндотелиальный транспорт инсулина нарушается, что может способствовать развитию ИР. Однако, до настоящего времени не получено достаточно данных в пользу первичной или вторичной роли эндотелиопатии в генезе инсулинорезистентности [4; 6]. Итак, основные механизмы повышения АД:
13
1.объемозависимый
2.повышение активности ренин-ангиотензин-адьдостеро-новой и симпатоадреналовой систем
3.дисфункция эндотелия
4.гиперлептинемия
5.блокада вазодилатирующего эффекта инсулина.
Имеются данные, указывающие на снижение фибриноли-тической активности у пациентов с МС. PAI-1 является основнымингибитором активатора плазминогена, обеспечивая до 60% общейингибиторной активности в отношении активаторов плазминогена вплазме. Повышение уровня PAI-1 связано с риском тромбозов. PAI-1 синтезируется эндотелиальными клетками, моноцитами, макрофагами, гладкомышечными клетками, адипоцитами висцеральнойжировой ткани. Эндотелиальные клетки и тромбоциты регулируютвыделение PAI-1 в процессе фибринолиза. Было установлено, чтоГИ, гипергликемия и гипертриглицеридемия приводят к значительному повышению экспрессии гена, ответственного за продукциюPAI-1, и, соответственно, к повышению концентрации в крови. Внастоящее время считается, что повышение уровня PAI-1 являетсямаркером высокого риска инфаркта миокарда, ассоциируется ссахарным диабетом [4].
ГЛАВА 3. МЕТАБОЛИЧЕСКИЙ СИНДРОМ У ЖЕНЩИН В РАЗЛИЧНЫЕ ВОЗРАСТНЫЕ ПЕРИОДЫ
Для возникновения и установления нормального менструального цикла у женщины в ее организме должно накопиться пороговое, минимальное количество жира. Возникновение ожирения в любом физиологическом периоде женщины может оказать неблагоприятное влияние на формирование, становление и функцию репродуктивной системы. Реакция гипоталамуса на потерю или накопление жировой массы тела неоднозначна. Так, при ожирении более длительную репродуктивную жизнь связывают с более ранним менархе и плейотропическим действием мутации бета-3-АР гена на репродуктивный статус. Некоторые авторы ранний возраст менархе считают независимым прогнозирующим фактором нарастания индекса массы тела и других осложнений ожирения. Как известно, половые гормоны оказывают влияние на различные органы и ткани благодаря связыванию со специфическими рецепторам. Патологические изменения соотношения гормонов (недостаток эстрогенов и избыток андрогенов) может приводить к развитию у женщин МС (табл.2). С другой стороны, ИР способствует развитию различных гинекологических заболеваний (схема 4).
14

Таблица 2. Влияние гормонов на метаболические процессы у женщин
Гормоны |
Влияние на метаболические |
|
процессы |
|
|
Эстрогены |
Антиатерогенный эффект |
|
|
Гестагены |
Слабый проатерогенный |
|
эффект |
|
|
Андрогены |
Проатерогенный эффект |
|
|
Глюкокортикоиды |
Способствуют развитию ИР |
|
|
Гормон роста |
Способствует развитию ИР |
|
|
Пролактин |
Стимулирует синтез |
|
андрогенов в надпочечниках |
|
|
15
3.1. Особенности метаболического синдрома в период детства и полового созревания
Будучи фактором риска развития тяжелых метаболических нарушений, избыточная масса тела и ожирение у девочек-подростков сопровождаются высокой частотой нарушения становления менструального цикла с гиперандрогенными проявлениями, а при достижении девушками репродуктивного возраста - бесплодием, различными гиперпластическими процессами (гиперплазия и аденоматоз эндометрия), высоким риском развития рака эндометрия, яичников, молочных желез и других гормоно-чувствительных органов [2].
Ожирение в подростковом возрасте достоверно коррелирует с дальнейшими нарушениями менструального цикла по типу аменореи и олигоменореи с ожирением и гирсутизмом в репродуктивном возрасте [9; 11]. Частота МС резко возрастает среди детей и подростков с ожирением, достигая 30-58% [17;50;53]. Согласно данным Американской диабетической ассоциации, среди детей с ожирением нарушение толерантности к глюкозе наблюдается в 28% случаев[42].
Установлено, что при наличии МС у родителей резко возрастает его риск развития у потомства. Проведены лишь единичные исследования МС в детской и подростковой популяциях. Между тем, растущая распространенность ожирения у детей и подростков, а также высокая частота нарушений углеводного и жирового обмена на фоне ожирения обусловливают актуальность изучения МС именно в этой возрастной группе [42].
В 2007 году Международной диабетической федерацией (IDF) приняты новые критерии абдоминального ожирения и метаболического синдрома у детей и подростков. Эти критерии различаются в зависимости от возраста [54].
Абдоминальное ожирение диагностируется у детей и подростков в возрасте 6-15 лет в том случае, если ОТ ≥ 90 процен-тиля значений процентильного распределения окружности талии (приложение 1). У подростков 16 лет и старше абдоминальное ожирение устанавливается согласно критериям для взрослых.
Ввозрастной группе 6-9 лет диагноз МС не устанавливается, но если у пациента имеется абдоминальное ожирение в сочетании с отягощенным семейным анамнезом по МС, СД 2 типа, ССЗ, включая АГ и/или ожирение, то необходимо проводить и другие исследования для последующего наблюдения за пациентами.
Ввозрасте 10-15 лет диагноз МС устанавливается, если помимо абдоминального ожирения у пациента имеется 2 из следующих критериев: ТГ≥ 1,7 ммоль/л, ХС ЛПВП <1,03 ммоль/л, АД ≥130/85 мм рт.ст., глюкоза натощак ≥5,6 ммоль/л (или наличие СД 2 типа). В возрасте 16 лет и старше диагноз метаболического синдрома устанавливается с использованием критериев для взрослых [15; 50; 54].
При обследовании 3116 девушек в возрасте с 12 до 19 лет канадские ученые Jollife C.J., Janssen I. (2007) предложили отрезные точки (cut off) для диагностики метаболического синдрома у девушек, адаптированные критериям для взрослых
(Adult Treatment Panel III и IDF) (табл.3).
16
Таблица 3. Критерии метаболического синдрома для девушек (Jollife C.J.,
Janssen I., 2007)
Показатель |
|
|
|
Девушки |
|
|
|
||
|
|
|
|
|
|
|
|
|
|
Возраст, годы |
12 |
13 |
14 |
15 |
16 |
17 |
18 |
19 |
20 |
|
|
|
|
|
|
|
|
|
|
Окружность талии, см: |
79,5 |
81,3 |
82,9 |
84,2 |
85,2 |
86,2 |
87,0 |
87,7 |
88,0 |
ATP III IDF |
72,5 |
|
|
76,8 |
77,7 |
78,5 |
79,2 |
79,8 |
80,0 |
|
|
74,2 |
75,7 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
ХС ЛПВП, моль/л |
1,25 |
1,25 |
1,26 |
1,26 |
1,27 |
1,27 |
1,28 |
1,29 |
1,30 |
|
|
|
|
|
|
|
|
|
|
Систолическое АД |
121 |
123 |
125 |
126 |
128 |
128 |
129 |
130 |
130 |
|
|
|
|
|
|
|
|
|
|
Диастоличе-ское АД |
80 |
82 |
83 |
84 |
84 |
85 |
85 |
85 |
85 |
|
|
|
|
|
|
|
|
|
|
Триглицери-ды, моль/л |
1,60 |
1,53 |
1,46 |
1,44 |
1,46 |
1,53 |
1,61 |
1,68 |
1,70 |
|
|
|
|
|
|
|
|
|
|
Глюкоза в крови, |
5,6 |
5,6 |
5,6 |
5,6 |
5,6 |
5,6 |
5,6 |
5,6 |
5,6 |
моль/л |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
У подростков могут наблюдаться переходные формы метаболических нарушений, так называемый premetabolic syndrome, являющийся прогностически неблагоприятным в отношении развития МС. Premetabolic syndrome может регистрироваться до наступления полной клинически и лабораторно диагностируемой манифестации заболевания в виде ожирения, артериальной гипертензии, дислипидемии, гиперурикемии, СПКЯ, нарушений менструальной и репродуктивной функций. И в дальнейшем трансформируется в неполный МС, а затем в полный МС.
Существенным ограничением использования индексов для определения инсулинорезистентности является отсутствие референтных значений с учетом возраста и пола. Единые критерии оценки инсулинорезистентности, особенно у детей и подростков, отсутствуют.
По результатам исследований, полученных Леонтьевой И.В. (2008), на основании обследования 372 детей на разной стадии полового созревания предложены средние значения ИР: глюкоза крови натощак - 87±7,75 мг/дл, инсулин - 7,74 ± 5,35 мкЕД/ мл, С-пептид - 1,76 ± 0,79 нг/мл, индекс НОМАR - 1,72 ± 1,27. Величины этих показателей прогрессивно нарастают в пубертатном периоде. Предложенные отрезные точки (cut-off), соответствующие 90-му перцентилю, составляют: инсулин - 15,05 мкЕД/ мл, С-пептид - 2,85 нг/мл, индекс НОМАR - 3,43, индекс QUICKI - более 1,10, гиперхолестеринемия > 5,2 ммоль/л, гипертриглицеридемия > 1,1 ммоль/л (до 10 лет), >1,5 ммоль/л (после 10 лет), ХС ЛПВП < 0,9 ммоль/л. Представленные показатели могут быть полезными для идентификации отдельных компонентов метаболического синдрома у подростков.
Для подросткового возраста характерна относительная нестабильность клинических проявлений МС [45]. Устойчивость основных его компонентов у подростков различна: наивысший коэффициент устойчивости получен для индекса массы тела (0,85), наименьшая устойчивость - для значений инсулина, определенного натощак (0,18). Устойчивость показателя инсулиноре-зистентности так же относительно высока (0,42) [49].
17
Группы риска по развитию МС у детей и подростков:
1.Дети с избыточной массой тела при рождении в сочетании с наличием сахарного диабета у матери [40];
2.Дети с низкой массой тела (более неблагоприятно) при рождении [17];
3.Дети, имеющие отягощенную наследственность по СД II типа или ожирению со стороны матери [1];
4.Дети, имеющие повышенный уровень мочевой кислоты в крови - относительно новый фактор риска [44].
Развитие избыточной массы тела и нарушение последовательности стадий полового созревания, таких как инициация пубертата с изолированного пубархе обсуждается в качестве маркера гиперандрогении и предиктора метаболических нарушений и инсулинорезистентности [11; 37].
Учитывая доказанный высокий риск трансформации инсу-линорезистентности в СПКЯ с его грозными метаболическими исходами, совершенно очевидна необходимость уточнения состояния углеводного и жирового обмена у девочек с избыточной массой тела.
Даже при нормальных результатах рутинного обследования (глюкозотолерантный тест и базальная липидограмма), начиная с этого возраста, вполне оправдана непрерывная программа ранних профилактических мероприятий, направленных на предупреждение ожирения, гиперинсулинизма и преждевременного атерогенеза.
Вышесказанное требует обратить пристальное внимание на отдельные элементы метаболических и эндокринных расстройств у девочек-подростков с ожирением и их роль в формировании и прогрессировании нарушений становления репродуктивной функции. Раннее выявление этих состояний, устранение неблагоприятных клинических и метаболических отклонений может способствовать более успешной профилактике нарушений репродуктивного здоровья, начиная с детского возраста.
18
3.2. Особенности развития метаболического синдрома в репродуктивный период
Нарушения эндокринной системы у женщин тесно связаны с ожирением, начиная с периода полового созревания и на протяжении всей жизни. Имеется прямая зависимость между нарастанием массы тела и тяжестью нарушений овариальной функции, сопровождающихся ановуляцией, неполноценностью люте-иновой фазы цикла и снижающимся числом беременностью.
Гиперандрогения - одно из наиболее частых эндокринных нарушений у женщин репродуктивного возраста. Проведенные исследования свидетельствуют о важной роли инсулина в патогенезе гиперандрогении и СПКЯ. Полагают, что хроническая гиперинсулинемия стимулирует биосинтез андрогенов в текастромальных клетках яичника, нарушает нормальный рост и созревание фолликулов, приводя к хронической ановуляции [19; 28]. Ожирение выявляется у пациенток с СПКЯ в 25-42% случаев. Риск развития СД 2 типа у женщин с СПКЯ и ИР в анамнезе достоверно выше, чем у здоровых женщин. Согласно данным ВОЗ (1998), НТГ и/или СД 2 типа выявляется у 40% женщин с СПКЯ и ожирением и высокий риск развития СД 2 типа у женщин с СПКЯ связан с ИР. Механизмы развития поликистозных яичников при нейроэндокринном ожирении изучены в работах В.Н. Серова, В.Н. Прилепской, Т.В. Овсянниковой [27; 28]. Повышение синтеза β-эндорфинов в ЦНС и нарушение дофаминергической регуляции кортиколиберина и гонадолиберина при стрессе являются основополагающими в патогенезе как гиперплазии эндометрия, так и СПКЯ, а также андроидного ожирения. Ведущая роль принадлежит хронической ановуляции, андроидному типу ожирения, сопровождающимся нарушением стероидогенеза и гиперинсулинемией (схема 5) [3]. Более выраженная продукция тестостерона в текаклетках поликистозных яичников обусловлена влиянием гиперинсулинемии на ЛГзависимый синтез гормона. Степень выраженности гирсутизма зависит от активности 5α-редуктазы, метаболизирующей тестостерон в активную форму - дигидро-тестостерон. Снижение уровня андрогенов на фоне лечения у пациенток с СПКЯ не уменьшает инсулинорезистентность, а ги-перинсулинемия при ожирении является вторичным нарушением [37].
Значительная часть женщин с СПКЯ имеет высокий уровень лептина. Лептин воздействует на репродуктивную функцию через центральные (гонадотропинрилизинг система) и периферические механизмы [10]. Некоторые авторы, принимая во внимание данные о наличии мРНК рецепторов лептина в овариальной ткани, продемонстрировали прямое действие данного гормона на стероидогенез клеток гранулезы крыс in vitro. При этом было показано дозозависимое подавляющее действие лептина на ИПФР-I, потенцированное увеличением ФСГ-стимулированного синтеза Е2 клетками гранулезы.
19
