
3 курс / Патологическая анатомия / Лекции по патану Серов
.pdfВ ж е л у д о ч н о - к и ш е ч н о м т р а к т е характерными проявлениями ДВС-синдрома являются кровоизлияния в слизистую оболочку, эрозии, иногда острые язвы. В микроциркуляторном русле желудка и тонкой кишки обнаруживаются резкое полнокровие, сладж и агглютинация эритроцитов; изредка выявляются чисто фибриновые и эритроцитарные микротромбы.
К о ж н ы е п р о я в л е н и я ДВС-синдрома носят преимущественно геморрагический характер: петехиальная, мелко- и крупнопетлистая, иногда сливная геморрагическая сыпь, множественные кровоизлияния в местах инъекций, операционных разрезах. Иногда в центре высыпаний можно обнаружить очаги некроза. При гистологическом исследовании находят единичные фибриновые, лейкоцитарные и смешанные микротромбы сосудов дермы.
Для поражения а д е н о г и п о ф и з а характерна |
распро- |
страненная внутрисосудистая коагуляция с образованием |
гиали- |
новых и чисто фибриновых тромбов, приводящая к дистрофии и некрозу клеток передней доли гипофиза, что у выживших больных приводит к гипофизарной недостаточности(синдром III и хена).
В м и о к а р д е проявление распространенного свертывания крови наблюдается редко. Единичные гиалиновые микротромбы обтурируют капилляры. Довольно часто обнаруживают геморрагии под эпи- и эндокардом.
В г о л о в н о м м о з г е микротромбы выявляются редко; чаще они встречаются в мягких мозговых оболочках, а также в сосудистых сплетениях и имеют характер чисто фибриновых в гиалиновых.
В с е л е з е н к е морфологические признаки внутрисосудистой коагуляции имеются в мелких внутриорганных артериях и венах (гиалиновые и чисто фибриновые тромбы), синусоидах (тяжи и нити фибрина). В фолликулах определяются белковые массы, содержащие фибрин. Геморрагический синдром также находит свое отражение: постоянно обнаруживаются кровоизлияния в пульпу органа и под капсулу.
КЛАССИФИКАЦИЯ
Клинико-морфологические проявления ДВС-синдрома многообразны. Они определяются степенью нарушения кровотока в системе микроциркуляции отдельных органов, интенсивностью и распространенностью геморрагического синдрома.
В зависимости от р а с п р о с т р а н е н н о с т и выделяют генерализованные и локальные формы ДВС-синдрома.
В зависимости от с к о р о с т и р а з в и т и я и х а р а к т е - р а течения ДВС-синдрома выделяют острую (развивается в сро-
144
ки от нескольких часов до суток), подострую (развивается в течение нескольких дней или 1 нед) и хроническую (развивается в течение недель и месяцев) формы.
Острая форма ДВС-синдрома чаще имеет генерализованный характер. Развивается она в условиях быстрого поступления в кровоток тромбопластинового компонента при эмболии околоплодными водами, переливании несовместимой крови, жировой эмболии (при переломе костей), обширных хирургических операциях, укусах ядовитых змей. Острая форма сопровождается шоковым состоянием: гипотензией, острой дыхательной недостаточностью, затемнением сознания и пр. Параллельно развивается геморрагический синдром. В клинической практике наиболее часто встречаются следующие синдромы, в основе которых лежит окклюзия микроциркуляторного русла тромбами: острая дыхательная недостаточность, острая почечная недостаточность, острая надпочечниковая недостаточность, очаговая ишемичсская дистрофия миокарда, нарушение мозгового кровообращения, эро- зивно-язвенный гастроэнтерит, очаговый панкреокекроз.
Подострая форма ДВС синдромаможет носин, локальный характер. Для нее типично более благоприятное течение. Она нередко сопутствует развитию злокачественных новообразований, лейкозов. реакция отторжения трансплантата, наблюдается при введении некоторых препаратов. Признаки повышенной кровоточивости варьируют от умеренно выраженных до минимальных. Мозаичность симптомов свидетельствует о поражении разных органов и систем. Такое состояние может продолжаться довольно долго, однако присоединение какого-либо даже небольшого экзоили эндогенного стимула переводит синдром из подострой локальной формы в острую генерализованную. Предотвратить такой исход можно, своевременно диагностируя признаки коагулопатии потребления и определяя уровень ПДФ.
При хронической форме ДВС-синдрома, длящейся неделями и месяцами, на первый план выступают медленно нарастающие функциональные нарушения в органах. Подобные варианты те-
чения ДВС соответствуют клинической картине хронических воспалительных заболеваний — хронического нефрита, гепатита, панкреатита, пневмонии и др. Хронический ДВС развивается также при аутоиммунных заболеваниях, ревматических заболеваниях, миелоидных лейкозах, гигантских гемангиомах, злокачественных новообразованиях.
Прогноз. При ДВС-синдроме прогноз определяется степенью его выраженности, распространенностью и характером течения. Опыт современной медицины дает основание говорить о возможности эффективного лечения больных с острыми вариантами ДВС-синдрома, однако летальность пока составляет 50 %.
145

Л е к ц и я 13
ВОСПАЛЕНИЕ
• Воспаление — один из самых распространенных общепатологических процессов и лежит в основе многих заболеваний(воспалительные заболевания). Неудивительно поэтому, что со времен Гиппократа взгляды на воспаление исторически отражали взгляды на сущность болезни вообще. Поэтому воспаление испытало груз всех течений в медицине— гуморализма, целлюляризма, нервизма, физиологизма, а в конце XX столетия — влияние достижений иммунологии, генетики и молекулярной биологии.
ИСТОРИЧЕСКАЯ СПРАВКА
Клинические признаки воспаления были впервые описаны римским энциклопедистом Цельсом 2000 лет назад. Он относил к ним красноту (rubor), припухлость ткани — опухоль (tumor), жар (calor) и боль (dolor). В начале нашей эры греческий врач Гален дополнил эти четыре признака пятым— нарушением функции
(functio laesa).
В довирховский период все многочисленные исследования воспаления проводились путем визуальных наблюдений, хотя и предпринимались попытки выделения различных его форм— катаральное, флегмонозное, гнойное, острое, хроническое воспаление (К.Рокитанский, 1846). Р.Вирхов в "целлюлярной патологии" (1858) смог раскрыть механизмы каждого из классических признаков воспаления: краснота и жар связаны с воспалительной гиперемией, припухлость — со скоплением в ткани экссудата, боль — с повреждением (альтерацией) ткани. Отстаивая свою нутритивную (питательную) теорию воспаления, Р.Вирхов противопоставляет паренхиматозный тип воспаления отделительному (экссудативному).
Важным этапом изучения воспаления вXIX веке явились исследования Ю.Конгеймом (1878) сосудистого компонента воспалительной реакции, позволившие выдвинуть сосудистую теорию воспаления. Подтверждением этой теории послужило открытие А.С.Шкляревским краевого стояния лейкоцитов и В.В.Подвысоцким (1899) межэндотелиальной миграции лейкоцитов в очаге воспаления.
К концу прошлого столетия сущность воспалительной реак-
ции стала достаточно ясной: это защитно-приспособительная реакция, а назначение ее заключается как в уничтожении агента, вызвавшего повреждение, так и в восстановлении повреж-
146
денной ткани. Такое толкование воспаления определяет необходимость изучения его в филогенезе. Этот труд взял на себя И.И.Мечников, показавший, что основой воспалительной реакции является фагоцитоз, осуществляющийся с помощью клеточных "цитаз", названных впоследствии лизосомами. Появляется фагоцитарная теория воспаления И.И.Мечникова(1892), наиболее аргументированная в"Сравнительной патологии воспаления" (1917). Теория Мечникова убеждает в совершенствовании механизмов воспаления по мере эволюции организмов, но она касается лишь фагоцитоза, направленного на уничтожение повреждающего агента; репаративная функция воспаления, ее эволюционное совершенствование оказались вне поля зрения исследователя. Репаративный компонент воспаления был раскрыт лишь в середине нашего столетия исследователями, показавшими роль медиации и клеточной рецепции в кинетике воспалительного процесса.
H.Dale и P.Luidow (1909) первыми открыли первый медиатор воспаления гистамин, a V.Menkin (1948) выделяет из экссудата вещество — лейкотаксин, влияющий на состояние сосудистой стенки и движение лейкоцитов в очаг воспаления. В дальнейшем среди медиаторов воспаления были выделены биогенные амины, плазменные системы, производные арахидоновой кислоты, кислородные радикалы и гидропероксидазы липидов, а также многочисленные медиаторы нейтрофилов, моноцитов, лимфоцитов и фибробластов [Серов В.В., Пауков B.C., 1995].
Эти исследования позволили дать наиболее полное, раскрыкающее сущность процесса, определение воспаления.
СУЩНОСТЬ И ЭТИОЛОГИЯ ВОСПАЛЕНИЯ
• Воспаление — наиболее древняя и сложная сосудисто-мезен- чимальная реакция на повреждение, направленная не только на ликвидацию повреждающего агента, но и на восстановление поврежденной ткани.
Уникальность воспаления в его многоликости. Биологическое его назначение — сохранение вида. Как категория медицинская, воспаление — это и проявление болезни, и патологический процесс, направленный на устранение повреждающего начала и репарацию, т.е. на исцеление от болезни.
Этиология воспаления многообразна. Оно может быть вызва-
но разнообразными э н д о г е н н ы м и и |
э к з о г е н н ы м и |
о и о л о г и ч е с к и м и (вирусы, бактерии, |
грибы, животные- |
паразиты, антитела и иммунные комплексы), |
ф и з и ч е с к и м и |
(лучевая и электрическая энергия, высокие и низкие температуры, пыли и аэрозоли, различные травмы) и х и м и ч е с к и м и ( химические вещества, в том числе лекарства, токсины, яды) фа к т о р а м и .
147
Определение воспаления предусматривает тесную его связь как с иммунитетом(становление иммунитета осуществляется "посредством воспаления" — достаточно вспомнить постинфекционный иммунитет), так и с регенерацией (третья фаза воспаления — фаза репарации). Связь воспаления с иммунитетом и регенерацией хорошо объясняет ставшее аксиомой положение: иммунологический гомеостаз — это структурный гомеостаз.
ВОСПАЛЕНИЕ И ИММУНИТЕТ - КИНЕТИКА ВОСПАЛИТЕЛЬНОГО ПРОЦЕССА
Сопряжение воспаления с иммунитетом для репарации обес печивается участием всех систем защиты организма в уникал ной реакции терминальных сосудов и соединительной ткан„, которая составляет сущность воспаления.
Как известно, защиту организма определяют неспецифические факторы и иммунологическая реактивность, или иммунный ответ.
Неспецифические факторы защиты и иммунологическая реактивность [по Петрову Р.В., 1982]
Неспецифические факторы защиты |
Иммунологическая реактивность |
|
(иммунный ответ) |
|
|
Фагоцитоз |
Антитела |
Система комплемента |
Гиперчувствительность |
|
немедленного типа (ГНТ) |
Интерферон |
Гиперчувствительность |
|
замедленного типа(ГЗТ) |
Лизоцим |
Иммунологическая память |
Пропердин |
Иммунологическая толерант- |
|
ность |
Гидролитические фрагменты |
Идиотипы — антиидиотипы |
Бактерицидные субстанции тканей |
Фагоцитоз |
Непроницаемость покровов |
Система комплемента |
|
|
В становлении иммунитета при воспалении велика роль ка фагоцитоза, так и системы комплемента. Место фагоцитоза, осуществляемого полиморфно-ядерными лейкоцитами (ПЯЛ) и моноцитарными фагоцитами (макрофаги), в системе иммунитета определяется тем, что, несмотря на неспецифичность самого акта фагоцитоза, фагоциты, особенно макрофаги, принимают участие в очищении антигенов, переработке их в иммуногенную форму, которую воспринимает Т-хелпер. Место макрофагов
системе иммунитета определяется и участием в кооперации -Ти В-лимфоцитов, необходимой для становления иммунного ответа. Поэтому фагоцитоз дополняет формы реакций иммунологической реактивности. Система комплемента участвует в специфических реакциях, присоединяя свои компоненты к молекулам антител, что обеспечивает лизис антигенных субстанций, против которых выработаны антитела. Из этого следует, что комплемент как один из неспецифических факторов защиты принимает участие в иммунном ответе, поэтому он, как и фагоцитоз, дополняет формы иммунологической реактивности. Как видно, вклю-
чение иммунного ответа при воспалении обеспечивается двумя клеточными системами неспецифической защиты: системой моноцитарных фагоцитов, а также плазменной системой — системой комплемента.
Кинетика воспалительной реакции для достижения конечной цели — элиминации повреждающего агента и репарации ткани
— характеризуется сменой взаимоотношений клеточных систем защиты между собой и с системой соединительной ткани, что определяется медиаторной регуляцией. Из этого, однако, не следует, что в воспалительной реакции участвуют лишь ПЯЛ, макрофаги, лимфоциты и фибробласты. Клетки — носители вазоактивных аминов (лаброциты, базофилы, тромбоциты), как и сдерживающие их функциональную активность эозинофилы, имеют огромное значение для развития собственно сосудистой реакции воспаления. Но они непричастны к основному назначению воспалительной реакции — элиминации повреждающего начала и репарации повреждения. Как цепная, в значительной мере саморегулирующаяся, воспалительная реакция укладывается в универсальную схему: повреждение -+ медиация ► рецепция ► кле точная кооперация > клеточные трансформации ► репарация (схема 16). Воспалительная реакция определяет и последовательно развивающиеся фазы: 1) повреждения, или альтерации, 2) экссудации, 3) пролиферации и дифференцировки клеток.
П о в р е ж д е н и е ( а л ь т е р а ц и я ) — обязательный компонент воспаления. Это изначально то, на что возникает со- судисто-мезенхимальная реакция, составляющая сущность воспаления. Можно ли считать альтерацию фазой воспаления? Вопрос этот не решается однозначно. Одни современные патологи IRobbins S. et al., 1981] не выделяют альтерацию как таковую, подменяя ее нарушениями микроциркуляции и реологических свойств крови. А.М.Чернух в монографии"Воспаление" (1979) первой стадией воспаления называет сосудистую, выделяя в ней две фазы. Д.С.Саркисов и В.Н.Галанкин(1988) рассматривают альтерацию как неспецифический компонент воспаления, причем не всегда обязательный (В.Н.Галанкин) для развития после-
148 |
149 |

150
дующей |
экссудации |
и |
пролиферации. Иными |
словами, |
без |
||||
допускается |
возможность |
|
развития |
воспаления |
|||||
повреждения, причем альтерация в такой ситуации подменяется |
|
||||||||
функциональной |
недостаточностью |
полиморфно-ядерных |
|
||||||
лейкоцитов. Эта позиция, даже условно допускаемая, исключает |
|
||||||||
понимание воспаления как сосудисто-мезенхимальной реакции |
|
||||||||
на повреждение. |
|
|
|
|
|
|
|
|
|
Многие патологи [Струков А.И., 1972; Серов В.В., Пауков |
|
||||||||
B.C., 1995; Cottier H„ 1980] отстаивают |
|
необходимость |
|
||||||
выделения альтеративной фазы воспаления, характеризующей |
|
||||||||
инициальные процессы (дистрофия, |
некроз) |
|
и выделение |
|
|||||
медиаторов. Вероятно, у патологоанатома есть все основания |
|
||||||||
для |
сохранения |
этой |
, |
фазыимеющей |
конкретное |
|
|||
морфологическое и биохимическое выражение. |
|
|
|
|
|||||
■ Следует заметить, что сохранение альтеративной фазы воспа- |
|
||||||||
лительной реакции не оправдывает выделения альтеративной |
|
||||||||
формы |
воспаления, |
при |
которой |
|
сама |
сосудисто- |
|
||
мезенхимальная |
реакция |
на |
повреждение |
практически |
|
||||
отсутствует. Поэтому необходимо согласиться с большинством |
|
||||||||
современных патологов |
в том, |
что признание |
|
альтеративного |
|
||||
воспаления, выделяемого классической патологией прошлого, противоречит сути воспалительной реакции в ее современном толковании.
Повреждение и медиация — неразрывные компоненты морфогенеза воспаления, поскольку медиаторы "рождаются" в самом повреждении (альтерации).
Принято выделять плазменные(циркулирующие) медиаторы, представленные прежде всего калликреин-кининовой системой, системой комплемента и системой свертывания крови, а также клеточные (локальные) медиаторы, связанные со многими клетками: лаброцитами, тромбоцитами, базофилами, ПЯЛ, макрофагами, лимфоцитами, фибробластами и др. Однако и плазменные, и
клеточные медиаторы тесно взаимосвязаны и работают при
воспалении как аутокаталитическая система, использующая |
|
|||||||
принципы "обратной связи", "дублирования", "необходимого раз- |
|
|||||||
нообразия" и"антагонизма". |
|
|
|
|
|
|||
Эти принципы системы позволяютциркулирующим медиато- |
|
|||||||
рам обеспечить повышение сосудистой проницаемости и актива- |
|
|||||||
цию хемотаксиса ПЯЛ для фагоцитоза, а внутрисосудистую коа- |
|
|||||||
гуляцию в отводящих из очага воспаления сосудах— для отгра- |
|
|||||||
ничения возбудителя и самого очага воспаления(барьерная |
|
|||||||
функция очага воспаления). При этом основные этапы сосудистой |
|
|||||||
реакции |
— повышение |
проницаемости, активация |
хемотаксиса |
|
||||
ПЯЛ и фактора Хагемана— дублируются несколькими ме- |
|
|||||||
диаторами. Те же принципы системы в аутокаталитической реак- |
|
|||||||
ции клеточных медиаторов обеспечивают не только повышение |
|
|||||||
сосудистой проницаемости, фагоцитоз и вторичную деструкцию, но |
|
|||||||
и включение иммунного ответа для элиминации повреждающего |
|
|||||||
агента и продуктов повреждения , инаконец, репарацию ткани |
очаге |
|||||||
путем |
пролиферации |
и |
дифференцировки |
клеток |
в |
|||
воспаления. |
|
|
|
|
|
|
|
|
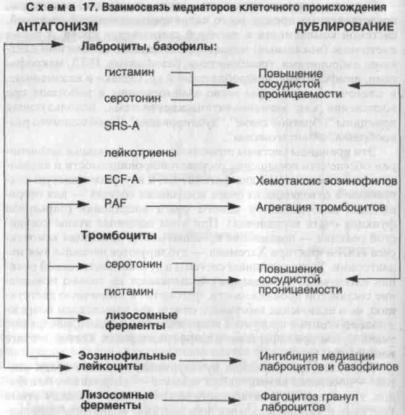
Наиболее ярко принцип дублирования выражен среди клеток |
|
|||||||
— носителей вазоактивных веществ — лаброцитов, базофи-лов, |
|
|||||||
тромбоцитов, а |
антагонистические |
начала— между этими |
|
|||||
клетками и эозинофильными лейкоцитами: медиаторы лаброци- |
|
|||||||
тов и базофилов стимулируют хемотаксис эозинофилов, послед- |
|
|||||||
ние же способны инактивировать эти медиаторы и фагоцитиро- |
|
|||||||
вать гранулы лаброцитов (схема 17). Среди клеток, несущих ме- |
|
|||||||
диаторы сосудистой проницаемости, возникает "антагонистиче- |
|
|||||||
ское равновесие", определяющее своеобразие морфологии сосу- |
|
|||||||
дистой фазы воспаления, особенно при аллергических реакциях. |
|
|
||||||
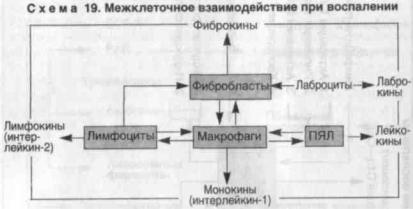
Клеточные медиаторы — лейкокины, монокины (интерлей- |
|
|||||||
кин-1), лимфокины (интерлейкин-2) и |
фиброкины — являются |
|
||||||
локальными регуляторами кооперации клеток на"поле" воспа- |
|
|||||||
ления — ПЯЛ, макрофага, |
лимфоцита и фибробласта[Серов |
|
||||||
В.В., Шехтер А.Б., 1981]. Другими словами, клеточные медиаторы |
|
|||||||
определяют последовательность и долю участия в воспалении |
|
|||||||
фагоцитарной и иммунной систем, с одной стороны, и системы |
|
|||||||
соединительной ткани — с другой. |
|
|
|
|
||||
"Дирижером" ансамбля клеточных медиаторов следует счи- |
|
|||||||
тать м о н о к и н ы |
м а к р о ф а г о в |
(схема 18). Макрофаги, |
|
|
||||
|
|
|
|
|
|
151 |
|
|
поддерживаемые |
медиаторной |
ауторегуляцией, способны |
|
||||
управлять |
с |
помощью |
монокинов |
дифференцировкой |
|||
гранулоцитов |
и |
моноцитов |
из |
стволовой, |
клетки |
||
пролиферацией |
этих |
клеток, т.е. являются |
регуляторами |
|
|||
фагоцитоза. Макрофаги не только влияют на функциональную |
|
||||||
активность Т- и В-лимфоцитов, принимают участие в их |
|
||||||
кооперации, |
но |
и |
секретируют6 |
первых |
компонентов |
|
|
комплемента, т.е. являются |
посредниками |
привлечения |
|
||||
иммунной системы в воспалительную реакцию. Макрофаги |
|
||||||
индуцируют рост фибробластов и синтез коллагена, т. . |
|
||||||
являются стимуляторами завершающей фазы репаративной |
|
||||||
реакции при воспалении. Вместе с тем сами макрофаги |
|
||||||
испытывают регулярное влияние лимфокинов и фиброкинов, |
|
||||||
т.е. теснейшим образом связаны в локальной клеточной |
|
||||||
регуляции |
с |
лимфоцитом и |
фиб-робластом[Серов В.В., |
|
|||
Шехтер А.Б., 1981; Маянский А.Н., Ма-янский Д.Н., 1983]. 152

К л е т о ч н а я р е ц е п ц и я играет огромную роль в локальной клеточной регуляции при воспалении. С нею связаны межклеточное взаимодействие и привлечение в очаг воспаления компонентов иммунных реакций, так как у всех эффекторных клеток воспаления обнаруженыFc-рецепторы иммуноглобулинов и С-рецепторы комплемента. Становятся понятными нераз-
рывная связь и неравнозначное во времени сопряжение фагоцитарной системы, иммунной системы и системы соединительной ткани в реализации конечной цели воспалительной реакции
(схема 19).
Варианты этого сопряжения, зависящие от особенностей как повреждающего агента, так и организма, реагирующего на повреждение, должны, вероятнее всего, определять развитие той или иной формы воспаления. Так, гнойное воспаление (вид экссудативного воспаления) отражает, вероятно, особую форму сопряжения функционально несостоятельной системы ПЯЛ с макрофагами. При этом макрофаги, усиленно фагоцитирующие распадающиеся ПЯЛ, становятся устойчивыми к возбудителю. В.Е.Пигаревский (1978), изучающий это особое взаимоотношение двух систем фагоцитоза, называет его резорбтивной клеточной резистенцией. Как видно, оно отражает вторичную несостоятельность фагоцитарной функции макрофагов при первичной несостоятельности фагоцитоза ПЯЛ.
Первичная и избирательная несостоятельность системы моноцитарных фагоцитов, разобщение ее с системой ПЯЛ лежат в основе гранулематозного воспаления (вид продуктивного воспаления). Фагоцитарная недостаточность макрофагов определяет образование из них эпителиоидных и гигантских клеток, теряющих фагоцитарные функции. Фагоцитоз подменяется отграниче-
154
нием, персистенцией возбудителя. Незавершенный фагоцитоз делает незавершенной и несовершенной саму воспалительную реакцию. Она становится выражением реакции гиперчувствительности замедленного типа (ГЗТ).
Очевидно также, что наследственные дефекты каждой из систем защиты, как и системы самой соединительной ткани, делают дефектной и воспалительную реакцию как по форме ее проявления и течению, так и по возможности реализации конечной цели. Достаточно вспомнить наследственную недостаточность бактерицидных систем ПЯЛ и моноцитов, наиболее ярко представленную при хронической гранулематозной болезни детей, наследственные и врожденные иммунные дефициты и фатальность развивающейся при них гнойной инфекции, врожденную несостоятельность соединительной ткани и упорство хронического воспаления. Нельзя не сказать и о наследственных дефицитах системы комплемента, особенно СЗ- и С5-компонснтов ее. Эти дефициты проявляются либо рецидивирующей гнойной инфекцией, либо волчаночноподобным синдромом. При воспалении, особенно вызываемом различными агентами, пошлются как циркулирующие в крови, так и локальные гетсрологичные иммунные комплексы, при хроническом течении воспалении они могут быть и аутологичными. Так, при воспалении возникают иммунокомплексные реакции — наиболее частые среди реакций гиперчувствительности немедленного типа (ГНТ).
ВОСПАЛЕНИЕ И ГИПЕРЧУВСТВИТЕЛЬНОСТЬ - ИММУННОЕ ВОСПАЛЕНИЕ
Связь воспаления и иммунных реакций в сенсибилизированном организме известна давно, со времени формирования
C.F.Pirquet и B.Schick (1905) самого понятия "аллергия". Тот же
C.F.Pirquet предложил выделять среди аллергических реакций немедленную (ускоренную) и замедленную (растянутую) формы. Однако лишь после работR.Rossle (1914) и А.И.Абрикосова (1933) стала понятна гиперергическая сущность аллергического воспаления. Ими было показано, что для гиперергического воспаления характерны не только выраженная экссудация, но и дистрофические и некротические (фибриноидный некроз) изменения соединительной ткани, микротромбы в сосудах, кровоизлияния.
Потребовалось несколько десятков лет поисков и находок иммунологии и морфологии для того, чтобы показать, что немедленная и замедленная аллергия в своей основе имеет иммунопатологические реакции, а последние представлены своеобразным в о с п а л е н и е м , которое не без оснований стали называть
155
и м м у н н ы м [ Струков А.И., 1979]. Важно отметить, что характер иммунного воспаления, т.е. морфология реакций гиперчувствительности, целиком зависит от особенностей иммунопатологического механизма (подробнее см. лекцию 17 "Реакции гиперчувствительности") .
КЛАССИФИКАЦИЯ ВОСПАЛЕНИЯ
Классификация воспаления учитывает характер течения процесса и морфологические формы в зависимости от преобладания экссудативной или пролиферативной фазы воспаления.
По х а р а к т е р у т е ч е н и я воспаление подразделяют на
острое, подострое и хроническое.
Следует заметить, что критерии выделения подострого воспаления весьма условны. О хроническом воспалении говорят тогда, когда оказывается несостоятельной репаративная фаза. Поэтому хроническое воспаление и является основным проявлением дисрегенерации (подробнее см. лекцию 16 "Воспаление, регенерация и дисрегенерация").
По п р е о б л а д а н и ю ф а з ы в о с п а л е н и я различают э к с с у д а т и в н о е и п р о л и ф е р а т и в н о е (продуктивное) воспаление; каждое из них подразделяется на несколько видов.
О несостоятельности выделения альтеративной формы воспаления уже упоминалось. Не обосновано и бытующее еще деление воспаления на "банальное" и "специфическое", так как любая форма воспаления, развивающаяся в результате воздействия того или иного повреждающего агента, может быть названа специфической. Недостаточно оправдано и выделение геморрагического вида экссудативного воспаления, критерии отличия которого от кровоизлияния практически отсутствуют.
Многие вопросы, касающиеся классификации воспаления, его взаимодействия с другими реакциями организма, биологической сущности — состоятельность защитно-приспособительной реакции, клинического значения и др., подлежат дальнейшему изучению и обсуждению.
Л е к ц и я 14
ЭКССУДАТИВНОЕ ВОСПАЛЕНИЕ
• Экссудативное воспаление характеризуется преобладанием второй, экссудативной, фазы воспаления. Как известно, эта фаза возникает в разные сроки вслед за повреждением клеток и тка-
156
ней и обусловлена выделением медиаторов воспаления. В зависимости от степени повреждения стенки капилляров и венул и интенсивности действия медиаторов характер образующегося экссудата может быть разным. При легком повреждении сосудов в очаг воспаления просачиваются только низкомолекулярные альбумины, при более тяжелом повреждении в экссудате появляются крупномолекулярные глобулины и, наконец, наиболее крупные молекулы фибриногена, превращающиеся в ткани в фибрин. В состав экссудата входят также клетки крови, эмигрирующие через сосудистую стенку, и клеточные элементы поврежденной ткани. Таким образом, состав экссудата может быть различным.
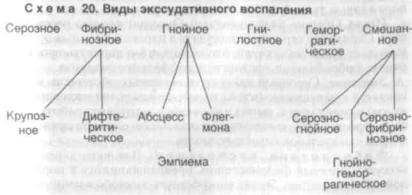
Классификация. Классификация экссудативного воспаления учитывает два фактора: характер экссудата и локализацию процесса. В зависимости от х а р а к т е р а э к с с у д а т а выделяют серозное, фибринозное, гнойное, гнилостное, геморрагичс ское, смешанное воспаление (схема 20). Особенность л о к а л и - з а ц и и п р о ц е с с а на слизистых оболочках определяет -раз витие одного вида экссудативного воспаления — катаральной'.
С е р о з н о е в о с п а л е н и е. Характеризуется образованием экссудата, содержащего до 2 % белка, единичные поли- морфно-ядерные лейкоциты (ПЯЛ) и спущенные эпителиальные клетки. Серозное воспаление развивается чаще всего в серозных полостях, слизистых оболочках, мягких мозговых оболочках, коже, реже — во внутренних органах.
Причины. Причины серозного воспаления разнообразны: инфекционные агенты, термические и физические факторы, аутоинтоксикация. Серозное воспаление в коже с образованием везикул является характерным признаком воспаления, вызванного иирусами семейства Herpesviridae (простой герпес, ветряная оспа).
157

Некоторые бактерии (микобактерия туберкулеза, менингококк, диплококк Френкеля, шигелла) также могут вызывать серозное воспаление. Термические, реже химические ожоги характеризуются образованием в коже пузырей, заполненных серозным экссудатом.
Морфологическая характеристика. При воспалении серозных оболочек в серозных полостях скапливается мутноватая жидкость, бедная клеточными элементами, среди которых преобладают спущенные мезотелиальные клетки и единичные ПЯЛ. Такая же картина наблюдается в мягких мозговых оболочках, которые становятся утолщенными, набухшими. В печени серозный экссудат скапливается перисинусоидально, в миокарде — между мышечными волокнами, в почках — в просвете клубочковой капсулы. Серозное воспаление паренхиматозных органов сопровождается дистрофией паренхиматозных клеток. Серозное воспаление кожи характеризуется скоплением выпота в толще эпидермиса, иногда экссудат накапливается под эпидермисом, отслаивая его от дермы с образованием крупных пузырей(например, при ожогах). При серозном воспалении всегда наблюдается полнокровие сосудов. Серозный экссудат способствует удалению из пораженных тканей возбудителей и токсинов.
Исход. Обычно благоприятный. Экссудат хорошо рассасывается. Скопление серозного экссудата в паренхиматозных органах вызывает гипоксию тканей, что может стимулировать пролиферацию фибробластов с развитием диффузного склероза.
Значение. Серозный экссудат в мозговых оболочках может привести к нарушению оттока цереброспинальной жидкости(ликвора) и отеку мозга, выпот в перикарде затрудняет работу сердца, а серозное воспаление паренхимы легкого может привести к острой дыхательной недостаточности.
Ф и б р и н о з н о е в о с п а л е н и е. Для него характерен экссудат, богатый фибриногеном, превращающимся в пораженной ткани в фибрин. Этому способствует высвобождение тканевого тромбопластина. Кроме фибрина, в составе экссудата обнаруживаются также ПЯЛ и элементы некротизированных тканей. Фибринозное воспаление чаще локализуется на серозных и слизистых оболочках.
Причины. Причины фибринозного воспаления разнообразны — бактерии, вирусы, химические вещества экзогенного и эндогенного происхождения. Среди бактериальных агентов развитию фибринозного воспаления наиболее способствуют дифтерийная коринебактерия, шигелла, микобактерия туберкулеза. Фибринозное воспаление может вызываться также диплококками Френкеля, пневмококками, стрептококками и стафилококками, некоторыми вирусами. Типично развитие фибринозного воспаления при аутоинтоксикации (уремия). Развитие фибринозного
158
воспаления определяется резким повышением проницаемости сосудистой стенки, что может быть обусловлено, с одной стороны, особенностями бактериальных токсинов (например, вазопаралитическое действие экзотоксина дифтерийной коринебактерии), с другой — гиперергической реакцией организма.
Морфологическая характеристика. На поверхности слизи-
стой или серозной оболочки появляется светло-серая пленка. В зависимости от вида эпителия и глубины некроза пленка может быть рыхло или прочно связана с подлежащими тканями, в связи с чем выделяют две разновидности фибринозного воспаления; крупозное и дифтеритическое.
К р у п о з н о е в о с п а л е н и е чаще развивается на однослойном эпителии слизистой или серозной оболочки, имеющем плотную соединительнотканную основу. При этом фибринозная пленка тонкая, легко снимающаяся. При отделении такой пленки образуются поверхностные дефекты. Слизистая оболочка набухшая, тусклая, иногда кажется, что она как бы посыпана опилками. Серозная оболочка тусклая, покрыта серыми нитями фибрина, напоминающими волосяной покров. Например, фибринозное
воспаление перикарда издавна образно называют волосатым сердцем. Фибринозное воспаление в легком с образованием кру. позного экссудата в альвеолах доли легкого называют крупозной пневмонией.
Д и ф т е р и т и ч е с к о е в о с п а л е н и е развевается и органах, покрытых многослойным плоским эпителием или однослойным эпителием с рыхлой соединительнотканной основой, способствующей развитию глубокого некроза ткани. В таких случаях фибринозная пленка толстая, трудно снимающаяся, при ее отторжении возникает глубокий дефект ткани. Дифтеритическое воспаление возникает на стенках зева, на слизистой оболочке матки, влагалища, мочевого пузыря, желудка и кишечника, в ранах.
Исход. На слизистых и серозных оболочках исход фибринозного воспаления неодинаков. На слизистых оболочках пленки фибрина отторгаются с образованием язв— поверхностных при крупозном воспалении и глубоких при дифтеритическом. Поверхностные язвы обычно регенерируют полностью, при заживлении глубоких язв образуются рубцы. В легком при крупозной пневмонии экссудат расплавляется протеолитическими ферментами нейтрофилов и рассасывается макрофагами. При недостаточной протеолитической функции нейтрофилов на месте экссу. цата появляется соединительная ткань(происходит организация экссудата), при чрезмерной активности нейтрофилов возможно развитие абсцесса и гангрены легкого. На серозных оболочках фибринозный экссудат может расплавляться, но чаще он подвер. гается организации с образованием спаек между серозными лист-
159
