

Рак эндометрия
Клинические практические рекомендации ESMO по диагностике, лечению и последующему наблюдению
Переведено каналом THE piNcet: Кабанов И.В., Омельченко Д.В., Попов М.С.

СПЕЦИАЛЬНАЯ СТАТЬЯ
Рак эндометрия: Клинические практические рекомендации ESMO по диагностике, лечению и последующему наблюдению
Доступно онлайн с 8 июня 2022 г
Ключевые слова: рак эндометрия, Клинические рекомендации ESMO, диагностика, лечение, динамическое наблюдение
ЗАБОЛЕВАЕМОСТЬ И ЭПИДЕМИОЛОГИЯ
Во всем мире рак эндометрия (РЭ) занимает седьмое место среди всех онкологических заболеваний у женщин, причем большинство случаев возникает в возрасте от 65 до 75 лет.¹ В Европе рак тела матки занимает четвертое место среди женских новообразований с заболеваемостью
12,9-20,2:100 000 и низким уровнем смертности: 2,0-2,7:100 000.²´³ Это несоответствие связано с тем, что 80% РЭ при постановке диагноза локализуется в матке и сопровождаются кровотечениями в постменопаузе, что приводит к быстрому выявлению.¹
РЭ более распространен в странах с высоким/средним уровнем развития. Факторы риска РЭ включают: индекс массы тела (ИМТ) (с увеличением риска на 21% для ИМТ
22-27.2, на 43% для ИМТ 27.5-29.5 и на 273% при ИМТ
>30), гипертоническая болезнь, гиперинсулинемия и длительное воздействие чистого эстрогена (часто связанное с отсутствием родов и бесплодием, связанными с синдромом поликистозных яичников или применением тамоксифена). ´
Уровень смертности увеличивается в среднем на 1,9% в год, что в основном связано с ростом заболеваемости. Ожирение — главный фактор риска РЭ. ´
РЭ традиционно классифицируются на два подтипа в соответствии с их гистопатологическими характеристиками (тип 1и 2). Однако эта система классификации находится в переходном периоде и заменяется четко определенной системой, основанной на молекулярных фенотипах.
Хотя >90% РЭ являются спорадическими, 5-10% передаются по наследству, обычно как часть синдрома наследственного неполипозного колоректального рака (HNPCC) или синдрома Линча. Женщины с HNPCC имеют 10-кратный риск развития РЭ, а также повышенный риск развития рака толстой кишки и яичников. Обычно это микросателлитно-нестабильные опухоли, которые, как правило, возникают в более молодом возрасте.¹
ДИАГНОСТИКА, ПАТОЛОГИЯ И МОЛЕКУЛЯРНАЯ БИОЛОГИЯ
Традиционная дуалистическая гистопатологическая классификация, предложенная Боманом, разделила РЭ на две группы: тип I и тип II. Эндометриоидный подтип был классифицирован как тип I, в то время как все остальные гистологические подтипы были классифицированы, как рак II типа. Рак II типа ассоциировался с более высоким риском рецидива по сравнению с типом I. Опухоли классифицируют в соответствии с критериями, определенными FIGO, и переходят к двухуровневой классификации, объединяющей эндометриоидные карциномы (G1) и (G2), как низкой степени злокачественности, и (G3), высокой степени злокачественности.¹¹ Кроме того, традиционно высокий риск рецидива заболевания определяется множеством факторов: гистологический подтип, степень злокачественности G3, инвазия миометрия >50%, инвазия в лимфоваскулярное пространство (LVSI), метастазы в лимфатические узлы и диаметр опухоли >2см. Значительная LVSI является основным неблагоприятным прогностическим фактором.
Выраженная LVSI определяется как широко распространенная инвазия опухолевых эмболов в сосудистые пространства на инвазивной передней поверхности опухоли и за ее пределами. Выраженная LVSI может быть диагностирована на предметных стеклах с гематоксилином и эозином (H&E) без необходимости в дополнительных иммунологических исследованиях. Хотя степень LVSI может варьироваться на каждом срезе H&E, очаги LVSI часто обнаруживаются на нескольких срезах. Если степень LVSI ограничена менее чем четырьмя сосудами, это считается очаговой LVSI. Существенной LVSI определяется, как четыре и более сосудов, положительных по LVSI, по крайней мере на одном срезе H&E. В отличие от существенной LVSI, минимальная или очаговая LVSI оказывает ограниченное влияние на прогноз.¹² ¹ Наряду с этими характеристиками молекула клеточной адгезии L1 (L1CAM) является еще одним важным показателем заболевания высокого риска.¹ ´¹ Экспрессия L1CAM наиболее часта при p53-аномальных опухолях (p53-abn), она также позволяет прогнозировать худший исход среди пациентов без специфического молекулярного профиля (NSMP).¹ ´¹
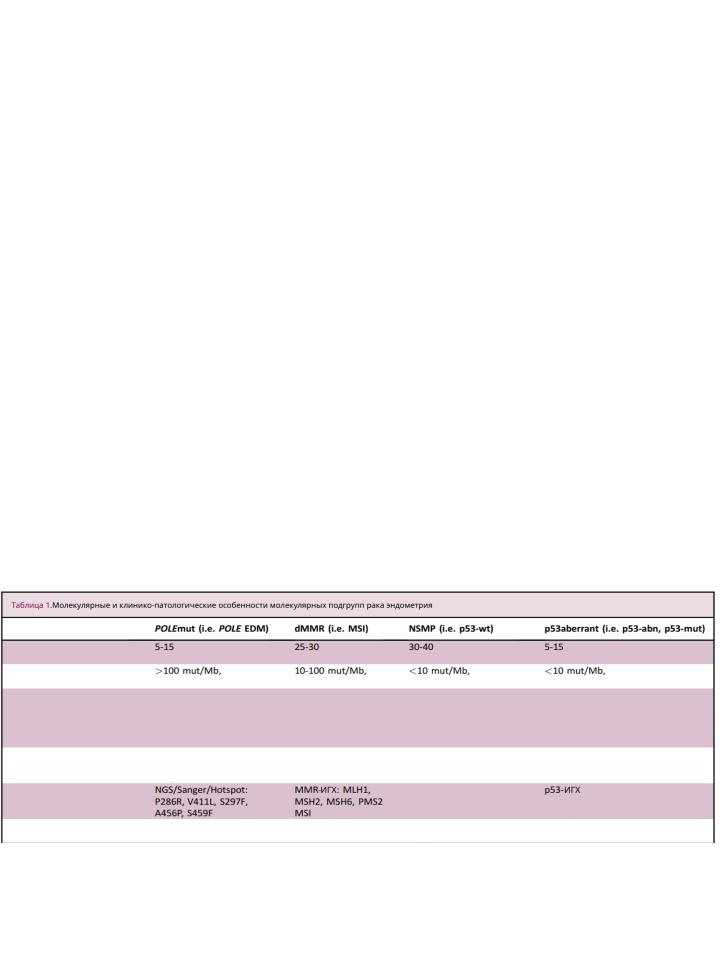
В последние годы, становится все более очевидным, что традиционной классификации недостает воспроизводимости, что препятствует прогрессу и внедрению точной медицины и она приводит к образованию гетерогенных молекулярных групп19,20. Это особенно проблематично для будущих клинических испытаний с целевыми подходами, которые потребуют включения раковых заболеваний с молекулярным сходством. Классификация РЭ, первоначально предложенная проектом "Атлас генома рака" (TCGA), хорошо служит этой цели, поскольку она основана на сочетании соматической мутационной нагрузки и изменений числа соматических копий. Этот подход TCGA приводит к молекулярной стратификации РЭ на четыре различные молекулярные группы; (I) ультрамутированная [>100 мутаций/мегаоснование (mut/Mb)] с патогенными вариациями в экзонуклеазном домене ДНКполимеразы эпсилон (POLE)-ультрамутированная (POLEmut), (II) гипермутированная (10-100 (mut/Mb), микросателлитнонестабильная, (III) высокое число соматических копий с частыми патогенными вариантами в TP53 и (IV) низкое число соматических к о п и й с ч а с т ы м и н а р у ш е н и я м и п е р е д а ч и с и г н а л о в фосфоинозитид-3-киназы (PI3K) и WNT.
Важно отметить, что ряд публикаций о крупных клинических испытаниях показали, что суррогатные маркеры могут быть использованы для молекулярной классификации на основе TCGA в рутинной хирургической патологии без необходимости обширного секвенирования.¹ ´²¹ ²³ Эта прагматичная альтернатива опирается на небольшое количество хорошо зарекомендовавших себя иммуногистохимических (ИГХ) маркеров (MSH6, PMS2 и p53) в сочетании с таргетным секвенированием опухоли (POLE анализ «горячих точек»), а также автоматически служит для предварительного скрининга синдрома Линча, поскольку включает рефлекторное тестирование белков восстановления несоответствия (MMR) (Таблица 1).
Был предложен простой и четко определенный диагностический алгоритм для молекулярной классификации РЭ² (рис. 1). POLEmut РЭ может быть диагностирован после обнаружения патогенной мутации в экзонуклеазном домене POLE. Руководство по интерпретации патогенных вариантов было недавно описано Леоном-Кастильо и др.,² что позволяет провести единообразную классификацию POLEmut РЭ. Впоследствии, для случаев, которые не несут патогенный POLE вариант, проводят иммунизацию по меньшей мере двух (PMS2 и MSH6) или предпочтительно четырех (PMS2, MLH1, MSH6 и MSH2) белков MMR. Полная потеря экспрессии одного или нескольких из этих белков MMR достаточна для диагностики РЭ с дефицитом MMR (dMMR).² Наконец, иммуноокрашивание p53 служит почти идеальным суррогатным маркером для лежащей в основе мутации TP53 и, следовательно, используется для классификации РЭ, как p53-abn (после исключения POLEmut и dMMR).² Обширное исследование этих суррогатных маркеров показало хорошую взаимосвязь с клиническим исходом, установив их прогностическую ценность. У POLEmut РЭ отличный результат, а у p53-abn РЭ самый плохой клинический результат, независимо от группы риска, типа адъювантного лечения, типа опухоли или степени тяжести.²¹ ²³ Это означает, что следует изучить возможность деэскалации адъювантного лечения пациентов с POLEmut РЭ, как это в настоящее время делается при клиническом исследовании, послеоперационной лучевой терапии рака эндометрия (PORTEC)-4a.²
Таблица 1. Молекулярные и клинико-патологические особенности молекулярных подгрупп рака эндометрия
Распространенность в
когорте TCGA, % Связанные молекулярные
особенности
Наиболее часто связанные гистологические особенности
Сопутствующие клинические признаки
Диагностический тест
SCNA-очень низкий
Эндометриоидный Часто high grade
Неоднозначная морфология Значимый TIL и TLS
Более низкий ИМТ Ранняя стадия (IA-IB) Раннее начало
Прогноз |
Благоприятный |
MSS, SCNA-низкий, MSI |
SCNA-низкий, MSS |
SCNA-высокий, MSS |
|
Эндометриоидный |
Преимущественно low grade |
Все гистологические подтипы |
|
Часто high grade |
|||
Заметное отсутвие TIL |
В основном high grade |
||
Существенная LVSI |
|||
Плоскоклеточная дифферец. |
Высокая цитоядерная атипия |
||
Значимый TIL |
|||
ER/PgR диффузия |
Низкий уровень TILS |
||
Инвазия MELF типа |
|||
|
|
||
Более высокий ИМТ |
Более высокий ИМТ |
Нижний ИМТ |
|
Поздние стадии |
|||
синдром Линча |
|
||
|
Позднее начало |
||
|
|
анализ |
|
Mutant-like/ненормальное |
Сомнительный |
окрашивание |
|
Сомнительный |
Неблагоприятный |
|
|
Зависит от стадии |
|
Переведено каналом THE piNcet: Кабанов И.В., Омельченко Д.В., Попов М.С.

РЭ (независимый от гистологического подтипа)
|
|
POLE |
|
POLE wild тип или |
|
POLE статус |
|||||
|
патогенный |
|
непатогенный |
||
|
|
|
|||
|
|
|
|
|
MMR статус |
|
dMMR |
|
pMMR |
|
|
|
|
|
p53 статус |
|
P53 wild тип |
|
p53-mut |
|
|
|
|
|
Комплексная |
|
|
|
|
|
|
|
|
|
РЭ, POLEmut |
|
РЭ, dMMR |
|
РЭ, NSMP |
|
РЭ, p53-mut |
|
диагностика |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Рисунок 1. Диагностический алгоритм интегрированной молекулярной классификации РЭ. Этот алгоритм можно применять ко всем гистологическим подтипам РЭ (включая карциносаркомы). Пожалуйста, обратитесь к рекомендациям для получения дополнительной информации о показаниях к анализу POLEmut.
|
|
|
|
|
|
Более того, недавние данные свидетельствуют о том, что |
Это, в частности, относится к пациентам, классифицированным, |
|
|
|
наибольшая польза от добавления химиотерапии (ХТ) в |
как высокая степень злокачественности или высокая стадия (> |
|
|
|
адъювантном режиме наблюдается для РЭ, несущих p53-abn, что |
стадии II по FIGO), поскольку клинические последствия для этих |
|
|
|
включает в себя большинство серозных раков, а также |
пациентов будут наиболее выраженными. |
|
|
|
значительную часть других гистологических подтипов, таких как |
На этом переходном этапе, на котором существуют две системы |
|
|
|
карциносаркомы.²³ Это показывает, как молекулярная |
классификации РЭ, рекомендуется указать используемую систему |
|
|
|
классификация РЭ может улучшить ведение пациентов, сокращая |
классификации. Как и в случае с другими локализациями опухолей, |
|
|
|
чрезмерное или недостаточное лечение. |
претерпевающими аналогичный переход, раки эндометрия, |
|
|
|
При планировании будущих исследований следует |
которые не были (полностью) классифицированы на молекулярном |
|
|
|
использовать молекулярную классификацию, поскольку она |
уровне, должны быть обозначены как РЭ, не указанные иным |
|
|
|
позволит проводить сравнение между группами пациентов, |
образом (EC-NOS), и продолжать использовать систему |
|
|
|
обладающих сходными/аналогичными признаками. |
классификации, основанную на гистологии [например, РЭ |
|
|
|
Было показано, что молекулярная классификация является |
эндометриоидного типа (EC-NOS).² |
Это дополнительное |
|
|
прогностически информативной при РЭ низкого, среднего и |
примечание внесет ясность для лиц, осуществляющих лечение. |
|
|
|
высокого риска. Таким образом, хорошо зарекомендовавшее себя |
Классификация, основанная на гистологии, остается неизменной и |
|
|
|
ИГХ-окрашивание на белки p53 и MMR (MLH1, PMS2, MSH2, MSH6) |
различает эндометриоидный, серозный, светлоклеточный и |
|
|
|
теперь рекомендуется в качестве стандартной практики для всех |
недедифференцированный РЭ. Карциносаркомы матки - это |
|
|
|
образцов патологии РЭ, независимо от гистологического типа, а |
метапластические карциномы с молекулярными признаками, |
|
|
|
также для завершения молекулярной классификации в |
которые перекрываются с серозными и эндометриоидными |
|
|
|
соответствии с диагностическим алгоритмом (Рисунок 1), путем |
аденокарциномами и, следовательно, должны быть включены в |
|
|
|
секвенирования экзонуклеазного домена POLE, где это возможно. |
список "эпителиальных злокачественных новообразований |
|
|
|
Поскольку в настоящее время не все лаборатории способны |
эндометрия". Данные о прогностической ценности молекулярной |
|
|
|
провести молекулярную классификацию всех РЭ, приоритет |
классификации для более редких (неэндометриоидных) |
|
|
|
молекулярной классификации должен быть сделан в тех случаях, |
гистологических вариантов ЭК по-прежнему ограничены |
|
|
|
когда результаты имеют отношение к рекомендациям по |
пилотными исследованиями; однако все молекулярные классы |
|
|
|
адъювантному лечению. |
идентифицированы во всех гистологических подтипах.² ´³ |
|
|
|
|
|
|
|
|
|
|
|
|
Переведено каналом THE piNcet: Кабанов И.В., Омельченко Д.В., Попов М.С.
Рекомендации
•Гистологический тип, степень по FIGO, инвазия в миометрий и LVSI (очаговая/существенная) должны быть описаны для всех образцов с РЭ [V, A].
•Молекулярная классификация с помощью хорошо зарекомендовавшего себя ИГХ-окрашивания белков p53 и MMR (MLH1, PMS2, MSH2, MSH6) в сочетании с таргетным секвенированием опухолей (POLE hotspot analysis) следует проводить для всех образцов с РЭ, независимо от гистологического типа [IV, А].
СТАДИЯ И ОЦЕНКА РИСКА
Хотя РЭ является заболеванием, диагностируемым хирургическим путем, в соответствии с системой FIGO (Дополнительная таблица S1, доступна по адресу https://doi.org/10.1016/j.annonc.2022.05.009 ), предоперационное обследование может помочь установить группу риска рецидива и определить последующее хирургическое лечение, главным образом на основе оценки инвазии в миометрий/шейку матки и метастазов в лимфатические узлы. Предоперационное обследование включает клинический и гинекологический осмотр, трансвагинальное ультразвуковое исследование, полный анализ крови и анализ функции печени и почек. Следует отметить, что МРТ считается наиболее точным методом визуализации для предоперационной оценки РЭ благодаря отличному контрастному разрешению мягких тканей. Глубина инвазии миометрия и стромы шейки матки являются важными аспектами определения стадии РЭ.
МРТ с динамическим контрастированием и Т2-взвешенные изображения являются полезными инструментами для оценки этих признаков с точностью 98% и 90% для оценки инвазии миометрия и стромы шейки матки соответственно.³¹ Следует рассмотреть возможность проведения компьютерной томографии брюшной полости и грудной клетки (КТ) для выявления наличия внетазовых заболеваний. ПЭТ-КТ с 18F-ФДГ демонстрирует высокую специфичность и положительную прогностическую ценность для выявления отдаленных метастазов.³² 18F-ФДГ ПЭТКТ обладает отличными диагностическими характеристиками для выявления метастазов в лимфатических узлах до операции и рецидива заболевания после операции у пациентов с РЭ и может рассматриваться как дополнительная диагностическая процедура.³³ РЭ диагностируется после гистопатологического исследования образцов, полученных при диагностическом выскабливании (D&C), или Пайпель биопсии. Гистероскопия может быть полезна для проведения репрезентативной биопсии или для удаления таргетного очага поражения.
Рекомендации
•Получение образца эндометрия с помощью биопсии или диагностического выскабливания являются приемлемыми начальными подходами к гистологической диагностике РЭ [IV, A].
•Предоперационное обследование должно включать клиническое и гинекологическое обследование, трансвагинальное ультразвуковое исследование, МРТ малого таза, полный анализ крови и анализ функции печени и почек [IV, B].
•Дополнительные исследования (например, КТ грудной клетки и брюшной полости и/или 18F-ФДГ ПЭТ-КТ ) могут быть рассмотрены у пациентов с высоким риском внетазовых заболеваний [IV, С].
I стадия РЭ: хирургия
Гистерэктомия с двухсторонней сальпингоофорэктомией [I, А]
I стадия, G1-G2 |
I стадия, G3 |
Серозный РЭ I стадия, |
|
карциносаркома |
|||
|
|
I стадия, G1, эндометриойдиный РЭ в пременопаузе
Сохранение яичников, [IV, А]
Малоинвазивная хирургия [I, A для G1-2] [II, A для G3] |
Полное хирургическое стадирование, |
|
включая резекцию большого сальника, |
||
Сторожевой л/у можно рассматривать как стрегию оценки |
||
биопсию брюшины, лимфодиссекцию [IV, |
||
поражения лимфоузлов [II, A] |
||
A] |
||
|
Переведено каналом THE piNcet: Кабанов И.В., Омельченко Д.В., Попов М.С.
ЛЕЧЕНИЕ МЕСТНЫХ И ЛОКОРЕГИОНАЛЬНЫХ ЗАБОЛЕВАНИЙ
Хирургическое лечение
На ранней стадии РЭ целью хирургического вмешательства является удаление макроскопической опухоли, исследование на наличие микроскопических метастазов и определение стадии опухоли для оценки необходимости адъювантной терапии(см. рис. 2). Лапаротомия была традиционным хирургическим методом лечения РЭ. Крупные рандомизированные исследования и метаанализ продемонстрировали, что минимально инвазивные методы имеют операционные результаты, сходные с лапаротомией в отношении прогноза.³ ´³ Несмотря на то, что большинство пациентов, включенных в эти исследования, имели низкий риск(например, G1 или G2), и только 17% пациентов имели более высокий риск (например G3), лапароскопический подход может быть распространен на опухоли G3, поскольку не было продемонстрировано отрицательных последствий. Роботизированный подход является потенциальным дополнением к стандартной лапароскопической хирургии и может быть особенно полезен у женщин с ожирением. Стандартной операцией является гистерэктомия с двусторонней сальпингоофорэктомией. Сохранение яичников может быть рассмотрено у пациенток в пременопаузе со стадией FIGO IA G1 EEC. Сохранение яичников не рекомендуется пациентам с генетическим риском развития рака яичников (например, мутация BRCA, синдром Линча). Стадийная оментэктомия должна рассматриваться при карциносаркоме и серозном типе РЭ.
Риск метастазов в лимфатические узлы колеблется от <5% до 40% в зависимости от степени, инвазии в миометрий и гистологии. Поскольку выявление метастазов в лимфатических узлах влияет на проведение адъювантной терапии, оценка состояния лимфатических узлов рекомендуется пациентам с неэндометриоидной гистологией, стадией FIGO IB или G3. Оценка состояния лимфатических узлов может быть опущена при эндометриоидном FIGO IA, G1-G2, поскольку риск узлового метастазирования очень низок(<5%).³
В двух проспективных рандомизированных исследованиях изучали влияние систематической тазовой лимфаденэктомии (ЛНЭ) при РЭ.³ ´³ Эти исследования не смогли продемонстрировать улучшение прогноза, связанное с ЛАЭ. Впоследствии для объяснения результатов обсуждались многочисленные причины, такие как: включение пациентов с опухолями низкого риска, недостаточное качество хирургического вмешательства и дисбаланс в адъювантной терапии. Таким образом, был сделан вывод, что оба исследования показали, что систематическая ЛАЭ не показана при эндометриоидных опухолях стадии IA G1-G2, но исследования не смогли предоставить четких рекомендаций относительно оптимального ведения пациентов с более высоким риском. Вопрос систематического ЛАЭ оценивается в исследовании ECLAT (NCT03438474).
Биопсия сторожевого узла или сторожевая ЛАЭ стала альтернативой диссекции лимфатических узлов для стадирования лимфатических узлов. Чувствительность дозорного ЛУ, как подхода к стадированию лимфатических узлов у пациентов с РЭ на ранней стадии была подтверждена многочисленными исследованиями в пользу его применения при хирургическом лечении.³ ´ Исследование FIRES, крупнейшая проспективная когорта, анализирующая роль сторожевых ЛАЭ в стадии I РЭ, показало, что этот подход может безопасно идентифицировать сторожевые лимфатические узлы при РЭ. В настоящее время единственные данные, подтверждающие дозорный ЛАЭ с точки зрения прогноза, были получены в результате ретроспективных исследований.
Результаты рандомизированных клинических испытаний с конечной точкой выживаемости по-прежнему отсутствуют. Сообщается, что сторожевая ЛАЭ с индоцианиновым зеленым вполне осуществима и дает наилучшие результаты с технической точки зрения и поэтому является предпочтительным методом. ¹ Указывает ли положительная оценка тазовых сторожевых лимфатических узлов на дальнейшую забрюшинную стадию (тазовая и/или парааортальная ЛАП), пока не определено. В заключение, основываясь на данных, предоставленных проспективными и ретроспективными исследованиями, биопсия сторожевого лимфатического узла может быть рассмотрена в целях стадирования у пациентов с заболеванием низкого/ промежуточного риска.³ ´ Это также может представлять собой альтернатива систематической ЛАЭ при III стадии заболевания с высоким/промежуточным риском.
Циторедуктивная хирургия с целью полной резекции должна рассматриваться при III и IV стадиях РЭ (включая карциносаркому) ², если это возможно, после полного предоперационного стадирования. По-видимому, нет никакой роли в так называемом неоптимальном устранении остаточной опухоли размером 1-10 мм, как при раке яичников. ³
Адъювантное лечение
В последних опубликованных рандомизированных исследованиях адъювантной терапии использовался давний подход к набору пациентов, основанный на оценке риска, в зависимости от стадии и патологических особенностей. Однако недавние данные позволяют предположить, что риск рецидива должен учитывать молекулярные особенности опухоли. Была предложена молекулярная классификация для улучшения оценки риска рецидива. Теперь это включено в рекомендации, помогающие принимать решения относительно адъювантного лечения.
Традиционные клинико-патологические факторы риска, особенно возраст, гистопатологический тип и степень дифференцировки, инвазия миометрия и LVSI, важны для оценки прогноза. Совсем недавно было показано, что когда LVSI является существенной (также называемой значительной), существует значительно повышенный риск рецидива и смерти.¹² ´
Как описано в предыдущих разделах, TCGA идентифицировал четыре подгруппы молекулярных РЭ со значительными прогностическими различиями между ними. Эти клинически значимые молекулярные подгруппы были воспроизведены с использованием суррогатных маркеров в фиксированных формалином и залитых в парафин тканях, идентифицируя эквивалентные подгруппы: p53-abn, POLEmut, dMMR и NSMP.¹ ´²²´ ´ Интеграция этой молекулярной классификации с общепризнанными клинико-патологическими данными привела к созданию обновленной системы классификации рисков, позволяющей установить относительный риск рецидива. Эту систему теперь можно использовать для изучения молекулярно-таргетной терапии в этих подгруппах (Таблица 2).
Все рекомендации применимы к женщинам с РЭ I-IVA стадии, перенесшим хирургическое вмешательство и не имеющим макроскопической остаточной опухоли.
РЭ с низким риском
Показаний к адъювантному лечению РЭ низкого риска нет, поскольку риск рецидива низок (см. Рисунок 3). Многочисленные исследования не показали никакой пользы для выживаемости от адъювантного лечения, а отдельных пациентов с местным рецидивом можно эффективно лечить с помощью лучевой терапии (ЛТ).
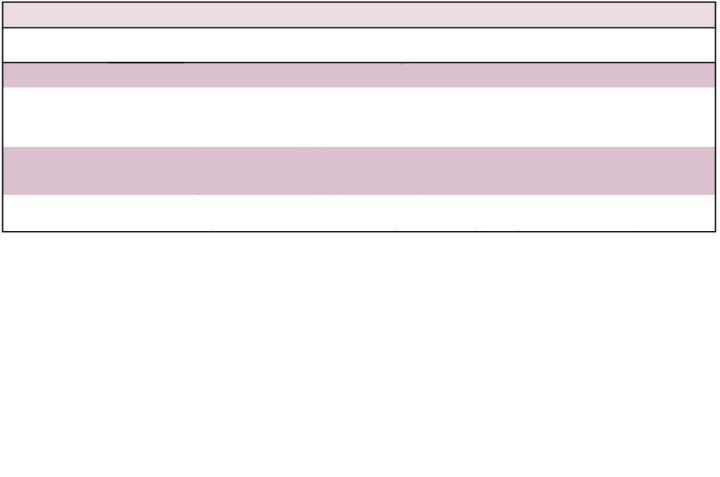
Таблица 2. Группы риска ЕС Группы риска
Низкий риск
Промежуточный риск
Высокий средний риск
Высокий риск
Стадия IA (G1-G2) эндометриоидный тип (dMMR и NSMP) и отсутствие или очаговая LVSI
Стадии I/II POLEmut рак; III стадия POLEmut рак (POLEmut стадия III может рассматриваться как низкий риск)
Стадия IA G3 эндометриоидный тип (dMMR и NSMP) и отсутствием или очаговая LVSI.
Стадия IA неэндометриоидный тип (серозный, светлоклеточный, недифференцированный, карциносаркома, смешанный) и/или рак p53abn без инвазии в миометрий и без или с очаговая LVSI
Стадия IB (G1-G2) эндометриоидный тип (dMMR и NSMP) и отсутствием или очаговая LVSI Стадия II G1 эндометриоиднымй тип (dMMR и NSMP) и отсутствием или очаговая LVSI
Стадия I эндометриоидный тип (dMMR и NSMP) любой диффер. и любая инвазия со значительным LVSI. Стадия IB G3 эндометриоиднымйтип (dMMR и NSMP) независимо от LVSI.
Стадия II G1 эндометриоидный тип (dMMR и NSMP) со значительной LVSI
Стадия II G2-G3 эндометриоидный тип (dMMR и NSMP)
Все стадии и все гистологии с p53-abn и инвазией в миометрий.
Все стадии с серозным или недифференцированным раком, включая карциносаркому с инвазией в миометрий. Все стадии III и IVA без остаточной опухоли, независимо от гистологии и независимо от молекулярного подтипа
Текущие данные исследований PORTEC-1/2 и дополнительные |
Популяционное исследование в Дании подтвердило, что риск |
серии продемонстрировали наличие POLEmut, как индикатора |
локорегионального рецидива был выше (~14%) при отсутствии БТ, |
благоприятного прогноза РЭ, независимо от других клинико- |
но ОВ не отличалась из-за успешного лечения рецидива. Согласно |
патологических переменных. Таким образом, у пациенток с |
этим данным, отказ от адъювантного лечения может быть |
опухолями I-II стадии и POLEmut в настоящее время также считаются представителями низкого риска и вряд ли получат пользу от адъювантного лечения.¹ ´ ´ ´ ¹ POLEmut РЭ, однако, включает лишь небольшую подгруппу (всего 5–15% РЭ), и эту мутацию редко можно обнаружить у пациентов с поздними стадиями заболевания.¹ ´²³ Тем не менее, отказ от адъювантного лечения также возможен при III стадии POLEmut РЭ, хотя в настоящее время нет доступных данных о результатах без адъювантного лечения. Клинические исследования (наблюдательные) настоятельно приветствуются в данной группе POLEmut РЭ.
рассмотрен в индивидуальных случаях после консультации с пациентом.
В эту промежуточную группу входят пациенты со стадией IA неэндометриоидного рака и/или рака p53-abn без инвазии в миометрий и без или с очаговой LVSI. Следует отметить, что эти пациенты не были включены в рандомизированные исследования. Таким образом, потенциальная польза адъювантной терапии для этих пациентов неясна; следовательно, рекомендации по адъювантному лечению или наблюдению следует рассматривать в каждом конкретном случае после междисциплинарного обсуждения.
Промежуточный риск РЭ
Высокий-промежуточный риск РЭ
Клинические исследования PORTEC-1 и Gynecology Oncology Group (GOG)-99 продемонстрировали, что тазовая лучевая терапия значительно снижает локорегиональные рецидивы в группе промежуточного риска, при этом наибольшее абсолютное снижение отмечено в группах высокого среднего риска. ´ Поскольку большинство рецидивов в этих случаях наблюдалось в своде влагалища, PORTEC-2 оценивал эффективность и токсичность вагинальной брахитерапии (БТ) по сравнению с дистанционной лучевой лучевой терапией (ДЛТ) в группе высокого промежуточного риска, определенной PORTEC-1 (см. рис. 3). Данные десятилетней выживаемости подтвердили отличные показатели вагинального контроля (>96%) в обеих группах с одинаковыми показателями изолированных тазовых рецидивов, отдаленных метастазов и общей выживаемости (ОВ). ³ Более того, в этом долгосрочном анализе значительная сверхэкспрессия LVSI, p53-abn и L1CAM была тесно связана с более высоким риском рецидива. Среди пациентов с любым из этих неблагоприятных факторов риска ДЛТ обеспечивала лучший контроль, чем БТ. Таким образом, пациенты с любым из этих признаков больше не относятся к группе промежуточного риска.¹ ´¹ ´
Традиционная группа РЭ высокого промежуточного риска, определенная как в PORTEC-1, так и в GOG-99 (например, возраст 70 лет и старше с одним фактором риска, возраст 50 лет и старше с двумя факторами риска или возраст 18 лет и старше с три фактора риска: факторы риска включают опухоль G2 или G3, глубину инвазии более половины миометрия и лимфоваскулярную инвазию) были изменены в связи с дальнейшими знаниями о молекулярных и клинико-патологических характеристиках. ¹ ´ Эта переопределенная группа, как описано в Таблице 2, включает группу с более высоким риском рецидива. Таким образом, потенциальная польза ХТ для снижения рецидивов заболевания в этой группе РЭ рассматривалась в нескольких исследованиях, ни одно из которых не включало точно такую же группу риска. Два из этих исследований, оба опубликованные более десяти лет назад, оценивали адъювантную ХТ на основе платины по сравнению с лучевой терапией и не обнаружили никаких преимуществ по ОВ. ´ Объединенный анализ исследования ManGO ILIADE-III и исследования NSGO-EC-9501/ EORTC-55991, сравнивающего ЛТ с ЛТ+ХТ, показали, что, хотя выживаемость без прогрессирования (ВБП) улучшалась при комбинированной терапии тенденция общей выживаемости не достигла статистической значимости.
Переведено каналом THE piNcet: Кабанов И.В., Омельченко Д.В., Попов М.С.
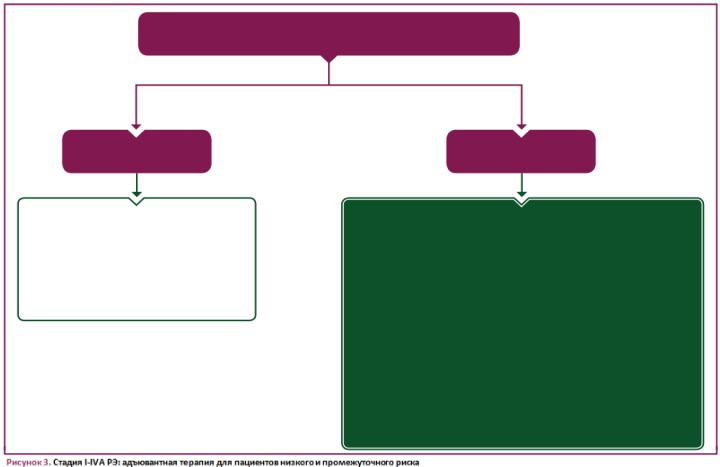
Стадия I-IVA РЭ: адъювантная терапия для пациентов с низким и промежуточным риском
Низкий риск |
Промежуточный |
|
риск |
||
|
Пациенты с IA стадией (G1 и G2) с EEC (MMRd или NSMP) и отсутствием или очаговой LVSI
• Адъювантная терапия не рекомендуется [I, E]
Для пациентов с IA стадией G3 EEC (dMMR или NSMP) и отсутствием или очаговой LVSI
•Рекомендуется адъювантная БТ [I, A]
• Можно рассмотреть возможность отказа от адъювантной брахитерапии, особенно для пациенток в возрасте <60 лет [IIII, C]
Пациенты с раком POLEmut I-II стадии |
Для пациентов с G1-G2 стадиями IB (dMMR или NSMP) и отсутствием или очаговой LVSI |
|
|
•Адъювантная терапия не рекомендуется [III, D] |
•Рекомендуется адъювантная БТ [I, A] |
• Можно рассмотреть возможность отказа от адъювантной брахитерапии, особенно для |
|
|
пациентов в возрасте <60 лет [III, C] |
Для пациенток с EEC II стадии G1 (dMMR или NSMP) и отсутствием или очаговой LVSI
•Рекомендуется адъювантная БТ [II, B]
•Может быть рассмотрен вопрос об отказе от адъювантной брахитерапии, особенно для пациентов в возрасте <60 лет [III, C]
Для пациентов с опухолями IA стадии p53-abn, не инфильтрирующими миометрий или ограничивающимися полипом
• Адъювантная терапия не рекомендуется [III, E]
Недавно в исследовании III фазы GOG-249 было проанализировано влияние на безрецидивную выживаемость (БВР) замены дистанционной лучевой терапии на БТ с последующими тремя курсами паклитаксела и карбоплатина у пациентов с РЭ высокого промежуточного риска. В исследование были включены женщины, соответствующие критериям высокого промежуточного риска GOG-99 и/или серозная или светлоклеточная карцинома стадии II или стадии I-II. Примечательно, что 89% имели исследованные ЛУ и не были отрицательными. 5-летний БРВ и OВ не выявили различий между обеими группами. Острые нежелательные явления 2 степени были обнаружены у 94% пациентов, получавших ХТ и БТ, по сравнению с 44% пациентов, получавших ЛТ. Через 24 месяца сенсорная нейропатия 2-й степени была значительно хуже в группе ХТ+БТ - 10% по сравнению с <1% в группе ЛТ. Хотя оценка долгосрочных побочных эффектов потребует более длительного наблюдения, эти результаты привели авторов к выводу, что ЛТ органов малого таза остается подходящим стандартным лечением заболевания высокого риска на ранних стадиях.
Более того, недавнее исследование PORTEC-3 предоставило дополнительные данные для определения более эффективных подходов к лечению. ¹´ ² В этом исследовании оценивалась роль ХТ во время и после лучевой терапии (ХЛТ) по сравнению с только лучевой терапией таза у женщин с РЭ высокого промежуточного и высокого риска (стадия IA G3 с LVSI; стадия IB G3; стадия II любой степени; стадия III эндометриодниый рак и серозный или светлоклеточный рак матки IA-III стадии).
Следует отметить, что около половины пациенток имели раннюю стадию высокого риска (в том числе 28% G3 и 25% неэндометриоидный РЭ), а 45% имели заболевание III стадии. Недавно опубликованное обновление со средней продолжительностью наблюдения 72,6 месяца действительно продемонстрировало значительное улучшение 5-летней общей выживаемости и безсобытийной выживаемости (FFS). При анализе результатов по стадиям комбинированное адъювантное лечение женщин с несерозным раком I-II стадий показало лишь небольшое абсолютное улучшение (т.е. 2% при 5-летней ОВ и 4% при FFS). Следовательно, учитывая результаты исследований GOG-249 и PORTEC-3, решение о комбинированном лечении на этих ранних стадиях должно обсуждаться в каждом конкретном случае, принимая во внимание баланс между повышенной частотой нежелательных явлений и конечной выгодой (см. Рисунок 4).
Высокий риск РЭ
Принятие точного определения РЭ высокого риска оказалось сложной задачей. В настоящее время РЭ стадии III-IVA без остаточной опухоли или стадия I-IVA p53-abn или неэндометриоидные карциномы без остаточноой опухоли с инвазией в миометрий считаются РЭ высокого риска.
Переведено каналом THE piNcet: Кабанов И.В., Омельченко Д.В., Попов М.С.

Стадия I-IVA РЭ: адъювантная терапия для пациентов с высоким-промежуточным с высоким риском
Высокий промежуточный риск
Высокий промежуточный риск, |
Высокий промежуточный риск, |
pN0 после стадирования Л/У |
без стадирования Л/У |
Для пациентов с IA и IB стадиями со значительной LVSI Для пациентов с IB стадией G3
Для пациентов со II стадией G1 со значительной LVSI Для пациентов со II стадией G2-G3 (dMMR или NSMP)
•Рекомендуется адъювантная ДЛТ [I, A]
•Возможно добавление (сопутствующей и/или последовательной) ХТ к ДЛТ, особенно при G3 и/ или существенной LVSI [II, C]
Недавние данные трех соответствующих исследований III фазы (PORTEC-3, GOG-249 и GOG-258), в которых участвовали пациенты с РЭ высокого-промежуточного и высокого риска, два из которых были описаны в предыдущем разделе, приводят к изменению парадигмы лечения.
Обновленный анализ PORTEC-3 со средним периодом наблюдения 72 месяца показал улучшение общей выживаемости на 5% и улучшение безсобытийной выживаемости (FFS) на 7% в группе одновременного лечения с адъювантной ХТ по сравнению только с лучевой терапией. При анализе подгрупп женщины с РЭ III стадии наряду с женщинами с серозным РЭ получили наибольшую пользу от добавления ХТ к ЛТ. Следует отметить, что в PORTEC-3 было включено только 105 пациентов с серозным раком; таким образом, число женщин и событий слишком мало, чтобы сообщить об эффективности лечения на разных стадиях. ¹ Традиционно светлоклеточный и серозный рак объединяли из-за худшего прогноза. Тем не менее, в этом анализе PORTEC-3 частота рецидивов среди женщин со светлоклеточным раком (особенно p53 wild type) была аналогична частоте рецидивов у женщин с эндометриоидными опухолями и заметно ниже, чем у женщин с серозным раком.
Что касается профиля безопасности, добавление ХТ привело к значительно более высокой токсичности, связанной с лечением, но большинство различий устранилось начиная с 12 месяцев, при сохранении различий в длительной сенсорной нейропатии.
Высокий риск
Все стадии и все гистологические исследования с p53-abn и инвазией миометрия Все стадии с серозной или недифференцированной
карциномой, включая карциносаркому с инвазией миометрия
Все III и IV стадии без остаточной опухоли, независимо от гистологиии молекулярного подтипа
•Адъювантная ДЛТ + одновременная ХТ [I, A]
•Последовательная ХТ и KT [I, B]
•Только ХТ [I, B]
Висследовании GOG-258, 813 женщин со стадией III-IVA РЭ были рандомизированы для получения тазовой лучевой терапии с одновременной адъювантной ХТ (та же схема, что и в исследовании PORTEC-3) или для получения только ХТ (шесть циклов карбоплатина и паклитаксела). Хотя различий в БРВ и ОВ обнаружено не было, значительно больше вагинальных, тазовых и/ или парааортальных рецидивов наблюдалось у женщин, получавших только ХТ. ³ Принимая во внимание результаты этих двух исследований, пользу, полученную от добавления ХТ к ЛТ, и связанное с этим увеличение уровня токсичности следует обсуждать, как часть совместного принятия решений между врачами и их пациентами. Хотя ХЛТ является рекомендованной схемой для пациентов из группы высокого риска, только ЛТ может быть рекомендована в случаях серьезных сопутствующих заболеваний и противопоказаний к ХТ. ¹
Учитывая растущую прогностическую ценность молекулярной классификации РЭ, результаты и влияние ХТ для каждой молекулярной подгруппы были проанализированы с использованием образцов тканей из PORTEC-3. Результаты показали, что пациенты с РЭ p53-abn имели самый плохой прогноз независимо от гистологии, тогда как POLEmut был самым сильным благоприятным прогностическим фактором, даже среди случаев высокой степени злокачественности и поздних стадий. Эффект лечения также различался внутри молекулярных подгрупп. Пациенты с РЭ p53-abn имели весьма значительную пользу от ХЛТ независимо от гистологическического подтипа и стадии, тогда как у пациентов с POLEmut РЭ показал отличную выживаемость в обеих группах лечения
Переведено каналом THE piNcet: Кабанов И.В., Омельченко Д.В., Попов М.С.
Однако пациенты с dMMR и NSMP РЭ имели промежуточный результат, и когда были проанализированы различия в эффекте адъювантного лечения (ХЛТ и ЛТ) среди этих молекулярных подгрупп, не наблюдалось никакой пользы между ХЛТ и ЛТ только у пациентов с dMMR РЭ. У пациентов с NSMP РЭ наблюдалась тенденция к положительному эффекту от ХЛТ, аналогичная общим результатам исследования.²³
Карциносаркомы, которые в настоящее время считаются метапластическими дедифференцированными РЭ, не были включены в исследования, упомянутые выше. Они единообразно расцениваются, как группы высокого риска, и большинство из них классифицируются как p53-abn РЭ. Рекомендации для заболеваний высокого риска в значительной степени применимы и к карциносаркомам, и эта гистологический тип должен быть включен в предстоящие клинические исследования
Рекомендации
РЭ с промежуточным риском
•Пациенткам с эндометриоидным типом стадии IA G3 (dMMR и NSMP) и отсутствием или очаговой LVSI рекомендуется адъювантная БТ для уменьшения вагинальных рецидивов [I, A].
•Пациенткам с эндометриоидным типом IB G1-G2 (dMMR и NSMP) и отсутствием или очаговой LVSI рекомендуется адъювантная БТ для уменьшения вагинальных рецидивов [I, A].
•Пациенткам с эндометриоидным раком II стадии G1 (dMMR и NSMP) и отсутствием или очаговой LVSI рекомендуется адъювантная БT для уменьшения вагинальных рецидивов [II, B].
•Можно рассмотреть вопрос об отказе от адъювантной БХ (особенно у пациентов в возрасте <60 лет) на всех вышеперечисленных стадиях после консультации пациента и при соответствующем наблюдении [III, C].
РЭ высокого-промежуточного риска со стадией Л/У (pN0)
•Гистерэктомия с двусторонней сальпингоофорэктомией является стандартной хирургической процедурой при ранних стадиях РЭ [I, A].
•Минимально инвазивная хирургия является рекомендуемым подходом при РЭ I стадии G1-G2 [I, A].
•Минимально инвазивная хирургия также может быть предпочтительным хирургическим подходом на I стадии G3 [II, A].
•Сохранение яичников может рассматриваться у женщин в пременопаузе со стадией IA G1 EEC [IV, A]. –
•Сторожевую ЛАЭ можно рассматривать как стратегию узловой оценки при РЭ низкого/среднего риска (например, стадии IA G1-G3 и стадии IB G1-G2) [II, A]. Его можно не проводить в случаях без инвазии миометрия. Систематическая ЛНЭ не рекомендуется в этой группе [II, D].
•Хирургическое стадирование лимфатических узлов следует проводить у пациентов с заболеванием высокогопромежуточного/высокого риска. Биопсия сторожевых лимфатических узлов является приемлемой альтернативой систематической ЛАЭ для определения стадии лимфатических узлов у I-II стадии высокого промежуточного риска/высокого риска [III, B].
•Полное хирургическое стадирование, включая оментэктомию, биопсию брюшины и стадирование лимфатических узлов, следует рассматривать при серозных РЭ и карциносаркомах [IV, B].
•Если это возможно и при приемлемой заболеваемости, на III и IV стадиях следует рассматривать циторедуктивную хирургию в максимальном хирургическом объеме [IV, B].
РЭ с низким риском
•Пациенткам со стадией IA (G1 и G2) с эндометриоидным типом (dMMR и NSMP) и отсутствием или фокальной LVSI адъювантное лечение не рекомендуется [I, E].
•Пациентам со стадией IA неэндометриоидного типа (и/или p53-abn), без инвазии в миометрий, и без или с очаговой LVSI адъювантное лечение не рекомендуется [III, E].
•Для пациентов с I-II стадией POLEmut рака адъювантное лечение не рекомендуется [III, D].
•Для пациентов с III стадией POLEmut рака рекомендуется лечение в рамках клинических исследований, однако также возможно отсутствие адъювантного лечения [III, C].
Для пациентов со стадией IA и IB с существенной LVSI, стадией IB G3, стадией II G1 с существенной LVSI и стадией II G2-G3 (dMMR и NSMP):
•Рекомендуется адъювантная лучевая терапия [I, A].
•Добавление (сопутствующей и/или последовательной) ХТ к ДЛТ, особенно для G3 и/или значительной LVSI [II, C].
•Адъювантная БТ (вместо ДЛТ) может быть рекомендована для уменьшения вагинальных рецидивов, особенноу женщин без существенной LVSI
•При тщательном наблюдении можно отказаться от любого адъювантного лечения после совместного принятия решения с пациентом [IV, C].
РЭ высокого-промежуточного риска без стадирования Л/У
Для пациентов со стадией IA и IB с существенной LVSI, стадией IB G3, стадией II G1 с существенной LVSI и стадией II G2-G3 (dMMR и NSMP):
•Рекомендуется адъювантная лучевая терапия [I, A].
•Добавление (сопутствующей и/или последовательной) ХТ к ДЛТ, особенно при значительной LVSI и G3 [II, C].
•Адъювантная БТ возможна при IB G3 без значительной LVSI для уменьшения вагинальных рецидивов [II, C].
РЭ с высоким риском
•Рекомендуется адъювантная лучевая терапия с одновременной адъювантной ХТ [I, A].
•Можно использовать последовательную ХТ и ЛТ [I, C].
•Альтернативным вариантом является только ХТ [I, B].
РЕЦИДИВРУЮЩИЙ/МЕТАСТАТИЧЕСКИЙ РЭ
Результаты запущенных/рецидивирующих заболеваний остаются неудовлетворительными: 5-летняя выживаемость составляет 20– 25%. Лечение пациенток с рецидивирующим/ метастатическим РЭ всегда должно требовать мультидисциплинарного подхода в специализированных центрах и должно основываться на состоянии пациента, распространенности заболевания, предшествующем лечении и молекулярном профиле.
