
Понятия о раздражителях, раздражимости, раздражении, возбудимости и биологических реакциях
На ткани организма постоянно действуют какие-то факторы, которые могут находиться внутри или вне организма, которые называются раздражителями. Раздражители – это факторы внешней или внутренней среды, обладающие запасом энергии и при действии которых на ткань отмечается их биологическая реакция. Различают два вида биологических реакций: специфические и неспецифические. Специфические реакции характерны для какой-то строго определенной ткани. Например, специфическая реакция мышечной ткани – это сокращение, для железистой ткани – это выделение секрета или инкрета (гормона), для нервной ткани – это генерация и передача нервного импульса. Таким образом, специфической деятельностью обладают специализированные ткани. Неспецифические реакции характерны для любой живой ткани. Например, изменение интенсивности обмена веществ, изменение мембранного потенциала покоя, изменение ионного градиента и т.д. Теперь дадим определение таким понятиям, как раздражение, раздражимость, возбудимость и биологические реакции. Раздражение – это любые воздействия на ткань. В ответ на раздражения возникают биологические реакции ткани, т.е. ответная реакция ткани на действие раздражителя. Все биологические реакции делятся на две группы: 1) неспецифические реакции – эти реакции свойственны для любой ткани и проявляются они в виде изменения интенсивности обмена веществ, величины мембранного потенциала покоя и др.; 2) специфические реакции – эти реакции свойственны только для специализированных тканей: для мышечной ткани - это сокращение, для железистой ткани – это выделение секрета или инкрета (гормона), для нервной ткани – это генерация (образование) нервного импульса и передача его к рабочему органу (эффектору). Раздражимость – это универсальное свойство живой материи и отражает способность любой живой ткани изменять свою неспецифическую деятельность под влиянием раздражения. Возбудимость – это свойство специализированных тканей и отражает способность ткани реагировать на раздражение изменением своих специфических реакций. Возбудимость ткани определяется его пороговой силой: чем меньше пороговая сила, тем больше возбудимость ткани.
Классификация раздражителей ( по силе и биологическому соответствию)
Все многообразие раздражителей можно выделить в отдельные группы. Классификация раздражителей зависит от того, что берется за основу:
По биологическому соответствию, то есть насколько раздражитель соответствует данной ткани. По данной классификации различают два вида: 1) адекватные – раздражители, которые соответствуют данной ткани. Например, для сетчатки глаза свет – все остальные раздражители не соответствуют сетчатке, для мышечной ткани – нервный импульс и т.д.; 2) неадекватные – раздражители, которые не соответствуют данной ткани. Для сетчатки глаза все раздражители кроме светового будут неадекватные, а для мышечной ткани все раздражители, кроме нервного импульса.
По силе – различают пять основных раздражителей (рис.1):
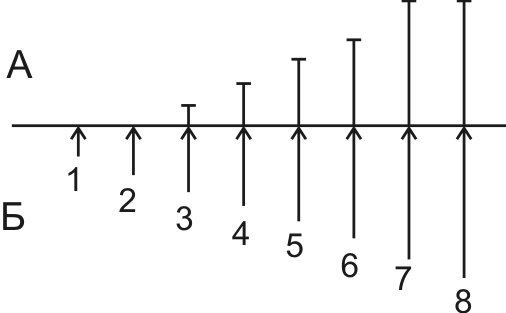
1) подпороговые раздражители – это сила раздражителя при которой не возникает ответная реакция (локальный ответ, т.е. изменения происходят только на месте действия раздражителя); 2) пороговый раздражитель – это минимальная сила, которая вызывает ответную реакцию при бесконечном времени действия. Эту силу еще называют реобазой – она единственная для каждой ткани; 3) надпороговые, или субмаксимальные; 4) максимальный раздражитель – это минимальная сила при которой возникает максимальная ответная реакция ткани; 5) сверхмаксимальные раздражители – при этих раздражителях реакция ткани либо максимальная, либо уменьшается, либо временно исчезает. Таким образом, для каждой ткани существует один пороговый раздражитель, один максимальный и множество подпороговых, надпороговых и сверхмаксимальных.
Характеристика адекватного и неадекватного раздражителей
По биологическому соответствию, то есть насколько раздражитель соответствует данной ткани. По данной классификации различают два вида: 1) адекватные – раздражители, которые соответствуют данной ткани. Например, для сетчатки глаза свет – все остальные раздражители не соответствуют сетчатке, для мышечной ткани – нервный импульс и т.д.; 2) неадекватные – раздражители, которые не соответствуют данной ткани. Для сетчатки глаза все раздражители кроме светового будут неадекватные, а для мышечной ткани все раздражители, кроме нервного импульса. Адекватный раздражитель для каждой ткани только один, а неадекватных раздражителей – много. Пороговая сила адекватного раздражителя меньше, чем пороговая сила неадекватного раздражителя.
Функциональные состояния ткани, их физиологическая характеристика.
Различают три функциональных состояний ткани: покой, возбуждение и торможение. Состояние покоя – это пассивный процесс, при котором отсутствуют внешне выраженные проявления специфической деятельности. Например, сокращение, секреция и др. Состояние возбуждения и торможения – это активные процессы, при которых в одном случае усиливается специфическая деятельность ткани (возбуждение), а в другом – либо полностью исчезает проявление специфической деятельности, либо уменьшается, хотя на ткань при этом продолжает действовать раздражитель.
Возбудимость, мера возбудимости (пороговая сила и хронаксия)
Возбудимость – это свойство специализированных тканей и отражает способность ткани реагировать на раздражение изменением своих специфических реакций. Возбудимость ткани определяется его пороговой силой и хронаксией. Пороговая сила – это минимальная сила, которая вызывает ответную реакцию при бесконечном времени действия. Эту силу еще называют реобазой – она единственная для каждой ткани: пороговая сила обратнопропорциональна возбудимости: чем больше пороговая сила, тем меньше возбудимость ткани. Хронаксия – это минимальное время, в течении которого необходимо действовать силой в две реобазы, чтобы получить ответную реакцию ткани. Для определения хронаксии необходимо вначале определить пороговую силу (реобазу), затем удвоить эту силы (взять две реобазы) и найти минимальное время, которое необходимо, чтобы при действии силы в две реобазы произошла ответная реакция ткани. Для определения хронаксии используется прибор - хронаксиметр. Этот прибор широко используется в клинике нервных болезней для определения хронаксии нервов и мышц, чтобы оценить возбудимость этих тканей и тем самым определить степень поражения этих тканей с одной стороны и с другой стороны – определить эффективность назначенного лечения. Если после проведенного лечения хронаксия не уменьшается, значит лечение было не правильным.
Законы раздражения возбудимых тканей: силы, времени.
Законы раздражения возбудимых тканей: 1) закон силы – возбудимость обратно-пропорциональна пороговой силе: чем больше пороговая сила, тем меньше возбудимость. Однако для возникновения возбуждения недостаточно только действия силы раздражения. Необходимо, чтобы это раздражение длилось какое-то время; 2) закон времени действия раздражителя. При действии одной и той же силы на разные ткани потребуется разная длительность раздражения, что зависит от способности данной ткани к проявлению своей специфической деятельности, то есть возбудимости: наименьшее время потребуется для ткани с высокой возбудимостью и наибольшее время - с низкой возбудимостью. Таким образом, возбудимость обратно-пропорциональна времени действия раздражителя: чем меньше время действия раздражителя, тем больше возбудимость.
При взаимоотношении живого объекта со средой практически не проявляются только закон силы или только закон времени. Любое воздействие на биологические системы одновременно обладает двумя неотделимыми друг от друга свойствами – силой и длительностью действия. При этом усиление раздражения приводит к укорочению времени, необходимого для возбуждения, но не беспредельно, то есть для каждой силы раздражения существует свой порог времени (минимальное время). Таким образом, сила и длительность раздражения находятся в обратной зависимости, что отражается кривой «силы-времени» (рис.3)
Закон скорости нарастания силы раздражителя. Аккомодация
В сложных взаимоотношениях организма со средой ему приходится сталкиваться не только с изменением силы и длительности действия раздражителя, но и с быстротой их изменений. Быстроту изменения силы характеризует скорость нарастания силы раздражения, что отражается третьим законом – зависимости возбудимости ткани от скорости нарастания силы раздражителя: чем меньше пороговая скорость нарастания силы раздражителя, тем больше возбудимость ткани. Для каждой ткани существует своя пороговая скорость нарастания силы раздражения. Если мы опустим лапку лягушки в горячую воду ( +50о), то возникает ответная реакция в виде отдергивания лапки. Теперь опустим лапку лягушки в воду с комнатной температурой - никакой реакции не будет. Не вынимая лапки лягушки, медленно будем нагревать воду до +50о – реакции не будет. Таким образом, реакция ткани зависит не только от силы раздражителя, но и от скорости нарастания силы раздражения. Если на ткань действовать силой, скорость нарастания которой ниже пороговой величины, то ткань не реагирует на этот раздражитель. Такое явление получило название аккомодация, то есть приспособление ткани на действие раздражителя. Сущность аккомодации заключается в повышении порога возбудимости, которое возникает при медленно нарастающей силе раздражения. При этом уменьшается критический уровень деполяризации, что приводит к увеличению пороговой силы, уменьшению возбудимости и в связи с этим ткань не реагирует на данный раздражитель.
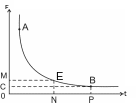
Кривая силы-времени. Показать на этой кривой реобазу, хронаксию, полезное время
Эта кривая отражает зависимость силы раздражителя (F) от времени его действия (t). Эта зависимость в пределах А-В обратно-пропорциональна: чем больше сила раздражителя, тем меньше время его действия. На данной кривой можно определить следующие показатели: пороговую силу, или реобазу (ОС), полезное время (ОР) и хронаксию (ON).
Биопотенциалы, их виды. МПП и МПД, величина и способ регистрации.
Биопотенциалы – это разность потенциалов между двумя точками живой ткани, отражающая ее биоэлектрическую активность. Можно сказать, что биопотенциалы – это электрический ток в живых системах.
Различают три вида биопотенциала:
1) мембранный потенциал покоя (МПП);
2) мембранный потенциал действия (МПД);
3) потенциал градиента основного обмена (метаболический потенциал).
МПП – это разность потенциалов между наружней и внутренней поверхностью мембраны в состоянии покоя. При этом на наружней поверхности мембраны скапливаются положительные заряды, а на внутренней поверхности – отрицательные заряды. Величина МПП соответствует –70 - -90 мв. Знак минус означает, что в покое на внутренней поверхности мембраны скапливаются отрицательные заряды. Такое распределение зарядов для клеточной мембраны характерно, когда клетка находится в состоянии физиологического покоя. Мембрана с расположенными отрицательными зарядами на внутренней ее поверхности и положительными на наружней находится в состоянии поляризации. Регистрация МПП осуществляется только внутриклеточным способом. Для этой цели используют микроэлектроды – их диаметр должен соответствовать порам мембраны. Использование микроэлектрода связана с тем, что мембрана при этом практически не повреждается при введении электрода во внутрь клетки.
МПД – это разность потенциалов между наружней и внутренней поверхностью мембраны при возбуждении. Можно дать другое определение: МПД – это разность между возбужденной и невозбужденной частью мембраны. Таким образом, МПД можно регистрировать двумя способами: 1) внутриклеточным – для этого также используют микроэлектроды; 2) внеклеточным способом. Этот способ возможен благодаря тому, что возбуждение не сразу охватывает всю мембрану клетки, а распространяется волнообразно. При этом на наружной поверхности возбужденной части мембраны скапливаются отрицательные заряды, а на невозбужденной части – положительные. Благодаря внеклеточной регистрации, МПД широко используется в клинике: а) ЭМГ – электромиография, регистрация МПД скелетных мышц, используется для изучения функционального состояния мышц; б) ЭЭГ – электроэнцефалография, регистрация МПД мозга, используется для изучения функционального состояния коры больших полушарий; в) ЭГГ – электрогастрография, регистрация МПД желудка, используется для изучения двигательной функции желудка; г) ЭКГ – электрокардиограмма, регистрация МПД сердечной мышцы, используется для изучения функционального состояния сердечной мышцы. Величина МПД соответствует +110 +120 мв. Знак плюс означает, что при возбуждении внутренняя поверхность мембраны заряжена положительно.
Мембранный потенциал покоя, его величина, происхождение и способ регистрации.
МПП – это разность потенциалов между наружней и внутренней поверхностью мембраны в состоянии покоя. При этом на наружней поверхности мембраны скапливаются положительные заряды, а на внутренней поверхности – отрицательные заряды. Величина МПП соответствует –70 - -90 мв. Знак минус означает, что в покое на внутренней поверхности мембраны скапливаются отрицательные заряды. Такое распределение зарядов для клеточной мембраны характерно, когда клетка находится в состоянии физиологического покоя. Мембрана с расположенными отрицательными зарядами на внутренней ее поверхности и положительными на наружней находится в состоянии поляризации. Регистрация МПП осуществляется только внутриклеточным способом. Для этой цели используют микроэлектроды – их диаметр должен соответствовать порам мембраны. Использование микроэлектрода связана с тем, что мембрана при этом практически не повреждается при введении электрода во внутрь клетки.
В настоящее время экспериментально доказано, что большую роль в таком распределении зарядов играют ионы натрия и калия, которые неравномерно распределены во внутриклеточной и внеклеточной среде. В клетках возбудимых тканей концентрация ионов калия достигает 150 ммоль/л, а во внеклеточной среде – 4-5 ммоль/л, то есть концентрация ионов калия во внутриклеточной среде в 30-50 раз больше, чем во внеклеточной среде. Концентрация ионов натрия, наоборот, больше во внеклеточной среде, чем во внутриклеточной (во внеклеточной среде ионов натрия 140 ммоль/л, а во внутриклеточной среде – 14 ммоль/л, то есть во внеклеточной среде ионов натрия в 10 раз больше. В механизме возникновения МПП большую роль играют специальные поры – каналы, просветы которых так узки, что проходить через них способны только относительно мелкие ионы натрия и калия. Причем, в мембране имеются специальные каналы, пропускающие калий (калиевые каналы), или натрий (натриевые каналы). Известно, что в состоянии покоя поры мембраны, пропускающие ионы калия (калиевые каналы), в основном открыты, а поры, пропускающие ионы натрия (натриевые каналы), в основном закрыты. В связи с этим в состоянии покоя проницаемость для ионов калия (пассивный транспорт по градиенту) в несколько раз больше, чем для ионов натрия. Каждый выходящий ион калия остается на наружней поверхности мембраны, так как анион не может пройти через калиевый канал и остается на внутренней поверхности мембраны. В состоянии покоя происходит поляризация мембраны: на наружней поверхности мембраны скапливаются положительные заряды (ионы калия), а на внутренней поверхности – анионы (отрицательные заряды). Следует отметить, что в состоянии покоя натриевые каналы в основном закрыты, поэтому они в очень незначительном количестве проникают во внутриклеточную среду. Причем, каждый зашедший натрий захватывает анион с внутренней поверхности мембраны и проходит во внутриклеточную среду. В связи с этим ион калия, находящийся на наружной поверхности мембраны, также, соединяясь с анионом, проходит во внеклеточную среду. Таким образом, каждый зашедший во внутрь клетки ион натрия, уменьшает поляризацию, а, следовательно, уменьшает величину МПП, а каждый, вышедший из клетки ион калия, увеличивает поляризацию и величину МПП. Наличие МПП в клетке сваидетельствует о готовности мембраны реагировать на раздражение.
Мембранный потенциал действия, его величина, происхождение и способ регистрации.
МПД – это разность потенциалов между наружней и внутренней поверхностью мембраны при возбуждении. Можно дать другое определение: МПД – это разность между возбужденной и невозбужденной частью мембраны. Таким образом, МПД можно регистрировать двумя способами: 1) внутриклеточным – для этого также используют микроэлектроды; 2) внеклеточным способом. Этот способ возможен благодаря тому, что возбуждение не сразу охватывает всю мембрану клетки, а распространяется волнообразно. При этом на наружной поверхности возбужденной части мембраны скапливаются отрицательные заряды, а на невозбужденной части – положительные. Благодаря внеклеточной регистрации, МПД широко используется в клинике.
Величина МПД соответствует +100 – +120мв. Знак плюс означает, что при возбуждении на внутренней поверхности мембраны скапливаются положительные заряды. Такое распределение зарядов для клеточной мембраны характерно, когда клетка находится в состоянии возбуждения. Мембрана с расположенными положительными зарядами на внутренней ее поверхности и отрицательными на наружней находится в состоянии деполяризации. В настоящее время наибольшее признание получила ионная теория, объясняющая механизм возникновения МПД.
Экспериментально доказано, что большую роль в таком распределении зарядов играют ионы натрия и калия, которые неравномерно распределены во внутриклеточной и внеклеточной среде. В клетках возбудимых тканей концентрация ионов калия достигает 150 ммоль/л, а во внеклеточной среде – 4-5 ммоль/л, то есть концентрация ионов калия во внутриклеточной среде в 30-50 раз больше, чем во внеклеточной среде. Концентрация ионов натрия, наоборот, больше во внеклеточной среде, чем во внутриклеточной (во внеклеточной среде ионов натрия 140 ммоль/л, а во внутриклеточной среде – 14 ммоль/л, то есть во внеклеточной среде ионов натрия в 10 раз больше. В механизме возникновения МПД большую роль играют специальные поры – каналы, просветы которых так узки, что проходить через них способны только относительно мелкие ионы натрия и калия. Причем, в мембране имеются специальные каналы, пропускающие калий (калиевые каналы), или натрий (натриевые каналы). Известно, что при действии раздражителя изменяются свойства мембраны: поры (каналы), пропускающие ионы натрия открываются, а поры, пропускающие ионы калия закрываются. В связи с этим после нанесения раздражения резко увеличивается проницаемость мембраны для ионов натрия и натрий начинает по градиенту (пассивный транспорт) заходить в Каждый заходящий ион натрия остается на внутренней поверхности мембраны, так как анион не может пройти через натриевый канал и остается на наружней поверхности мембраны. В состоянии возбуждения происходит деполяризация мембраны: на наружней поверхности мембраны скапливаются отрицательные заряды (анионы), а на внутренней поверхности – положительные (ионы натрия). Таким образом, каждый зашедший во внутрь клетки ион натрия, уменьшает поляризацию, а, следовательно, уменьшает величину МПП, что приводит к деполяризации мембраны – возникает МПД
Критический уровень деполяризации. Изменение возбудимости при при изменении КУД
Соотношение ионов натрия и калия внутри и во внеклеточной среде. Их роль в возникновении МПП и МПД
Фазы МПД, механизм возникновения каждого периода
При раздражении клетки изменяются свойства мембраны таким образом, что открываются натриевые каналы, а калиевые закрываются. В связи с этим ионы натрия начинают заходить в клетку, так как их вне клетки в 10 раз больше. Начинается перезарядка мембраны – деполяризация. В момент раздражения наружная поверхность мембраны имеет положительные заряды, поэтому первые порции ионов натрия заходят в клетку медленно, так как при этом действует электростатическая отталкивающая сила.
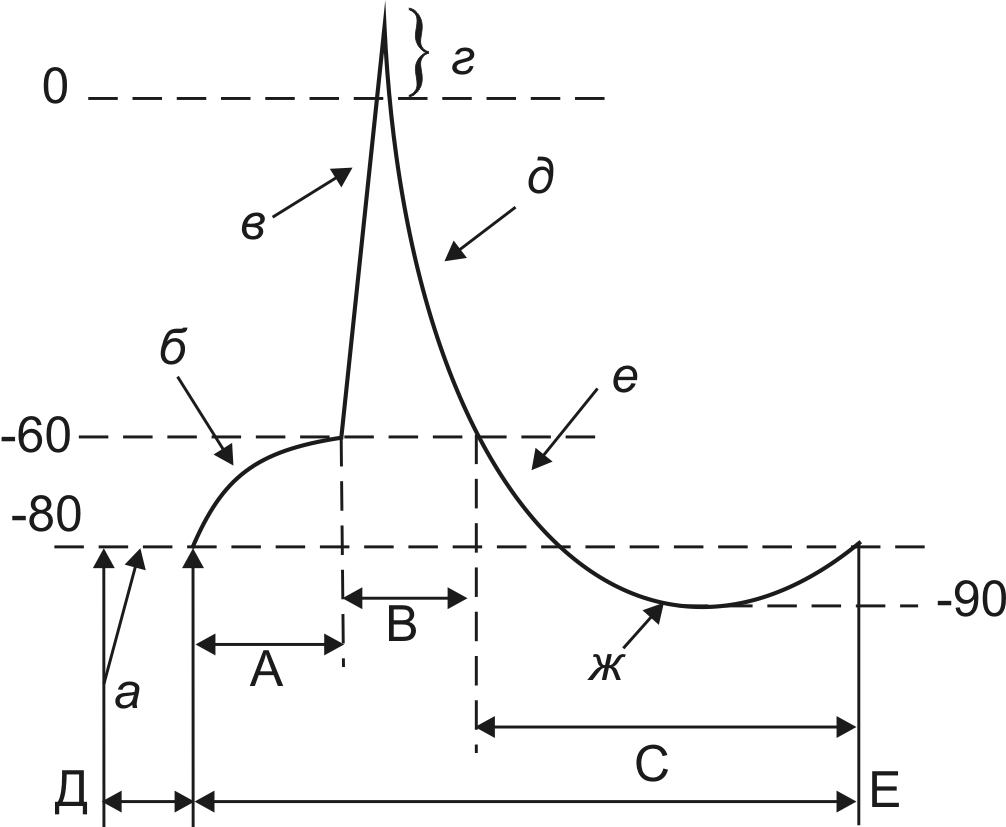
Медленный заход натрия происходит до определенного уменьшения МПП (до –50-70 мВ), после чего перестает действовать отталкивающая сила. Этот уровень МПП, при котором отсутствует отталкивающая сила, называется критический уровень деполяризации (КУД). Уменьшение МПП до КУД соответствует первой фазе МПД – порог деполяризации (А). От величины КУД зависит пороговая сила, а, следовательно, и возбудимость ткани (чем меньше КУД, тем больше пороговая сила и меньше возбудимость ткани). При уменьшении МПП до уровня КУД начинается залповый заход натрия в клетку и МПП резко уменьшается за счет перезарядки мембраны – это вторая фаза МПД – пик МПД (В). Эта фаза имеет два периода: а) период деполяризации (в) – в этот период происходит резкое уменьшение МПП до определенного уровня (+20+30 мВ) Во время этого периода мембрана теряет свой нормальный заряд (свою «поляризацию»), поэтому этот период называю периодом деполяризации. Как правило, деполяризация переходит за нулевую линию и внутренняя поверхность мембраны приобретает положительный заряд – эта положительная часть пика МПД называется овершут. б) период реполяризации (д) – после достижения своего максимального уровня происходит восстановление исходной величины МПП, то есть мембрана возвращается в состояние поляризации. При этом до уровня КУД происходит быстрое восстановление, затем реполяризация замедляется. В реполяризационной части пика МПД большую роль играет повышение проводимости для инов калия. Кроме этого, реполяризации мембраны способствует работа натриевого насоса, благодаря чему происходит выкачивание ионов натрия из клетки, чтобы вернуть прежнее соотношение ионов натрия внутри и вне клетки (восстановить прежнюю асимметрию ионов натрия). Период реполяризации осуществляется до уровня КУД, затем начинается третья фаза МПД – следовой потенциал (С). Эта фаза также состоит из двух периодов: а) период следовой деполяризации (е) – при этом реполяризация еще не достигает уровня МПП; б) период следовой гиперполяризации (ж) – при этом величина МПП становится больше, чем было до раздражения. Это происходит, потому что реполяризация осуществляется за счет работы натриевого насоса и за счет увеличения проницаемости ионов калия – в результате этого ионов калия выходит больше и количество положительных зарядов на наружной поверхности мембраны становится больше (гиперполяризация). Для предотвращения ионного равновесия в определенный момент срабатывает механизм калиевого насоса, и калий начинает заходить в клетку (транспорт ионов калия против градиента) состояние мембраны возвращается к исходной поляризации. Длительность МПД составляет около 1мс в нервах, 10 мс в скелетной мышце и более 200 мс в миокарде.
Соотношение фаз МПД с фазами возбудимости
Если нормальную возбудимость (в условиях физиологического покоя) принять за 100%, то в ходе одного цикла возбуждения она изменяется как в сторону повышения (экзальтации), так и в сторону понижения (рефрактерности).
Изменение возбудимости ткани в разные фазы МПД отражено на рисунке.
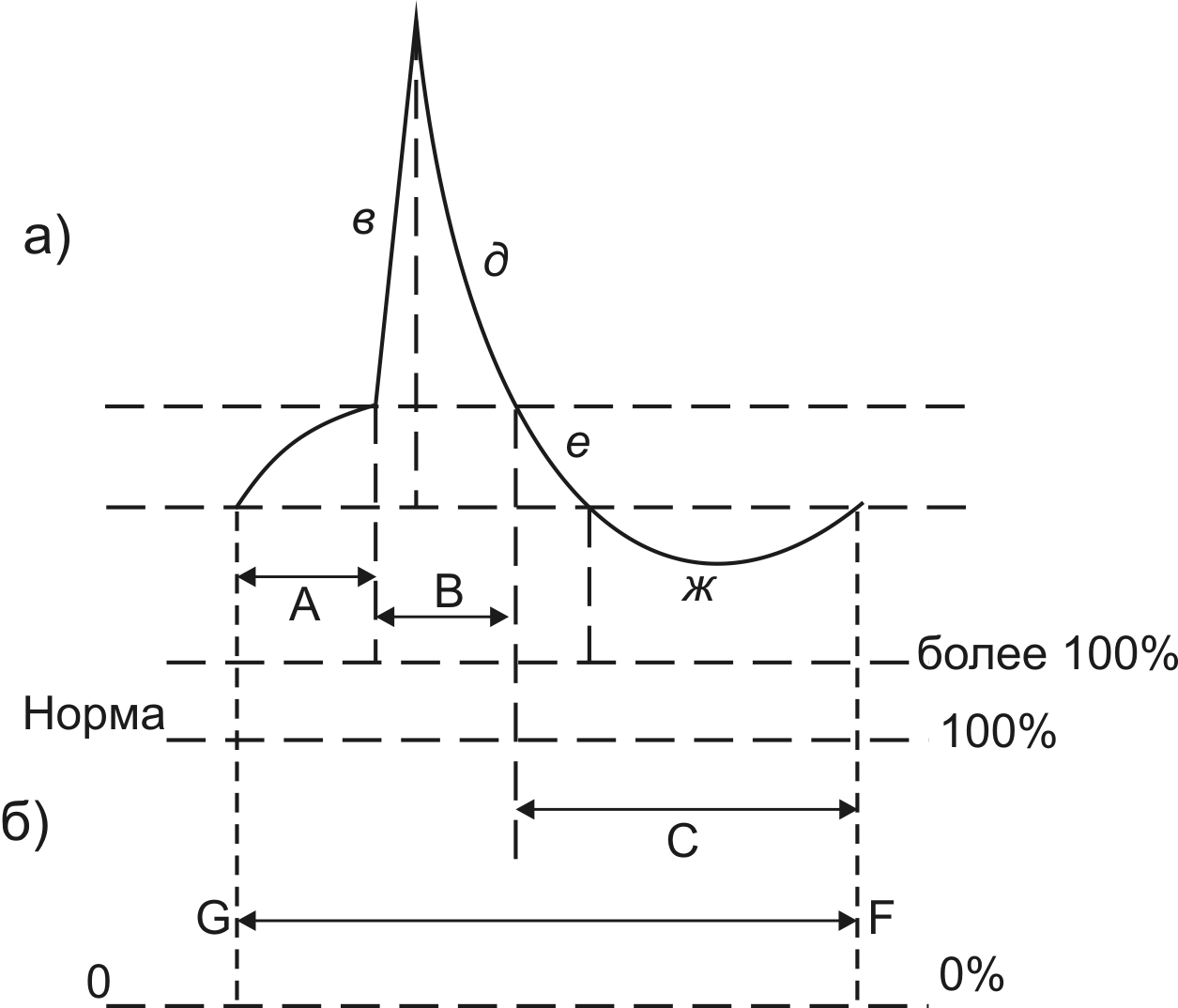
Рис. 8. Изменение возбудимости в разные фазы МПД
В первую фазу МПД – порога деполяризации (А) - возбудимость ткани возрастает – становится выше нормы (более 100%) эта фаза возбудимости называется супернормальная возбудимость, или фаза экзальтации. Такая же повышенная возбудимость в период следовой деполяризации (С е). В период деполяризации пика МПД (В в) возбудимость полностью исчезает (0%) – эта фаза абсолютной рефрактерности. В период реполяризации пика МПД возбудимость снижена (меньше 100%) – эта фаза относительной рефрактерности (В д). Такое же снижение возбудимости отмечается в период следовой гиперполяризации (С ж). Таким образом, при возбуждении возбудимость ткани неоднородна: может повышаться (фаза экзальтации) в фазу порога деполяризации и в период следовой деполяризации МПД, может уменьшаться (фаза относительной рефрактерности) в период реполяризации пика МПД и в период следовой гиперполяризации, может полностью отсутствовать (фаза абсолютной рефрактерности) в период деполяризации пика МПД.
Биологическое значение абсолютной рефрактерности заключается в том, что эта фаза защищает живую ткань от чрезмерных энергетических трат и позволяет «без помех» осуществлять текущую приспособительную реакцию.
Изменение МПП и МПД при повышении внеклеточного калия и натрия
Изменение возбудимости (реобазы и хронаксии) при увеличении и уменьшении МПП
Изменение возбудимости (реобазы и хронаксии) при увеличении и уменьшении КУД
Активный и пассивный транспорт ионов через мембрану. Калий-натриевый насос, его роль в возникновении МПП и МПД, механизм работы.
Выход ионов калия из клетки (при возниковении МПП) и заход ионов натрия внутрь клетки (при возникновении МПД) осуществляется пассивно – по концентрационному градиенту, то есть из области высокой концентрации ионы проникают в область низкой концентрации. Однако, наличие только пассивного транспорта привело бы к исчезновению разности концентраций, что несовместимо в нормальной ткани, то есть исчезновение разности концентраций ионов приводит к гибели клетки (жизнь – это ионная ассиметрия клетки). Следовательно, должен существовать еще один ток ионов через мембрану, поддерживающий ионную асимметрию клетки на каком-то оптимальном уровне. Этот ток ионов осуществляется активно, против градиента (калий-натриевый насос): при этом ионы калия будут заходить в клетку за счет калиевого насоса, который начинает функционировать при сильном увеличении МПП (следовая гиперполяризация), а ионы натрия – выходить из клетки – за счет натриевого насоса, который начинает функционировать при максимальном значении МПД (овершут). Таким образом, калий-натриевый насос это условный механизм, который обеспечивает активный транспорт ионов калия (калиевый насос) и натрия (натриевый насос). В каждой клетке имеется свое пороговое соотношение ионов калия и натрия. Когда в клетке возникает это пороговое соотношение ионов калия и натрия, происходит активация аденозинтрифосфатазы мембраны и происходит расщепление АТФ, освобождается энергия, которая обеспечивает активный транспорт ионов калия и натрия – эта энергия и есть калий-натриевый насос. За счет этой энергии восстанавливается прежнее соотношение ионов калия и натрия внутри и вне клетки.
Этот насос будет функционировать до оптимального соотношения ионов калия и натрия во внеклеточной и внутриклеточной среде.
Мышцы, их классификация и свойства. Типы скелетных мышц, их характеристика.
Двигательная единица.
Мышечные волокна делятся на две группы: 1)поперечно-полосатые мышцы, которые, в свою очередь делятся на два вида: а) скелетные мышцы, б) сердечная мышца (миокард); 2) гладкие мышцы.
По международной номенклатуре скелетные мышцы делятся на три типа: 1) I тип мышечных волокон (быстрые мышцы, белые, окислительные, ааэробные). Эти мышцы практически не содержат миоглобина, поэтому сокращаются в безкислородной среде. Энергия для сокращения этих мышц образуется за счет окисления глюкозы, поэтому их еще называют аэробные, или окислительные; IIА тип мышечных волокон (медленные, красные, окислительно-гликолитические, аэробно-анаэробные); IIВ тип мышечных волокон (красные, медленные, анаэробные, гликолитические). IIА и IIВ типы мышечных волокон содержат много миоглобина, поэтому имеют красный цвет. IIВ тип мышечных волокон отличаются от IIА тем, что первые хорошо васкулизированны (содержат много капилляр, имеют хорошее кровоснабжение). По своей функции скелетные мышцы можно разделить на: 1) фазные – эти мышцы генерирут МПД, который распространяется по всей мышце, они быстро сокращаются и быстро расслабляются (отмечается четкая фазность мышечного сокращения); 2) тонические – эти мышцы не способны генерировать полноценный МПД, распространяющегося типа, поэтому эти мышцы сокращаются и длительно находятся в этом состоянии (в этих мышцах отсутствует четкая фазность в процессе сокращения)
По своей локализации скелетные мышцы различают: 1) интрафузальные – они локализованны в рецепторах мышц (мышечном веретене); 2) экстрафузальные – все мышечные волокна, принадлежащие данной мышце и не входящие в состав мышечного веретена.
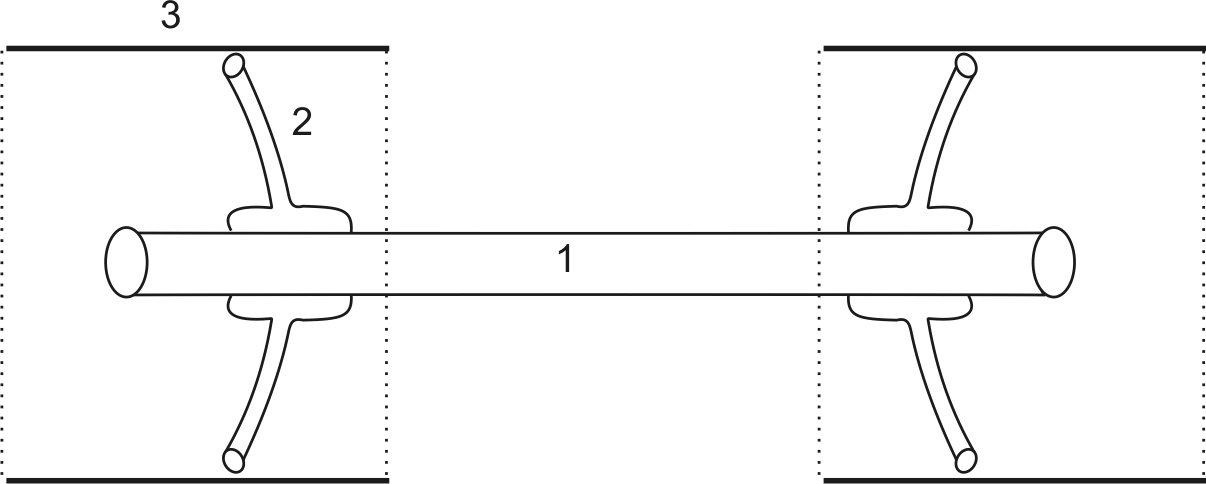
Двигательная единица состоит из трех элементов: Мотонейрона (1), локализованного в передних рогах спинного мозга; эфферентного нерва (2) и скелетной мышцы (3).
![]()
Режимы сокращения мышц
Выделяют три основных режима сокращения мышц (рис.):

А Б В Г
Изотонический режим (Б) – при этом сокращение мышцы происходит за счет укорочения мышечного волокна, а напряжение (тонус) при этом практически не меняется - при этом сокращение мышц происходит за счет увеличения напряжения (тонуса), а длина мышечных волокон практически не меняется - увеличивается поперечное сечение мышцы а1 больше, чем а: длина мышцы не изменяется (в=в1); изометрический режим – (В) укорочение длины мышечного волокна (в2 меньше, чем в), поперечное сечение не изменяется (а=а2); 3) ауксотонический режим, или смешанный режим сокращения (Г). При этом происходит укрочение мышцы (в3 меньше в) и увеличение поперечного сечения (тонуса): а3 больше а.
Структура мышечного волокна и протофибриллы
Мышечное волокно состоит из множества миофибрилл, каждая из которых состоит из большого количества протофибрилл и каждая протофибрилла состоит из миофиламентов. Таким образом, структурно-функциональная единица мышцы – миофиламенты. На поперечном разрезе видно, что каждая миофиламента состоит из одного толстого волокна (миозина - 1) и вокруг него шесть тонких нитей (волокон) – актина (2)
Между миозином (1) и актиновыми нитями (3) имеются миозиновые поперечные мостики (2). В состоянии покоя головка поперечного мостика не соединяется с актином - их соединению препятствует тропомиозин, который находится на глобуле актиновых нитей. Периодически (под влиянием раздражения) тропомиозин двигается в глубину бороздки – в желобок актиновых нитей и освобождает место на актиновой нити для связывания с головкой поперечного мостика.
Белки мышц и их роль в мышечном сокращении
В механизме мышечного сокращения большую роль играют четыре белка: 1) миозин – этот белок образует толстые нити в структуре миофиламенты, а также участвует в образовании актомиозинового комплекса; 2) актин – этот белок образует тонкие нити в структуре миофиламенты и участвует в образовании актомиозинового комплекса, а при разрыве поперечных мостиков продвигается вдоль миозина, способствуя сокращению мышцы; 3) тропомиозин – это белок регулирует образование актомиозина (обладает аденозинтрифосфотазной активностью), что зависит от локализации тропомиозина: при локализации тропомиозина на глобуле актиновых нитей головка поперечного мостика не соединяется с актином (мышца расслаблена), при локализации тропомиозина в желобке актиновых нитей головка поперечного мостика соединяется с актином и образуется актомиозин, расщепляется АТФ, освобождается энергия нити актина скользят вдоль миозина - происходит сокращение мышцы.; 4) тропонин – этот белок способен изменять свою конформацию (пространственное расположение) в присутствии ионов кальция. Конформационное изменение тропонина, в свою очередь, способствует продвижению тропомиозина в желобок актиновых нитей, благодаря чему головка поперечного мостика соединяется с актином и образуется актомиозиновый комплекс.
Одиночное мышечное сокращение, его фазы. Тетанус и его виды.
Одиночное мышечное сокращение – этот вид сокращения возникает на одиночное раздражение, достаточного для вызова возбуждения мышцы. При этом виде сокращения различают три фазы: а) латентная фаза (короткий скрытый период) от момента раздражения до появления сокращения; б) фаза напряжения (сокращения) – в эту фазу происходит нарастание силы сокращения; в) фаза расслабления – происходит падение силы сокращения до исходной величины. В латентную фазу происходят следующие процессы: деполяризация мембраны-возникновение МПД-распространение пика МПД до Тсистем-выход ионов кальция из цистерн и его соединение с тропонином-изменение конформации тропонина-уход тропомиозина в желобок актиновых нитей-соединение головки поперечного мостика с актином с образованием актомиозинового комплекса-расщепление АТФ. В фазу мышечного сокращение за счет энергии АТФ происходит периодический разрыв поперечного мостика, что приводит к скольжению актиновых нитей вдоль миозина (сокращение мышцы). В фазу расслабления происходят следующие процессы: меньшая часть энергии АТФ-работа кальциевого насоса-заход ионов кальция в цистерны-возвращение тропонина к исходной конформации-выход тропомиозина из желобка актиновых нитей-разъединение головки поперечного мостика от актина-возвращение актиновых нитей к исходной позиции (расслабление).
Тетаническое сокращение, или суммированное – при этом происходит длительное и сильное сокращение мышцы. Этот вид сокращения возникает в ответ на ритмический раздражитель – при этом происходит суммация сокращений. Тетаническое сокращение – это сильное и длительное мышечное сокращение, возникающее при действии ритмического раздражителя. В зависимости от частоты ритмического раздражителя различают зубчатый (5-10Гц) и гладкий (более 15 и более Гц) тетанус. При этом суммация может происходить после частичного расслабления мышцы (зубчатый тетанус) или без частичного расслабления (гладкий тетанус).
Продольные и поперечные канальцы. Т-системы
В мышечном волокне имеются множество продольных и поперечных канальцев (рис.)
Продольные канальцы (2) являются вместилищем ионов кальция (кальциевые цистерны) – в состоянии покоя концентрация ионов кальция в межфибрилярном пространстве очень низкая, так как они находятся в цистернах. Выход ионов кальция из цистерн осуществляется при возникновении МПД, который доходит до этих канальцев (Т-системы мышц). Поперечные канальцы (1) связывают внеклеточную среду с внутриклеточной, а также по мембране этих канальцев осуществляется распространение МПД. Место соединение одного поперечного канальца и двух продольных называю Т-системы мышц.
Последовательность процессов, происходящих при мышечном сокращении
В состоянии покоя головка поперечного мостика не может соединяться с актином, так как этому препятствует тропомиозин, находящийся на актиновой нити. При сокращении мышцы последовательно происходят следующие процессы: раздражение мышцы – возникновение МПД и его распространение по мембране поперечного канальца до Т-систем – увеличивается проницаемость мембраны продольных канальцев (кальциевых цистерн) для ионов кальция – выход кальция в межфибрилярное пространство – изменение конформации тропонина (пространственное распложение молекулы тропонина) – продвижение тропомиозина в желобок актиновых нитей – освобождается место в актиновой нити для соединения головки поперечного мостика с образованием актомиозинового комплекса – гидролиз АТФ с освобождением энергии (все эти процессы происходят в скрытую фазу мышечного сокращения) – большая часть энергии идет на крутящиеся движения поперечных мостиков с последующим их разрывом – скольжение актиновых нитей вдоль миозина, то есть сокращение мышцы. Следует отметить, что каждый разрыв поперечного мостика сопровождается укорочением (напряженим) мышцы. Таким образом, при образовании актомиозинового комплекса происходит расщепление АТФ и выделение энергии. Большая часть энергии используется для того, чтобы создать крутящий момент и отрыв мостика от актиновой нити и благодаря этому актиновая нить продвигается вдоль миозина (скользит) на 10нм. За период укорочения (напряжения) происходит около 50 «гребков», в результате чего длина саркомера уменьшается примерно на 50%.
Последовательность процессов, происходящих при расслаблении мышц. Роль кальцевого насоса в мышечном расслаблении
Меньшая часть энергии, освободившаяся при расщеплении АТФ тратится на работу кальциевого насоса, в результате чего ионы кальция заходят в цистерны и уровень кальция в межфибрилярном пространстве снижается, белок тропонин возвращается к прежней конформации, белок тропомиозин «выходит» из желобка, головка поперчного мостика отталкивается (разъединяется) от актина. Нити актина возвращаются в исходное состояние и наступает процесс расслабления. Таким образом, роль кальциевого насоса заключается в том, что этот насо (энергия) обеспечивает активный транспорт ионов кальция из межфибрилярного пространства (где их мало) в кальциевые цистерны (где их много) и запускает последовательность процессов при расслаблении мышцы.
Современная теория мышечного сокращения. Понятие о состоянии ригор.
Процесс сокращения, согласно теории А. Хаксли, Симмонс (1971), происходит за счет скольжения актиновых нитей вдоль миозина за счет крутящегося движения поперечного мостика («гребок») с последующим его разрывом, в результате чего происходит продвижение (скольжение) актиновых нитей вдоль миозина. Скольжения актиновых нитей происходит благодаря целому ряду последовательных процессов: раздражение мышц – возникновение МПД и его распространение по мембране поперечного канальца до Т-систем – увеличивается проницаемость мембраны продольных канальцев (кальциевых цистерн) для ионов кальция – выход кальция в межфибрилярное пространство – изменение конформации тропонина – продвижение тропомиозина в желобок актиновых нитей – соединение головки поперечного мостика с актином и образование актомиозинового комплекса – гидролиз АТФ с освобождением энергии (все эти процессы происходят в скрытую фазу мышечного сокращения) – большая часть энергии идет на крутящиеся движения поперечных мостиков с последующим их разрывом – скольжение актиновых нитей вдоль миозина, то есть сокращение мышцы. Следует отметить, что каждый разрыв поперечного мостика сопровождается укорочением (напряженим) мышцы. Таким образом, при образовании актомиозинового комплекса происходит расщепление АТФ и выделение энергии. Большая часть энергии используется для того, чтобы создать крутящий момент и отрыв мостика от актиновой нити и благодаря этому актиновая нить продвигается вдоль миозина (скользит) на 10нм. За период укорочения (напряжения) происходит около 50 «гребков», в результате чего длина саркомера уменьшается примерно на 50%. В случае отсутствия АТФ наступает стойкое прикрепление головки поперечного мостика к актину без последующего отрыва такое состояние мышц называется ригор. Это имеет место, например, при трупном окоченении.
Другая часть (меньшая) энергии идет на работу кальциевого насоса – ионы кальция заходят в цистерны – наступает расслабление мышцы.
Функциональная подвижность (лабильность) тканей. Усвоение ритма. Оптимум и пессимум.
Способность ткани реагировать на ритмический раздражитель Н.Е. Введенским названа функциональной подвижностью (лабильностью) ткани. Причем, способность ткани воспроизводить циклы возбуждения на ритмический раздражитель зависит от скорости тех элементарных реакций, которыми сопровождается это возбуждение. Поэтому Н.Е. Введенский под лабильностью понимал «большую или меньшую скорость тех элементарных реакций, которыми сопровождается физиологическая деятельность данного аппарата». Из определения следует, что мерой лабильности является максимальное количество циклов возбуждения (пиков МПД), воспроизводимое в единицу времени. Лабильность ткани не является абсолютно постоянной. В ходе ритмического раздражителя лабильность ткани может повышаться – это явление А.А. Ухтомский назвал усвоением ритма. Об усвоении ритма наглядно демонстрирует опыт Мевеса на изолированном нервном волокне лягушки: вначале максимальное количество циклов возбуждений, которое воспроизводило нервное волокно было 460 циклов возбуждений в 1с. При раздражении этого волокна ритмическим раздражителем в 740 импульсов в секунду - нервное волокно воспроизводило каждый второй импульс, но через несколько секунд возникло 740 циклов возбуждений в 1с, то есть нервное волокно усвоило заданный ритм раздражения вследствие повышения лабильности.
Н.Е. Введенский в опытах на нервно-мышечном препарате лягушки обнаружил, что если наносить раздражение одной и той же силы, но последовательно увеличивать частоту ритмического раздражителя, то ответная реакция также последовательно нарастает. Им установлено, что с увеличением частоты раздражителя увеличивается ответная реакция. При достижении максимальной величины, ответная реакция постепенно уменьшается и даже прекращается. Частота раздражения (40 – 50гц), вызывающая максимальную ответную реакцию, будет оптимальной, а частота (200 – 400гц), приводящая к уменьшению или исчезновению ответа – пессимальной. Эти реакции объясняются тем, что при оптимальной частоте раздражения каждый последующий импульс попадает в фазу супернормальной возбудимости. При повышении частоты каждый последующий импульс попадает либо в относительную (ответная реакция уменьшается), либо в абсолютную (реакция исчезает полностью) рефрактерность.
Парабиоз и его фазы.
Н.Е. Введенский разработал эксперимент с альтерацией (отравлением) нерва на ограниченном участке, тем самым, создав зону пониженной лабильности, то есть возникшее возбуждение в этом участке исчезает медленнее, чем в нормальном.
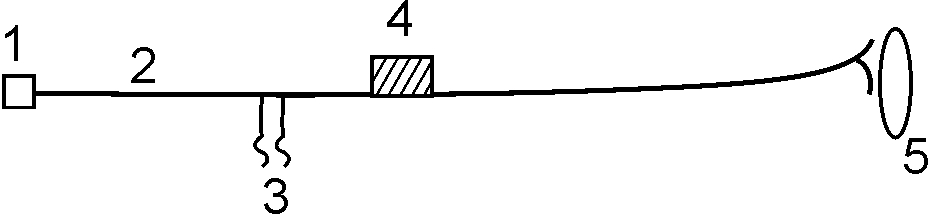
Рис. 12. Опыт Введенского с альтерацией нерва. 1 – соответствующие сегменты спинного мозга; 2 – эфферентный нерв; 3 – раздражение нерва электрическим током; 4 - вата смоченная хлороформом; 5 – мышца.
Альтерацию нерва (2) можно проводить ваткой, смоченной эфиром или хлороформом (4). При этом участок нервного волокна, подвергшийся альтерации, обладает всеми признаками возбуждения (электроотрицательность, изменение физико-химического состояния), кроме одного – этот участок не в состоянии проводить бегущие волны возбуждения. Действуя на электроды (3) ритмическим раздражителем оптимальной частоты, но разной силы (слабые, средние, сильные) Н.Е.Введенский обнаружил несколько последовательно протекающих стадий:
1ст. – трансформирующая, уравнительная, провизорная – при этой стадии на все силы интенсивности раздражения возникает равная по величине реакция; 2ст. – парадоксальная при этом минимальная сила раздражения вызывает более сильный эффект, чем раздражение максимальной силы; 3ст. – тормозная – при этом мышца не реагирует на раздражение любой силы. Тормозная стадия обратимая, но при углублении и усилении альтерации может произойти необратимое нарушение жизнедеятельности – смерть. Именно поэтому обнаруженное явление вследствие альтерации небольшого участка нерва Н.Е. Введенский назвал парабиозом. Парабиоз – состояние близкое к жизни (околожизненное состояние) – активный процесс, который характеризуется неспособностью проводить возбуждение. Наркоз – это частный случай универсальной парабиотической реакции на повреждающее воздействие.
Классификация нервов по структуре
Нерв это совокупность аксонов и дендритов нейрона (нервной клетки). Все нервы по своей структуре делятся на две группы: 1) безмиелиновые нервы, или безмякотные; 2) миелиновые нервы, или мякотные. Безмиелиновые нервы состоят и осевого цилиндра (совокупность отростков) и Швановской оболочки. Миелиновые нервы состоят из: 1) осевого цилиндра; 2) миелина – липид, выполняющий функцию изолятора, а также участвующего в синтезе медиатора; 3) перехваты Ранвье – участок нерва не покрытого миелином; 4) Швановская оболочка. Таким образом, по своей структуре нервы бывают миелиновые и безмиелиновые. Каждый нерв обладает двумя физиологическими свойствами: возбудимостью и проводимостью
Особенности проведения возбуждения по миелиновым и безмиелиновым нервам
Распространение возбуждения по нерву объясняется теорией местных и круговых токов. При действии раздражителя на безмиелиновый нерв происходит деполяризация мембраны в результате чего возникают местные токи и происходит деполяризация мембраны соседних участков слева и справа, возбуждение распространяется в обе стороны (двухстороннее распространение возбуждения). В данном случае возбуждение распространяется по всей поверхности мембраны, поэтому скорость передачи возбуждения в безмиелиновых нервах очень низкая (0,5 – 10 м/с). При действии раздражителя на миелиновый нерв происходит деполяризация мембраны не покрытые миелином (в перехватах Ранвье) в результате чего возникают круговые токи между перехватами Ранвье слева и справа и происходит деполяризация мембраны этих перехватов, возбуждение распространяется в обе стороны (двухстороннее распространение возбуждения). В данном случае возбуждение распространяется от одного перехвата Ранвье к другому или сразу к третьему, поэтому скорость передачи возбуждения в миелиновых нервах очень высокая (до 70 – 120 м/с).
Механизм непрерывного и сальтаторного проведения возбуждения по нервам
Механизм передачи возбуждения по нерву будет зависеть от его структуры. В безмиелиновом нервном волокне происходит непрерывное распространение возбуждения, поэтому местные токи проходят через большую поверхность мембраны. В миелиновых нервах участки, покрытые миелином обладают очень высоким сопротивлением (100000 – 160000 ом/см2). Таким образом, строение миелинового нерва создает предпосылки для качественно нового типа проведения возбуждения – сальтаторного (от латинского persaltum – прыжки). Местные токи, в одном из перехватов не проходят через всю мембрану (как это отмечалось в безмиелиновых нервах), а идут через соседние перехваты, то есть, возникший МПД в участке раздражения, как бы перескакивают («прыгают») от одного перехвата Ранвье к другому. При этом МПД может перескакивать через 2-3 и даже 5 перехватов Ранвье. Нетрудно убедиться в преимуществе сальтаторного типа проведения возбуждения по нерву: 1) при этом увеличивается скорость распространения возбуждения (до 120 м/с); 2) распространение возбуждения происходит с меньшими затратами энергии, то есть более экономно.
Скорость проведения импульсов возрастает с увеличением диаметра аксона, так как при этом снижается внутреннее сопротивление.
Законы проведения возбуждения по нервам
Различают три закона проведения возбуждения по нерву. Первый закон свидетельствует о том, что возбуждение распространяется по нерву только в случае его анатомической и физиологической целостности.
Так, если перерезать нерв (нарушить анатомическую целостность), то возбуждение по нерву распространяться не будет. Если каким-либо повреждающим агентом (хлороформ, эфир, раствор KCl) подействовать на нерв, мы нарушаем временно физиологическую целостность нерва. В этом случае возбуждение также не будет распространяться по нерву.
Второй закон свидетельствует о том, что возбуждение распространяется по нерву в обе стороны от места раздражения, то есть в нервах отмечается двухстороннее проведение возбуждения.
Третий закон свидетельствует об изолированном проведении возбуждения по нерву, то есть возбуждение с одного нерва не передается на другой нерв как бы близко не находились нервные волокна.
Следует отметить, что закон физиологической целостности нерва в какой-то мере относителен для миелиновых волокон, в которых возбуждение распространяется скачкообразно, поэтому при небольшом участке альтерации нерва возбуждение может перейти этот участок. Закон изолированного проведения возбуждения относителен для безмиелиновых нервов, так как при сильном возбуждении оно может перейти с одного безмиелинового нерва на другой безмиелиновый нерв. При местном обезболивании временно нарушается физиологическая целостность нерва, поэтому импульсы от болевых рецепторов не достигаю соответствующих зон в коре большихполушарий и человек не чувствует боль.
Синапс, его структура
Нервная система состоит из отдельных нейронов, разделенных межклеточными промежутками, поэтому должен существовать механизм, который позволяет нервному импульсу «перескакивать» с аксона одного нейрона на дендриты или тела другого или, в случае нервно-мышечного соединения - на мышцу.
Синапс – это структурное образование, где происходит переход одного нервного волокна на другой, или переход нерва на нейрон и мышцу. Структура любого синапса состоит из: 1) пресинаптической мембраны, в которой находятся пузырьки заполненные физиологически активным веществом (медиатор); 2) постсинаптической мембраны (5), которая отличается от внесинаптической мембраны наличием реактивной субстанции, обладающей высокой чувствительностью к медиатору; 3) синаптической щели между пре- и постсинаптической мембраной. Пузырьки пресинаптической мембраны содержат специфическое вещество, которое освобождается при возбуждении аксона и называется медиатором. Окончание аксона с пузырьками называется пресинаптической мембраной. Участок нерва, нейрона или мышцы, куда непосредственно передается возбуждение называется постсинаптической мембраной. Между этими двумя структурами имеется небольшой промежуток (не более 50 нм), который называется синаптической щелью. Таким образом, любой синапс состоит из трех частей: пресинаптической мембраны, синаптической щели и постсинаптической мембраны. Из вышеизложенного следует, что в синапсах передача возбуждения осуществляется химическим способом и происходит это за счет трех процессов: 1) освобождения медиатора из пузырьков; 2) диффузии медиатора в синаптическую щель; 3) соединением этого медиатора со специфическими реактивными структурами постсинаптической мембраны, что приводит к образованию нового импульса.
Механизм передачи возбуждения через синапс. ВПСП и ТПСП
При каждом нервном импульсе происходит освобождение медиатора из пузырьков, который диффундирует в синаптическую щель и соединяется с реактивными структурами (субстанциями, рецепторами) постсинаптической мембраны и при этом возникает усиление проницаемости для ионов натрия (возбуждающие медиаторы) или ионов калия (тормозные медиаторы).
Рис. 29. Возникновение возбуждающего (ВПСП) и тормозного (ТПСП) постсенаптического потенциала. Разница между МПП (-80) и КУД (-60) определяет возбудимость постсенаптической мембраны: чем больше эта разница (порог деполяризации), тем меньше возбудимость. Порог деполяризации в состоянии покоя 9А) равен 20 mV.
За счёт возбуждающего медиатора увеличивается проницаемость для ионов натрия и происходит деполяризация постсинаптической мембраны с образованием возбуждающего постсинаптического потенциала (ВПСП). Если ВПСП не доходит до критического уровня, возникает локальный ответ. Если ВПСП доходит до критического уровня (это зависит от количества медиатора), тогда во внесинаптической мембране возникает МПД. За счет тормозоного медиатора увеличивается проницаемость для ионов калия и происходит гиперполяризация мембраны с образованием тормозного постсинаптического потенциала (ТПСП). Возникновение ВПСП или ТПСП на постсинаптической мембране зависит от медиатора, который выделяется в пресинаптической мембране и от реактивной субстанции в постсинаптической мембране. Например, ацетилхолин может вызвать образование ВПСП и ТПСП: если ацетил холин взаимодействует с Н-холинореактивной субстанцией повышается проницаемость постсинаптической мембраны для ионов натрия и возникает ВПСП, если ацетилхолин взаимодействует с М-холинореактивной субстанцией повышается проницаемость для ионв калия и возникает ТПСП.
Холинореактивные и адренореактивные субстанции
В постсинаптической мембране синапса может быть два вида белков чувствительных к медиатору (эти белки называются реактивной субстанцией): 1) холинореактивные субстанции, обладающие высокой чувствительностью к медиатору ацетилхолину. В зависимости от повышения проницаемости постсинаптической мембраны для ионов калия или натрия холинореактивные субстанции делятся на а) Н-холинореактивные – при взаимодействии их с ацетилхолином увеличивается проницаемость для ионов натрия и на постсинаптической мембране будет деполяризация, возникает возбуждающий постсинаптический потенциал; б) М-холинореактивные субстанции - при взаимодействии их с ацетилхолином увеличивается проницаемость для ионов калия и на постсинаптической мембране будет гиперполяризация, возникает тормозной постсинаптический потенциал; 2) адренореактивные субстанции, обладающие высокой чувствительностью к медиатору норадреналину. В зависимости от повышения проницаемости постсинаптической мембраны для ионов калия или натрия адренореактивные субстанции делятся на а) альфа, и бета1 адренореакивные субстанции
– при взаимодействии их с норадреналином увеличивается проницаемость для ионов натрия и на постсинаптической мембране будет деполяризация, возникает возбуждающий постсинаптический потенциал; б) бета2 адренореактивные субстанции - при взаимодействии их с норадреналином увеличивается проницаемость для ионов калия и на постсинаптической мембране будет гиперполяризация, возникает тормозной постсинаптический потенциал;
АНС, его отделы и функции
По ныне действующей анатомической номенклатуре все термины (вегетативная нервная система, висцеральная, чревная, непроизвольная) заменены на «автономную нервную систему» (АНС). Однако в нашей литературе пользуются термином «вегетативная нервная система» (ВНС). Той же анатомической номенклатурой АНС делится на симпатический и парасимпатический отделы.
АНС включает следующие образования: 1) нервные волокна (пре- и постганглионарные), 2) переферические нервные узлы (ганглии), состоящие из нейронов, 3) центров в сером веществе головного (мезенцефальной и бульбарной области) и спинного мозга (боковых рогах), 4) высших центров, находящихся в межуточном мозге (гипоталамусе). АНС состоит из двух отделов: симпатического и парасимпатического.
Функции АНС: 1) обеспечивает местное и общее ауторегулирование (саморегуляцию) органов и систем организма в целях сохранения относительного динамического постоянства внутренней среды (гомеостазиса); 2) обеспечивает адаптацию вегетативных функций к изменяющимся условиям внешней и внутренней среды; 3) обеспечивает трофическую функцию органов и тканей. Трофическое влияние заключается в регулирующем влиянии АНС на обмен веществ и питание органов и тканей.
Локализация нейронов симпатического и парасимпатического отделов.
Нейроны симпатического и парасимпатического отделов АНС локализуются в центральной части, которую можно разделить на 4 области: 1) мезенцефальная (средний мозг), здесь находятся нейроны, отростки которых образуют парасимпатические нервы I-IV пары черепно-мозговых нервов; 2) бульбарная (продолговатый мозг) – здесь находятся нейроны, отростки которых образуют восемь пар черепно-мозговых нервов (V – ХII пары), также относящихся к парасимпатическим нервам; 3) сакральная (в боковых рогах II – IV крестцовых сегментов спинного мозга) – осуществляется парасимпатическая иннервация мочеполовых органов и нижних отделов пищеварительного тракта. 4) тораколюмбальная (боковые рога грудных и поясничных сегментов спинного мозга), здесь находятся нейроны, отростки которых образуют симпатические нервы, которые осуществляют иннервацию всех органов и тканей организма.
Отличия АНС и соматической нервной системы
Основные отличия АНС от цереброспинальной (соматической) нервной системы:
1. По расположению двигательных нейронов: для соматической нервной системы двигательные нейроны (мотонейроны) расположены в сером веществе спинного мозга (в передних рогах). Для АНС первый нейрон расположен в мезенцефальной и бульбарной области головного мозга (парасимпатический отдел АНС) а также в боковых рогах спинного мозга (симпатический – в шейных, грудных и поясничных сегментах, парасимпатический – в крестцовых сегментах). Вторые нейроны рассеяны на периферии: а) скопление нейронов в позвоночных ганглиях, находящихся на телах позвонков в составе пограничного симпатического ствола; б) скопление нейронов в предпозвоночных узлах (солнечное сплетение, нижнее брыжеечное сплетение, сердечное сплетение и т.д.); в) парасимпатические ганглии залегают внутри органа – интрамуральные ганглии.
2. По конечному результату: эфферентные волокна соматической нервной системы заканчиваются в скелетных мышцах, а эфферентное волокно АНС – во всех внутренних органах и гладкой мускулатуре сосудов.
3. По связи эффектора (рабочего органа) с ЦНС: для соматической нервной системы эта связь однонейронная, то есть аксон мотонейрона, находящегося в передних рогах спинного мозга, заканчивается в скелетных мышцах. Для АНС – эта связь двухнейронная, поэтому эфферентное нервное волокно АНС состоит из двух частей: преганглионарного волокна (его нейрон находится в спинном и головном мозгу) и постганглионарного (его нейрон находится в переферическом ганглии).
4. Выходом нервных волокон: волокна соматической нервной системы выходят из ЦНС строго сегментарно; волокна АНС подразделяются на симпатические и парасимпатические. Симпатические волокна выходят из центров, расположенных в боковых рогах шейных, грудных и поясничных сегментов. Парасимпатические волокна выходят из центров, расположенных в среднем и продолговатом мозге, а также в боковых рогах спинного мозга крестцовых сегментов.
5. По структуре нервного волокна: соматические нервные волокна в основном относятся к типу А – миелиновые волокна большого диаметра (в среднем 15 мкм.) и большой скоростью проведения возбуждения (в среднем 100 м/с). Преганглионарные волокна АНС в большей части относятся к типу В – миелиновые волокна меньшего диаметра (в среднем 3 мкм.) и меньшей скоростью (в среднем 7 м/с) Постганглионарные волокна АНС в большей части относятся к волокнам типа С – немиелиновые, маленького диаметра (в среднем 1 мкм) и маленькой скоростью проведения возбуждения (в среднем 1 м/с).
6. По медиатру: в окончаниях соматического нерва выделяется только ацетилхолин; в окончаниях симпатического нерва выделяется ацетилхолин (в окончаниях преганглионарного волокна) и норадреналин (в окончаниях постганглионарного волокна); в окончаниях пре- и постганглионарного волокна парсимпатического нерва выделяется только ацетилхолин.
7. По реактивной субстанции в постсинаптической мембране (ПСМ): в ПСМ соматического синапса отмечается только Н-холинореактивная субстанция; в ПСМ симпатического и парасимпатического ганглия отмечается Н-холинореактивная субстанция; в ПСМ рабочего органа симпатического нерва может быть либо альфа, либо бета1, либо бета2 адренореактивная субстанция; в ПСМ рабочего органа парасимпатического нерва может быть либо М-, либо Н-холинореактивная субстанция.
Отличия симпатического и парасимпатического отделов АНС
Симпатический нейрон автономной нервной системы локализуется в боковых рогах спинного мозга шейных, грудных и поясничных сегментов. Его эфферентный нерв прерывается в симпатиическом ганглии, который находится ближе к ЦНС. Эфферентный симпатический нерв состоит из пре- и постганглионарного волокна. В окончаниях преганглионарного волокна (симпатическом ганглии) выделяется ацетилхолин, а в окончаниях постганглионарного волокна выделяется норадреналин. В постсинаптической мембране симпатического ганглия находится Н-холинореактивная субстанция. В пост-синаптической мембране эффектора находится либо альфа, либо бета1, либо бета2 адренореактивная субстанция, поэтому здесь может возник-нуть либо возбуждение эффектора (за счет взаимодействия норадреналина с альфа или бета1 адренореактивной субстанцией), либо торможение (за счет взаимодействия норадреналина с бета2 адренореактивной субстан-цией). Парасимпатические нейроны локализуются: 1) в боковых рогах спинного мозга крестцовых сегментов; 2) продолговатом мозге; 3) среднем мозге. Его эфферентный нерв прерывается в парасимпатическом ганглии, который находится ближе к рабочему органу (эффектору). Эфферентный парасимпатический нерв состоит из пре- и постганглионарного волокна. В окончаниях преганглионарного волокна (парасимпатическом ганглии) и постганглионарного волокна выделяется ацетилхолин. В постсинаптической мембране парасимпатического ганглия находится Н-холинореактивная субстанция. В постсинап-тической мембране эффектора находится либо Н-, либо М-холинореак-тивная субстанция, поэтому здесь может возникнуть либо возбуждение эффектора (при взаимодействии ацетилхолина с Н-холинореактивной субстанцией), либо торможение (при взаимодействии ацетилхолина с М-холинореактивной субстанцией). Таким образом, симпатический отдел АНС отличается от парасимпатического локализацией нейронов, расположением ганглия, своим медиатором и реактивной субстанцией на постсинаптической мембране эффектора
Медиаторы АНС и СНС
Эфферентные нервы соматического нерва однонейронный и в его окончаниях выделяется медиатор ацетилхолин.
Эфферентные нервы АНС двухнейронные, поэтому здесь дважды выделяется медиатор: в синапсах между пре- и постганглионарными волокнами (в ганглиях) и между постганглионарным волокном и органом.
Симпатический нерв по выделяемому медиатору не однороден: в окончаниях преганглионарных волокон выделяется ацетилхолин, а в окончаниях постганглионарных волокон выделяется норадреналин. Некоторые симпатические постганглионарные нервные волокна выделяют ацетилхолин (потовые железы). Парасимпатический нерв по выделяемому медиатору однороден, так как в пре- и постганглионарных волокнах выделяется ацетилхолин.
В органах, иннервируемых АНС имеются специальные белковые структуры, обладающие очень высокой чувствительностью к медиатору. Выше было отмечено, что в постганглионарных волокнах симпатического нерва выделяется норадреналин, а парасимпатического нерва – ацетилхолин, поэтому все белковые структуры органов можно разделить на две группы:
I. Белковые структуры, обладающие высокой чувствии-тельностью к норадреналину – это адренореактивные структуры. Было отмечено, что раздражение симпатического нерва вызывает разную реакцию различных органов. Например, при раздражении симпатического нерва сердца происходит увеличение всех свойств сердечной мышцы и работа сердца усиливается, а при раздражении симпатического нерва кишечника – уменьшается тонус мышц кишечника. Это различие связано с различными адренореактивными структурами, имеющимся в этих органах. Различают три вида адренореактивных структур: 1) альфа адренореактивные структуры – при взаимодействии этих структур с норадреналином происходит усиление функции; 2) бета1 – адренореактивные структуры – при взаимодействии этих структур с норадреналином также происходит усиление функции органа; 3) бета2 – адренореактивные структуры – при взаимодействии этих структур с норадреналином происходит ослабление функции органа. Таким образом, при раздражении симпатического нерва результат работы органа будет разным в зависимости от того, какие адренореактивные структуры превалируют в этом органе. II. Белковые вещества, обладающие высокой чувствительностью к ацетилхолину – холинореактивные структуры. В свою очередь, раздражение парасимпа-тического нерва также может привести к ослаблению или усилению функции, что зависит от различных видов холинореактивных структур: 1) М-холинореактивные структуры, котрые чувствительны к ацетилхолину и мускарину (яду грибов). При взаимодействии ацетилхолина с этими структурами происходит ослабление функции органа; 2) Н-холинореактивные структуры – они чувствительны к ацетилхолину и никотину. При взаимодействии ацетилхолина с этими структурами происходит усиление функции органа. Таким образом, конечный результат функции органа при раздражении парсимпатического нерва зависит от преимущественного содержания в этом органе М- или Н-хлинореактивных структур. Так, в сердечной мышце превалируют М-холинореактивные структуры, а в мышечном слое кишечника Н-холинореактивные структуры, поэтому при раздражении парасимпатического нерва сила сокращения сердечной мышцы уменьшается или мышца не сокращается (остановка сердца), а сила сокращения мышц кишечника увеличивается (усиливается моторика кишечника). Следует отметить, что в постсинаптической мембране ганглиев и скелетных мышц имеются только Н-холинореактивные структуры.
Синергизм и антагонизм отделов АНС. Типы взаимодействия отделов АНС, способ определения
По основным эффектам при раздражении холинергических и адренергических нервов можно выделить два типа взаимоотношения симпатического и парасимпатического отделов АНС: 1) чаще всего отмечается антагонизм. Так, сердечная мышца при раздражении симпатического нерва усиливает свое сокращение, а при раздражении парасимпатического нерва – уменьшается сила сокращения; гладкая мускулатура бронхов и кишечника при раздражении симпатического нерва расслабляется, а при раздражении парасимпатического нерва – усиливает свое сокращение; 2) в ряде случаев отмечается синергизм – однонаправленное действие симпатического и парасимпатического нервов. Так, при раздражении симпатического нерва усиливается сокращение радиарных мышц зрачка (зрачок расширяется), а при раздражении парасимпатического нерва тоже усиливается сокращение, но уже циркулярных мышц зрачка (зрачок суживается). По конечному результату вроде бы отмечается антагонизм (в одном случае зрачок расширяется, в другом – суживается), но по влиянию непосредственно на мышцы – отмечается синергизм в обоих случаях усиливается сокращение мышц. Синергизм можно отметить и при действии этих нервов на слюнные железы: при раздражении парасимпатического нерва усиливается слюноотделение жидкой консистенции, а при раздражении симпатического нерва количество слюны либо не меняется, либо несколько увеличивается, но при этом слюна становится вязкой (трофическое влияние симпатического нерва). Существуют органы, снабжаемые только симпатическими нервами (почти все кровеносные сосуды, селезенка, гладкие мышцы волосяных луковиц) или только парасимпатическими (циркулярные мышцы зрачка, слезная железа) нервами. Под действием симпатических нервов может усиливаться глюкогенолиз в печени и липолиз в жировых клетках, что приводит к увеличению концентрации глюкозы и свободных жирных кислот в крови. Парасимпатические нервы не влияют на эти процессы.
Под влиянием симпатического и парасимпатического отдела АНС на орган можно выделить три типа взаимодействия:
1) нормотонический тип – при этом отмечается оптимальная координация симпатического и парасимпатического отделов АНС в регуляции работы органа; 2) симпатикотонический тип – при этом отмечается дискоординация во влиянии отделов АНС на орган с преимущественным влиянием симпатического нерва; 3) ваготонический тип – при этом отмечается также дискоординация во влиянии отделов АНС на орган, но с преимущественным влиянием парасимпатического нерва. Типы взаимодействия отделов АНС можно определить при помощи корреляционных ритмограмм.
Особенности постсинаптической мембраны в ганглиях и эффекторах
В постсинаптической мембране симпатического и парасимпатического ганглия находятся только Н-холинореактивные субстанции, которые соединяются с ацетилхолином и возникает возбуждающий постсинаптический потенциал за счет повышения проницаемости для ионов натрия. Благодаря возникновению ВПСП импульс передается от преганглионарного волокна на постганглионарное и дальше к рабочему органу.
В окончаниях постганглионарного волокна парасимпатического нерва выделяется ацетилхолин, поэтому в постсинаптической мембране эффектора могут быть Н- и М-холинореактивные структуры. При взаимодействии ацетилхолина с Н-холинореактивной структурой увеличивается проницаемость для инов натрия и возникает ВПСП – усиливается функция эффектора. При взаимодействии ацетилхолина с М-холинореактивной структурой увеличивается проницаемость для инов калия и возникает ТПСП – уменьшается функция эффектора. В окончаниях постганглионарного волокна симпатического нерва выделяется норадреналин, поэтому в постсинаптической мембране эффектора могут быть альфа, бета1 или бета2 адренореактивные структуры. При взаимодействии норадреналина альфа и бета1 адренореактвной структурой увеличивается проницаемость для ионов натрия и возникает ВПСП – усиливается функция эффектора. При взаимодействии норадреналина с бета2 адренореактивной структурой увеличивается проницаемость для инов калия и возникает ТПСП – уменьшается функция эффектора.
Нейрон, как структурная и функциональная единица ЦНС, их классификация.
Структурно-функциональной единицей ЦНС является нейрон (нервная клетка). Он состоит из тела (сомы) и отростков – многочисленных дендритов и одного аксона. Дендриты (короткие отростки) сильно ветвятся и образуют множество синапсов с другими клетками, что определяет их ведущую роль в восприятии нейроном информации. Аксон начинается от тела аксонным холмиком, функцией которого является генерация нервного импульса, который по аксону проводится к другим клеткам. Аксон сильно ветвится, образуя множество коллатералей, терминали которых образуют синапсы с другими клетками.
Многочисленные нейроны можно разделить на следующие:
Афферентные нейроны, или чувствительные, они самые многочисленные и локализуются в задних рогах спинного мозга. Аксоны этих нейронов заканчиваются на различных рецепторах и фактически составляют афферентные пути, то есть пути, по которым сигналы поступают в ЦНС.
Мотонейроны, или двигательные нейроны. Различают три вида основных мотонейронов: а) альфа-мотонейроны – они локализуются в передних рогах спинного мозга, их аксоны заканчиваются на экстрафузальных мышцах; б) гамма-мотонейроны – также локализуются в передних рогах спинного мозга, их аксоны заканчиваются в интрафузальных мышцах; в) вегетативные мотонейроны - локализуются в боковых рогах спинного мозга, их аксоны заканчиваются на внутренних органах и сосудах и составляют симпатические и парасимпатические нервы. Из вышеизложенного следует, что аксоны всех мотонейронов образуют эфферентные пути, то есть пути, по которым сигналы из ЦНС поступают в рабочие органы.
Гигантские тормозные клетки Реншоу. Отростки этих нейронов заканчиватся на альфа мотонейронах, вызывая их торможение за счет гиперполяризации. При возбуждение этих нейронов происходит процесс торможения в альфа мотонейронах и возникает торможение спиномозговых рефлексов.
Тормозные интернейроны – их отростки заканчиватся на клетках Реншоу. При возбуждении тормозных интернейронов происходит торможение клеток Реншоу и возникает облегчение спиномозговых рефлексов.
Особенности проведения возбуждения в ЦНС (замедление скорости проведения возбуждения, одностороннее проведение возбуждения, конвергенция, дивергенция, иррадиация).
Все особенности проведения возбуждения в ЦНС связаны с наличием большого количества синапсов:
1) Замедление проведения возбуждения по ЦНС. Эта особенность обусловлена тем, что в ЦНС имеются много синапсов, а в каждом синапсе передача возбуждения осуществляется за счет медиатора – необходимо время для выделения медиатора, его диффузии через пресинаптическую мембрану и взаимодействие с реактивной субстанцией постсинаптической мембраны с возникновением ВПСП.
2) Одностороннее проведение возбуждения, так как в синапсах возбуждение передается только от пресинаптической мембраны (здесь выделяется медиатор при помощи которого происходит передача возбуждения в синапсах) к постсинаптической.
3) Конвергенция, то есть схождение импульсов к одному нейрону. Эта особенность обусловлена тем, что рецепторов значительно больше, чем нейронов, поэтому от нескольких рецепторов (одного и того же рецептивного поля) импульсы поступают к одному нейрону – это и есть конвергенция.
4) Дивергенция - иррадиация – расхождение импульсов в ЦНС от одного нейрона к другому. Расхождение импульсов в ЦНС обусловлено наличием большого количества вставочных нейронов и многочисленных отростков. При сильном раздражении рецептора происходит распространение (иррадиация) возбуждения в ЦНС от одного нейрона к другим и даже к тем нейронам, которые не относятся к данному рецептивному полю. В результате иррадиации процессом возбуждения охватываются большое количество эффекторов (рабочих органов), и даже тех, которые не относятся к данному рецептивному полю. Из выше изложенного следует, что иррадиация является следствием дивергенции.
Пространственная и последовательная суммация возбуждения в ЦНС. Последействие
Различают два вида суммаций: 1) пространственная, или одновременная Этот вид суммации возникает благодаря тому, что рецепторов значительно больше, чем афферентных нейронов, поэтому из 2-х и более рецепторов сигналы поступают в один и тот же нейрон. Для того, чтобы убедиться в наличии данной суммации, необходимо подействовать на рецептор подпороговой силой – никакого ответа не будет. Затем подействовать одновременно двумя подпороговыми силами на два рецептора одного и того же рецептивного поля (совокупность рецепторов при раздражении которых происходит одна и та же реакция) – будет ответная реакция. При действии одной подпороговой силой выделяется мало медиатора и ВПСП на постсинаптической мембране не доходит до критического уровня, поэтому нет ответной реакции. При одновременном действии двух подпороговых сил медиатор выделяется одновременно в двух нервных окончаниях, которые заканчиваются на одном и том же нейроне. Таким образом, количество медиатора становится достаточным для того, чтобы ВПСП дошел до критического уровня; 2)последовательная суммация, или временная. Этот вид суммации происходит при действии ритмического раздражителя. При этом частота ритмического раздражителя должна быть достаточно высокой, чтобы медиатор, выделившийся на первый стимул не успел разрушиться и выделяется новая порция медиатора от последующих раздражений. Из выше изложенного следует, что при обоих видах суммаций происходит суммация медиатора. При пространственной (одновременной) суммации медиатор суммируется в синоптической щели. При последовательной (временной) суммации медиатор суммируется в пресинаптической мембране.
Различают два вида последействия: а) кратковременное последействие – его причиной является высокий уровень следовой деполяризации в нейронах ЦНС; б) длительное последействие – его причиной является циркуляция импульсов в ЦНС по коллатералям через вставочные нейроны. Длительное последействие возникает на действие максимального или сверхмаксимального раздражителя. При этом происходит длительная циркуляция импульса в ЦНС, через вставочный возбуждающий нейрон, поэтому при одиночном раздражении рецептора в ЦНС длительно сохраняется возбуждение и отмечается длительная ответная реакция эффектора после прекращения раздражения рецептора. Кратковременное последействие может возникнуть при действии порогового раздражителя. Это связано с особенностью возникновения МПД в нейронах и с низким порогом раздражения: разница между МПП (-70 мв) и критическим уровнем деполяризации (-60 мв). При возникновении МПД в нейронах возникает высокий уровень следовой деполяризации, поэтому одиночное раздражение вызывает несколько реакций: первая реакция в ответ на раздражение, остальные (последействие) за счет высокого уровня следовой деполяризации.
Окклюзия и последействие (кратковременное и длительное)
Окклюзия, закупорка – уменьшение величины ответной реакции при одновременном раздражении двух и более рецепторов по сравнению с суммарной реакцией, полученной при раздражении каждого рецептора в отдельности.
Механизм окклюзии: При раздражении каждого из двух рецепторов в отдельности в ЦНС происходит возбуждение по 4 нейрона: при раздражении одного рецептора возбуждаются четыре нейрона, а при раздражении другого рецептора возбуждаются также четыре нейрона. Причем, два нейрона являются общими для каждого рецептора, то есть эти нейроны возбуждаются при раздражении каждого рецептора в отдельности. При одновременном раздражении обеих рецепторов в ЦНС возбуждаются не 8 нейронов, а 6, так как два нейрона являются общими. Эти два нейрона возбуждаются по конкурентному механизму либо за счет раздражения одного рецептора, либо за счет раздражения другого рецептора. Если эти нейроны возбуждаются за счет импульсов, возникающих при раздражении одного рецептора, то определенное время эти нейроны будут находиться в рефрактерной фазе возбудимости и не реагируют на импульсы, возникающие при раздражении другого рецептора. Таким образом, в результате окклюзии (закупорки импульсов, возникающих при раздражении обеих рецепторов). При одновременном раздражении обеих рецепторов реакция обеих эффекторов будет меньше суммы реакции каждого эффектора при раздражении рецепторов в отдельности. Из выше изложенного видно, что окклюзия является следствием конвергенции.
Виды торможения в ЦНС
Впервые о торможение в ЦНС высказал И.М.Сеченов (1861 год). Исследуя рефлекторную деятельность лягушки с сохраненными зрительными буграми, И.М.Сеченов определял время сгибательного рефлекса – в ответ на погружение лапки лягушки в кислоту происходило сгибание конечности в тазобедренном и коленном суставах. При помещении на зрительные бугры кристаллы поваренной соли, возникает торможение, о чем свидетельствует удлинение времени рефлекса. Это наблюдение и позволило И.М. Сеченову говорить о явлении торможения в ЦНС. В последующем такой вид торможения получил название сеченовское торможение, или центральное торможение.
По своей локализации различают два вида торможения в ЦНС: 1) пресинаптическое, которое локализовано в пресинаптических терминалях, за счет постоянного возбуждения возбуждающих вставочных нейронов; 2) постсинаптическое – локализовано в постсинаптической мембране. К этому виду торможения относятся: сеченовское, реципрокное (сопряженное), возвратное и пессимальное.
Виды постсинаптического торможения, их механизм
Постсинаптическое торможение локализуется в постсинаптической мембране. Различают следующие виды: 1) Сеченовское торможение: после препарирования зрительных бугров у лягушки проверяем время рефлекса. Для этого наносим раздражение (раствором серной кислоты) на рецептор и возникает ответная реакция (отдергивание лапки – рефлекс). Определяем время рефлекса (время от момента раздражения до появления ответной реакции). После этого наносим кристаллики поваренной соли на зрительные бугры. В результате при действии прежнего раздражителя на рецептор требуется больше времени для возникновения ответной реакции – происходит торможение; 2) Реципрокное торможение обеспечивает осуществлению противоположных функций (вдоха и выдоха, сгибание и разгибание, отведение и приведение и т.д.). Реципрокное торможение можно рассмотреть на примере коленного рефлекса – разгибание голени. В данном случае удар неврологическим молоточком по сухожилию мышц разгибателей голени происходит растяжение этой мышцы, возбуждаются рецепторы мышечного веретена. Импульсы от этого рецептора через афферентные нейроны одновременно поступают в тормозные клетки Реншоу и альфа мотонейроны мышц разгибателей голени. Таким образом, при ударе неврологическим молоточком по сухожилию мышц разгибателей голени одновременно происходит возбуждение альфа мотонейронов мышц разгибателей голени и торможение альфа мотонейронов мышц сгибателей – отмечается разгибание голени (коленный рефлекс). Такое торможение нейронов, которое происходит при одновременном возбуждении другого нейрона получило название реципрокного, или сопряженного, так как этот вид торможения связан (сопряжен) с возбуждением другого нейрона; 3) Возвратное торможение. При сильном раздражении рецептора импульсы идут не только к эффектору, но по коллатерали возвращаются к нейрону через клетки Реншоу, вызывая его гиперполяризацию (торможение). Таким образом, альфа-мотонейрон, активируясь, через систему тормозного нейрона сам себя тормозит, за счет возвратных импульсов; 4) Пессимальное торможение возникает при действии ритмического раздражителя высокой частоты. В основе механизма сеченовского, реципрокного и возвратного торможения лежит гиперполяризация постсинаптической мембраны, которая происходит при возбуждении клеток Реншоу. В основе механизма пессимального торможения лежит стойкая деполяризация постсинаптической мембраны в результате чего блокируются натриевые каналы и происходит торможение.
Доминантный очаг возбуждения, его свойства.Обратная связь, его виды
Принцип доминанты - был открыт А.А. Ухтомским. Изучая ответы скелетной мышцы кошки на электрические раздражения коры больших полушарий, он обнаружил, что при акте дефикации ответы мышцы прекращаются. Проанализировав этот факт А.А. Ухтомский пришел к мнению о наличии в ЦНС явления доминанты – господствующего очага возбуждения. Дело в том, что среди многочисленных рефлекторных актов, которые могут быть выполнены в данный момент, осуществляются те реакции, которые наиболее значимы для организма в данный момент времени. Центры, участвующие в реализации более значимых для организма реакций, А.А. Ухтомский назвал «доминантным очагом возбуждения». Этот «очаг» обладает рядом важных свойств: а) повышенной возбудимостью; б) стойкостью возбуждения (инертностью), поэтому этот очаг возбуждения трудно подавить другим очагом возбуждения; в) способностью к суммации субдоминантных возбуждений, то есть доминантный очаг возбуждения притягивает к себе другие очаги возбуждения, менее значимые для организма в данный момент времени; г) способностью тормозить субдоминантные очаги возбуждения.
Принцип обратной связи. ЦНС посылает к рабочим органам определенные команды (каким должен быть результат). Фактический результат работы органа несколько отличается от должного. Разница фактического и должного результата называется рассогласованием: чем больше рассогласование, тем менее оптимальными являются процессы управления. Обратная связь несет информацию в ЦНС о параметрах фактического результата и в ЦНС осуществляется сравнение фактических параметров с теми, которые должны быть в данных условиях. Если фактический результат больше заданного уменьшается функция эффектора (отрицательная обратная связь), если фактический результат меньше заданного – усиливается функция эффектора (положительная обратная связь). Из вышеизложенного следует, что благодаря сигналам по обратной связи происходит коррекция (исправление) командных сигналов от ЦНС, чтобы приблизить параметры фактического результата к должным параметрам – в результате уменьшается рассогласование и происходит оптимизация процессов управления. При положительной обратной происходит усиление параметров результата, а при отрицательной - уменьшение.
Функции спинного мозга (фазические и тонические рефлексы)
Спинной мозг расположен в спиномозговом канале и выполняет две основные функции: 1) рефлекторную и 2) проводниковую. Все рефлексы спинного мозга можно разделить на: 1) соматические (тонические и фазические) и 2) вегетативные. В 1811 году Белла, разрушая передние корешки спинного мозга поясничных сегментов, отметил потерю двигательной функции задних конечностей. В 1822 году Мажанди, разрушая задние корешки спинного мозга поясничных сегментов, отметил потерю чувствительности кожи нижних конечностей. Таким образом, в задних корешках проходят чувствительные центростремительные нервные волокна от рецепторов кожи (болевые, температурные, тактильные и давления), мышц,сухожилий, суставов (проприоцептивная система) и от рецепторов внутренних органов (вегетативная система); в передних корешках проходят двигаьтельные центробежные нервные волокна от нейронов к мышцам. Эта особенность функции задних и передних корешков спинного мозга отражается законом Белла-Мажанди.
В соматических рефлексах участвуют альфа и гамма мотонейроны в передних рогах спинного мозга. Аксоны этих нейронов заканчиваются на экстрафузальных (альфа мотонейроны) и интрафузальных (гамма мотонейроны) мышцах. К фазическим относится все антогонистические рефлексы (сгибание-разгибание, отведение-приведение и т.д.). Эти рефлексы осуществляются фазно: мышцы быстро сокращаются и быстро расслабляются. Как правило, в этих рефлексах участвуют белые мышцы (мышцы I типа). Тонические рефлексы – это длительное сокращение мышц. В этих рефлексах участвуют красные мышцы (IIA и IIB типы). Тонические рефлексы можно разделить на периферические и центральные. Периферические тонические рефлексы осуществляются при расслаблении экстрафузальных мышц, что приводит к растяжению ядерной сумки мышечного веретена (рецепторов растяжения скелетных мышц). При этом происходит возбуждение рецепторов ядерной сумки, импульсы по афферентным волокнам через задние корешки спинного мозга поступают в альфа мотонейроны передних корешков и отсюда по эфферентным волокнам импульсы идут в экстрафузальные мышцы, происходит их сокращение. Центральные тонические рефлексы осуществляются за счет ретикуло- спинального пути. Импульсы от нейронов РФ мозга поступают в гамма мотонейроны передних корешков спинного мозга, отсюда по эфферентным путям к интрафузальным мышцам, при сокращении которых происходит натяжение ядерной сумки. При этом происходит возбуждение рецепторов ядерной сумки, импульсы по афферентным волокнам через задние корешки спинного мозга поступают в альфа мотонейроны передних корешков и отсюда по эфферентным волокнам импульсы идут в экстрафузальные мышцы, происходит их сокращение. Таким образом, натяжение ядерной сумки мышечного веретена (возбуждение проприорецепторов мышц) происходит двумя способами: 1) за счет расслабления экстрафузальных мышц и 2) за счет сокращения интрафузальных мышц.
Вегетативные рефлексы – это ответная реакция внутренних органов. Эти рефлексы осуществляются за счет аксонов вегетативных нейронов, расположенных в боковых рогах спинного мозга и составляющих периферические нервы симпатического и парасимпатического отделов АНС. Эти рефлексы участвуют в регуляции артериального давления, деятельности сердца, секреции и моторной функции пищеварительного тракта и функции мочеполовой системы.
Проводниковая функция спинного мозга: восходящие, идущие к различным отделам голвного мозга, и нисходящие – от головного мозга к спинному. К восходящим путям относится: 1) пучок Бурдаха (от рецепторов верхней части тела и в/конечностей) и Голя (от рецепторов нижней части тела и н/конечностей. Это пути тактильной чувствительности (прикосновение и давление). Импульсы по этим путям достигают таламуса и отсюда в заднюю центральную извилину (кора больших полушарий); 2) путь болевой и температурной чувствительности, или дорсальный спиноталамический путь – от ноцицепторов и терморецепторов к канатиковым интернейронам, отсюда на противоположную сторону и до таламуса; 3) дорсальный (пучок Флексига) и вентральный спиномозжечковый пути передают информацию от сухожилий, кожи и висцерорецепторов до мозжечка. Эти пути участвуют в поддержании тонуса мышц при движении и сохранении позы тела в прострастве. К нисходящим путям относится: 1) пирамидный, или кортикоспинальный (латеральный и передний). Эти пути обеспечивают связь нейронов двигательной зоны КБП с альфа мотонейронами спинного мозгаи отвечает за произвольные движения; 2) руброспинальный (красноядерно-спиномозжечковый) тракт (Манакова) относится к экстрапирамидной системе, связывает нейроны красного ядра среднего мозга с мозжечком, продолговатым мозгом и спинным – управляет тонусом мышц и непроизвольной координацией движений; 3) вестибулоспинальный также относится к экстрапирамидной системе, отвечает за связь между ядром Дейтерса варолиевого моста, мозжечком и альфа мотонейронами передних рогов спинного мозга. Регулирует тонус мышц, координацию движений, равновесие и ориентацию в пространстве; 4) ретикулоспинальный путь – также относится к экстрапирамидной системе. В зависмости от того в каких нейронах спинного мозга заканчивается этот путь различают следующие функции: а) торможение спиномозговых рефлексов – при этом путь заканчивается на клетках Реншоу, их возбуждение приводит к гиперполяризации альфа мотонейронов, что приводит к торможению; б) облегчение спиномозговых рефлексов – при этом путь заканчивается на тормозных интернейронах, их возбуждение приводит к торможению клеток Реншоу, поэтому снимается тормозной эффект этих клетое на альфа мотонейроны, происходит облегчение спиномозговых рефлексов; в) повышает тонус скелетных мышц – при этом путь заканчивается на гамма мотонейронах спинного мозга, их возбуждение приводит к сокращению интрафузальных мышц, происходит натяжение ядерной сумки, возбуждение рецепторов, усиливается поток импульсов по афферентному пути через задние корешки спинного мозга в альфа мотонейроны, при возбуждении которых увеличивается тонус мышц.
Функции продолговатого мозга. Классификация тонических рефлексов по Магнусу
Продолговатый мозг. Выполняет две функции: 1) рефлекторную и 2) проводниковую. Рефлекторная функция осуществляется благодаря: а) ядрам 8 пар черепномозговых нервов (VIII-XII); б) автоматическим центрам (дыхательный, сосудодвигательный, чихания, кашля, морганья, рвоты, пилорического); в) участие нейронов продолговатого мозга в тонических рефлексах (статические рефлексы). Тонические рефлексы обеспечивают регуляцию мышечного тонуса. Афферентные импульсы, вызывающие эти рефлексы приходят по вестибулярной ветви VIII пары черпномозговых нервов, по спиномозговым, проводящим импульсы от рецепторов мышц лица, шеи, конечностей и туловища. Все тонические рефлексы Магнус разделил на две группы: 1) статические – при раздражении рецепторов этого рефлекса обуславливают определеное положение тела в пространстве; 2) статокинетические – сохраняют равновесие тела в пространстве при его перемещении. Статические рефлексы в свою очередь можно разделить на две группы: 1) познотонические – обеспечивают определенную позу тела в пространстве; 2) установочные, или выпрямительные – обеспечивают возвращение тела из неестественного положения в нормальное (из горизонтального положения в положение стоя). Центр статических познотонических рефлексов находится в продолговатом мозге, а центр статических выпрямительных и статокинетических – в среднем мозге. Афферентны пути этих рефлексов начинаются с рецепторов вестибулярного аппарата (предверия улитки и полукружных канальцев), проприорецепторов мышц шеи и тактильных рецепторов кожи туловища сбоку. Значение проприорецепторов мышц шеи: при запрокидывании головы назад повышается тонус мышц разгибателей верхних конечностей и понижается тонус мышц разгибателей нижних конечностей; при нагибании головы к грудной клетке – ппонижается тонус мышц разгибателей верхних конечностей и повышается тонус мышц разгибателй нижних конечностей; при повороте головы влево – повышается тонус мышц разгибателей верхней кончности слева и повышается тонус мышц сгибателей справа; при повороте головы вправо – повышается тонус мышц разгибателей верхней кончности справа и повышается тонус мышц сгибателей слева. Выпрямительные рефлексы осуществляются в две фазы: 1) подъем головы – за счет раздражения рецепторов вестибулярного аппарата (предверия улитки) и кожной поверхности туловища; 2) выпрямление туловища – при раздражении проприорецепторов мышц шеи и кожной поверхности туловища. Статокинетические рефлексы осуществляются при вращательной пробе – при этом возникают вестибуломоторные, вестибуловегетативные и вестибулосенсорные рефлексы. Проводниковая функция продолговатого мозга – через него проходят все восходящие и нисходящие пути спинного мозга
Функции мозжечка.
Мозжечок выполняет функцию координации и регуляции произвольных и непроизвольных движений. Эти функции обеспечиваются множественными связями мозжечка со спинным мозгом и другими структурами головного мозга: 1) спиноцеребелярный путь – информирует мозжечок о тонусе скелетных мышц; 2) веточка от кортикоспинального пути несет информацию о необходимом тонусе скелетных мышц; 3) церебелоспинальный – этот путь корегирует необходимый тонус скелетных мышц в конкретной ситуации (путем сравнения сигналов от спиноцребелярного пути и кортикоспинального). 1-3 пути обеспечивают координацию тела в пространстве при осознанных движений; 4) двухсторонняя связь мозжечка с продолговатым и средним мозгом – этот путь обеспечивает координацию неосознанных движений; 5) двухсторонняя связ с гипоталамусом и таламусом – обеспечивает координацию сенсорных и вегетативных функций.
При экспериментальном одностороннем поражении мозжечка наблюдаются следующие симптомы: 1) манежные движения – животное движется по кругу; 2) штопорообразные движения – если лягушку опустить в воду она совершает штопорообразные движения. Оба симптома связаны с тем, что при одностороннем поражении мозжечка происходит ярко выраженная дистония – на стороне поражения усиливается тонус мышц сгибателей и исчезает тонус мышц разгибателей, а на здоровой стороне наоброт: повышается тонус мышц разгибателей и исчезает тонус мышц сгибателей. При двухстороннем поражении отмечается полная обездвиженность, животное самостоятельно не может передвигаться. В клинике отмечается частичное поражение мозжечка и различают следующие клинические симптомы: первые три симптома были описаны Лючиани и названы три а, так как все симптомы начинаются с буквы а: 1) астения – быстрая утомляемость мышц, так как при этом в двигательный акт вовлекаются «лишние» группы мышц за счет поражения 1-3 пути; 2) атония – отсутствие тонуса скелетных мышц, затем было установлено, что тонус мышц полностью не исчезает, а происходит нарушение тонуса (тонус одних мышц повышается, других понижается), поэтому првильнее этот симптом называть дистония; 3) астазия – утрачивается способность мышц к тетаническому сокращению – этот симптом проявляется в том, что при движении происходит качание различных частей тела; помимо вышеперечисленных симптомов наблюдаются 4) дизартрия – нарушение плавности речи; 5) дисметрия – нарушается соразмерность движения, как правило в сторону увеличения; 6) атаксия – нарушение координации движения, неуверенная походка; 7) эквилибристика – нарушение равновесия при ходьбе.
Функции ретикулярной формации мозга.
Ретикулярная формация мозга – представленная диффузным скоплением клеток разного вида и величины, разделенных множеством разнонаправленных волокон. Этот отдел так был назван Дейтерсом в 1885 году за характерную цитоархитектонику. РФ располагается в центральной части мозгового ствола (между таламусом и спинным мозгом). Название ретикулярной формации, или сетевой, оно получило благодаря сетевых связей почти со всеми стуктурами ЦНС.
Ретикулоспинальный путь относится к экстрапирамидной системе. Этот путь проводит импульсы от ретикулярной формации к различным нейронам спинного мозга. В зависмости от того в каких нейронах спинного мозга заканчивается этот путь различают следующие функции: а) торможение спиномозговых рефлексов – при этом путь заканчивается на клетках Реншоу, их возбуждение приводит к гиперполяризации альфа мотонейронов, что приводит к торможению; б) облегчение спиномозговых рефлексов – при этом путь заканчивается на тормозных интернейронах, их возбуждение приводит к торможению клеток Реншоу, поэтому снимается тормозной эффект этих клетое на альфа мотонейроны, происходит облегчение спиномозговых рефлексов; в) повышает тонус скелетных мышц – при этом путь заканчивается на гамма мотонейронах спинного мозга, их возбуждение приводит к сокращению интрафузальных мышц, происходит натяжение ядерной сумки, возбуждение рецепторов, усиливается поток импульсов по афферентному пути через задние корешки спинного мозга в альфа мотонейроны, при возбуждении которых увеличивается тонус мышц.
Восходящие пути от РФ: 1) ретикулокортикальные пути – от центра Мэгуна Моруции – повышает тонус нейронов КБП – бодрствующее состояние; 2) связь с гипоталамусом и лимбической системой (миндалевидный комплекс, гипокамп и поясная извилина) – этот путь обеспечивает целостную реакцию организма и регулирует вегетативные и гомеостатические функции организма.
Функции гипоталамуса.
Гипоталамус: серый бугор, мамилярные тела и серое вещество, образующее дно и стенки 3 желудочка. Обширная связь гипоталамуса с КБП, мозжечком, РФ, парсимпатическими ядрами продолговатого мозга, симпатическими ядрами спинного мозга, таламусом, гипофизом обеспечивает многообразие его функций, обеспечивающих 32 парами ядер, которые подразделены на пять групп: 1) ядра преоптической области; 2) передняя группа ядер; 3) наружняя группа ядер; 4) средняя группа ядер; 5) задняя группа ядер. К функциям гипоталамуса относится: 1) это высший центр АНС: задняя группа ядер повышает тонус симпатического отдела, а передняя группа ядер – тонус парасимпатического отдела (см. раздел АНС). Эти ядра принимают участие в формировании вегетативного компонента эмоций; 2) высший центр эндокринной функции – через систему либеринов и статинов регулирует выработку тропных гормонов, которые в свою очередь регулируют выработку горрмонов-эффекторов через эндокринные железы (см. раздел физиологии эндокринной системы). Либерины и статины участвуют в формировании эндокринного компонента эмоции; 3) участие в терморегуляции через центр терморегуляции, состоящий из двух отделов – центра теплоотдачи и центра теплопродукции (см. функциональную систему, обеспечивающую постоянство температуры тела); 4) участвует в регуляции сна и бодрствования. Здесь обнаружен центр Гесса, при возбуждении которого происходит торможение бодрствующего центра Мэгуна Моруции, что приводит к разлитому торможению КБП – возникновению сна; 5) участвует в регуляции пищеварения и формировании пищевой мотивации (см. физиологию пищеварения): раздражение наружних ядер (ц. голода) вызывает ощущение голода, раздражение вентромедиальных ядер (ц. насыщени) вызывает отказ от пищи; 6) за счет осморецепторов регулирует осмотическое давление крови через изменение диуреза (см. физиологию почек); 7) за счет гормонов-эффекторов вазопресина (антидиуретического) и окситацина участвует в регуляции диуреза, АД, сокращения матки и мышц альвеол молочной железы (окситацин); 8) является составной частью ЦНС, участвующей в формировании эмоций; 9) участвует в адаптационном поведении через различные биологические мотивации. Гипоталамус является пейцмеккером всех биологических мотиваций.
Нервная регуляция физиологических функций. Рефлекс. Особенности соматической и вегетативной дуги.
Регуляция, или управление – это такие воздействия на систему, при которых система переходит из одного уровня функционирования на другой – заранее предусмотренный. Все воздействия на систему можно разделить на два вида:1) задающие сигналы – это такие воздействия, при которых система переходит на заданный уровень функционирования; 2) возмущающие сигналы – это такие воздействия, при которых происходит отклонение от заданного уровня функционирования (фактический уровень функционирования), их количество зависит от обстановки, в которой находится человек. Возмущающие сигналы отклоняют работу эффектора от заданного уровня, поэтому фактический результат работы эффектора всегда отличается от заданного. Отклонение фактического результата от заданного называется рассогласованием: чем меньше рассогласование, тем оптимальнее процессы регуляции.
Нервная регуляция - при этом воздействия на рабочий орган осуществляются через нервную систему, за счет рефлекса. Рефлекс – это ответная реакция организма при обязательном участии ЦНС. Рефлекс в переводе с латинского языка означает «отражение». Впервые термин «отражение» был применен Р.Декартом (1595 – 1650) для характеристики реакций организма в ответ на раздражение органов чувств. Материальной субстанцией, или структурной основой любого рефлекса является рефлекторная дуга – совокупность морфологических структур, которая обеспечивает осуществление рефлекса. Различают два вида рефлекторной дуги:
- соматическая, обеспечивающая ответную реакцию скелетных мышц в ответ на раздражение;
- вегетативная, обеспечивающая ответную реакцию внутренних органов и сосудов в ответ на раздражение.
Отмечаются некоторые особенности вегетативной рефлекторной дуги по сравнению с соматической: а) отростки афферентных нейронов в соматической рефлекторной дуге заканчиваются на альфа-мотонейронах в передних рогах спинного мозга, а в вегетативной – на вегетативных нейронах в боковых рогах спинного мозга; б) эфферентный путь в соматической рефлекторной дуге однонейронный, а в вегетативной – двухнейронный (преганглионарное волокно и постганглионарное); в) рабочий орган в соматической рефлекторной дуге скелетные мышцы, а в вегетативной – внутренние органы и сосуды.
Звенья рефлекторной дуги, их роль
Любая рефлекторная дуга состоит из пяти основных звеньев, выключение каждого из которых приводит к исчезновению рефлекса:
1) рецептор – звено, которое воспринимает раздражение и преобразует энергию раздражения в нервный импульс. Таким образом, можно сказать, что рецептор выполняет функцию переводчика: переводит сигналы раздражения в сигналы, понятные для ЦНС (нервный импульс);
2) афферентный нервный путь – передает нервный импульс от рецептора в ЦНС;
3) нервный центр – здесь происходит анализ полученных сигналов в результате чего изменяется работа необходимого эффектора. Следует отметить, что нервный центр может иметь несколько вставочных нейронов, где происходит задержка импульса для анализа. Чем сложнее рефлекс, тем больше вставочных нейронов содержится в нервном центре;
4) эфферентный нервный путь – обеспечивает переход сигнала от ЦНС к рабочему органу (эффектору). Эфферентный путь вегетативного рефлекторного пути прерывается в ганглии и состоит из пре- и постганглионарных волокон;
5) эффектор (рабочий орган). Таким образом, соматический и вегетативный рефлекторный путь состоит из 5 звеньев: рецептора, афферентного пути, вставочного нейрона, эфферентного пути и эффектора (рабочего органа) Из вышеизложенного следует, что при выключении любого звена будет отсутствовать результат (ответная реакция), хотя причины отсутствия результата будут разными, так как каждое звено выполняет только ей присущую функцию.
Регуляция по возмущению (предупредительная) и по отклонению (компенсаторная)
Гуморальная регуляция. Звенья гуморальной регуляции.
Гуморальная регуляция – это воздействия на органы и системы через жидкости (Humor) организма при действии на специфические рецепторы гормонов или биологически активные вещества (БАВ). Гормоны и БАВ могут выделяться в общее русло крови, но их конечный эффект определяется наличием в соответствующем органе специфических рецепторов. Таким образом, гуморальная регуляция осуществляется по принципу сигнала «SOS», то есть гормоны или БАВ проходят через все ткани, а реагируют только те из них, которые имеют специфические рецепторы. Отмечается ряд особенностей гуморальной и нервной регуляции. При нервной регуляции импульсы от рецептора по афферентным путям поступают в ЦНС, откуда по эфферентным путям идут к эффектору. Нервная регуляция осуществляется на базе рефлексов. При гуморальной регуляции импульсы от рецептора по афферентным путям поступают в ЦНС. При этом происходит возбуждение гипоталамуса, в результате чего выделяются либерины или статины, которые по автономному гипоталамо-гипофизарному тракту поступают в переднюю долю гипофиза – аденогипофиз. Здесь либо усиливается выделение соответствующего тропного гормона (при действии либеринов), либо – уменьшается (при действии статинов). Тропные гормоны гипофиза через кровь влияют на соответствующие эндокринные железы, которые выделяют гормон-эффектор, влияющие через кровь на функцию эффектора. Таким образом, при гуморальной регуляции в процесс включаются несколько промежуточных эффекторов (гипоталамус, гипофиз, эндокринные железы), поэтому скорость гуморальной регуляции намного меньше скорости нервной регуляции.
Отличия нервной и гуморальной регуляции
Нервная регуляции функций отличается от гуморальной: 1) филогенетическое отличие – в процессе развития организма вначале возникает гуморальная регуляция, а затем на базе гуморальной возникает нервная регуляция; 2) пути, по которым осуществляются эти виды регуляций – при гуморальной регуляции – это сосуды, а при нервной - это нервы; 3) по скорости – при гуморальной регуляции максимальная скорость может быть 0,5 м/с, а при нервной – скорость может достигать 120 м/с. В связи с этим нервная регуляци – это срочный вид регуляции, а гуморальный – поддерживающий вид регуляции; 4) по источнику воздействия – при нервной регуляции – это нервный импульс, а при гуморальной – гормоны и БАВ; 5) по точности регуляции – нервная регуляция – это точный вид регуляции, так как импульс от ЦНС доходит до конкретного органа. Гуморальная регуляция не имеет точного адресата, так как гормоны или БАВ поступают в кровь и разносятся по всем органам и тканям. Этот вид регуляции осуществляется по механизму сигнала «SOS».
ФУС, его звенья
ФУС – это динамическая организация деятельность которой направлена на совершение какого-либо конечного полезного приспособительного результата (КППР). Динамическая организация, так как количество эффекторов, участвующих в той или иной ФУС постоянно меняется, а если КППР в пределах нормы, то ФУС не функционирует. Функциональных систем в организме много, каждая из которых отвечает за какой-то полезный результат. Например, ФУС, обеспечивающая постоянство газов крови, отвечает за оптимальное содержание кислорода и углекислого газа в крови. Любая ФУС по мнению П.К. Анохина состоит из следующих компонентов:
1) конечный полезный приспособительный результат (КППР) – это ведущее звено ФУС, так как от степени отклонения конечного результата зависит формирование ФУС. Любой КППР (артериальное давление, температура тела, газы крови и т. д.) находится в организме на каком-то оптимальном уровне. При отклонении КППР от оптимального уровня (в сторону увеличения или уменьшения), начинает формироваться ФУС, работа которого направлена на возвращение КППР к оптимальному уровню;
2) специфические рецепторы – для каждого КППР имеются специфические рецепторы, которые начинают возбуждаться при отклонении КППР от оптимального уровня;
3) афферентный путь по которому идут сигналы в ЦНС, свидетельствующие об отклонении КППР от оптимального уровня. Различают афферентный нервный путь от специфических рецепторов к ЦНС) и гуморальный афферентный путь - непосредственное изменение КППР воздействует на ЦНС током крови;
4) ЦНС, который включает три уровня: а) специфический центр, который возбуждается при изменении какого-либо показателя; б) гипоталамус, который является высшим центром всех вегетативных и эндокринных функций; в) кора больших полушарий, при возбуждении которого включается внешнее звено ФУС – целенаправленное поведение, направленное на конкретный результат;
5) эффекторы - рабочие органы. Заметим, что в ФУС, в отличии от рефлекторной дуги, несколько эффекторов. Количество эффекторов в ФУС зависит от степени отклонения КППР от оптимального уровня и постоянно изменяется (в связи с этим ФУС – это динамическая организация, так как количество эффекторов в ней постоянно меняется). От специфического центра и гипоталамуса по эфферентным путям импульсы поступают на эффекторы, работа которых изменяет данный КППР. При вовлечении в процесс гипоталамуса параллельно с нервными импульсами включается гуморальное звено воздействия на эффекторы через изменение функций эндокринных желез;
6) поведение – это внешнее звено ФУС. Это звено включается в работу после того, как все эффекторы, входящие в данную ФУС, задействованы, но КППР не возвращается к оптимальному уровню. Таким образом, внешнее звено ФУС начинает функционировать после исчерпания внутренних резервов организма. Первый признак исчерпания внутренних резервов – это появление отрицательных эмоций. С этого момента начинает включаться в работу ФУС высший уровень ЦНС – кора больших полушарий, возникает система осознанных двигательных актов, которая проявляется в том или ином поведении. При этом поведение направлено на удовлетворение внутренней потребности организма. Поведение будет меняться один за другим пока КППР не восстановится до оптимальной величины.
Звенья центрального блока ФУС
Центральный блок любой ФУС состоит из следующих звеньев: I. Афферентного синтеза (АС), где объединяются сигналы нескольких порядков: а) пусковой сигнал, который поступает от специфического рецептора и свидетельствует об отклонении КППР; б) обстановочные сигналы, которые несут информацию об обстановке в которой находится объект через соответствующие рецепторы; в) сигналы из блока памяти; г) сигналы из доминирующего очага возбуждения. При объединении вышеизложенных сигналов АС отвечает на следующие вопросы: 1) что делать? При объединении пускового и обстановочных сигналов; 2) как делать? При объединении пускового, обстановочных сигналов и поступающих из блока памяти; 3) когда делать? При объединении пускового, обстановочных сигналов, поступающих из блока памяти и доминирующего очага возбуждения; II. Принятия решения (ПР); III. Программы действия (ПД), то есть какие эффекторы и в каком режиме должны функционировать, чтобы вернуть КППР на оптимальный уровень; IV. При реализации ПД формируется четвертый блок – акцептор результатов действия (АРД) – этот блок П.К. Анохин назвал аппаратом будущего предвидения. В этом блоке отражены параметры будущего функционирования эффекторов, то есть какими должны быть параметры функционирования эффекторов. При изменении функции эффекторов сигналы об их фактическом результате по обратной связи поступают в АРД. В этом блоке происходит сравнение заданного результата с фактическим, поступающим по обратной связи. Если фактический результат не совпадает с заданным импульсы от АРД идут в ПД и при этом происходит изменение уже функционирующих эффекторов.
Роль АС и АРД. Значение обратной связи в работе ФУС
Афферентного синтеза (АС) это первое звено центрального блока любой ФУС, где объединяются сигналы нескольких порядков: а) пусковой сигнал, который поступает от специфического рецептора и свидетельствует об отклонении КППР; б) обстановочные сигналы, которые несут информацию об обстановке в которой находится объект через соответствующие рецепторы; в) сигналы из блока памяти; г) сигналы из доминирующего очага возбуждения. При объединении вышеизложенных сигналов АС отвечает на следующие вопросы: 1) что делать? При объединении пускового и обстановочных сигналов; 2) как делать? При объединении пускового, обстановочных сигналов и поступающих из блока памяти; 3) когда делать? При объединении пускового, обстановочных сигналов, поступающих из блока памяти и доминирующего очага возбуждения.
Акцептор результатов действия (АРД) – это звено центральной части ФУС, который формируется при реализации программы действия. Это звено П.К. Анохин назвал аппаратом будущего предвидения. В этом звене отражены параметры будущего функционирования эффекторов, то есть какими должны быть параметры функционирования эффекторов. При изменении функции эффекторов сигналы об их фактическом результате по обратной связи поступают в АРД. В этом блоке происходит сравнение заданного результата с фактическим, поступающим по обратной связи. Если фактический результат не совпадает с заданным импульсы от АРД идут в ПД и при этом происходит изменение уже функционирующих эффекторов. Значение обратной связи заключается в том, что сигналы по этой связи поступают в АРД и информируют о фактическом результате работы эффекторов (в АРД заложены параметры работы эффекторов, которые должны быть).
ССС
Электрокардиограмма, зубцы, интервалы и сегменты
Электрокардиограмма – ЭКГ - это запись мембранного потенциала действия сердца, возникающих при возбуждении миокарда.

На ЭКГ различают 5 зубцов: P, Q, R, S, T, 4 интервала: P-Q, QRS, Q-T , R-R и три сегмента: P-Q, S-T, T-P. Зубец P отражает возбуждение в обеих предсердиях, зубец Q – начало возбуждения (деполяризация) в желудочках, конец зубца S отражает, что возбуждение охвачено всеми волокнами миокарда желудочков сердца, зубец Т отражает процесс спада возбуждения в желудочках (реполяризация). Амплитуда зубцов отражают изменение возбудимости миокарда. Интервалы отражают изменение проводимости миокарда – чем короче интервал, тем больше проводимость. Интервал P-Q (3) отражает время необходимое для проведения импульсов от СА к желудочкам сердца, его величина от 0,12 до 0,18с. Интервал QRS (4) отражает время необходимое для охвата процессом возбуждения всех волокон миокарда, его величина от 0,07 до 0,09с. Интервал Q-T (7) отражает время в течении которого отмечается процесс возбуждения в желудочках сердца (электрическая систола), его величина от 0,37 до 0,41с. Интервал R-R (9) отражает время продолжительности одного сердечного цикла, его величина от 0,8 до 1,0с. Зная величину R-R, можно определить частоту сердечных сокращений (ЧСС). Для этого необходимо 60 разделить на длительность интервала R-R. Сегмент – это часть интервала, который находится на изоэлектрической линии ЭКГ (эта линия показывает, что в это время не регистрируется МПД). Сегмент P-Q (2) отражает время атриовентрикулярной задержки. При этом МПД не регистрируется, так как возбуждение в предсердиях закончилось, а в желудочках не началось и миокард находится в состоянии покоя (МПД отсутствует). Сегмент S-T (5) отражает время в течении которого все волокна миокарда находятся в состоянии возбуждения, поэтому МПД не регистрируется, так как регистрация ЭКГ происходит внеклеточным способом. Сегмент T-P (8) отражает время в течении которого нет возбуждения в желудочках и предсердиях, время от конца возбуждения в желудочках до начала возбуждения в предсердиях (общая пауза). На ЭКГ можно определить продолжительность возбуждения в предсердиях (1), или электрическая систола предсердий (от начала зубца Р до конца зубца Р), продолжительность диастолы предсердий (от конца зубца Р до начала следующего зубца Р - 10), продолжительность возбуждения в желудочках, или электрическая систола (от начала зубца Q до конца Т), продолжительность диастолы желудочков (от конца T до начала Q - 11)
Отведения ЭКГ. Понятие о треугольнике Эйнтховена.
Регистрация ЭКГ осуществляется в 12 отведениях.

Рис.55 Стандартные и однополюсные отведения ЭКГ от конечностей.
А – три стандартные отведения от конечностей, которые обозначаются римскими цифрами: I стандартное отведение, при котором потенциал действия регистрируется между правой и левой руками; II стандартное отведение – между правой рукой и левой ногой; III стандартное отведение – между левой рукой и левой ногой. Б– три однополюсные отведение, предложенные Вильсоном: aVR, при котором потенциал регистрируется только с правой руки; aVL – потенциал регистрируется только с левой руки; aVF – потенциал регистрируется только с левой ноги. В. Шесть однополюсных отведений от грудной клетки: V1, при котором потенциал действия регистрируется с четвертого межреберья по правому краю грудины; V2 – с четвертого межреберья по левому краю грудины; V3 – по середине между V2 и V4; V4 – с пятого межреберья по среднеключичной линии; V5 – с пятого межреберья по передней подмышечной линии; V6 – с пятого межреберья по средней подмышечной линии. При этом I, aVR, V1, V2 отражают процессы, происходящие в правой половине сердца, a III, aVL, V5, V6 отражают процессы, происходящие в левой половине сердца.
Треугольник Эйнтховена образуется путем соединения точек регистрации стандартных отведений ЭКГ. При этом стороны треугольника соответствуют стандартным отведениям. При помощи треугольника Эйнтховена можно определить относительную величину вольтажа зубцов, которая связана с направлением электрической оси сердца, зависимая от позиции сердца в грудной клетке.
Электрическая ось и позиции сердца, способы определения при помощи треугольника Эйнтховена.
Электрическая ось сердца – это условная линия, проходящая через возбужденный миокард таким образом, что по обе стороны этой линии находятся приблизительно одинаковое количество разноименных зарядов (положи-тельных и отрицательных). Направление электрической оси сердца измеряется в градусах и зависит от позиции сердца в грудной клетке, гипертрофии миокарда правого и левого желудочков. Различают следующие позиции сердца в грудной клетке: горизонтальная позиция, когда направление электрической оси от 0 град. до +39 град.; промежуточная – направление электрической оси от +40 град. до +69 град.; вертикальная позиция сердца – направление электрической оси от +70 град. до +90 град. При умеренной гипертрофии правого желудочка направление электрической оси соответствует до -30 град, а при умеренной гиперторофии левого желудочка – до +120 град. Электрическую ось сердца можно определить при помощи I и III стандартном отведении ЭКГ с использованием треугольника Эйнтховена. Треугольник Эйнтховена образуется путем соединения точек регистрации стандартных отведений ЭКГ. При этом стороны треугольника соответствуют стандартным отведениям. При помощи треугольника Эйнтховена можно определить относительную величину вольтажа зубцов, которая связана с направлением электрической оси сердца, зависимая от позиции сердца в грудной клетке. Для определения направления электрической оси сердца определяют алгебраическую сумму амплитуды зубцов R и S (мм) в I и III стандартном отведениях. Полученную сумму R1 и S1 откладываем на стороне треугольника, соответствующего I стандартному отведению, а сумму RIII и SIII на стороне треугольника, соответствующего III стандартному отведению. Из полученных точек опускаем перпендикуляр до их пересечения. Затем соединяем центр треугольника с полученной точкой за счет перекреста двух перпендикуляров – это и будет направление электрической оси сердца.
Современные представления о субстрате, природе и градиенте автоматизма.
Проводящая система обеспечивает автоматизм сердца – это способность спонтанно активироваться, то есть создавать электрические импульсы без помощи нервной стимуляции. Анатомическим субстратом автоматизма является мало дифференцированные мышечные клетки, из которых состоят элементы проводящей системы сердца. Особенностью проводящей системы сердца является способность каждой клетки самостоятельно генерировать возбуждение.
Природа автоматизма – электрическая. Во время диастолы желудочков в клетках СА узла возникает медленная деполяризация (медленная диастолическая деполяризация – МДД) за счет открытия медленных натриевых каналов. При достижении МДД критического уровня деполяризации (-60 мв) происходит быстрая деполяризация до нулевого уровня – это и есть импульс в ответ на который миокард сокращается. После чего начинается реполяризация длительность которой совпадает с длительностью систолы желудочков. Таким образом, продолжительность от начала МДД до пика МПД соответствует диастоле желудочков. От пика МПД до начала следующего МДД соответствует систоле желудочков. МПД в СА узле отличается от МПД в АV узле только различной скоростью МДД: скорость МДД в СА больше, чем скорость МДД в АV), поэтому автоматизм СА узла значительно (в 1,5-2 раза) выше, чем автоматизм в АV. У здорового человека с учетом влияния на сердце блуждающего нерва в СА узле в 1мин возникает 60-80 имп/мин, а в АV узле – 40-45 имп/мин. При возникновении импульсов в СА в нижележащих отделах проводящей системы (АV-узел, пучек Гисса, ножки Гисса, волокна Пуркенье) импульсы не возникают – они проводят до миокарда желудочков импульсы, возникающие в СА узле. Таким образом, самая большая скорость МДД в клетках СА. Чем дальше от СА и ближе к волокнам Пуркинье тем меньше скорость МДД. Самой большой способностью к автоматии обладают клетки СА и наименьшей автоматией обладают волокна Пуркинье – это явление называется градиент автоматизма.
Способность к автоматизму различных отделов проводящей системы изучалось Станиусом при помощи наложения лигатур.
Первая лигатура ( I ) накладывалась таким образом, что венозный синус (VS) сердца лягушки отделялся от (AV). После наложения первой лигатуры венозный синус сокращался в прежнем ритме (55-60 раз в минуту), а предсердия и желудочки, после временной остановки, возобновили свои сокращения, но в меньшем ритме (30-35 раз в минуту). Результаты опыта после первой лигатуры свидетельствуют о том, что, во-первых, венозный синус (или СА у человека и млекопитающих) обладает большей автоматией, чем AV. Во-вторых, временная остановка предсердий и желудочков свидетельствуют о том, что при генерации импульсов в VS в нижележащих отделах проводящей системы импульсы не генерируются, они лишь проводят те импульсы, которые возникли в VS.
Вторая лигатура (II) накладывалась между предсердиями и AV. После наложения второй лигатуры предсердия не сокращаются, так как к ним не подходят импульсы из венозного синуса (за счет первой лигатуры) и от AV (за счет второй лигатуры). Венозный синус и желудочки сердца продолжают сокращаться в прежнем ритме (соответственно – 55-60 и 30-35раз в минуту).
Третья лигатура накладывалась в область верхушки сердца, после этой лигатуры верхушка сердца не сокращалась, что свидетельствует о том, что верхушка сердца не обладает автоматизмом. Таким образом, остановка предсердий после второй лигатуры и верхушки сердца после третьей лигатуры свидетельствует о том, что рабочий миокард не обладает автоматизмом, этим свойством обладают лишь клетки проводящей системы сердца.
Проводящая система сердца и ее отделы. Пучки Бахмана, Венкебаха и Тореля.
Проводящая система сердца включает следующие элементы:
1) синоатриальный узел (СА), который находится между синусом (место впадения полых вен в правое предсердие) и правым предсердием. Существуют два вида клеток СА – водителя ритма или пейсмекерные (Р-клетки) и проводниковые (Т-клетки). Р-клетки генерируют электрические импульсы, а Т-клетки выполняют функцию проводников. Р-клетки связываются между собой и с Т-клетками. Этот узел обладает наибольшей автоматией;
2) атриовентрикулярный узел (АВ) – находится справа от межпредсердной перегородки над местом прикрепления створки, непосредственно рядом с устьем коронарного синуса трехстворчатого клапана. АВ также содержит два вида клеток – Р и Т. Автоматизм этого узла в 1,5 раза меньше чем автоматизм СА. СА связан с АВ тремя межузловыми пучками: а) передний межузловой пучок – начинается от СА и на уровне межпредсердной перегородки делится на две веточки одна из которых доходит до левого предсердия (пучок Бахмана), другая – к АВ; б) средний межузловой пучок (пучок Венкебаха) начинается от СА, проходит позади верхней полой вены, спускается вниз по задней части межпредсердной перегородки и достигает АВ; в) задний межузловой пучок ( пучок Тореля) отходит от СА, идет вниз и кзади;
3) пучок Гиса – начинается в нижней части АВ и в области межжелудочковой перегородки делится на две ножки;
4) правая ножка пучка Гиса – длинный тонкий пучок, который в дистальной части выходит из межжелудочковой перегородки и достигает передней сосочковой мышцы правого желудочка, где разветвляется и связывается с волокнами Пуркинье;
5) левая ножка пучка Гиса, которая делится на две ветви – переднюю и заднюю. Передняя ветвь достигает основания передней сосочковой мышцы и разветвляется в передне-верхней части левого желудочка. Задняя ветвь достигает основания задней сосочковой мышцы.
6) волокна сети Пуркинье – конечные разветвления правой и левой ножек пучка Гиса связываются анастамозами с обширной сетью клеток Пуркинье. Клетки Пуркинье представляют собой видоизмененные клетки миокарда, которые непосредственно связываются с сократительным миокардом желудочков.
Проводимость миокарда и проводящей системы сердца различна: по миокарду предсердий – 0,8 – 1,0 м/с, по миокарду желудочков – 0,8 – 0,9 м/с, по проводящей системы сердца 4,5 – 5,0 м/с. В небольшом участке АВ скорость распространения возбуждения резко уменьшается и достигает 0,02 – 0,04 м/с. Благодаря этому осуществляется задержка проведения возбуждения от предсердий к желудочкам – атриовентрикулярная задержка. Она обеспечивает координацию (последовательность) сокращения предсердий и желудочков и позволяет предсердиям нагнетать дополнительную порцию крови в полость желудочков до начала их сокращения.
МПД кардиомиоцитов и его фазы
На МПД кардиомиоцита различаю деполяризацию, раннюю, или быструю реполяризацию, плато и позднюю, или медленную реполяризацию. Следует отметить на высокий уровень МПП сердечной мышцы - -90мв. В кардиомиоцитах имеются быстрые натриевые каналы (как и в скелетных мышцах), открытие которых способствуют быстрой деполяризации (1 фаза МПД) и медленные натрий-кальциевые каналы. При открытии этих каналов (открытие происходит при изменении МПП до –40мв) в миокардиоцит начинают входить ионы натрия и кальция. Это пораждает достижение пика МПД – деполяризацию с явлением овершута. Процесс реполяризации осуществляется в три приема: 1) происходит ранняя, или быстрая реполляризация – она обусловлена заходом в клетку ионов хлора; 2) период «плато» за счет входа в клетку ионов натрия и кальция по медленным натрий-кальциевым каналам. Одновременно в этот период открываются калиевые каналы и катионы калия начинают выходить из клетки – число входящих в клетку катионов кальция и натрия соответствует числу выходящих ионов калия, в результате чего мембранный потенциал «застывает» на месте – возникает плато МПД; 3) поздняя, или медленная реполяризация при этом поток выходящих катионов калия становится заметно сильнее, чем поток входящих ионов натрия и кальция, так как медленные натрий-кальциевые каналы закрываются. Во время быстрой деполяризации, ранней реполяризации и «плато» происходит инактивация быстрых натриевых каналов, поэтому в эти фазы МПД мышца находится в фазе абсолютной рефрактерности и не способна реагировать на раздражение. Длительность МПД миокардиоцита желудочков достигает 330 мс.: 270 мс приходится на абсолютный рефрактерный период, 30 мс. – на относительный рефрактерный период и 30 мс – на супернормальный период возбудимости. Наличие такой длительной абсолютной рефрактерной фазы чрезвычайно важно – благодаря этому сердечная мышца не способна к тетаническому сокращению. В скелетных мышцах длительность абсолютной рефрактерной фазы очень незначительна и в 20 раз меньше, чем в кардиомиоците.
Экстраситола и компенсаторная пауза, условия для их возникновения. Сердечный блок и его стадии.
Экстрасистола, или внеочередная систола, возникает при следующих условиях:
1) необходимо наличие дополнительного источника раздражения (в организме человека этот дополнительный источник называется эктопическим очагом и возникает при различных патологических процессах);
2) экстрасистола возникает лишь в том случае, если дополнительный раздражитель попадает в относительную или супернормальную фазу возбудимости.
Систола желудочков и первая треть диастолы относится к абсолютной рефрактерной фазе, поэтому экстрасистола возникает, если дополнительный раздражитель попадает во вторую треть диастолы. После желудочковой экстрасистолы возникает удлиненная диастола, или компенсаторная пауза. Причина компенсаторной паузы в том, что очередной импульс из СА узла попадает в абсолютную фазу возбудимости миокарда (приходится на экстрасистолу) и диастола продолжается до следующего импульса, при этом пропускается один сердечный цикл.
В клинике отмечается нарушение проведения импульсов от СА к миокарду. При этом различают три стадии сердечного блока:
1 стадия - отмечается удлинение интервала PQ, т.е. нарушается проведение импульсов от СА к АВ. В норме это время соответствует 0,12-0,18с, у спортсменов до 0,2-0,22с. Более 0,18с (у спортсменов более 0,22с) отмечается при нарушении проводимости;
2 стадия – с каждым последующим сердечным циклом происходит удлинение интервала PQ и затем пропускается целый сердечный цикл. При этом выпадение сердечного цикла может наступить либо через 2 (бигиминия), либо через 3 (тригиминия) сердечных цикла.
3 стадия – полный сердечный блок, при этом импульсы от СА не проходят через АВ, поэтому предсердия сокращаются под влиянием импульсов от СА (60-80 ударов), а желудочки – под влиянием импульсов от АВ (40-45 ударов).
Систолический и минутный объем крови. Сердечный и ситолический индексы.
Сердце – это полый мышечный орган, выполняющий функцию насоса по нагнетанию крови в магистральные сосуды (аорту и легочную артерию). Эта функция выполняется во время сокращения желудочков (систолы). За одну минуту у взрослого человека выбрасывается из каждого желудочка в среднем 4,5-5 л крови – этот показатель называется минутным объемом крови (МОК). В расчете на единицу поверхности тела за 1 мин. сердце взрослого человека выбрасывает в каждый круг 3 л/м2. Этот показатель называется сердечный индекс (количество крови, выбрасываемое желудочками сердца за одну минуту, отнесенную на единицу поверхности). Помимо нагнетательной функции сердце выполняет резервуарную функцию – в период расслабления (диастолы) желудочков в нем накапливается очередная порция крови. Максимальный объем крови перед началом систолы желудочков составляет 140-180мл. Этот объем называется «конечно-диастолическим». В период систолы из желудочков выбрасывается по 60-80 мл крови. Этот объем называется систолический объем крови (СОК). После изгнания крови из желудочков во время систолы в желудочках остается по 70-80 мл (конечно-систолический объем крови). Конечно-систолический объем крови принято делить на два отдельных объема: остаточный объем и резервный.
Остаточный объем – это объем, который остается в желудочках после максимально сильного сокращения. Резервный объем – это объем крови, который выбрасывается из желудочков при его максимально сильном сокращении в дополнение к систолическому объему в условиях покоя. СОК в литературе часто называют «ударным объемом» или «сердечным выбросом». Этот показатель, отнесенный к единице поверхности, называется систолическим индексом. В норме у взрослого человека этот показатель равен 41 мл/м2. СОК у новорожденного составляет 3-4 мл, а ЧСС 140 уд/мин, следовательно, МОК – 500 мл. СОК и МОК – это основные показатели гемодинамики. Наиболее точный способ определения МОК – это способ Фика. Для этой цели необходимо определить количество потребляемого кислорода в 1 минуту (в норме 400 мл/мин) и артерио-венозную разницу по кислороду (в номе в артериальной крови 200 мл/л, а в венозной крови – 120 мл/л). В состоянии покоя артерио-венозная разница по кислороду составляет 80 мл/л, то есть, если через ткани протекает 1 литр крови, то потребление кислорода составляет 80 мл. В одну минуту ткани организма потребляют 400 мл. Составляем пропорцию и находим: 400млх1л/80мл =5л. Зная МОК и ЧСС, можно определить СОК: СОК= МОК/ЧСС.
Краткая характеристика свойств миокарда
Миокард обладает четырьмя свойствами: 1) возбудимостью, 2) проводимостью, 3) сократимостью, 4) автоматизмом.
Возбудимость – это способность миокарда в ответ на раздражение проявлять свою специфическую функцию. Возбудимость миокарда отличается от возбудимости скелетной мышцы. Это отличие обусловлено из-за разности МПД в скелетной мышце и миокарде. Абсолютрная реырактерная фаза возбудимости (полное отсутствие возбудимости) в скелетной мышце соответствует длительности периода деполяризации пика МПД (очень короткий период). В сердечной мышце абсолютный рефрактерный период соответствует трем фазам: быстрой деполяризации, ранней реполяризации и «плато». В это время происходит инактивация быстрых натриевых каналов, поэтому миокард не способен реагировать на раздражение. Длительность этих фаз (или абсолютного рефрактерного периода возбудимости) 270 мс (в 20 раз больше длительности этого периода в скелетной мышце. Наличие такой длительной абсолютной рефрактерной фазы чрезвычайно важно – благодаря этому сердечная мышца не способна к тетаническому сокращению. В скелетных мышцах за счет короткой абсолютной рефрактерной фазы отмечается зубчатый и гладкий тетанус.
Проводимость миокарда и проводящей системы сердца различна: по миокарду предсердий – 0,8 – 1,0 м/с, по миокарду желудочков – 0,8 – 0,9 м/с, по проводящей системы сердца 4,5 – 5,0 м/с. В небольшом участке АВ скорость распространения возбуждения резко уменьшается и достигает 0,02 – 0,04 м/с. Благодаря этому осуществляется задержка проведения возбуждения от предсердий к желудочкам – атриовентрикулярная задержка. Она обеспечивает координацию (последовательность) сокращения предсердий и желудочков и позволяет предсердиям нагнетать дополнительную порцию крови в полость желудочков до начала их сокращения.
Сократимость сердечной мышцы сердечной мышцы отличается от сократимости скелетной мышцы тем, что миокард сокращается по закону по закону «все или ничего», а скелетные мышцы – по закону силы, то есть чем больше сила раздражителя, тем больше ответная реакция. Эта особенность связана с тем, что мышечное волокно скелетных мышц состоит из множества миофибрил, каждая из которых отделена друг от друга и обладает своей возбудимостью. При действии порогового раздражителя реагируют миофибрилы с наибольшей возбудимостью. С увеличением силы раздражителя увеличивается количество миофибрил, участвующих в сокращении, что приводит к увеличению ответной реакции. Закон «все или ничего» характерна для миокарда, кардиомиоциты которого соединены друг с другом при помощи нексусов. При определенной силе раздражителя все кардиомиоциты возбуждаются и происходит максимальная реакция (все). На предыдущие силы раздражителя миокард не реагирует (ничего).
Автомаитизм – это способность органа и ткани возбуждаться под влиянием импульсов, возникающих в самом органе или ткани. Автоматизм сердца обеспечивается наличием проводящей системы. Анатомическим субстратом автоматизма является мало дифференцированные мышечные клетки, из которых состоят элементы проводящей системы сердца. Особенностью проводящей системы сердца является способность каждой клетки самостоятельно генерировать возбуждение.
Природа автоматизма – электрическая. Во время диастолы желудочков в клетках СА узла возникает медленная деполяризация (медленная диастолическая деполяризация – МДД) за счет открытия медленных натриевых каналов. При достижении МДД критического уровня деполяризации (-60 мв) происходит быстрая деполяризация до нулевого уровня – это и есть импульс в ответ на который миокард сокращается. После чего начинается реполяризация длительность которой совпадает с длительностью систолы желудочков.
Особенность возбудимости миокарда и скелетной мышцы
Особенность возбудимости скелетной мышцы и сердечной зависит от МПД в скелетной и сердечной мышцы. Абсолютрная реырактерная фаза возбудимости (полное отсутствие возбудимости) в скелетной мышце соответствует длительности периода деполяризации пика МПД (очень короткий период). В сердечной мышце абсолютный рефрактерный период соответствует трем фазам: быстрой деполяризации, ранней реполяризации и «плато». В это время происходит инактивация быстрых натриевых каналов, поэтому миокард не способен реагировать на раздражение. Длительность этих фаз (или абсолютного рефрактерного периода возбудимости) 270 мс (в 20 раз больше длительности этого периода в скелетной мышце. Наличие такой длительной абсолютной рефрактерной фазы чрезвычайно важно – благодаря этому сердечная мышца не способна к тетаническому сокращению. В скелетных мышцах за счет короткой абсолютной рефрактерной фазы отмечается зубчатый и гладкий тетанус.
Систола желудочков: фазы и периоды, состояние клапанов
Циклом сердечной деятельности называется период от начала одной систолы до начала следующей. В норме сердечный цикл длится 0,8 – 1,0 с. При тахикардии (учащении сердечной деятельности) длительность кардиоцикла уменьшается, при брадикардии (урежении сердечной деятельности) – увеличивается. Сердечный цикл состоит из нескольких фаз и периодов. Систола желудочков длится 0,33 с. и состоит из двух фаз и четырех периодов. Фаза напряжения – в эту фазу происходит подготовка желудочков к полезной основной работе по изгнанию крови в магистральные сосуды. Длительность этой фазы составляет 0,07 - 0,08 с. и состоит из двух периодов: 1) период асинхронного сокращения. В этот период происходит асинхронное (неодновременное) сокращение различных частей миокарда желудочков, при этом форма изменяется, а давление в желудочках не увеличивается. В этот период происходит охват возбуждением всего миокарда желудочков. Длительность этого периода составляет 0,04 - 0,05с. В этот период створчатые клапаны открыты, а полулунные – закрыты; 2) период изометрического сокращения - начинается с момента закрытия створчатых клапанов, но полулунные клапаны еще не открылись и сокращение миокарда происходит при замкнутых полостях желудочков и длина мышечных волокон при этом не меняется, но увеличивается их напряжение. Длительность этой фазы составляет 0,02-0,03 с. В результате сокращения в замкнутых полостях в этот период происходит повышение давления и когда в левом желудочке становится равным 70-80 мм.рт.ст., а в правом – 12-15 мм.рт.ст. происходит открытие полулунных клапанов аорты и легочной артерии. С этого момента наступает вторая фаза – изгнание крови, ее длительность составляет 0,26 - 0,29 с. и состоит из двух периодов – период быстрого изгнания (0,12с). В это время давление в желудочках продолжает нарастать – в левом желудочке до 110-120 мм.рт.ст., а в правом – до 25-30 мм.рт.ст.. Второй период – период медленного изгнания (0,13-0,17с). Период изгнания продолжается до равенства давления в полостях желудочков и в магистральных сосудах.
Диастола желудочков: фазы и периоды, состояние клапанов
Диастола желудочков начинается с момента прекращения изгнания (давление в желудочках соответствует давлению в магистральных сосудах). При этом полулунные клапаны еще не закрылись, но изгнание прекратилось. Диастола состоит из нескольких фаз и периодов. После равенства давления в желудочках оно начинает уменьшаться по сравнению с давлением в аорте и легочной артерии и кровь из них оттекает обратно в желудочки. При этом кровь затекает в карманы полулунных клапанов, – клапаны закрываются. Время от прекращения изгнания до закрытия полулунных клапанов называется протодиастолическим периодом (0,015-0,02с). После закрытия полулунных клапанов происходит расслабление миокарда желудочков при замкнутых полостях (створчатые и полулунные клапаны закрыты) – этот период называется изометрическим расслаблением (0,08с). К концу этого периода давление в желудочках становится ниже, чем в предсердиях, створчатые клапаны открываются, и происходит фаза наполнения желудочков (0,35с), состоящий из трех периодов: 1) период быстрого пассивного наполнения (0,08с). По мере наполнения желудочков давление в них увеличивается, и скорость их наполнения снижается, – наступает 2) период медленного пассивного наполнения (0,17с). Вслед за этим периодом наступает 3) период активного наполнения желудочков, осуществляемой систолой предсердий (0,1с).
Межфазовые показатели систолы желудочков (внутрисистолический показатель, индекс напряжения миокарда).
К межфазовым показателям систолы желудочков относится: 1) внутрисистолический показатель (ВСП), 2) индекс напряжения миокарда (ИНМ). Эти показатели отражают эффективность работы сердца. Для определния ВСП необхолимо знать длительность фазы изгнания и длительность механической систолы. Механическая систола – это часть систолы, при котором происходят механические процессы в сердце: повышение давления в желудочках сердца (период изометрческого сокращения) и изгнание крови из желудочков сердца (фаза изгнания). ВСП определяется отношением фазы изгнания к механической систоле умноженное на 100 и измеряется в в %: чем больше ВСП, тем больше эффективность работы сердца. Для определения ИНМ необходимо знать длительност фазы напряжения (сумма длительности периодов асинхронного и изометрического сокращения) и длительность общей систолы (сумма длительности периодов асинхронного, изометрического сокращения и фазы изгнания). ИНМ определяется отношением фазы напряжения к общей систоле, умноженное на 100 и измеряется в в %: чем больше ИНМ, тем меньше эффективность работы сердца.
Тоны сердца, их происхождение.
За один сердечный цикл возникает четыре тона, два из которых (I, II) являются основными и их можно прослушать, а два других (III, IV) можно выявить только с помощью фонокардиограммы (ФКГ запись звуковых колебаний в сердце). I тон называется систолическим, так как он возникает при систоле желудочков. Он формируется за счет четырех компонентов: 1) напряжении мышц желудочков и натяжения сухожильных нитей створчатых клапанов; 2) закрытия створчатых клапанов; 3) открытии полулунных клапанов; 4) динамического эффекта крови, выбрасываемой из желудочков и вибрации стенок магистральных сосудов. Наилучшим местом прослушивания закрытия двухствор-чатого клапана является 5 межреберье слева на 1,5 - 2 см. кнутри от средне-ключичной линии, а закрытия трехствор-чатого клапана – у основания мечевидного отростка. II тон называется диастолическим, так как он возникает в начале диастолы желудочков и он обусловлен закрытием полулунных клапанов. Лучшим местом прослушивания закрытия клапанов аорты является II межреберье справа у края грудины, а закрытия клапанов легочной артерии - во втором межреберье слева у края грудины. Кроме того, звуковые колебания, связанные с закрытием полулунных клапанов аорты можно прослушать слева у грудины на месте прикрепления III-IV ребер (точка Боткина). III тон возникает в результате вибрации стенок желудочков в фазу их быстрого наполнения при открытии створчатых клапанов. IV тон связан с колебаниями стенок желудочков в фазу добавочного наполнения за счет систолы предсердий. Таким образом, за один сердечный цикл возникает четыре тона: один во время систолы (I тон), остальные во время диастолы (II, III и IV тоны).
Аускультация и фонокардиография. Анализ ФКГ.
Звуковые колебания (тоны сердца), происходящие в течение одного сердечного цикла, можно прослушать – это называется аускультацией или записать – фонокардиограмма (ФКГ). Во время аускультации можно услышать только два тона: I (возникающий во время систолы) и II (возникающий во время диастолы). Основным компонентом I тона является закрытие створчатых клапанов. Наилучшим местом прослушивания закрытия двухстворчатого клапана является 5 межреберье слева на 1,5 - 2 см. кнутри от средне-ключичной линии, а закрытия трехстворчатого клапана – у основания мечевидного отростка. Компонентом II тона является закрытие полулунных клапанов. Лучшим местом прослушивания закрытия клапанов аорты является II межреберье справа у края грудины, а закрытия клапанов легочной артерии - во втором межреберье слева у края грудины. Кроме того, звуковые колебания, связанные с закрытием полулунных клапанов аорты можно прослушать слева у грудины на месте прикрепления III-IV ребер (точка Боткина). На ФКГ можно отметить 4 тона: один систолический (I тон) и три диастолических (II III и IV тоны). II тон возникает в результате вибрации стенок желудочков в фазу их быстрого наполнения при открытии створчатых клапанов. IV тон связан с колебаниями стенок желудочков в фазу добавочного (активного) наполнения за счет систолы предсердий.
Интракардиальные механизмы регуляции работы сердца.
интракардиальные (внутрисердечные) механизмы. Этот механизм заложен в самом сердце и осуществляется двумя способами:
- миогенная ауторегуляция (саморегуляция) – за счет изменения силы сокращения миокарда. При этом сила сокращения миокарда может изменяться за счет изменения длины мышечных волокон (гетерометрический тип миогенной ауторегуляции), либо без изменения длины мышечных волокон (гомеометрический тип миогенной ауторегуляции).
Гетерометрический тип МА впервые был обнаружен в 1895 г. О. Франком. Им было отмечено: чем больше растянуто сердце, тем сильнее оно сокращается. Окончательно эту зависимость проверил и сформулировал Е. Старлинг в 1918 г. В настоящее время эта зависимость обозначается как закон Франка-Старлинга: чем больше растягивается мышца желудочков во время фазы наполнения, тем сильнее она сокращается во время систолы. Эта закономерность соблюдается до определенной величины растяжения, за пределами которого происходит не увеличение силы сокращения миокарда, а уменьшение.
Гомеометрический тип МА объясняется феноменом Анрепа, – при увеличении давления в аорте возрастает сила сокращения миокарда, без изменения длины мышечных волокон. Полагают, что в основе этого лежит коронарно-инотропный механизм. Дело в том, что коронарные сосуды, несущие кровь к миокарду, хорошо наполняются во время диастолы желудочков. Чем больше давление в аорте, тем с большей силой кровь возвращается в желудочки сердца во время диастолы. Полулунные клапаны при этом закрываются, и кровь проходит в коронарные сосуды. Чем больше крови в коронарных сосудах, тем больше питательных веществ и кислорода поступают в миокард и тем интенсивнее окислительные процессы, тем больше выделяется энергии для мышечного сокращения.
Внутрисердечный периферический рефлекс - в волокнах миокарда имеются рецепторы растяжения, которые возбуждаются при растяжении миокарда (при наполнении желудочков сердца во время диастолы). При этом импульсы от рецепторов растяжения поступают в интрамуральный ганглий одновременно к двум нейронам: адренергическим и холинергическим. При возбуждении адренергических нейронов в окончаниях эфферентного волокна выделяется норадреналин, который взаимодействует с бета1 адренореактивными структурами миокарда и усиливается сокращение миокарда. При возбуждении холинергических нейронов в окончаниях эфферентного нерва выделяется ацетилхолин, который взаимодействует с М-холинореактивными структурами миокарда и уменьшается сила сокращения миокарда. Кроме этих нейронов в интрамуральном ганглии находится тормозной нейрон, возбуждение которого происходит при сильном возбуждении адренергического нейрона (при сильном растяжении миокарда). Возбуждение тормозного нейрона вызывает толрможение адренергического нейрона и на миокард действует ацетил холдин. Возбудимость адренергических нейронов значительно выше возбудимости холинергических. При слабом растяжении миокарда желудочков происходит возбуждение лишь адренергических нейронов, поэтому сила сокращения миокарда под влиянием норадреналина возрастает. При сильном растяжении миокарда импульсы от эфферентного нерва адренергического нейрона по коллатерали возвращаются к данному нейрону через тормозной нейрон и вызывает его торможение. При этом начинает возбуждаться холинергический нейрон и под влиянием ацетилхолина сила сокращения миокарда уменьшается.
Внутрисердечный периферический рефлекс.
Этот рефлекс обеспечивает саморегуляцию работы сердца и начинается с возбуждения рецепторов растяжения миокарда во время диастолы желудочков (происходит наполнение желудочков кровью, что приводит к растяжению миокарда). При возбуждении этих рецепторов импульсы по афферентным путям одновременно поступают в адренергический и холинергический нейроны интрамурального ганглия. При этом возбуждается только адренергический нейрон (его возбудимость больше возбудимости холинергического) и в нервных окончаниях эфферентного волокна адренергического нейрона выделяется норадреналин, который взаимодействует с бета-1 адренореактивными структурами миокарда и происходит увеличение возбудимости миокарда (положительный батмотропный эффект), проводимости (положительный дромотропный эффект) и сократимости (положительный инотропный эффект). При сильном растяжении миокарда отмечается возбуждение холинергического нейрона и одновременно с этим по коллатерали эфферентного волокна адренергического нейрона импульсы поступают в тормозной нейрон, возбуждение которого тормозит адренергический нейрон. Таким образом, при сильном растяжении в окончаниях эфферентного волокна холинергического нейрона выделяется ацетилхолин (выделение норадреналина в окончаниях эфферентного волокна адренергического нейрона прекращается), который взаимодействует с М-холинореактивными структурами миокарда, что приводит к уменьшению возбудимости миокарда (отрицательный батмотропный эффект), проводимости (отрицательный дромотропный эффект) и сократимости (отрицательный инотропный эффект)
Экстракардиальные механизмы регуляции работы сердца.
Экстракардиальные (внесердечные) механизмы, которые осуществляются двумя путями: нервным и гуморальным. Нервная экстракардиальная регуляция осуществляется импульсами, поступающими к сердцу по симпатическим и парасимпатическим нервам
Симпатические нервы сердца образованы отростками нейронов, расположенных в боковых рогах верхних пяти грудных сегментов. В симпатической регуляции работы сердца принимают участие три шейных ганглия (верхний, средний и нижний), а также нейроны в боковых рогах спинного мозга верхних пяти грудных сегмента (th1-th5). Преганглионарные волокна нейронов th1 заканчивается в нижнем шейном ганглии, образуя звездчатый ганглий. Постганглионарные волокна симпатического нерва от шейных и паравертебральных ганглиев th2-th5 (4) заканчиваются в синоатриальном (СА) узле, атриовентрикулярном (АV) узле и бета-1 адренореактивных структурах миокарде правого и левого желудочков. В нервных окончаниях постганглионарного волокна симпатического нерва выделяется норадреналин. При взаимодействии норадреналина с Р клетками СА узла увеличивается скорость медленной диастолической деполяризации, что приводит к увеличению количества импульсов, образующихся в СА узле и увеличению ЧСС (тахикардия) – это положительный хронотропный эффект. При взаимодействии норадреналина с бета-1 адренореактивными структурами миокарда желудочков отмечается увеличение возбудимости миокарда (положительный батмотропный эффект), проводимости (положительный дромотропный эффект) и сократимости (положительный инотропный эффект). И.П. Павлов среди симпатических нервов, идущих к сердцу, обнаружил веточки, раздражение которых вызывает либо только положительный инотропный эффект (усиливающий нерв), либо только положительный хронотропный эффект (нерв ускоритель).
Парасимпатические нервы сердца представлены блуждающим нервом, ядро которого находятся в продолговатом мозге. Преганглионарное волокно блуждающего нерва заканчивается в интрамуральном ганглиитри. Постганглионарные волокна блуждающего нерва соответственно заканчиваются в синоатриальном узле (СА), атриовентрикулярном узле (АV) и М-холинореактивных структурах миокарда правого и левого желудочков. В нервных окончаниях постганглионарного волокна блуждающего нерва выделяется ацетилхолин. При взаимодействии ацетилхолина с Р клетками СА узла уменьшается скорость медленной диастолической деполяризации, что приводит к уменьшению количества импульсов, образующихся в СА узле и уменьшению ЧСС (брадикардия) – это отрицательный хронотропный эффект. При взаимодействии ацетилхолина с М холинореактивными структурами миокарда желудочков отмечается уменьшение возбудимости миокарда (отрицательный батмотропный эффект), проводимости (отрицательный дромотропный эффект) и сократимости (отрицательный инотропный эффект).
Тонус центров сердечных нервов.
При перерезке блуждающего нерва отмечается увеличение ЧСС с 70-80 ударов/мин до 130-140 ударов/мин. Этот результат свидетельствует о том, что ядро блуждающего нерва обладает тонусом, то есть находится в постоянном возбуждении. Таким образом, в состоянии покоя сердце постоянно находится под воздействием блуждающего нерва.
При перерезке симпатический нерв ЧСС практически не изменяется. Этот результат свидетельствует о том, что центр симпатического нерва сердца не обладает тонусом, то есть в состоянии покоя сердце не получает импульсы по волокнам симпатического нерва.
Эти эксперименты свидетельствуют о том, что центр блуждающего нерва находится в постоянном возбуждении, то есть обладает тонусом, а центр симпатического нерва не имеет тонуса. У новорожденного ребенка отсутствует тонус вагуса, поэтому у него ЧСС доходит до 140 уд/мин.
Взаимодействие интракардиальных и экстракардиальных механизмов. Парадоксальный эффект вагуса.
Из экстракардиальных нервов только парасимпатический нерв взаимодействует с нейронами внутрисердечного периферического рефлекса, так как преганглионарное волокно блуждающего нерва заканчивается в интрамуральном ганглии, где находятся нейроны внутрисердечного периферического рефлекса. При слабом раздражении вагуса возбуждается только адренергический нейрон (его возбудимость больше возбудимости холинергического) и в нервных окончаниях эфферентного волокна адренергического нейрона (порстганглионарного волокна вагуса) выделяется норадреналин, который взаимодействует с бета-1 адренореактивными структурами миокарда и происходит увеличение возбудимости миокарда (положительный батмотропный эффект), проводимости (положительный дромотропный эффект) и сократимости (положительный инотропный эффект).
При сильном раздражении вагуса отмечается возбуждение холинергического нейрона и одновременно с этим по коллатерали эфферентного волокна адренергического нейрона импульсы поступают в тормозной нейрон, возбуждение которого тормозит адренергический нейрон. При этом в окончаниях эфферентного волокна холинергического нейрона (постганглионарное волокно вагуса) выделяется ацетилхолин (выделение норадреналина в окончаниях эфферентного волокна адренергического нейрона прекращается), который взаимодействует с М-холинореактивными структурами миокарда, что приводит к уменьшению возбудимости миокарда (отрицательный батмотропный эффект), проводимости (отрицательный дромотропный эффект) и сократимости (отрицательный инотропный эффект)
Симпатическая регуляция
Симпатические нервы сердца образованы отростками нейронов, расположенных в боковых рогах верхних пяти грудных сегментов. В симпатической регуляции работы сердца принимают участие три шейных ганглия (верхний, средний и нижний), а также нейроны в боковых рогах спинного мозга верхних пяти грудных сегмента (th1-th5). Преганглионарные волокна нейронов th1 заканчивается в нижнем шейном ганглии, образуя звездчатый ганглий. Постганглионарные волокна симпатического нерва от шейных и паравертебральных ганглиев th2-th5 (4) заканчиваются в синоатриальном (СА) узле, атриовентрикулярном (АV) узле и бета-1 адренореактивных структурах миокарде правого и левого желудочков. В нервных окончаниях постганглионарного волокна симпатического нерва выделяется норадреналин. При взаимодействии норадреналина с Р клетками СА узла увеличивается скорость медленной диастолической деполяризации, что приводит к увеличению количества импульсов, образующихся в СА узле и увеличению ЧСС (тахикардия) – это положительный хронотропный эффект. При взаимодействии норадреналина с бета-1 адренореактивными структурами миокарда желудочков отмечается увеличение возбудимости миокарда (положительный батмотропный эффект), проводимости (положительный дромотропный эффект) и сократимости (положительный инотропный эффект). И.П. Павлов среди симпатических нервов, идущих к сердцу, обнаружил веточки, раздражение которых вызывает либо только положительный инотропный эффект (усиливающий нерв), либо только положительный хронотропный эффект (нерв ускоритель).
Парасимпатическая регуляция
Парасимпатические нервы сердца представлены блуждающим нервом, ядро которого находятся в продолговатом мозге. Преганглионарное волокно блуждающего нерва заканчивается в интрамуральном ганглиитри. Постганглионарные волокна блуждающего нерва соответственно заканчиваются в синоатриальном узле (СА), атриовентрикулярном узле (АV) и М-холинореактивных структурах миокарда правого и левого желудочков. В нервных окончаниях постганглионарного волокна блуждающего нерва выделяется ацетилхолин. При взаимодействии ацетилхолина с Р клетками СА узла уменьшается скорость медленной диастолической деполяризации, что приводит к уменьшению количества импульсов, образующихся в СА узле и уменьшению ЧСС (брадикардия) – это отрицательный хронотропный эффект. При взаимодействии ацетилхолина с М холинореактивными структурами миокарда желудочков отмечается уменьшение возбудимости миокарда (отрицательный батмотропный эффект), проводимости (отрицательный дромотропный эффект) и сократимости (отрицательный инотропный эффект).
Гуморальная регуляция работы сердца
Изменения работы сердца наблюдается при действии на него ряда биологически активных веществ. Катехоламины (дофамин, норадреналин и адреналин) увеличивают силу и учащают ритм сердечных сокращений. Этот эффект возникает в результате следующих факторов: 1) эти гормоны взаимодействуют со специфическими структурами миокарда в результате чего активизируется внутриклеточный фермент аденилатциклаза, которая ускоряет образование 3,5-циклического аденозинмонофосфата. Он активирует фосфорилазу, вызывающую расщепление внутримышечного гликогена и образование глюкозы – источника энергии для сокращения миокарда; 2) катехоламины повышают проницаемость клеточных мембран для ионов кальция в результате чего усиливается поступление их из межклеточного пространства в клетку и усиливается мобилизация ионов кальция из внутриклеточных депо. Активация аденилатциклазы отмечается в миокарде при действии глюкагона. Ангиотензин (гормон почек), серотонин и гормоны коры надпочечников увеличивают силу сердечных сокращений, а тироксин (гормон щитовидной железы) учащает сердечный ритм. Отмечается особенность действия адреналина и норадреналина на сердце: адреналин гуморально при непосредственном действии на сердце вызывает положительные эффекты, а через ЦНС повышает тонус блуждающего нерва, который вызывает отрицательные эффекты. Норадреналин с одной стороны при непосредственном действии на миокард вызывает положительные эффекты, а с другой стороны норадреналин увеличивает тонус центра симпатического нерва, что также вызывает положительные эффекты.
Ацетилхолин, гипоксемия, гиперкапния и ацидоз угнетают сократительную функцию миокарда.
Рефлекторная регуляция работы сердца
Рефлекторные реакции могут как тормозить, так и возбуждать сердечные сокращения. Рефлекторные реакции, возбуждающие сердечную деятельность называются симпатикотонические рефлексамы, а тормозящими сердечную деятельность – ваготонические рефлексы. Особое значение в регуляции работы сердца имеют рецепторы, расположенные в некоторых участках сосудистой системы. Наиболее значительна роль рефлексогенных зон, расположенных в дуге аорты и в области разветвления общей сонной артерии. Здесь находятся барорецепторы, которые возбуждаются при повышении давления. Поток афферентных импульсов от этих рецепторов повышает тонус ядра блуждающих нервов, что приводит к четырем отрицательным эффектам миокарда, уменьшается СОК и МОК, что приводит к уменьшению АД.
К ваготоническим рефлексам также относится рефлекс Гольца: легкое поколачивание по желудку и кишечнику лягушки вызывает остановку или замедление сокращений сердца. К этому же рефлексу относится глазосердечный рефлекс Ашнера: урежение сердцебиений на 10 – 20 ударов в минуту при надавливании на глазные яблоки. При легком покалачивании по кишечнику и надавливание на глазные яблоки импульсы от рецепторов по афферентным нервам идут в ядро блуждающего нерва, повышается тонус ядра и увеличивается действие вагуса на сердце, что приводит к брадикардлии.
К симпатикотоническим рефлексам относится рефлекс Бейнбриджа: при повышении давления в правом предсердии или в устье полых вен происходит возбуждение механорецепторов. Залпы афферентных импульсов от этих рецепторов идут к группе нейронов ретикулярной формации ствола мозга (сердечно-сосудистый центр). Афферентная стимуляция этих нейронов приводит к активации нейронов симпатического отдела АНС и происходит тахикардия за счет усиления действия симпатического нерва на сердце.
Особенности строения сосудистой системы, влияющие на их функцию.
Особенности строения сосудистой системы обеспечивает их функцию.
1) аорта, легочная артерия и крупные артерии в своем среднем слое содержат большое количество эластических волокон, что и определяют их основную функцию – эти сосуды называют амортизирующими, или упруго-растяжимые, то есть сосуды эластического типа. Во время систолы желудочков происходит растяжение эластических волокон и образуется аортальная «компрессионная камера» благодаря которой не происходит резкого подъема артериального давления во время систолы. Аортальная компрессионная камера - это функциональное образование, которое образуется во время систолы желудочков, благодаря большому количеству эластических волокон в среднем слое стенки аорты. Во время систолы желудочков часть энергии сердца расходуется на растяжение эластических волокон аорты, благодаря чему образуется аортальная компрессионная камера – это потенциальная энергия. Другая часть энергии сердца расходуется на придание скорости кровотоку – это кинетическая энергия. Во время диастолы желудочков сердца потенциальная энергия компрессионной камеры аорты переходит в кинетическую энергию скорости кровотока. Таким образом, благодаря эластическим свойствам аорты, легочной артерии и крупных артерий прерывистый ток крови из сердца (во время систолы есть выход крови из желудочков, во время диастолы нет) превращается в непрерывный ток крови по сосудам.
Кроме этого, освобождение крови из "«компрессионной камеры" во время диастолы способствует тому, что давление в артериальной части сосудистой системы не падает до нуля;
2) средние и мелкие артерии, артериолы (мельчайшие артерии) и прекапиллярные сфинктеры в своем среднем слое содержат большое количество мышечных волокон, поэтому они оказывают наибольшее сопротивление току крови – их называют резистивными сосудами. Это особенно относится к артериолам, поэтому эти сосуды И.М.Сеченов назвал «кранами» сосудистой системы. От состояния мышечного слоя этих сосудов зависит кровенаполнение капилляр;
3) капилляры состоят из одного слоя эндотелия, благодаря этому в этих сосудах происходит обмен веществ, жидкости и газов – эти сосуды называются обменными. Капилляры не способны к активному изменению своего диаметра, который изменяется за счет состояния пре- и посткапиллярных сфинктеров;
4) вены в своем среднем слое содержат малое количество мышечных и эластических волокон, поэтому они обладают высокой растяжимостью и способны вмещать большие объемы крови (75 –80% всей циркулирующей крови находится в венозной части сосудистой системы) – эти сосуды называют емкостными;
5) артерио-венозные анастамозы (шунтирующие сосуды) – это сосуды соединяющие артериальную и венозную части сосудистого русла, минуя капилляры. При открытых артерио-венозных анастамозов кровоток через капилляры либо резко уменьшается, либо полностью прекращается. Состояние шунтов отражается и на общем кровотоке. При открытии анастамозов увеличивается давление в венозном русле, что увеличивает приток к сердцу, а, следовательно, и величину сердечного выброса.
Закон Гагена-Пуазейля в гемодинамике. Написать формулу закона Гагена-Пуазейля, используемую в клинике
Гемодинамика – это
раздел науки, изучающий механизмы
движения крови в сердечно-сосудистой
системе. По закону Гагена количество
протекающей жидкости через определенный
участок трубочки зависит от следующих
факторов: 1) от градиента давления
(разницы давления в начальной и конечной
части трубочки) – чем больше градиент
давления, тем больше количество
протекающей жидкости; 2) от длины
трубочки – чем больше длина трубочки,
тем меньше объем протекающей жидкости;
3) от поперечного сечения – отмечается
прямая зависимость от радиуса в четвертой
степени; 4) от вязкости протекающей
жидкости – чем больше вязкость, тем
меньше объем протекающей жидкости; 5)
от времени – чем больше время, тем
больше объем протекающей жидкости.
Коэффициент пропорциональности при
этом соответствует
![]() .
Таким образом, объем протекающей жидкости
через любую трубочку (ΔV)
прямопропорциональна градиенту давления
(ΔP), радиусу 4-ой степени
(r4),
времени (t) и
обратнопропорциональна длине трубочки
( l
) и вязкости жидкости (η):
.
Таким образом, объем протекающей жидкости
через любую трубочку (ΔV)
прямопропорциональна градиенту давления
(ΔP), радиусу 4-ой степени
(r4),
времени (t) и
обратнопропорциональна длине трубочки
( l
) и вязкости жидкости (η):
![]()
Сопротивление току
жидкости по трубочкам изучал Пуазейль
и определил, что сопротивление зависит
от следующих факторов: 1) вязкости
жидкости, – чем больше вязкость, тем
больше сопротивление; 2) от радиуса
трубки в четвертой степени – чем
больше радиус, тем меньше сопротивление;
3) от длины трубки – чем больше длина
трубки, тем больше сопротивление.
Коэффициент пропорцианальности при
этом соответствует
![]() .
Таким образом, сопротивление току
жидкости по трубочкам ( R
) прямопропорциональна длине трубочки
( l
), вязкости (η) и обратно
пропорциональна ( r4 ):
.
Таким образом, сопротивление току
жидкости по трубочкам ( R
) прямопропорциональна длине трубочки
( l
), вязкости (η) и обратно
пропорциональна ( r4 ):
![]()
Сравнивая формулу
Гагена и Пуазеля видно, что часть формулы
Гагена
![]() есть обратная величина формулы Пуазеля.
Объединяя эти две формулы мы получим
закон Гагена-Пуазеля: объем жидкости,
протекающий через трубочку (ΔV)
прямо-пропорциональна градиенту давления
(ΔP = P1
– P2), времени (t)
и обратно пропорциональна сопротивлению
(R). В клинике вместо объема
протекающей жидкости используют объемную
скорость, то есть объем протекающей
крови через определенное сечение сосуда
за единицу времени: Q =
ΔV/t. В
конечном итоге закон Гагена-Пуазейля
применительно в клинике отражает
зависимость объемной скорости ( Q
) от градиента давления (P1-P2)
и сопротивления (R):
есть обратная величина формулы Пуазеля.
Объединяя эти две формулы мы получим
закон Гагена-Пуазеля: объем жидкости,
протекающий через трубочку (ΔV)
прямо-пропорциональна градиенту давления
(ΔP = P1
– P2), времени (t)
и обратно пропорциональна сопротивлению
(R). В клинике вместо объема
протекающей жидкости используют объемную
скорость, то есть объем протекающей
крови через определенное сечение сосуда
за единицу времени: Q =
ΔV/t. В
конечном итоге закон Гагена-Пуазейля
применительно в клинике отражает
зависимость объемной скорости ( Q
) от градиента давления (P1-P2)
и сопротивления (R):
![]()
Изменение основных показателей гемодинамики (объемная и линейная скорости, сопротивление,сечение, давление) в различных отделах сосудистой системы.
Давление в различных отделах сосудистой системы зависит от сопротивления: чем больше сопротивление, тем меньше давление. В каждом последующем сосуде сопротивление слагается из сопротивления данного сосуда и суммы сопротивлений предыдущих сосудов. Самое маленькое сопротивление в аорте, так как этот сосуд ближе всего к сердцу (насосу) – здесь самое большое давление (100 мм рт.ст.). Самое большое сопротивление в полых венах – дальше всего от сердца (насоса), поэтому здесь самое маленькое давление (-5 мм рт.ст.). Часть энергии сердца расходуется на давление на стенку сосуда, а часть - на преодоление сопротивления: чем ближе сосуд к сердцу (аорта), тем больше энергии тратится на давление и меньше на преодоление сопротивления; чем дальше сосуд от сердца (полые вены), тем меньше энергии остается на давление и больше расходуется на преодоление сопротивления. Таким образом, давление в различных отделах сосудистой системы обратно пропорциональна сопротивлению: чем больше сопротивление, тем меньше давление. Давление в артериях эластического типа падает плавно. Наибольшее сопротивление току крови оказывают артериолы, так как они богаты мышечным слоем, поэтому наибольший перепад давления отмечается в начальной и конечной части артериол. Наибольший перепад давления (разница между давлением вначале сосуда и в конце) отмечается в артериолах. Это связано с тем, что в среднем слое артериол наибольшее количество гладкомышечных клеток и артериолы вызывают наибольшее сопротивление току крови.
Начиная с капилляр давление плавно уменьшается до полых вен, где давление отрицательное (ниже атмосферного) и составляет – 5 мм рт.ст. Таким образом, градиент давления, обеспечивающее движение крови по сосудам большого круга кровообращения, составляет 100 – (-5) = 105 мм рт.ст.
Объемная скорость (количество крови, протекающее через поперечное сечение сосуда за единицу времени - Q), или МОК в различных отделах сосудистой системы не изменяется и определяется работой сердца (МОК = ЧСС х СОК): через суммарный просвет любой части сосудистой системы за единицу времени проходит одинаковое количество крови (Q1 = Q2 = Q3 = const.).
Линейная скорость – это расстояние пройденное частицей крови за единицу времени. Линейная скорость обратно пропорциональна суммарному поперечному сечению сосудов. Наименьшее сечение в аорте и здесь самая большая линейная скорость (0,5 м/с). Наибольшее суммарное сечение в капиллярах (в 600 раз больше сечения аорты) и здесь наименьшая линейная скорость (0,001 м/с). Суммарное сечение полых вен в два раза (две полые вены) больше, чем сечение аорты и линейная скорость в полых венах в два раза меньше (0,25 м/c).
Фактор, обеспечивающий движение крови по сосудам. Расчитать силу, способствующую движению крови по малому и большому кругу кровообращения
Гемодинамика – это раздел науки, изучающий механизмы движения крови в сердечно-сосудистой системе. Фактор, способствующий движению крови по сосудистой системе – это разница (градиент) давления в начале сосуда и в конце. Движение крови прекращается, если градиент давления будет равен нулю. Для расчета силы, способствующей движению крови по большому кругу кровообращения необходимо знать давление в начале (в аорте – 100мм РТ.ст.) и в конце (полые вены - -5 мм рт.ст.). Градиент (разница) давления между аортой и полыми венами соответствует силе, способствующей движению крови по большому кругу кровообращения. Таким образом, сила, обеспечивающая движению крови по сосудам большого круга кровообращения, составляет 100 – (-5) = 105 мм рт.ст. Для определения силы, способствующей движению крови по сосудам малого круга кровообращения необходимо знать давление в легочной артерии (начало малого круга – 20мм рт.ст ) и легочных вен (конец малого круга – 0мм рт.ст. Таким образом, градиент давления, обеспечивающее движение крови по сосудам малого круга кровообращения, составляет 20 – 0 = 20мм рт.ст. Таким образом, сила, способствующая движению крови по большому кругу кровообращения в 5 раз больше силы, способствующей движению крови по малому кругу кровообращения. Это связано с тем, что сопротивление току крови в большом круге в 5 раз больше.
Эластичность сосудов и непрерывность движения крови. Аортальная компрессионная камера и его значение
Аорта, легочная артерия и крупные артерии в своем среднем слое содержат большое количество эластических волокон, что и определяют их основную функцию – эти сосуды называют амортизирующими, или упруго-растяжимые, то есть сосуды эластического типа. Во время систолы желудочков происходит растяжение эластических волокон и образуется аортальная «компрессионная камера» благодаря которой не происходит резкого подъема артериального давления во время систолы. Аортальная компрессионная камера - это функциональное образование, которое образуется во время систолы желудочков, благодаря большому количеству эластических волокон в среднем слое стенки аорты. Во время систолы желудочков часть энергии сердца расходуется на растяжение эластических волокон аорты, благодаря чему образуется аортальная компрессионная камера – это потенциальная энергия. Другая часть энергии сердца расходуется на придание скорости кровотоку – это кинетическая энергия. Во время диастолы желудочков сердца потенциальная энергия компрессионной камеры аорты переходит в кинетическую энергию скорости кровотока. Таким образом, благодаря эластическим свойствам аорты, легочной артерии и крупных артерий прерывистый ток крови из сердца (во время систолы есть выход крови из желудочков, во время диастолы нет) превращается в непрерывный ток крови по сосудам.
Тонус сосудов (базальный и центральный)
Тонус сосудов – это определенная степень сужения сосудов. Различают два вида тонуса: базальный и центральный. Базальный тонус осуществляется за счет автоматии гладко-мышечных клеток стенки сосудов (ГМК), которая поддерживается за счет растяжения стенки сосудов при их кровенаполнении. При кровенаполнении сосуда происходит растяжение стенки сосуда и за счет автоматии ГМК сосудов происходит их сокращение, сосуды суживаются – это и есть базальный, или местный тонус. Центральный тонус поддерживается благодаря постоянному возбуждению прессорного отдела сосудодвигательного центра (СДЦ) за счет постоянного возбуждения хеморецепторов (ХР) дуги аорты и бифуркации сонной артерии на внутреннюю и наружнюю. Адекватным раздражителем ХР является уменьшение напряжения кислорода в артериальной крови. Следует отметить, что пороговое напряжение кислорода, при котором происходит возбуждение ХР, составляет 160-180 мм рт.ст., то есть при таком напряжении кислорода ХР чувствуют недостаток кислорода. Максимальное напряжении кислорода у человека, находящегося в нормальных условиях (атмосферное давлении 760 мм рт.ст.) 100 мм РТ.ст., поэтому в нормальных условиях ХР находятся в постоянном возбуждении, прессорный отдел тоже в постоянном возбуждении. Импульсы от прессорного отдела по эфферентному пути через боковые рога спинного мозга грудных и поясничных сегментов постоянно поступают в ГМК сосудов, благодаря чему ГМК сокращаются и сосуды суживаются (центральный тонус)
Артериальное давление (систолическое, диастолическое, пульсовое, среднее). Факторы, влияющие на его величину
Артериальное давление (АД) является одним из ведущих параметров гемодинамики. АД – это давление во всей артериальной части сосудистой системы – от аорты до артериол.
На величину АД (давления на стенку всей артериальной части сосудистой системы от аорты до артериол влияет два фактора: объемная скорость (Q) и сопротивление (R). Q зависит от работы сердца (Q=ЧССхСОК): чем больше Q, тем больше АД. R зависит от состояния гладкомышечных клеток (ГМК) артериол: при сокращении ГМК артериолы суживаются, повышается сопротивление и АД увеличивается, при расслаблении ГМК артериолы расширяются, сопротивление уменьшается и АД уменьшается. Таким образом, АД зависит от двух факторов, что можно выразить следующей формулой: АД = QхR, то есть АД прямопропорционально объемной скорости и сопротивлению: чем больше Q и R, тем больше АД.
Артериальное давление можно измерить двумя способами: прямой способ, который используется на животных путем введения в артерию стеклянную канюлю, или катетер, соединенного с манометром трубкой с жесткими стенками.
Косвенный, или бескровный способ определения АД. Для этого используют сфигмоманометр Рива-Роччи. Обследуемому накладывают на плечо полую резиновую манжету, которая соединена с резиновой грушей (для нагнетания воздуха) и с манометром. При надувании манжета сдавливается плечевая артерия, а манометр показывает величину этого давления. Для измерения давления с помощью данного прибора, по предложению Н.С. Короткова, выслушивают сосудистые тоны, возникающие в артерии к периферии от наложенной на плечо манжеты. В несдавленной артерии поток крови ламинарный, поэтому при движении крови звуки отсутствуют. Если после сдавливания просвета плечевой артерии выпускать воздух из манжеты (проводить декомпрессию), кровь с большой скоростью движется через сдавленный участок и ударяется о стенку артерии и это порождает звук, слышимый ниже манжеты. Кроме этого первый звук Н.С. Короткова обусловлен турбулентным движением крови. Давление в манжете, при котором появляются первые звуки Н.С. Короткова, соответствует систолическому (СД). При дальнейшем снижении давления в манжете, просвет исчезает и артерия занимает свой первоначальный диаметр и турбулентное движение крови переходит в ламинарный поток, что приводит к исчезновению звуков. Давление в манжете в момент исчезновения звуков в артерии соответствует диастолическому (ДД). После определения АД косвенным способом записываем результат АД = 120/80 мм рт. ст.: 120 – это систолическое давление; 80 – это диастолическое давление; разница между СД и ДД составляет пульсовое давление (ПД = 120 – 80 = 40) За счет ПД происходит артериальный пульс. Кроме СД, ДД и ПД определяют среднее артериальное давления (САД) – это равнодействующая всех изменений давления в сосудах (в данном случае 120+80/2 = 100 мм РТ.ст., или САД = ДД+0,42хПД) Среднее давление отражает степень кровоснабжения тканей. У новорожденных СД составляет 50 мм рт.ст. и к концу первого месяца жизни составляет 80 мм рт.ст.
Кривая АД, характеристика ее волн
Один из способов определения артериального давления (АД) это прямой способ, который используется на животных путем введения в артерию стеклянную канюлю, или катетер, соединенного с манометром трубкой с жесткими стенками. Катетер и соединительную трубку заполняют раствором противосвертывающего вещества, чтобы кровь в них не свертывалась. Этим способом можно записать кривую артериального давления. На кривой АД различают различные волны, отличающиеся по своему периоду:
Волны первого порядка (пульсовые или систолические) – самые частые (обладают наименьшим периодом). Эти волны образуются за счет повышения давления во время систолы желудочков и уменьшения давления во время диастолы желудочков. Давление, определяемое во время систолы называют систолическим (СД), или максимальным. Давление, определяемое во время диастолы называют диастолическим (ДД), или минимальным. Разность между систолическим и диастолическим давлением называют пульсовым давлением (ПД). Величина ПД влияет на амплитуду волн первого порядка. ПД прямо пропорционально величине сердечного выброса крови из желудочков сердца. В мелких артериях ПД уменьшается, а в артериолах и капиллярах – отсутствует, следовательно, и пульсовые волны в артериолах и капиллярах отсутствуют. Продолжительность понижения давления во время диастолы больше, чем продолжительность повышения давления во время систолы, поэтому САД ближе к величине диастолического.
Волны второго порядка (дыхательные), так как их колебания зависят от вдоха (понижается давление) и выдоха (повышается давление). Период этих волн больше, чем период волн первого порядка. Одна волна второго порядка соответствует длительности дыхательного цикла и включает 3 – 5 волн первого порядка. Эти колебания зависят от тонуса ядра блуждающего нерва: во время вдоха увеличивается тонус вагуса, и отрицательные эффекты вагуса уменьшают МОК, а при выдохе – наоборот, уменьшается тонус вагуса.
Волны третьего порядка – самые редкие (имеют самый длительный период) и низкоамплитудные – они включают несколько волн второго порядка. Эти волны обусловлены периодическими изменениями тонуса прессорного отдела (П) сосудодвигательного центра (СДЦ), находящегося в продолговатом мозге: при повышении тонуса П СДЦ величина АД увеличивается за счет сужения сосудов и увеличения сопротивления (R), при снижении тонуса П СДЦ (при возбуждении депрессорного отдела СДЦ) величина АД уменьшается за счет расширения сосудов и уменьшения R.
Морфофункциональная характеристика основных отделов микроциркуляторного русла
Микроциркуляторное русло включает все сосуды, диаметр которых не превышает 2мм. Сюда относятся: артериолы, прекапиллярные сфинктеры, капилляры, посткапиллярные сфинктеры, венулы и артериовенозные анастамозы. Функции различных отделов микроциркуляторного русла: 1) артериолы, средний слой которых состоит из большого количества гладкомышечных клеток (ГМК). Артериолы участвуют в регуляции АД за счет изменения сопротивления: при сокращении ГМК сосуд суживается, увеличивается сопротивление и АД увеличивается, при расслаблении ГМК сосуд расширяется, сопротивление уменьшается и уменьшается АД. Артерилы также участвует в регуляции кровенаполнения капилляр, поэтому этот сосуд И.М. Сеченов назвал кранами сосудистой системы – при сужении артериол меньше крови поступает в капилляры, а при расширении – больше. Благодаря этому свойству артериолы выполняют следующие функции: а) регулируют системное артериальное давление – при расслаблении мышечного слоя артериолы расширяются, сопротивление уменьшается и АД уменьшается; б) регулируют кровенаполнение капилляров; 2) прекапилярные сфинктеры непосредственно регулируют объем поступающей крови в капилляры: при сокращении ГМК прекапилярных сфинктеров уменьшается кровенаполнение капилляр, кровь проходит через артериовенозный анастамоз, минуя капиллярное ложе. При расслаблении – увеличивается кровенаполнение капилляр и улучшается кровоснабжение органа; 3) капилляры – это тончайшие сосуды, диаметром 5 – 7 мкм, длиной 0,5 – 1,1 мм. Эти сосуды пролегают в межклеточных пространствах, тесно соприкасаясь с клетками органов и тканей организма. Суммарная длина всех капилляров около 100000 км. Физиологическое значение капилляров состоит в том, что через их стенки осуществляется обмен веществ, жидкости и газов. Стенки капилляров образованы только одним слоем клеток эндотелия, снаружи которого находится тонкая соединительнотканная базальная мембрана. Количество капилляр на 1 мм2 поперечного сечения ткани зависит от интенсивности обмена веществ. Давление в артериальном конце капилляра около 30 мм рт ст, а на венозном – 15 мм рт.ст.. В капилляра почечных клубочков давление 65-70 мм рт.ст., а в капиллярах почечных канальцев 14-18 мм.рт.ст. Очень маленькое давление в капиллярах лёгких – 6 мм рт.ст.; 4) посткапилярные сфинктеры регулируют давление крови в капиллярах: при сокращении ГМК посткапилярных сфинктеров увеличивается внутрикапилярное давление, что способствует транскапилярной фильтрации (увеличивается переход жидкости из крови в ткань), при расслаблении ГМК уменьшается внутрикапилярное давление и снижается фильтрация; 5) венулы отводящие емкостные сосуды, они собирают и отводят кровь, протекающую через обменные сосуды; 6) артерио-венозные анастамозы, или шунтирующие сосуды, участвуют в терморегуляции: при низкой температуре окружающей среды рефлекторно сокращаются ГМК прекапилярных сфинктеров и кровь, минуя капилярное ложе, проходит через шунтирующие сосуды, уменьшая теплоотдачу; при увеличении температуры окружающей среды рефлекторно расслабляются ГМК прекапилярных сфинктеров и кровь проходит через капиллярное ложе, при этом увеличивается теплоотдача.
Артериальный и венный пульс, их происхождение. Сфигмография и флебография
Артериальный пульс – это колебание артериальной стенки, вызванное периодическим повышением давления в артериях во время систолы желудочков. Артериальный пульс можно исследовать путем его прощупывания (пальпации) и при помощи его записи (сфигмографии - СГ). При пальпации можно выявить ряд клинических характеристик: частоту и быстроту, амплитуду и напряжение, ритмичность и симетричность. Частота пульса характеризует частоту сердечных сокращений. В состоянии покоя частота пульса колеблется от 60 до 80 в минуту. Урежение пульса (менее 60) называется брадикардия, а учащение (более80) – тахикардия. Быстрота пульса – это скорость, с которой происходит повышение давления в артерии во время подъема пульсовой волны и снижение во время ее спада. По этой характеристики различают быстрый и медленный пульс. Амплитуда пульса – это амплитуда колебания стенки сосуда. Амплитуда зависит от величины систолического объема сердца и эластичности сосуда: амплитуда тем меньше, чем больше эластичность. По этой характеристикии различают пульс низкой и высокой амплитуды. Напряжение пульса (твердость пульса) оценивается тем усилием, которое необходимо приложить, чтобы сдавить артерию до прекращения ее колебаний. По этой характеристики различают мягкий и твердый пульс. Ритм пульса – характеризуется расстоянием от одного колебания до другого. В норме пульс является достаточно ритмичным. Отмечаются небольшие изменения ритма, связанные с фазами дыхания: в конце выдоха частота сокращения сердца уменьшается за счет повышения тонуса блуждающего нерва, а во время вдоха частота несколько возрастает. Это дыхательная аритмия. По данной характеристике различают ритмичный и аритмичный пульс. При уменьшении силы сердечного сокращения может наблюдаться дефицит пульса, который определяется разницей частоты сердечных сокращений и частоты пульса. В норме эта разница равна нулю. При уменьшении силы сердечного сокращения уменьшается систолический объем сердца, который не создает повышения давления в аорте, достаточного для распространения пульсовой волны до периферических артерий.
Венный пульс – это ритмическое колебание стенки вен при периодическом физиологическом затруднении оттока крови по венам. Из-за податливости вен, венный пульс не пальпируется, его можно записать (флебография). Следует отметить, что колебание стенки артерий за один сердечный цикл происходит 1 раз (во время систолы желудочков. Колебание стенки вен за один сердечный цикл происходит три раза: 1) вначале систолы желудочков за счет сдавления вены, находящейся рядом с сонной артерией; 2) в конце систолы желудочков предсердия заполнены кровью и временно затрудняется отток по полым венам; 3) во время систолы предсердий сужимаются устья
Свойства артериального пульса. Дефицит пульса
Артериальный пульс – это колебание артериальной стенки, вызванное периодическим повышением давления в артериях во время систолы желудочков. Артериальный пульс обладает следующими свойствами: частота и быстрота, амплитуда и напряжение, ритмичность и симетричность. Частота пульса характеризует частоту сердечных сокращений. В состоянии покоя частота пульса колеблется от 60 до 80 в минуту. Урежение пульса (менее 60) называется брадикардия, а учащение (более80) – тахикардия. Быстрота пульса – это скорость, с которой происходит повышение давления в артерии во время подъема пульсовой волны и снижение во время ее спада. По этой характеристики различают быстрый и медленный пульс. Амплитуда пульса – это амплитуда колебания стенки сосуда. Амплитуда зависит от величины систолического объема сердца и эластичности сосуда: амплитуда тем меньше, чем больше эластичность. По этой характеристикии различают пульс низкой и высокой амплитуды. Напряжение пульса (твердость пульса) оценивается тем усилием, которое необходимо приложить, чтобы сдавить артерию до прекращения ее колебаний. По этой характеристики различают мягкий и твердый пульс. Ритм пульса – характеризуется расстоянием от одного колебания до другого. В норме пульс является достаточно ритмичным. По данному свойству различают ритмичный и аритмичный пульс. Симетричность пульса определяется одновременной пальпацией пульса на левой и правой руке. По этому свойству различают симметричный пульс (одновременно пальпируется на обеих руках) и асиметричный (пальпируется на одной руке). При уменьшении силы сердечного сокращения может наблюдаться дефицит пульса, который определяется разницей частоты сердечных сокращений и частоты пульса. В норме эта разница равна нулю. При уменьшении силы сердечного сокращения уменьшается систолический объем сердца, который не создает повышения давления в аорте, достаточного для распространения пульсовой волны до периферических артерий.
Сосудодвигательный центр продолговатого мозга: структура, афферентные и эфферентные связи
Сосудодвигательный центр (СДЦ) расположен в продолговатом мозгу и состоит из двух отделов: прессорного (П) и депрессорного (Д), которые находятся в реципрокной зависимости – при возбуждении П происходит торможение Д и наоборот. Афферентные связи СДЦ: 1) от хеморецепторов дуги аорты и бифуркации общей сонной артерии импульсы поступают в П отдел и происходит его возбуждение и реципрокно тормозится Д отдел; 2) от барорецепторов, или прессорецепторов дуги аорты и бифуркации общей сонной артерии импульсы поступают в Д отдел и происходит его возбуждение и реципрокно тормозится П отдел. Раздражителем ХР является снижение напряжения кислорода в артериальной крови, а раздражителем барорецепторов является повышение давление в артериях. Эфферентные связи П отдела СДЦ посылают импульсы от П в боковые рога спинного мозга грудных и поясничных сегментов к вегетативным нейронам и отсюда импульсы поступают в ГМК сосудов, происходит их сокращение, сосуды суживаются, увеличивается сопротивление и АД повышается. Депрессорный отдел не имеет эфферентной связи. При возбуждении Д СДЦ происходит реципрокное торможение П отдела СДЦ и временно уменьшается или прекращается поток импульсов к ГМК сосудов, происходит их расслабление, сосуды расширяются, уменьшается сопротивление и АД уменьшается.
Сосудодвигательные нервы: вазодилятаторы и вазоконстрикторы
Сосудодвигательные нервы осуществляют нервную регуляцию сосудов. Различают вазоконстрикторы и вазодилятаторы. К вазаконстрикторам относится симпатический нерв. При этом норадреналин, выделяющийся в окончаниях постганглионарного волокна взаимодействует с альфа адренореактивными структурами гладкомышечных клеток сосудов и происходит сокращение этих мышц – сосуды суживаются, увеличивается сопротивление, что приводит к увеличению АД. К вазодилятаторам относится: 1) симпатические нервы – при этом норадреналин взаимодействует с бета2 адренореактивными структурами ГМК и происходит расслабление этих мышц, сосуды расширяются, сопротивление уменьшается и АД уменьшается; 2) парасимпатические нервы (блуждающий нерв, который расширяет сосуды желудка; парасимпатические нервы, расширяющие сосуды слюнных желез и сосуды мозговой оболочки); 3) задние корешки спинного мозга, расширяющие сосуды кожи.
Прессорный рефлекс (нарисовать и показать все звенья)
При прессорном рефлексе происходит сокращение ГМК сосудов, что приводит к их сужению и повышению артериального давления (рис).
Рецепторы этого рефлекса распложены в дуге аорты (1) и в месте бифуркации общей сонной артерии на наружную и внутреннюю (2) и называются хеморецепторами (3 - ХР). От ХР импульсы идут по афферентным путям (4) к прессорному отделу (П) сосудодвигательного центра (СДЦ - 6), который находится в продолговатом мозге (5). При возбуждении П происходит реципрокное торможение депрессорного отдела СДЦ (Д) и по эфферентным путям (7) от П отдела импульсы поступают в боковые рога спинного мозга грудных и поясничных сегментов (8). Отсюда начинается преганглионарное волокно (9) симпатического нерва (вазоконстриктора) до симпатического ганглия (10), отсюда начинается постганглионарное волокно (11), которое заканчивается в ГМК сосудов (12). В окончаниях постганглионарного волокна выделяется норадреналин, который взаимодействует с альфа или бета1 адренореактивными структурами ГМК, вызывая их сокращение, сосуды суживаются, увеличивается сопротивление и АД повышается. Норадреналин может взаимодействовать с бета2 адренореактивными структурами ГМК (сосуды печени, кожи и скелетных мышц), вызывая их расслабление, сосуды расширяются.
Дерессорный рефлекс (нарисовать и показать все звенья)
При депрессорном рефлексе происходит расслабление ГМК сосудов, что приводит к их расширению и снижению артериального давления (рис).
Рецепторы этого рефлексы распложены в дуге аорты (1) и в месте бифуркации общей сонной артерии на наружную и внутреннюю (2) и называются барорецепторами (3 - БР). Адекватным раздражителем этих рецепторов является повышение АД. При повышении АД происходит возбуждение БР. Импульсы от БР по афферентному пути (4а) достигают депрессорного отдела (Д) сосудодвигательного центра (СДЦ). Возбуждение Д приводит к рецепрокному торможению прессорного отдела (П) СДЦ, уменьшается тонус П, что приводит к расширению сосудов, уменьшению сопротивления и АД уменьшается. Кроме этого, импульсы от БР по афферентным путям (4б) достигают ядра блуждающего нерва и увеличивают его тонус (возбуждение). Импульсы по преганглионарным волокнам блуждающего нерва (8) достигают интрамурального ганглия (9) и по постганглионарным волокнам (8а) доходят до синоат-риального узла (СА) и миокарда желудочков. В окончаниях постганглионарного волокна выделяется ацетилхолин, который взаимодействует с Р клетками СА узла (уменьшается ЧСС – брадикардия – отрицательный хроно-тропный эффект – 10) и М-холино-реактивными струк-турами миокарда желудочков (уменьшается возбудимость миокарда – отрицательный батмотропный эффект – 11, уменьшается проводимость миокарда – отрицательный дромотропный эффект – 12, уменьшается сила сокращения миокарда - отрицательный инотропный эффект – 13). Таким образом, при депрессорном рефлексе уменьшение АД происходит за счет уменьшения объемной скорости (повышается тонус ядра блуждающего нерва) и сопротивления (возбуждение Д СДЦ, вызывающего реципрокное торможение П СДЦ).
Функциональная система, обеспечивающая постоянство АД
Гуморальная регуляция тонуса сосудов
Гуморальная регуляция осуществляется за счет сосудосуживающих и сосудорасширяющих веществ. К сосудосуживающим относится гормоны мозгового слоя надпочечников (адреналин и норадреналин) и гормона почек ренина. Адреналин и норадреналин взаимодействуют с альфа адренореактивными структурами ГМК, они сокращаются, сосуды суживаются, сопротивление повышается и АД повышается. Ренин почек попадает в кровь и взаимодействует с ангиотензиногеном крови (образуется в печени), превращая его в активную форму – ангиотензин. Это вещество способствует сокращению ГМК, а также повышает тонус симпатического отдела АНС, поэтому отмечается стойкое повышение АД. К сосудорасширяющим относится ацетилхолин, который расслабляет ГМК сосудов и АД снижается.
Кровь и его свойства
Система крови. Показать схематически составные части крови
В 1939 году клиницистом Г.Ф. Лангом введено понятие система крови, в которую входят: 1) переферическая кровь, циркулирующая по сосудам; 2) органы кроветворения – красный костный мозг, лимфатические узлы, слезенка; 3) органы кроверазрушения – селезенка, печень, красный костный мозг; 4) регулирующий нейрогуморальный аппарат.
Деятельность всех компонентов этой системы обеспечивает выполнение основных функций крови.
Кровь – это жидкая ткань организма, состоящая из твердой части (форменные элементы) и жидкой части (плазма). Схематически составные части крови можно представить следующим образом:
1) плазма; 2) неорганические вещества; 3) органические вещества (белки: А – альбумины, Г – глобулины, Ф – фибриноген); 4) форменные элементы крови (ФЭ): Э – эритроциты (зр – зрелые, р – юные эритроциты, ретикулоциты); Л – лейкоциты: З – зернистые (Н – нейтрофилы: ю – юные, п – палочкоядерные, с – сегментоядерные; Эз – эозинофилы; Б – базофилы); Нз – незернистые (Лм – лимфоциты, М – моноциты); Т – тромбоциты.
Функции крови
I. Транспортная – в зависимости от того, что транспортирует кровь, мы различаем следующие разновидности транспортных функций:
Дыхательная функция – при этом кровь транспортирует газы: кислород от лёгких к тканям и углекислый газ от тканей к легким. Эту функцию осуществляют эритроциты и плазма.
Трофическая функция – при этом кровь транспортирует питательные вещества от желудочно-кишечного тракта к тканям организма. Эту функцию осуществляет плазма.
Выделительная функция – при этом кровь транспортирует продукты метаболизма от тканей к выделительным органам. Эту функцию выполняет плазма.
II. Защитная – в зависимости от того, от чего защищает кровь наш организм, мы различаем следующие разновидности защитных функций:
Фагоцитоз – пожирание микробов, процесс активного захватывания и поглощения микроорганизмов, разрушенных клеток и инородных частиц. Эту функцию выполняют некоторые виды лейкоцитов: нейтрофилы – они меньших размеров и способны фагоцитировать 10-12 микробов, поэтому их называют микрофаги; моноциты – они более крупные и способны фагоцитировать 20-22 микроба, поэтому их называют макрофаги; иногда эту функцию выполняют лимфоциты.
Иммунитет – способность организма защищаться от генетически чужеродных тел и веществ. Эта функция осуществляется лимфоцитами и глобулинами плазмы за счет выработки антител.
Гемостаз – свертывемость крови. Эта функция защищает организм от кровопотери. В этой функции участвуют все составные части крови, а также сосудистый эндотелий и сосудистый субэндотелий.
III. Регуляторная функция:
Кровь является составной частью гуморальной регуляции всех физиологических функций, так как проходит через все органы и ткани нашего организма.
Большая роль отводится крови в регуляции постоянства температуры тела (терморегуляции).
Осмотическое давление крови. Растворы по осмотическому давлению
Осмотическое давление – это сила, способствующая диффузии (проникновению) растворителя через полупроницаемую мембрану, отделяющую растворы разной концентрации. При этом растворитель от раствора с более низкой концентрации переходит в раствор с более высокой концентрацией. В норме осмотическое давление составляет 7,6-8,1 атм (5776-6156 мм рт.ст.). Осмотическое давление образуется за счет растворенных в плазме органических (белков плазмы) и неорганических веществ. Все растворы по величине осмотического давления делятся на три группы: 1) изотонические – их осмотическое давление соответствует осмотическому давлению крови ( 0,9% раствор NaCl), 2) гипотонические – их осмотическое давление меньше, чем осмотическое давление крови (раствор NaCl менее 0,9%), 3) гипертонические – их осмотическое давление больше, чем осмотическое давление крови (раствор NaCl более 0,9%). Объем эритроцитов в изотоническом растворе не изменяются. В гипотоническом растворе вода проникает внутрь эритроцита, что приводит к увеличению его объема. При этом оболочка эритроцита может разрушиться – это осмотический гемолиз. В гипертоническом растворе вода выходит из эритроцита, что приводит к его сморщиванию. Разрушение оболочки эритроцита в гипотоническом растворе называется осмотическим гемолизом.
Онкотическое давление крови
Онкотическое давление – это часть осмотического давления, которая образуется за счет белков плазмы. В норме это давление равно 25-30 мм рт.ст., то есть в 200 раз меньше осмотического давления. Известно, что белки являются гидрофильными (любят воду), поэтому это давление играет большую роль в регуляции обмена воды между капиллярами и тканями организма. Если онкотическое давление более 30 мм рт.ст., тогда вода удерживается в сосудистом русле и уменьшается транскапиллярная фильтрация, что приводит к увеличению объема циркулирующей крови за счет жидкой ее части, то есть при этом гематокритный показатель уменьшается. Если онкотическое давление меньше 25 мм рт.ст. (при уменьшении количества белков плазмы), тогда вода в сосудистом русле не удерживается и увеличивается транскапиллярная фильтрация, наблюдается отек ткани. При этом уменьшается объем циркулирующей крови за счет жидкой части, поэтому гематокритный показатель увеличивается. Таким образом, при резком увеличении онкотического давления (за счет увеличения количества белков плазмы). Благодаря гидрофильности белков (любят воду), вода удерживается в сосудистом русле. Это приводит, с одной стороны, к сухости кожи, а с другой – к увеличению объема циркулирующей крови за счет жидкой части (плазмы), что приводит к уменьшению гематокрита и увеличению АД (за счет увеличения объемной скорости). Резкое уменьшение онкотического давления отмечается при уменьшении количества белков плазмы. При этом вода не удерживается в сосудистом русле и свободно проникает в ткань. Это приводит, с одной стороны, к отеку тканей (голодные, или безбелковые отеки), а с другой – к уменьшению объема циркулирующей крови за счет жидкой части (плазмы), что приводит к увеличению гематокрита и уменьшению АД (за счет уменьшения объемной скорости).
рН крови, понятие об ацидозе и алакалозе (компенсированном и некомпенсированном; газовым и метаболическим)
Кислотно-щелочное равновесие (КЩР) – определяется концентрацией водородных ионов, которая выражается отрицательным логарифмом молярной концентрации ионов водорода, обозначаемым рН. В норме рН крови составляет 7,36 – 7,4. Поддержание рH крови является важнейшей физиологической задачей – если бы не существовало механизма поддержания рH, то огромное количество кислых продуктов, образующихся в результате метаболических процессов вызывало бы закисление крови (ацидоз – при этом происходит уменьшение рH). В меньшей степени в организме накапливаются в процессе метаболизма щелочи, которые могут снизить содержание водородных ионов (алкалоз – при этом происходит увеличение рН). По изменению водородных ионов в крови различаем ацидоз и алкалоз. Ацидоз и алкалоз бывают газовый, или дыхательный и негазовый, или метаболический. Газвый ацидоз зависит от накопления углекислого газа, что отмечается при гиповентиляции (уменьшении функции легких). Газовый алкалоз отмечается при избыточном выделении углекислого газа, что отмечается при гипервентиляции (услении функции легких). Метаболический ацидоз возникает при накоплении в организме органических кислот. Например, при циррозе печени происходит накопление молочной кислоты, что приводит к ацидозу. По способности компенсировать избыток водородных ионов или гидроксильных различают компенсированный и некомпенсированный ацидоз и алкалоз. При некомпенсированном ацидозе и алкалозе происходит изменение рН крови (при ацидозе снижается, а при алкалозе – увеличивается). При компенсированном ацидозе и алкалозе рН неизменяется (происходит компенсация химическим или физиологическим механизмами). При этом изменяется буферная емкость (БЕ). БЕ крови определяется количеством кислоты (буферная емкость по кислоте - БЕк) или щелочи (буферная емкость по щелочи - БЕщ), которое необходимо добавить на 1л буферного раствора (крови), чтобы рН этого раствора изменить на 1 ед. Например, на 1л крови с рН=7,36 было добавлено 2л щелочи, после чего рН крови стало 8,36 (рН увеличился на 1ед), следовательно, БЕщ данной крови равна 2л. Если на 1л крови с рН=7,36 было добавлено 3л кислоты, после чего рН крови стало 6,36 (рН уменьшился на 1ед), следовательно, БЕк данной крови равна 3л. При компенсированном ацидозе происходит увеличение БЕщ или уменьшение БЕк без изменения рН. При компенсированном алкалозе происходит увеличение БЕк или уменьшение БЕщ без изменения рН.
Буферные системы крови, поддерживающие постоянство рН крови. Механизм действия
Б уферные
системы крови поддерживают постоянство
рН крови. Различают четыре основные
буферные системы крови: 1) бикарбонатный
( H2CO3
/ NaHCO3 ); 2) фосфатный
(NaH2PO4
/ Na2HPO4);
3) белковый (
уферные
системы крови поддерживают постоянство
рН крови. Различают четыре основные
буферные системы крови: 1) бикарбонатный
( H2CO3
/ NaHCO3 ); 2) фосфатный
(NaH2PO4
/ Na2HPO4);
3) белковый (![]() )
– эти буферные системы находятся в
плазме; 4) гемоглобиновый ( HHb/KhbO2
) – находится в эритроцитах. Механизм
поддержания pH крови при
помощи буферных систем заключается в
том, что при добавлении сильных кислот
в буферные растворы – они превращаются
в слабо диссоциированные кислоты, а при
добавлении сильных щелочей – в
слабощелочные растворы. Белки плазмы,
благодаря своим амфотерным свойствам,
способны присоединять к себе избыток
водородных ионов (к COO–
группе), либо избыток гидроксильных
ионов (к NH3+
группе). Бикарбонатный и фосфатный
буферные системы способствуют превращению
сильных кислот и щелочей в слабые.
)
– эти буферные системы находятся в
плазме; 4) гемоглобиновый ( HHb/KhbO2
) – находится в эритроцитах. Механизм
поддержания pH крови при
помощи буферных систем заключается в
том, что при добавлении сильных кислот
в буферные растворы – они превращаются
в слабо диссоциированные кислоты, а при
добавлении сильных щелочей – в
слабощелочные растворы. Белки плазмы,
благодаря своим амфотерным свойствам,
способны присоединять к себе избыток
водородных ионов (к COO–
группе), либо избыток гидроксильных
ионов (к NH3+
группе). Бикарбонатный и фосфатный
буферные системы способствуют превращению
сильных кислот и щелочей в слабые.
Органы, участвующие в поддержании постоянства рН крови
При истощении буферных систем поддержание постоянства рН крови осуществляется ф изиологическим механизмом, осуществляемый за счет функции следующих органов:
1) лёгких – в обычных условиях в сутки образуется около 550 л. угольной кислоты, которая удаляется через легкие. При усилении функции лёгких отмечается усиленное выделение углекислого газа, что приводит к уменьшению водородных ионов – возникает алкалоз за счет усиленного выделения СО2 (H2CO3 → H2O + CO2 → выделение через легкие). При уменьшении функции лёгких происходит накопление углекислого газа, что в конечном счете приводит к накоплению водородных ионов за счет накопления СО2 – возникает ацидоз ( CO2 + H2O → H2CO3 → Н+ + НСО3 ).
Возникновение ацидоза или алкалоза при изменении функции лёгких называется дыхательным (респираторным, или газовым);
2) почек – поддержание рН крови почками осуществляется при помощи следующих механизмов: за счет выделения избытка водородных или гидроксильных групп с помощью фосфатного буфера. Этот механизм работает до тех пор, пока рН мочи будет равен или меньше 5 ед. После этого постоянство рН происходит за счет амониогенезе (синтеза аммиака): в клетках канальцев начинается синтез аммиака в результате дезаминирования аминокислот (глутаминовой). Аммиак захватывает ион водорода из крови и превращается в аммоний, который секретируется в полость канальца, где вытесняет натрий из хлористого натрия. При этом образуется NH4Cl, который выводится с мочой. Освободившийся натрий реабсорбируется в кровь и соединяется с анионом HCO3, пополняя емкость бикарбонатного буфера.
3) печени – в печени происходят два процесса, которые способствуют поддержанию pH крови. Во-первых, в печени происходит окисление молочной кислоты до конечных продуктов и, во-вторых, в печени происходит синтез нейтральных веществ (мочевины) из кислых азотистых соединений (NH4 и NH4Cl), которые образуются при окислении белков.
Механизмы, поддерживающие постоянство рН крови (химические и физиологические).
Ф изиологический механизм, при истощении буферных систем поддержание постоянства рН крови осуществляется ф изиологическим механизмом, осуществляемый за счет функции следующих органов:
1) лёгких – в обычных условиях в сутки образуется около 550 л. угольной кислоты, которая удаляется через легкие. При усилении функции лёгких отмечается усиленное выделение углекислого газа, что приводит к уменьшению водородных ионов – возникает алкалоз за счет усиленного выделения СО2 (H2CO3 → H2O + CO2 → выделение через легкие). При уменьшении функции лёгких происходит накопление углекислого газа, что в конечном счете приводит к накоплению водородных ионов за счет накопления СО2 – возникает ацидоз ( CO2 + H2O → H2CO3 → Н+ + НСО3 ).
Возникновение ацидоза или алкалоза при изменении функции лёгких называется дыхательным (респираторным, или газовым);
2) почек – поддержание рН крови почками осуществляется при помощи следующих механизмов: за счет выделения избытка водородных или гидроксильных групп с помощью фосфатного буфера. Этот механизм работает до тех пор, пока рН мочи будет равен или меньше 5 ед. После этого постоянство рН происходит за счет амониогенезе (синтеза аммиака): в клетках канальцев начинается синтез аммиака в результате дезаминирования аминокислот (глутаминовой). Аммиак захватывает ион водорода из крови и превращается в аммоний, который секретируется в полость канальца, где вытесняет натрий из хлористого натрия. При этом образуется NH4Cl, который выводится с мочой. Освободившийся натрий реабсорбируется в кровь и соединяется с анионом HCO3, пополняя емкость бикарбонатного буфера.
3) печени – в печени происходят два процесса, которые способствуют поддержанию pH крови. Во-первых, в печени происходит окисление молочной кислоты до конечных продуктов и, во-вторых, в печени происходит синтез нейтральных веществ (мочевины) из кислых азотистых соединений (NH4 и NH4Cl), которые образуются при окислении белков.
Белки плазмы, их роль
Белки плазмы - в норме 65 – 85 г/л. К ним относятся альбумины (52 – 58%), глобулины и фибриноген. Белки выполняют следующие функции:
а) определяют величину онкотического давления (благодаря этому белки играют важную роль в транскапиллярном обмене воды, влияя на общую массу циркулирующей крови);
б) буферные свойства крови (за счет их амфотерности);
Избыток водородных ионов H+ присоединяется к СОО- группе, а избыток ОН- присоединяется к NH3+ группы. Благодаря амфотерности белки плазмы участвуют в сохранении рН крови на постоянном оптимальном уровне.
в) вязкость плазмы;
г) транспортную;
д) иммунную защиту (за счет глобулинов, определяющих уровень иммуноглобулинов G, M, A, E);
е) гемостатическую (за счет фибриногена).
Гемолиз и его виды. Осмотическая стойкость эритроцитов
Гемолиз – это разрушение оболочки эритроцита. В зависимости от причины разрушения оболочки различаем следующие виды гемолиза: 1) осмотический – при этом разрушение оболочки эритроцитов возникает в гипотоническом растворе; 2) химический – разрушение оболочки эритроцитов происходит в кислотах или щелочах; 3) термический – разрушение оболочки эритроцитов происходит при повышении температуры; 4) токсический – разрушение оболочки эритроцитов происходит за счет микробов или токсинов животного происхождения; 5) механический – разрушение эритроцитов происходит при сильной тряске. Возникновение осмотического гемолиза зависит от осмотической стойкости (резистентности) эритроцита – способности эритроцита выдерживать снижение осмотического давления раствора. Осмотическая стойкость эритроцита – это наибольшая концентрация гипотонического раствора, при котором происходит разрушение оболочки эритроцитов. Например, эритроцит с осмотической резистентностью 0,5% начинает разрушаться в 0,5% растворе NaCl. Если этот эритроцит поместить в раствор концентрация которого больше 0,5%, то эритроцит только набухает, но не разрушается. Если этот эритроцит поместить в раствор концентрация которого меньше 0,5% он также разрушается. Минимальная осмотическая стойкость эритроцитов соответствует 0,5% раствору NaCl – начало гемолиза. Максимальная осмотическая стойкость эритроцитов крови человека 0,38% раствор NaCl, поэтому при 0,38% растворе NaCl происходит полный гемолиз.
Основные константы крови (количество, вязкость, осмотическое и онкотическое давление, рН, гематокритный показатель, СОЭ)
Количество крови – в норме у человека количество крови составляет 13-ю часть веса. Например, у человека весом 65 кг должно быть 5 литров крови, а у человека весом 91 кг – 7 литров крови. Количество крови можно определить двумя способами: 1) методом разведения индеферентного красителя – этим способом можно определить только плазму; 2) с использование радиоактивных изотопов – этим способом можно определить только количество форменных элементов, зная гематокритный показатель, можно определить общее количество крови. Гематокритный показатель – объёмное соотношение форменных элементов и плазмы, определяется при помощи центрифугирования крови. В норме этот показатель равен 40-45%. Вязкость крови – в норме составляет 4,5 – 5,0. Этот показатель зависит от количества форменных элементов и белков плазмы. Скорость оседания эритроцитов (СОЭ) – измеряется величиной столба плазмы, освобождающейся от эритроцитов при их оседании из цитратной смеси в специальной пипетке и измеряется в мм за 1 час. В норме этот показатель равен от 2 до 9 мм за час. СОЭ зависит от многих факторов: количества эритроцитов, их морфологических особенностях и белкового состава плазмы. На СОЭ влияет физиологическое состояние организма. Так, например, при беременности, воспалительных процессах, эмоциональном напряжении СОЭ увеличивается. рН – определяется концентрацией водородных ионов, которая выражается отрицательным логарифмом молярной концентрации ионов водорода. В норме рН крови составляет 7,36 – 7,4. Поддержание рH крови является важнейшей физиологической задачей – если бы не существовало механизма поддержания рH, то огромное количество кислых продуктов, образующихся в результате метаболических процессов вызывало бы закисление крови (ацидоз – при этом происходит уменьшение рH). В меньшей степени в организме накапливаются в процессе метаболизма щелочи, которые могут снизить содержание водородных ионов (алкалоз – при этом происходит увеличение рН). По изменению водородных ионов в крови различаем ацидоз и алкалоз. Ацидоз и алкалоз бывают газовый, или дыхательный и негазовый, или метаболический. Газвый ацидоз зависит от накопления углекислого газа, что отмечается при гиповентиляции (уменьшении функции легких). Газовый алкалоз отмечается при избыточном выделении углекислого газа, что отмечается при гипервентиляции (услении функции легких). Метаболический ацидоз возникает при накоплении в организме органических кислот. Например, при циррозе печени происходит накопление молочной кислоты, что приводит к ацидозу. По способности компенсировать избыток водородных ионов или гидроксильных различают компенсированный и некомпенсированный ацидоз и алкалоз. При некомпенсированном ацидозе и алкалозе происходит изменение рН крови (при ацидозе снижается, а при алкалозе – увеличивается). При компенсированном ацидозе и алкалозе рН неизменяется (происходит компенсация химическим или физиологическим механизмами). При этом изменяется буферная емкость (БЕ). Онкотическое давление крови – это часть осмотического давления, которая образуется за счет белков плазмы. В норме это давление равно 25-30 мм рт.ст., то есть в 200 раз меньше осмотического давления. Известно, что белки являются гидрофильными (любят воду), поэтому это давление играет большую роль в регуляции обмена воды между капиллярами и тканями организма. Если онкотическое давление более 30 мм рт.ст., тогда вода удерживается в сосудистом русле и уменьшается транскапиллярная фильтрация, что приводит к увеличению объема циркулирующей крови за счет жидкой ее части, то есть при этом гематокритный показатель уменьшается. Если онкотическое давление меньше 25 мм рт.ст. (при уменьшении количества белков плазмы), тогда вода в сосудистом русле не удерживается и увеличивается транскапиллярная фильтрация, наблюдается отек ткани. При этом уменьшается объем циркулирующей крови за счет жидкой части, поэтому гематокритный показатель увеличивается. Осмотическое давление крови – это сила, способствующая диффузии (проникновению) растворителя через полупроницаемую мембрану, отделяющую растворы разной концентрации. При этом растворитель от раствора с более низкой концентрации переходит в раствор с более высокой концентрацией. В норме осмотическое давление составляет 7,6-8,1 атм. Осмотическое давление образуется за счет растворенных в плазме органических (белков плазмы) и неорганических веществ. Все растворы по величине осмотического давления делятся на три группы: 1) изотонические – их осмотическое давление соответствует осмотическому давлению крови ( 0,9% раствор NaCl), 2) гипотонические – их осмотическое давление меньше, чем осмотическое давление крови (раствор NaCl менее 0,9%), 3) гипертонические – их осмотическое давление больше, чем осмотическое давление крови (раствор NaCl более 0,9%).
Количество эритроцитов, их функции. Анемия, эритропения, эритроцитоз, эритропоэз. Физиологическая желтуха новорожденных.
Эритроциты – в норме 4,5 – 5,0 млн. в 1 мм3 (4,5 – 5,0х1012 /л). Средний диаметр эритроцитов 7,3 мкм, средняя продолжительность жизни – 120 дней. Поверхностная мембрана четырехслойная: наружный слой мембраны содержит набор антигенов, в том числе АВО, резус. Эритроциты выполняют следующие функции: 1) дыхательную – за счет транспорта кислорода из лёгких к тканям и углекислого газа из тканей к легким, 2) определяют групповую специфичность крови за счет наличия или отсутствия антигенов АВО; 3) регулирует содержание АДФ в крови за счет синтеза АДФазы, что влияет на свертываемость крови; 4) осуществляется синтез 2,3 дифосфоглицерат (2,3 ДФГ) в оболочке эритроцита при недостатке кислорода, в результате чего снижается сродство HbA к кислороду, благодаря чему увеличивается поступление кислорода к тканям; 5) участвуют в первом этапе свертывания крови – сосудисто-тромбоцитарном гемостазе.
При определенных заболеваниях количество эритроцитов может увеличиваться (эритроцитоз), либо уменьшаться (эритропения). Если уменьшение эртроцитов сопровождается уменьшением гемоглобина – это называется анемией. Образование новых эритроцитов называется эритропоэзом. Следует отметить, что бывает ложный эритроцитоз (рабочий), который отмечается при потере жидкой части крови (плазмы) при физических нагрузках при этом происходит увеличение гематокрита и истинный, при котором не изменяется гематокрит, что отмечается при гипоксических состояниях (недостатке кислрода), в данном случае увеличение эритроцитов происходит за счет эритропоэза.
Эритропоэз. Внутренний и внешний факторы эритропоэза.
Эритропоэз – образование новых эритроцитов. В этом процессе имеет значение два основных фактора: внешний и внутренний. К внешним факторам относятся те, что поступают в организм вместе с пищей – это витамин В12 и фолиевая кислота. К внутренним факторам относятся те, что синтезируются в организме – это фактор Кастла, или гастромукопротеид, который образуется слизистой желудка и способствует всасыванию витамина В12. К внутреннему фактору также можно отнести эритропоэтины, которые образуются в почке и попадают в кровь. Они воздействуют на эритропоэтин чувствительные клетки (ЭЧК) костного мозга и способствуют транспорту железа, благодаря чему происходит синтез гемоглобина и ЭЧК клетки превращаются в эритробласты. Предполагают, что витамин В12 действует на фолиевую кислоту и активизирует ее, превращая в фолиновую кислоту, которая воздействует на костный мозг, благодаря чему полипотентная клетка начинает дифференцироваться в сторону эритроцитов. Таким образом, эритропоэз начинается при действии фолиновой кислоты на костный мозг и при этом полипотентная стволовая клетка митотически делится 7-10 раз, превращаясь в предшественника эритропоэтин чувствительной клетки ( преЭЧК), которая митотически делится 7-10 раз и дифференцируется в эритропоэтин чувствительную клетку (ЭЧК). На ЭЧК действует эритропоэтин и спосбствует проникновению железа в цитоплазму ЭЧК и начинается синтез гемоглобина, благодаря чему ЭЧК превращаются в эритробласты. Которые через 1-3 суток превращаются в юнных эритроцитов – ретикулоцитов, которые созревают в течение 5-8 час и превращаются в эритроциты.
Кривая анизоцитоза. Цветной показатель.
Кривая анизоцитоза – показывает зависимость между процентным содержанием различных диаметров эритроцитов. Каждый эритроцит живет около 3 мес, поэтому в периферической крови отмечаются эритроциты различных возрастов, которые отличаются своим диаметром. Диаметр эритроцитов в норме варьирует (различается) в пределах 2,5-3 мк (разница между максимальным и минимальным диаметром эритроцитов). Наибольший процент эритроцитов (75%) с диаметром 7,2-7,5 мк.- это нормальная кривая анизоцитоза. При анемиях (уменьшении количества эритроцитов и гемоглобина) кривая анизоцитоза может смещаться влево или вправо. Смещение кривой анизоцитоза вправо наблюдается при витамин В12 дефицитной анемии. При этом резко увеличивается варьирование диаметров эритроцитов в пределах 7-8 мк – такое сильное варьирование диаметров эритроцитов называется пойкилоцитозом. При смещении кривой анизоцитоза вправо увеличивается процент эритроцитов с большим диаметром, поэтому насыщение одного эритроцита гемоглобином увеличивается и наблюдается увеличение цветного показателя (степень насыщения эритроцита гемоглобином) больше единицы (гиперхромная анемия). Цветной показатель (ЦП) – показывает степень насыщения одного эритроцита гемоглобином. В норме ЦП равен 0,8–1,0. По величине ЦП различаем три вида анемий: 1) нормохромная – при этом ЦП остается в пределах нормы; 2) гиперхромная – при этом ЦП больше 1,0; 3) гипохромная – при этом ЦП ниже 0,8.
Гемоглобин, количество, функции. Физиологические соединения гемоглобина
Количество гемоглобина – дыхательного пигмента эритроцита (практически весь объем эритроцита заполняется этим пигментом) состоит из 4 полипептидных цепей глобина (белка), каждая из которых связано с одной молекулой гемма (не белковой частью). Гемм построен из 4 молекул пиррола, образующих порфириновое кольцо, в центре которого находится атом двухвалентного железа. Количество гемоглобина в норме 130-160 г/л. Различают несколько типов гемоглобина, образующихся на разных сроках развития организма: 1) НвР – примитивный, или эмбриональный появляются у 19-дневного эмбриона, присутствует в эритроидных клетках в первые 3-6 мес беременности; 2) НвF – фетальный появляется на 8-36 недели беременности и составляет 90-95% всего гемоглобина плода. Особенность этого типа гемоглобина заключается в том, что его сродство к кислороду не изменяется в присутствии 2,3 дифосфоглицерата; 3) НвА начинает появляться на 7-8 мес беременности (10%) и максимальной величины достигает на 9 мес (90%) при уменьшении НвF (до 10%). Количество НвF при рождении является одним из объективных критериев доношенности плода – чем больше НвF, тем менее доношен плод. Следует отметить, что HbF в присутствии 2,3 дифосфоглицерата (ДФГ – продукт метаболизма оболочки эритроцита при недостатки кислорода) не меняет своего сродства к кислороду в отличии от HbA, сродство которого к кислороду снижается.
Различают следующие физиологические соединения гемоглобина: 1) оксигемоглобин (НвО2) соединение гемоглобина с кислородом, которое образуется в капиллярах малого круга кровообращения. При этом соединении валентность железа не меняется, оставаясь двухвалентным, благодаря чему это соединение легко распадается в капиллярах большого круга кровообращения; 2) карбогемоглобин (НвСО2) – соединение гемоглобина с углекислым газом, которое образуется в капиллярах большого круга кровообращения и распадается в капиллярах малого круга кровообращения; в) дезоксигемоглобин, или редуцированный (ННв).
Количество лейкоцитов, их виды и функции
Лейкоциты – это белые кровяные тельца. В норме их 4,5–9х109/л. Функции лейкоцитов:
Нейтрофилы, или микрофаги (48-78%) выполняют функцию фагоцитоза в нейтральной среде (процесс активного захватывания и поглощения микроорганизмов, разрушенных клеток и инородных частиц). Фагоцитоз и внутриклеточное переваривание чужеродных тел открыты в 1892 г лауреатом Нобелевской премии И.И. Мечниковым. Фагоцитоз осуществляется в 3 этапа – адгезия, поглощение и переваривание с участием лизосомальных ферментов. В среднем один нейтрофил способен фагоцитировать до 12-15 микробов, поэтому их называют микрофагами. В зависимости от возраста различают следующие виды нейтрофилов: юные (0-0,5%), палочкоядерные (1-4%) и сегментоядерные (65-70%). Базофилы – (0-1,0%) – «фармакологические бомбы», открыты в 1877 г. П. Эрлихом. Различают два вида базофилов: циркулирующие в переферической крови – гранулоциты и базофилы, локализованные в тканях – тканевые базофилы или тучные клетки. Они выполняют следующие функции – очищают среду от биологически активных веществ путем их поглощения, продуцируют гепарин, серотонин и гистамин – эти вещества участвуют в регуляции микроциркуляции (гистамин и серотонин активируют проницаемость капилляров, а гепарин препятсвует свертыванию крови). Эозинофилы (0,5-5,0%) их гранулы содержат антипаразитарный щелочной белок, простагландины, лейкотриены, гистаминазу. Эозинофилы участвуют в уничтожении гельминтов, тормозят функцию базофилов; – выполняют три основные функции: 1) противоглистный иммунитет; 2) предупреждает проникновение антигена в сосудистое русло: выйдя из капилляра, эозинофилы встречают на пути антигены и связывают их – это дезинтоксикационная функция; 3) эозинофилы способны поглощать гранулы базофилов, наполненные гистамином и за счет гистаминазы разрушать это вещество. Моноциты, или макрофаги (3-11%), образуются в костном мозге. Моноциты крови незрелые, проникая в ткани они дифференцируются в макрофаги. Они выполняют функцию фагоцитоза в кислой среде, участвуют в иммунных реакциях, синтезируют цитокины и факторы, принимающих участие в свертывании крови. Лимфоциты (20-35%) обеспечивают гуморальный и клеточный иммунитет, регулируют деятельность клеток других типов в иммунных реакциях, процессах пролиферации и регенерации тканей, секретируют цитокины. С функциональной точки зрения различают В-лимфоциты, Т-лимфоциты и NK-клетки. В-лимфоциты образуются в костном мозге и составляют около 10% от всех лимфоцитов – обеспечивают гуморальный иммунитет. Т-лимфоциты их предшественники из костного мозга поступают в тимус и здесь происходит их дифференцировка. Зрелые Т-лимфоциты поступают в кровь (80% от всех лимфоцитов), участвуют в клеточном и гуморальном иммунитете (уничтожают аномальные клетки своего организма, участвуют в аллергических реакциях и в отторжении чужеродного трансплантата.
Лейкоцитарная формула (изменение в онтогенезе). Лейкоцитоз (со сдвигом влево и вправо), лейкопения, лейкопоэз.
Лейкоцитарная формула – процентное содержание разных видов лейкоцитов: нейтрофилов – 65–70% (юных – 0-1%, палочкоядерных – 1-4%, сегментоядерных – 60-65%); базофилов – 0-1%; эозинофилов 0-5%; моноцитов 6-8% и лимфоцитов – 25-30%. В процессе онтогенеза отмечается особенности в изменении лейкоцитарной формулы. У новорожденного %-содержание нейтрофилов и лимфоцитов такое же как у взрослых. Затем отмечается увеличение % содержания лимфоцитов и уменьшение % содержания нейтрофилов и в возрасте 5-6 дней уравнивается % содержание нейтрофилов и лимфоцитов (первый перекрест). Далее с увеличением возраста продолжает увеличиваться % содержание лимфоцитов и снижаться % содержание нейтрофилов. К 5-6 мес отмечается наибольший % лимфоцитов (до 70%) и наименьший процент нейтрофилов (до 20%). После этого количество лимфоцитов уменьшается, а количество нейтрофилов увеличивается и к 5-6 годам уравнивается % содержание лимфоцитов и нейтрофилов (второй перекрест). К 14-16 годам (4) %-содержание нейтрофилов устанавливается в пределах 65-70%, а лимфоцитов – в пределах 20-25%, т.е. на ровне взрослых людей. Увеличение лейкоцитов называется лейкоцитоз. При этом увеличение количества лейкоцитов может быть преимущественно за счет молодых форм нейтрофилов (юных и палочкоядерных) в этом случае говорят о лейкоцитозе со сдвигом влево, а может быть увеличение лейкоцитов за счет преимущественно зрелых форм нейтрофилов (сегментоядерных) – в этом случае говорят о лейкоцитозе со сдвигом вправо. Уменьшение количества лейкоцитов называется лейкопения, образование новых лейкоцитов – лейкопоэз.
Тромбоциты, их функции (ангиотрофическая и адгезивно-агрегационная)
Тромбоциты – кровяные пластинки в норме их 190–405х109/л. Две трети кровяных пластинок находятся в крови, остальные депонированы в селезенке. Продолжительность жизни тромбоцитов 8 дней. В физиологических условиях тромбоциты находятся в неактивном состоянии и свободно циркулируют в крови, не адгезируют друг с другом и не прикрепляются к эндотелию сосуда (эндотелиальные клетки сосуда вырабатывают простациклин, препятствующий адгезии тромбоцитов к стенке сосуда). При повреждении сосуда тромбоциты вместе с плазменными факторами свертывания крови образуют сгусток – тромб, предотвращающий кровотечение.
Они выполняют следующие функции: 1) совершают ангиотрофику – питание сосудистой стенки; 2) образуют тромбоцитарную пробку; 3) поддерживают в спазмированном состоянии гладкие мышцы поврежденного сосуда; 4) участвуют в свертывании крови и фибринолизе.
Ангиотрофическая функция заключается в том, что тромбоциты «вливают» свое содержимое в эндотелий и «подпитывают» его. Для этой функции участвуют около 15% циркулирующих в крови тромбоцитов. При снижении тромбоцитов (тромбоцитопении) возникает дистрофия эндотелия, в результате чего эндотелий начинает пропускать эритроциты, возникает диапедез, кровоизлияние. При этом наблюдается повышенная ломкость сосудов.
Адгезивно-агрегационная функция – при этом возникает тромбоцитарная пробка. Образование тромбоцитарной пробки происходит в две фазы: вначале происходит адгезия (прилипание) тромбоцитов к субэндотелиальным структурам. Этому процессу способствует коллаген (3-10с). Затем происходит внутрисосудистая агрегация (скручивание и склеивание) тромбоцитов и образование конгломератов из 10-20 тромбоцитов, которые приклеиваются к месту повреждения. Тромбоцитарная пробка формируется в пределах 1-3 минут от момента повреждения. При образовании тромбоцитарной пробки разрушаются тромбоциты и освобождаются внутритромбоцитарные факторы, обозначаемые арабскими цифрами и буквой Р. В настоящее время известно 15 внутритромбоцитарных фактора.
Роль составных частей крови в свертывании
По современным представлениям в процессе свертывания крови принимают участие много факторов: плазменные, тромбоцитарные, сосудистого эндотелия и субэндотелия, а также форменные элементы.
Плазменные факторы свертывания крови – обозначаются римскими цифрами, активация фактора обозначается добавлением буквы «а». В настоящее время пятнадцать плазменных факторов:I – фибриноген, образуется в печени; II – протромбин, образуется в печени при участии витамина К; IV – ионы кальция участвует во всех стадиях коогуляционного гемостаза; V – проакцелерин, образуется в печени; VIII – антигемофильный глобулин А, образуется в печени, селезенке, лейкоцитах, эндотелии, почках; IX – антигемофильный глобулин В. Недостатоr VIII и IX факторов приводит к гемофилии; X – способствует переходу протромбина в тромбин; XII – фактор контакта (Хагемана), предположительно образуется эндотелиоцитами, лейкоцитами, макрофагами, способствует образованию протромбиназы; XIII – фибринстабилизирующий фактор препятствует фибринолизу
Тромбоцитарные факторы обозначаются арабскими цифрами. В настоящее время известно 15, которые участвуют при коогуляционном гемостазе
Сосудистый эндотелий синтезирует ряд веществ, препятствующих свертыванию крови: 1) активатор плазминогена – превращает плазминоген в плазмин (фибринолизин); 2) простоциклин ПГИ2 – ингибитор агрегации тромбоцитов; 3) антитромбин-III – самый мощный антикоагулянт – он ингибирует активность всех факторов внутреннего механизма образования протромбиназы, а также активизирует гепарин (в его отсутствии гепарин не проявляет свой эффект); 4) АДФазу, которая регулирует количество АДФ в крови необходимого для свертывания крови.
Сосудистый субэндотелий синтезирует факторы, которые способствует коагуляции крови: 1) колаген-активатор тромбоцитов – способствует агрегации тромбоцитов; 2) фактор Хагемана – от активности которого зависит процесс коагуляции.
Форменные элементы участвуют в сосудисто-тромбоцитарном гемостазе.
Стадии коагуляционного гемостаза
В ответ на повреждение сосуда развертываются два последовательных процесса – сосудисто-тромбоцитарный гемостаз и коагуляционный гемостаз (ферментативное свертывание).
Коагуляционный гемостаз. это ферментативное свертывание крови, при котором происходит превращение фибриногена в фибрин, в результате чего образуется кровяной сгусток, закупоривающий выход из сосуда. При коагуляционном гемостазе различают следующие фазы:
1 фаза – это образование активного ферментного комплекса, который раньше назывался тромбопластином, а в настоящее время – протромбиназой (комплекса, состоящего из активированного Х фактора, акцелерина, тромбоцитарного тромбопластина и ионов кальция – Ха + V + Р3 + ионы кальция).
2 фаза – это образование тромбина (IIа) из протрмбина (II) под влиянием протромбиназы. Этот процесс осуществляется очень быстро (2-5с.). Эта фаза протекает с участием факторов IV, V, Х, а также Р3 за счет которого повышается активность протромбиназы в 1000 раз.
3 фаза – это образование фибрина. Под влиянием тромбина от фибриногена отщепляются фибринопептиды В и А и образуется фибрин-мономер (Im), который благодаря свободным связям образуют сеть волокон фибрина - фибрин-полимер S (растворимый фибрин и чувствителен к плазмину), далее под действием фибринстабилизирующего фактора (XIIIа) и фибриназы тканей, тромбоцитов и эритроцитов происходит образование окончательного (нерастворимого) фибрина.
4 фаза – ретракция сгустка крови (уплотнение), или посткоагуляционная фаза (70 мин) – ретракция тромба, осуществляется за счет сократительных белков тромбоцитов, находящихся в тромбе, при этом объем тромба уменьшается на 50%. Спустя некоторое время после образования сгустка, он начинает уплотняться. Этот процесс протекает с участием Р6 (белок – тромбостенин) и ионов кальция. В результате ретракции тромб плотнее закрывает поврежденный сосуд и сближает края раны.
Стадии сосудисто-тромбоцитарного гемостаза
Сосудисто-тромбоцитарный гемостаз – первый этап свертывания крови, осуществляет остановку кровотечения в сосудах микроциркуляции (их диаметр менее 200мкм). При повреждении сосуда происходит образование тромба, чему способствуют свойства субэндотелия. Одновременно, в ответ на повреждение сосуда возникает спазм (сокращение) гладких мышц под влиянием серотонина. Все это уменьшает кровоток из поврежденного сосуда. Благодаря адгезивно-агрегационной функции тромбоцитов в местах повреждения сосудистой стенки образуется тромбоцитарная пробка, при котором различают следующие фазы:
-1ф – спазм поврежденных сосудов: а) первичный спазм – за счет рефлекторного механизма при взаимодействии медиатора норадреналина с альфа адренореактивной субстанцией ГМК сосудов; б) вторичный спазм – поддерживается адреналином, серотонином, трмбоксаном А2;
- 2ф – адгезия – прилипание тромбоцитов в зоне повреждения сосуда
- 3ф – агрегация тромбоцитов, скучивание с образованием конгломерата из тромбоцитов. При этом происходит освобождение внутритромбоцитарных факторов и начинается коагуляционный гемостаз;
- 4ф – ретракция (сокращение) тромбоцитарного тромба.
Показателем активности сосудисто-тромбоцитарного гемостаза является время кровотечения (норма 4 мин)
Антикоагулянты прямого и непрямого действия. Цитратная кровь
Антикоагулянты – это вещества, препятствующие свертыванию крови.Для практических целей используются искусственные антикоагулянты, которые по своему механизму действия различают два вида: прямые и непрямые.
Прямые антикоагулянты непосредственно препятствуют свертыванию крови, например, цитрат натрия. Это вещество осаждает ионы кальция, поэтому прекращается ферментативное свертывание крови, так как ионы кальция участвуют во всех стадиях коагуляционного гемостаза. Кровь с цитратом натрия называют цитратная кровь, она не свертывается. Цитрат натрия используют для стабилизации донорской крови. К прямым антикоагулянтам относится гепарин (блокирует фазу перехода протромбина в тромбин и фибриногена в фибрин); гирудин (фермент в слюне пиявок – блокирует переход фибриногена в фибрин); понижение температуры; плазмин (растворяет нити фибрина).
Непрямые антикоагулянты действуют на органы и препятствуют синтезу в этих органах прокоагулянтов, например, дикумарин, пелентан. Эти вещества действуют на печень и препятсвуют синтезу протромбина, который участвует в образовании тромбина.
В нормальных условиях кровь в сосудах всегда находится в жидком состоянии, хотя условия для образования внутрисосудистых тромбов существуют постоянно. Поддержание жидкого состояния крови осуществляется за счет свертывающей и противо-свертывающей системы.
Классификация групп крови по наличию или отсутствию агглютининов и агглютиногенов, формулы групп крови
В 1901 г. К. Ландштейнер впервые открыл группы АВО. Группы крови – это совокупность признаков, характеризующих антигенную структуру эритроцитов и специфичность антиэритроцитарных антител, которые учитываются при подборе крови для трансфузии (переливании). По международной системе различают четыре группы крови, которые отличаются по наличию или отсутствию агглютиногенов в эритроцитах и агглютининов в плазме. Агглютиногены – антигены, с которыми взаимодействуют агглютинины. Антигены – это вещества макромолекулярной природы, несущие признаки чужеродной для организма генетической информации. Агглютиногены находятся в оболочке эритроцита и различают А и В. Агглютинины (лат. agglutino – склеивать) – антитела, агглютинирующие эритроциты после взаимодействия с антигенами, находящимися на их поверхности. Различают два агглютинина – альфа и бета (гамма-глобулины), которые находятся в плазме. По системе АВО выделено 4 группы крови, обозначаемых римскими цифрами I, II, III и IV. Эритроциты группы крови I не содержат ни агглютиноген А, ни агглютиноген В, ее сокращенное наименование 0(I), эритроциты группы крови II содержат агглютиноген А – А(II), эритроциты группы крови III содержат агглютиноген В – В(III), эритроциты группы крови IV содержат агглютиноген А и В – АВ(IV). Плазма крови группы 0(I) содержит альфа и бета агглютинины; группы А(II) – бета агглютинины; группы В(III) – альфа агглютинины; группы АВ(IV) – нет агглютининов. Таким образом, полное сокращенное наименование группы крови (формула) выглядит следующим образом: I (0αβ); II (Aβ); III (Bα); IV (AB0). Количество людей с разными группами различна: I – 33,5%, II – 37,8%, III – 20,6% и IV – 8,1%.
Определение групп крови с помощью стандартных сывороток
Группы крови можно определить с использованием стандартной сыворотки I, II, и III групп, в каждую сыворотку добавляют кровь исследуемого (1/10, т.е. количество сыворотки должно быть в 10 раз больше крови). На лунки специальных стекол добавляем сыворотки Iгруппы с содержанием альфа и бета агглютининов, II группы с содержанием бета агглютининов и III группы с содержанием альфа агглютининов. После в каждую луночку добавляем по капле исследуемой крови. Разными стеклянными палочками размешивают кровь с сывороткой и через 5 мин оценивают результат.
Сыворотка I группы служит контролем: если реакция агглютинации произошла в сыворотке II группы или в сыворотке III группы (в), то обязательно должна произойти и в сыворотке I группы, где есть агглютинин альфа и бета.
Если реакция агглютинации происходит во всех сыворотках, тогда в эритроцитах исследуемой крови имеются агглютиногены А и В, следовательно эта кровь IV группы; реакция агглютинации в сыворотке I и II групп свидетельствует о наличии в исследуемой крови только агглютиногена А, следовательно это II группа крови; реакция агглютинации в сыворотке I и III групп свидетельствует о наличии в исследуемой крови только агглютиногена В, следовательно это III группа крови; отсутствие реакция агглютинации во всех сыворотках свидетельствует о том, что в эритроцитах исследуемой крови отсутствуют агглютиногены, следовательно это I группа крови);
Определение групп крови и резус-фактора с помощью цоликлонов
Более точный способ определения группы крови и резус фактора (агглютиноген Д) с помощью цоликлонов анти-А, анти-В и анти-Д. Цоликлон анти А дает возможность определить наличие или отсутствие агглютиногена А в эритроцитах исследуемой крови, цоликлон анти В – о наличии или отсутствия агглютиногена В в эритроцитах исследуемой крови, цоликлон анти Д дает возможность определить наличие (резус положительная кровь) или отсутствие (резус отрицательная кровь) агглютиногена Д (резус агглютиногена) в эритроцитах исследуемой крови.
Для этого в углубления планшеты двумя пипетками наносят по капле цоликлона анти-А и анти-В рядом с каплями наносят по маленькой капле крови (в 10 раз меньше), двумя стеклянными палочками смешиваем и через 2-3 мин оценивают результат (нет агглютинации с цоликлоном анти-А и с цоликлоном анти-В - I группа крови; агглютинация только с цоликлоном анти-А - II группа крови ; агглютинация только с цоликлоном анти-В - III группа крови; реакция агглютинация с цоликлоном анти-А и с цоликлоном анти-В - IV группа крови). Резус совместимость определяют с помощью цоликлона анти- D. Для этого в углубления планшеты пипеткой наносят каплю цоликлона анти- D, рядом с каплей наносим по маленькой капле крови (в 10 раз меньше), стеклянной палочкой смешиваем и через 2-3 мин оценивают результат (нет агглютинации с цоликлоном анти-D – кровь резус отрицательная, если есть агглютинация – кровь резус положительная).
Реакция агглютинации и условия для ее возникновения
При переливании крови необходимо остерегаться реакции агглютинации – склеивании эритроцитов с последующим их гемолизом (гемотрансфузионный шок). Для реакции агглютинации необходимы два условия: 1) встреча одноименных агглютиногенов и агглютининов (агглютиноген А с агглютинином альфа; агглютиноген В с агглютинином бета); 2) досточная концентрация агглютининов, так как они, в отличие от агглютиногенов, способны разбавляться в плазме реципиента. Пороговая концентрация агглютининов, при котором происходит реакция агглютинации, соответствует той, которая отмечается при разбавлении 1:13. Таким образом, если агглютинины разбавились в крови реципиента более, чем в 13 раз (1:14, 1:15, 1:16 и т.д.) они не способны склеивать эритроциты с одноименным агглютиногеном, если агглютинины разбавились в крови реципиента в 13 раз и меньше (1:13, 1:12, 1:11 и т.д.) они способны склеивать эритроциты с одноименным агглютиногеном. Следует отметить, что агглютиногены находятся в оболочке эритроцита и не способны разбавляться в крови реципиента (человека, которому переливают кровь), агглютинины находятся в плазме и поэтому способны разбавляться в крови реципиента.
Исходя из правила разведения, I гр. крови (в небольшом количестве 100-150 мл) можно переливать во все группы; II гр. – во II и IV; III гр. – в III и IV; IV гр. – только в кровь IV группы. Людей с I гр. крови называют универсальными донорами, а людей с IV гр. крови – универсальными реципиентами.
В настоящее время от этого принципа переливания крови практически отказались и для переливания используют только одногруппную кровь. Отказом от классических правил переливания служит две основные причины: 1) при переливании иногруппной крови невозможно переливать донорскую кровь в большом количестве, что бывает необходимым при ряде хирургических операциях; 2) наличие большого количества подгрупп крови , так как обнаружены несколько вариантов агглютиногенов А и В. Кроме того, в настоящее время известны и другие агглютиногены (кроме системы АВО): M, N, S, P и другие – всего около 400 агглютиногенов
Групповая, индивидуальная и биологическая совместимость крови
Перед переливанием крови обязательно проводится три пробы:
1) проба на групповую и резус совместимость крови донора с кровью реципиента.
Для этого используют более точный способ определения группы крови и резус фактора (агглютиноген Д) с помощью цоликлонов анти-А, анти-В и анти-Д. Цоликлон анти А дает возможность определить наличие или отсутствие агглютиногена А в эритроцитах исследуемой крови, цоликлон анти В – о наличии или отсутствия агглютиногена В в эритроцитах исследуемой крови, цоликлон анти Д дает возможность определить наличие (резус положительная кровь) или отсутствие (резус отрицательная кровь) агглютиногена Д (резус агглютиногена) в эритроцитах исследуемой крови.
2) индивидуальная совместимость в 2-3 капли сыворотки реципиента, взятой после ретракции сгустка крови, добавляют маленькую каплю донорской крови, агглютинация должна отсутствовать;
3) биологическая совместимость – переливают 5-10 мл крови и в течение 3-х мин убеждаются в отсутствии реакции на несовместимость (потемнение в глазах, боль в пояснице), такую процедуру проводят три раза, затем продолжают трансфузию.
Резус-фактор. Резус положительная и резус отрицательная кровь
Резус фактор был открыт К.Ландштейнером и А. Винером (1937-1940 гг.) в результате иммунизации кроликов кровью обезьян – макак-резусов. В настоящее время выявлено много антигенов этой природы, поэтому более правильно говорить о резус-системе. Наиболее активными в антигенном отношении является антиген D, в меньшей степени С и Е. Оказалось, не все люди содержат эти антигены. Человек считается резус-положительным, если в его эритроцитах обнаруживается наиболее активный антиген – D. Среди европейцов таких людей – 86%, у представителей монгольской расы – 100%. У аборигенов Австралии в эритроцитах не выявлен ни один представитель системы резус. Такой вариант называют резус-нуль. Человек считается резус-отрицательным, если в его эритроцитах отсутствует агглютиноген D. Резус-конфликт возникает в тех случаях, когда в крови с антигеном D возникают резус-агглютинины, которые способствуют реакции агглютинации эритроцитов (склеиванию эритроцитов), имеющих данный агглютиноген. Этот конфликт возникает при следующих обстоятельствах: 1) при переливании резус положительной крови реципиенту с резус отрицательной кровью то в его организме образуются антирезус-агглютинины. При повторном переливании этому человеку резус-положительной крови произойдет реакция агглютинация эритроцитов, содержащих резус-фактор; 2) при развитии плода с резус положительной кровью у матери с резус отрицательной кровью (резус фактор у плода появляется с 3-го мес и достигает иммунологической активности к концу беременности); 3) при переливании реципиенту с резус положительной кровью резус отрицательную кровь матери после резус-конфликта с плодом.
Условия конфликта по резус-фактору между организмами матери и плода
Следует отметить, что каждая 10-я женщина резус-отрицательная. Если у матери с резус-отрицательной кровью развивается резус-положительный плод, то при первой беременности вероятность иммунизации матери эритроцитами плода зависит от объема проникающих в русло матери этих эритроцитов. Обычно до 8-й недели эритроциты не способны проходить плацентарный барьер, в последующие недели беременности они в небольших количествах могут проникать в русло матери. Значительное поступление эритроцитов плода в организм матери наблюдается в период родовой деятельности. Ответ материнского организма зависит от объема проходящих эритроцитов: если входят малые количества, то развивается толерантность, материнский организм не синтезирует антитела к резус-фактору. Если проходят большие количества (более 0,1-0,5 мл), то вырабатываются антитела – резусагглютинины, которые проникают через плаценту и вызывают внутрисосудистый гемолиз эритроцитов плода. Обычно при первой беременности до родов массивного проникновения эритроцитов не происходит, поэтому антитела появляются лишь после родов, вызывая агглютинацию за счет перехода из материнского молока в организм ребенка. При повторной беременности (если не было иммунопрофилактики) за счет клеток-памяти продукция антител идет интенсивнее. У 10% резус-отрицательных женщин беременность протекает без образования антител. Самые ранние признаки резус-конфликта при первой беременности – после 24 недель.
Пробы, проводимые при переливании крови
Перед переливанием крови обязательно проводится следующие пробы:
1) проба на групповую и резус совместимость крови донора с кровью реципиента.
Для этого используют более точный способ определения группы крови и резус фактора (агглютиноген Д) с помощью цоликлонов анти-А, анти-В и анти-Д. Цоликлон анти А дает возможность определить наличие или отсутствие агглютиногена А в эритроцитах исследуемой крови, цоликлон анти В – о наличии или отсутствия агглютиногена В в эритроцитах исследуемой крови, цоликлон анти Д дает возможность определить наличие (резус положительная кровь) или отсутствие (резус отрицательная кровь) агглютиногена Д (резус агглютиногена) в эритроцитах исследуемой крови.
2) индивидуальная совместимость в 2-3 капли сыворотки реципиента, взятой после ретракции сгустка крови, добавляют маленькую каплю донорской крови, агглютинация должна отсутствовать;
3) биологическая совместимость – переливают 5-10 мл крови и в течение 3-х мин убеждаются в отсутствии реакции на несовместимость (потемнение в глазах, боль в пояснице), такую процедуру проводят три раза, затем продолжают трансфузию.
