
6 курс / Клинические и лабораторные анализы / Стабильность_структурно_функциональных_свойств_углеродных_диагностикумов
.pdf
ДОКЛАДЫ АКАДЕМИИ НАУК, 2013, том 450, № 4, с. 492–495
ОБЩАЯ
БИОЛОГИЯ
УДК 573.6.086.83:57.083.3
СТАБИЛЬНОСТЬ СТРУКТУРНО ФУНКЦИОНАЛЬНЫХ СВОЙСТВ УГЛЕРОДНЫХ ДИАГНОСТИКУМОВ
© 2013 г. В. П. Тимганова, М. С. Бочкова, М. Б. Раев
Представлено академиком В.А. Черешневым 14.08.2012 г.
Поступило 27.08.2012 г.
DOI: 10.7868/S0869565213160287
Такие характеристики систем аналитического тестирования, как надежность, стабильность, вос производимость, применительно к неинструмен тальным методам диагностики в конечном итоге определяют правомерность их использования в ре альной диагностической практике. Вместе с пара метрами, определяющими чувствительность и спе цифичность, показатели надежности способствуют закреплению на диагностическом рынке соответ ствующих тест систем. Отсутствие должного раз нообразия неинструментальных диагностических наборов по сравнению с инструментально аран жированными системами свидетельствует о на личии определенных проблем в их внедрении, не смотря на существенный интерес к разработке аналитических систем, предназначенных для упрощенной неинструментальной детекции, ос нованной на использовании метода твердофазно го иммуноанализа. Практика и опыт работы в данной области, а также многочисленные литера турные источники свидетельствуют о решающей роли в формировании проблем, связанных с внед рением методов упрощенного неинструментально го тестирования, неудовлетворительной стабильно сти структурно функциональных свойств компо нентов аналитических систем и в первую очередь – детектирующих реагентов (конъюгатов) [1, 2].
Твердофазный иммуноферментный анализ, реализующий свои задачи при помощи фермент но субстратных систем, позволяющих получать нерастворимые окрашенные продукты, имеет ряд недостатков: небольшой срок хранения конъюга тов, жесткие требования к условиям транспорти ровки, нестойкость хромогенных субстратов и их продуктов, недостаточную цветность отдельных продуктов реакции, токсичность большинства хромогенов. Кроме того, технология синтеза фер ментных диагностикумов требует четкого соблю
Институт экологии и генетики микроорганизмов Уральского отделения Российской Академии наук, Пермь
дения всех условий и режимов, отклонение от ко торых может приводить впоследствии к высокому уровню неспецифического связывания реагента с молекулами белков, не имеющих отношение к диагностическому результату, завышая, таким об разом, детектируемое количество лиганда [3].
Более привлекательным во многих отношени ях, в том числе и с точки зрения уменьшения вре менных затрат на проведение аналитической процедуры, является использование в аналитиче ских системах неферментных меток, позволяю щих осуществлять непосредственную визуальную регистрацию стереоспецифического соединения, без введения проявляющих компонентов. В каче стве таких меток применяются различные микро и наночастицы природного и синтетического происхождения: эритроциты, липосомы, латекс ные частицы, частицы коллоидного серебра, зо лота, оксида железа III, двуокиси кремния, а так же сера, теллур и др. [4–8].
Основными недостатками корпускулярных конъюгатов на основе вышеуказанных меток яв ляются: нестабильность структуры самой части цы, неустойчивость связи между частицей и аф финным компонентом, сказывающаяся на усло виях и сроке хранения диагностикума, а также низкая хромофорность метки, снижающая чув ствительность тест системы.
Хорошей альтернативой вышеперечисленным иммунореагентам являются диагностикумы на основе частиц углерода. Высокая хромофорность черной метки обеспечивает бóльшую чувстви тельность аналитического тестирования при ис пользовании углеродных конъюгатов по сравне нию с другими при прочих равных условиях [9], а постоянная структура самой частицы определяет надежность готовых диагностических реагентов.
Оригинальная технология синтеза углеродных конъюгатов с использованием различных аффин ных соединений, основанная на ковалентном структурировании белковых молекул на поверх ности наноразмерной частицы углерода [10, 11],
492
|
СТАБИЛЬНОСТЬ СТРУКТУРНО ФУНКЦИОНАЛЬНЫХ СВОЙСТВ |
493 |
|||||
Таблица 1. Размеры частиц углеродных конъюгатов, полученные методом динамического светорассеяния |
|||||||
|
|
|
|
|
|
|
|
|
Стрептавидин–углерод |
|
|
Белок А–углерод |
|
||
|
|
|
|
|
|
|
|
год синтеза |
СГД, нм |
ИП |
ПР, нм |
год синтеза |
СГД, нм |
ИП |
ПР, нм |
|
|
|
|
|
|
|
|
1990 |
180 |
0.10 |
201 |
1991 |
176 |
0.17 |
208 |
1992 |
184 |
0.15 |
219 |
1992 |
180 |
0.20 |
199 |
2002 |
173 |
0.15 |
203 |
1994 |
162 |
0.17 |
179 |
2009 |
201 |
0.10 |
232 |
2002 |
168 |
0.10 |
190 |
2010 |
181 |
0.10 |
205 |
|
|
|
|
2012 |
162 |
0.19 |
203 |
|
|
|
|
|
|
|
|
|
|
|
|
Примечание. СГД – средний гидродинамический диаметр, ИП – индекс полидисперсности, ПР – диаметр частиц по пику распределения размеров частиц по светорассеянию.
хорошо зарекомендовала себя не только в нашей стране, но и за рубежом [9].
Целью работы явилось исследование стабиль ности структурно функциональных свойств угле родных конъюгатов, синтезированных по автор ской технологии с 1990 по 2012 г.
МАТЕРИАЛЫ И МЕТОДЫ
Аморфный углерод получали путем конденси рования из пламени горящего толуола на стек лянной или металлической поверхности. Диагно стические реагенты на основе частиц углерода получены сотрудниками лаборатории экологиче ской иммунологии ИЭГМ УрО РАН [10].
Определение линейных размеров частиц, со ставляющих диагностические реагенты, произво дили на программно аппаратном комплексе Mal vern ZetaSizer NanoZS методом обратного дина мического светорассеяния под углом 173°.
Топографическое исследование конъюгиро ванных частиц осуществляли с использованием атомно силового микроскопа SMM 2000 (“Про тон МИЭТ”, Россия). Результаты любезно предо ставлены А.С. Васильченко (Оренбургский ГУ).
Проверку чувствительности конъюгатов стреп тавидин–углерод проводили в модельной тест си стеме на пористой твердой фазе из нитроцеллюлоз ной мембраны Trans Blot Transfer Medium, Pure Ni trocellulose Membrane с размером пор 0.45 мкм (“Bio Rad”, США). На диски из мембраны диамет ром 5 мм наносили дотами из капель по 3.5 мкл столбнячный анатоксин (“Пермское НПО “Био мед””) в концентрации 0.01 мг/мл в забуферен ном 0.15М Na фосфатами физиологическом рас творе с 0.1% м азидом натрия (“Sigma”, США) (ЗФР). С целью устранения неспецифического свя зывания диски инкубировали в блокирующем рас творе – ЗФР с добавлением 1% казеина (“Sigma”, США). Далее следовала инкубация в 8 последова тельных кратных двум разведениях кроличьих биотинилированных антител к столбнячному
анатоксину (“Пермское НПО “Биомед””) начи ная с концентрации 0.01 мг/мл. Отмывки прово дили ЗФР с добавлением 0.05% Tween 20 (“Fe rak”, Германия). Детекцию проводили конъюга тами стрептавидин–углерод, синтезированными в 1990, 1992, 2002, 2009, 2010, 2012 годах. Резуль тат оценивали визуально по окрашиванию зоны специфического связывания углеродного диагно стикума.
Для проверки чувствительности конъюгатов белок А–углерод использовали аналогичную тест систему, отличающуюся тем, что применяемые про тивостолбнячные кроличьи антитела были небиоти нилированными. Детекцию проводили конъюгата ми, синтезированными в 1991, 1992, 1994, 2002 го дах.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
В первую очередь мы оценивали структурную стабильность диагностикумов, а именно, способ ность отдельных частиц конъюгата сохранять ис ходные физические параметры (размер и форму), поскольку она лежит в основе функциональной надежности.
Интенсивность, % 15
10
5
0 


1 |
10 |
100 |
1000 |
10000 |
|
|
|
Диаметр, нм |
|
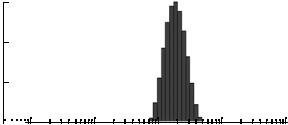
Рис. 1. Пример монопикового распределения разме ров частиц по интенсивности светорассеяния (конъ югат стрептавидин–углерод, размер по ПР = 181 нм).
ДОКЛАДЫ АКАДЕМИИ НАУК том 450 № 4 2013
494 |
ТИМГАНОВА и др. |
|
1 мкм |
|
|
500 нм |
|
|
200 нм |
|||
|
|
|
|
|
|
|
|
|
|
|
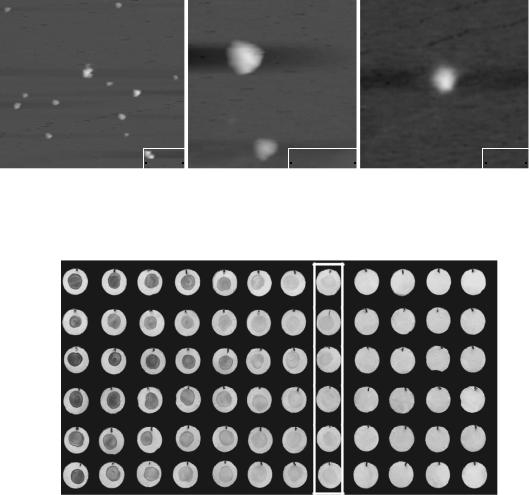
Рис. 2. Топографическое изображение конъюгированных частиц, полученное методом атомно силовой микроскопии в масштабе 1 мкм, 500 и 200 нм.
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
10 |
11 |
К |
|
|
Год |
|
|
|
|
|
|
|
|
|
|
|
– |
|
1990 |
|
|
|
|
|
|
|
|
|
|
|
|
|
1992 |
|
|
|
|
|
|
|
|
|
|
|
|
|
2002 |
|
|
|
|
|
|
|
|
|
|
|
|
|
2009 |
|
|
|
|
|
|
|
|
|
|
|
|
|
2010 |
|
|
|
|
|
|
|
|
|
|
|
|
|
2012 |
|
|
|
|
|
|
|
|
|
|
|
|
|
Рис. 3. Оценка чувствительности детекции конъюгатами стрептавидин–углерод в модельной тест системе с биотини лированными кроличьими антителами к столбнячному анатоксину. Здесь и на рис. 4 диски с 1 по 11 – разведения ан тител от 10 мкг/мл до 9 нг/мл. Белой рамкой выделены последние визуализируемые точки, соответствующие концен трации антител 78 нг/мл. K—отрицательный контроль (растворитель без антител).
Показатели среднего гидродинамического диа метра (СГД) частиц конъюгатов, синтезированных в разное время (табл. 1), варьируются в диапазоне от 162 до 201 нм. Однако индекс полидисперсности (ИП), в некоторых измерениях превышающий 0.1, не позволяет во всех случаях ориентироваться на СГД. При исследовании конъюгатов обнаружено, что распределение частиц по интенсивности све торассеяния во всех случаях было монопиковым (рис. 1), что само по себе говорит о преобладании одного размера, а следовательно, об отсутствии агрегации частиц. Анализ размеров по пикам рас пределения (ПР) позволяет убедиться в том, что размеры частиц конъюгатов, синтезированных с 1992 по 2012 г., находятся в узком диапазоне зна чений. Поскольку для синтеза всех конъюгатов использовали один и тот же аморфный углерод, а молекулы стрептавидина и белка А имеют близ кие размеры (Mr = 60 и 56 кДа соответственно),
мы сочли возможным статистически обработать данные, касающиеся размеров функционализи рованных этими молекулами частиц в единой вы борке: M ± m = 203.9 ± 4.6; σ = 14.46; CV = 7.09.
Полученные результаты свидетельствует об оптимальной технологичности синтеза конъюга тов, которая позволяет получать реагенты с высо ким уровнем стандартизации характеристик. На личие в суспензоиде конъюгата частиц различных размеров не сказывается отрицательно на резуль татах иммуноаналитических тестов [12], однако стандартизация частиц по размеру необходима, так как чувствительность детекции при наличии крупных частиц может неспецифически усили ваться. Это явление может происходить и при аг регации частиц конъюгатов при длительном хра нении.
Топографическое исследование конъюгирован ных частиц показало, что диагностические реаген
ДОКЛАДЫ АКАДЕМИИ НАУК том 450 № 4 2013

СТАБИЛЬНОСТЬ СТРУКТУРНО ФУНКЦИОНАЛЬНЫХ СВОЙСТВ |
495 |
||||||
1 |
2 |
3 4 |
5 |
6 7 8 |
9 |
10 11 |
К− |
Год
1991
1992
1994
2002
Рис. 4. Оценка чувствительности детекции конъюгатами белок А углерод в модельной тест системе с кроличьими ан тителами к столбнячному анатоксину.
ты состоят из отдельных оформленных структур. Единичные элементы (масштаб 500 и 200 нм) по форме близки к сферической, и их размер сопоста вим с результатами измерений, произведенных с использованием дзета сайзера (рис. 2).
Под функциональной стабильностью мы по нимаем сохранение способности к специфично му связыванию с определяемым соединением. Оценка чувствительности определения конъюга тами стрептавидин–углерод и белок А–углерод показала, что в процессе длительного хранения при t = 4–8°С функциональные свойства диагно стикумов не изменились, о чем свидетельствует одинаковая чувствительность детекции (78 нг/мл) всех конъюгатов в прямом сравнении со свеже синтезированным реагентом (рис. 3, 4).
Таким образом, проведенные исследования наглядно подтверждают высокую структурно функциональную стабильность диагностических реагентов, получаемых по разработанной техно логии, предусматривающей ковалентное структу рирование репортерного и аффинного компо нентов углеродных конъюгатов.
Полученные результаты показывают перспек тивность описанного технологического подхода как к решению проблемы функционализации на ночастиц, так и к конструированию средств ана литического тестирования, пригодных для при менения в клинической диагностике и в лабора торной аналитике.
СПИСОК ЛИТЕРАТУРЫ
1.Van den Pol A.N. // Quart. J. Exp. Physiol. 1984. V. 69.
P.1–33.
2.Bangs L.B. // Clin. Lab. News. 1988. V. 7. № 4A. P. 20– 25.
3.Nakane P.K., Kawaoi A. // J. Histochem. Cytochem. 1974. V. 22. № 12. P. 1084–1091.
4.Moeremans M., Daneels G., Dijck D.V., et al. // J. Im munol. Meth. 1984. V. 74. P. 353–360.
5.Tarcha P.J., Misun D., Finley D., et al. // Polymer La texes: Preparation, Characterization and Application, ACS Symp. Ser. 492; Wash. (D.C.): Amer. Chem. Soc., 1992. Ch. 22.
6.Guesdon J.L., Avrameas S. // Ann. Immunol. 1980.
V.131. № 3. P. 389–396.
7.Akzo N.V. NL Pat. 7807532 A. 15.01.1980.
8.Litchfield W.J., Freytag J.W., Adamich M. // Clin. Chem. 1984. V. 30. № 9. P. 1441–1445.
9.Linares M.E., Kubota L.T., Michaelis J., Thalham% mer S. // J. Immunol. Meth. 2012. V. 375. № 1/2.
P.264–270.
10.Плаксин Д.Ю., Раев М.Б., Громаковская Е.Т. Спо соб стереоспецифического анализа и способ полу чения конъюгата для стереоспецифического ана лиза. Пат. РФ 20899212 // Бюл. изобр. Полез. моде ли. 1997. № 25.
11. Раев М.Б. // Клин. лаб. диагностика. 2008. № 2. С. 45–48.
12. Posthuma%Trumpie G.A., Wichers J.H., |
Koets M., |
et al. // Anal. Bioanal. Chem. 2012. V. |
402. № 2. |
P. 593–600. |
|
ДОКЛАДЫ АКАДЕМИИ НАУК том 450 № 4 2013
