
- •Роль биологических маркеров в неотложной кардиологии
- •Рекомендации для использования биохимических маркеров для диагностики инфаркта миокарда Класс I
- •Класс iIb
- •Класс III
- •Новые биомаркеры: диагностика повреждения миокарда
- •Стратификация риска и выбор оптимальной тактики лечения
- •Многомаркерный подход к стратификации риска
- •Стратификация рисков при острой сердечной недостаточности
- •Тромбоэмболия легочной артерии
Роль биологических маркеров в неотложной кардиологии
Пархоменко А.Н., Иркин О.И., Лутай Я.М. Отдел реанимации и интенсивной терапии, Национальный научно-исследовательский центр «Институт кардиологии им. акад. Н.Д. Стражеско», г. Киев
Журнал «Медицина неотложных состояний» 7-8 (38-39) 2011 / Научный обзор
Болезни системы кровообращения занимают ведущее место в структуре заболеваемости и общей смертности населения большинства стран мира и Украины в частности. Основной причиной кардиальной смерти являются острые коронарные синдромы, острая сердечная недостаточность, тромбоэмболии и жизнеугрожающие нарушения ритма сердца. Правильная и ранняя диагностика острых состояний позволяет своевременно назначить лечение, а определение вероятности развития осложнений — обеспечить индивидуальный подход к терапии. Большую помощь в реализации такого подхода оказывают биологические маркеры (биомаркеры). Под термином «биомаркеры» в медицине принято понимать белки крови, концентрация которых отражает наличие или выраженность того или иного патологического состояния.
Сфера применения биомаркеров при различных острых состояниях в кардиологии:
1. Острый коронарный синдром:
— диагностика острого инфаркта миокарда;
— стратификация риска;
— выбор оптимальной тактики лечения.
2. Острая сердечная недостаточность:
— идентификация пациентов с сердечной недостаточностью (скрининг);
— подтверждение степени выраженности сердечной недостаточности;
— направленный мониторинг пациентов с сердечной недостаточностью (СН);
— мониторинг терапии и ее оптимизация.
3. Тромбоэмболия легочной артерии (ТЭЛА):
— дифференциальная диагностика;
— стратификация риска.
При остром коронарном синдроме (ОКС) биомаркеры в первую очередь применяют для диагностики повреждения миокарда. В настоящее время используется целый ряд маркеров, что обусловлено характерными для каждого из них уровнями кардиоспецифичности и особенностями попадания в кровь после повреждения кардиомиоцитов, опре деляющими различия во времени достижения диагностического и пикового значений, длительность циркуляции маркера (рис. 1).
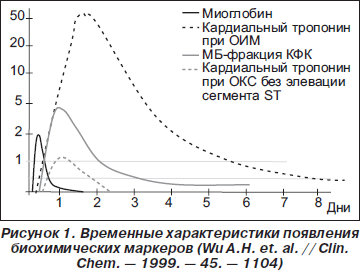
Миоглобин. Сложный белок мышц, связывающий переносимый гемоглобином кислород с образованием оксимиоглобина и, таким образом, обеспечивающий работающую мышцу некоторым запасом кислорода, перенося его к цитохромоксидазе мышечных митохондрий (рис. 2).
Поскольку миоглобин является довольно низкомолекулярным протеином, он легко диффундирует через мембраны поврежденных мышечных клеток и быстро появляется в периферической крови при повреждении миокарда. Содержание миоглобина при инфаркте миокарда (ИМ) повышается в сыворотке крови в пределах 2 ч после возникновения симптомов. Он в неизмененном виде выводится с мочой и уже через 24 часа с момента начала заболевания исчезает из кровотока. Диагностическим уровнем для ИМ считается повышение концентрации миоглобина до 20 нг/мл/ч. Большое содержание миоглобина в скелетной мускулатуре и зависимость его концентрации от функции почек ограничивают его применение для диагностики ИМ.
Факторы, влияющие на изменение концентрации миоглобина в крови:
— острый ИМ;
— сердечно-сосудистая операция;
— повреждение скелетной мускулатуры (в том числе при приеме статинов);
— чрезмерная физическая нагрузка;
— прогрессирующие мышечные дистрофии;
— шок;
— почечная недостаточность.
Преимущества применения миоглобина: высокая чувствительность, эффективен при ранней диагностике ИМ, полезен при исключении инфаркта миокарда, может быть маркером реперфузии. Недостатки: низкая специфичность при повреждении скелетной мускулатуры, травмах, быстро возвращается к нормальным значениям, что ограничивает возможности поздней диагностики.
Клинические рекомендации: не должен использоваться как самостоятельный диагностический маркер ввиду низкой специфичности.
МБ-фракция креатинфосфокиназы (МБ-КФК) — это гетеродимер с молекулярной массой 86 кДа. Среди традиционных маркеров именно определение активности МБ-КФК до последнего времени рассматривалось в качестве золотого стандарта в биохимической диагностике ОИМ. Изоформа МБ-КФК при ОИМ появляется в сыворотке крови через 3–4 ч после начала симптомов и достигает диагностически значимого уровня к 4–6-му часу. Повышенный уровень может сохраняться до 48–72 часов. Доля МБ-КФК среди общей КФК, превышающая 5–6 %, является специфичным признаком некроза миокарда.
При использовании MБ-КФК для диагностики ИМ необходимо неоднократное, динамическое определение концентрации этого маркера в крови, так как МБ-КФК обладает низкой чувствительностью в раннем (до 6–8 ч) и позднем (после 48 ч) периодах ИМ. Эксперты Европейского кардиологического общества считают предпочтительным расчет индекса МБ-КФК: индекс МБ-КФК = (МБ-КФК х х 100)/общая КФК.
Индекс МБ-КФК выше 3–6 % на фоне подъема общей КФК подтверждает диагноз ИМ. В настоящее время МБ-КФК разделяют на две изоформы: МБ1-КФК и МБ2-КФК. В норме соотношение МБ1-КФК : МБ2-КФК = 1 : 1. Соотношение МБ1- КФК : МБ2-КФК = 1 : 1,5 — ранний маркер повреждения миокарда: пик — 2–4 ч; возвращается к норме — 18–30 ч; нормальное соотношение МБ1- КФК : МБ2-КФК через 6 ч после приступа исключает ИМ. МБ2-КФК — тканевая форма, которая, попадая в кровоток, превращается в МБ1-КФК, поэтому соотношение МБ2-КФК/МБ1-КФК больше 1,5 через 1– 2 ч после начала болевого синдрома может свидетельствовать о развитии некроза миокарда.
Преимущества исследования МБ-КФК: быстрое, дешевое, доступное и точное определение, возможность диагностики раннего реинфаркта.
Недостатки: низкая специфичность при повреждении скелетной мускулатуры, травмах, после хирургических вмешательств, низкая чувствительность в ранние (< 6 часов) или поздние (> 36 часов) сроки от развития симптомов острого ИМ; низкая чувствительность при минимальном повреждении миокарда (положительный тест тропонина).
Клинические рекомендации: является стандартом в прошлом и в настоящее время; приемлем для большинства клинических ситуаций. Наибольшее значение имеет для диагностики реинфарктов.
Тропонины Т и I. Основная структурная сократительная единица миоцита — саркомер, который образуют упорядоченно расположенные толстые и тонкие волокна. Тонкие содержат волокна актина и тропонин-тропомиозиновый комплекс. Тропониновый регуляторный комплекс в поперечнополосатых мышцах состоит из трех полипептидов; при диагностике инфаркта миокарда определяют в крови содержание только тропонина Т и тропонина I (рис. 3).
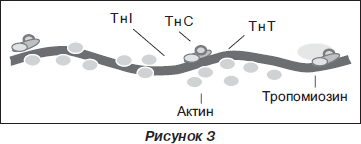
Для экстренной диагностики инфаркта миокарда на догоспитальном этапе наиболее подходит качественный иммунологический тест для определения содержания в крови специфического миокардиального белка тропонина Т. При инфаркте миокарда наблюдаются два пика повышения его концентрации в крови. Первый начинается через 2–3 ч, достигает максимума через 8–10 ч, второй начинается через трое суток. Нормализация концентрации тропонина Т в крови при ОИМ происходит через 10–14 суток. Чувствительность теста через 3 ч — примерно 60 %, через 10 ч приближается к 100 %, специфичность близка к 100 %. С помощью этого метода удается диагностировать инфаркты миокарда с зубцом Q, а также он используется для дифференциальной диагностики инфаркта миокарда без зубца Q и острого коронарного синдрома без повреждения миокарда — нестабильной стенокардии.
Новой проблемой в диагностике поражения мио карда при острых коронарных синдромах стали ультрачувствительные тропонины. Благодаря применению новых подходов (рекомбинантные белки, нанотехнологии) нижний уровень определения кардиальных тропонинов снижен в 10–100 раз. Разработчики таких тестов называют их или ультрачувствительными (ultra sensitive), или высокочувствительными (highly sensitive). Что «чувствуют» ультрачувствительные тесты? Молекулы тропонинов, «вытекающие» из нормального миокарда? Повреждения кардиомиоцитов, связанные только с ишемией? Или начало мионекроза?
Повышенный ультрачувствительный тропонин — показатель ишемии? Повышение уровня hs-cTnI > 1,3 пг/мл — это независимый предиктор ишемии.
У 195 лиц с подозрением на ИБС вызывали экспериментальную ишемию, которую контролировали с помощью однофотонной эмиссионной компьютерной томографии. Уровни hs-TnT определяли перед стрессом, затем через 18 мин, через 4 и 24 ч. Показано, что повышение hs-TnT — это скорее следствие необратимой смерти миоцитов, нежели результат обратимой миокардиальной ишемии, наступающей после физических упражнений или после фармакологического воздействия.
Среди 50 больных с установленным ИМ без подъе ма ST-сегмента и с отрицательными результатами стандартных cTnI-тестов 86 и 100 % лиц имели положительный us-cTnI-тест в 0 и 2 ч после начала болевого синдрома соответственно. У лиц без ОКС и без ИМ результаты обоих тестов были отрицательными. Таким образом, us-cTnI обнаруживает повреждения миокарда у большинства пациентов, у которых, согласно текущей классификации, диагностируется нефротический синдром (НС). Это, по мнению авторов, свидетельствует о том, что ишемическая загрудинная боль без повреждения миокарда — событие довольно редкое. Более чувствительный cTn-тест повысит количество положительных результатов и позволит раннюю диагностику кардиальных нарушений, хотя и будет выявлять патологии, не связанные с ОКС. Применение ультрачувствительных тестов на тропонины повышает количество как истинноположительных, так и ложноположительных результатов при диагностике ОИМ.
Повышенный ультрачувствительный тропонин — маркер мионекроза? Для подтверждения или исключения ОИМ следует проводить серийное определение ultra cTnI, при этом его повышение на 46 % или снижение на 32 % является основанием для интерпретации результатов.
