
6 курс / Кардиология / Розенштраух_Л_В_Основы_электрофизиологии_сердца
.pdf


Структура субъединиц КАТФ канала.
Внижней левой части рисунка показан октамерическая структура собранного канала.
Р– область поры. Кir6, субьединица К-канала. NDB – нуклеотид связывающий домен. SUR –
sulphonylurea рецептор.
Shivkumar K., Weiss JN. Adenosine Triphosphate-Sensitive Potassium Channels. In book: Cardiac Electrophysiology. From Cell to Bedside.
Third Edition. Ed’s Zipes / Jalife. W.B.Saunders Company. 2000, pp.86-93.

Ионные токи, участвующие в формировании диастолической деполяризации пейсмекерных клеток сердца.
На рисунке показан потенциал действия клетки из синусового узла
Anumonwo JMB, Jalife J. Cellular and subcellular mechanisms of pacemaker activity initiation and synchronization in the heart.Cardiac Electrophysiology. From Cell to Bedside. Second Edition. Ed’s Zipes DP, Jalife J. W.B. Sunders Company
1995, p.151-164/.

Иерархия пяти типов пейсмекерных волокон:
S-A сино-атриальный узел, РРА: потенциальные пейсмекеры предсердий, А-V: A-B узел; Н: ствол Гиса; Purk: волокна Пуркинье.
Частота ритма уменьшается в каудальном направлении.
;
A-V
H
h
Purk.

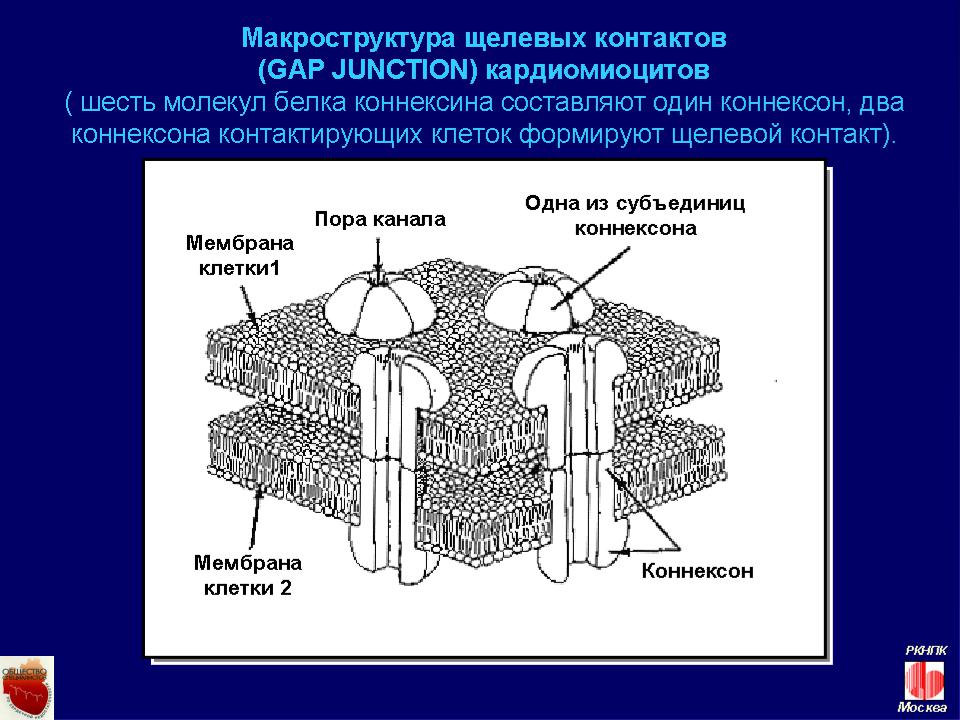
Щелевые контакты –
возможные мишени для новых
кардиотропных средств

Cx37
Cx40
Chick
Cx42
Cx43
Cx45
0
II. Первичная структура коннексинов
A B

 ...
...





 ...
...





 ...
...





 ...
...


|
|
|
|
100 |
200 |
300 |
400 |
Аминокислоты
В участках А и В малая гомология структуры

III. Топология коннексина
Внеклеточная
сторона
Внутриклеточная |
А |
|
|
сторона |
|
H2N |
|
В |
|
СООН
А, В - цитоплазмотические домены
From book: “ Cardiac Electrophysiology. From Cell to Bedside.
Ed’s D. Zipes and J. Jalife, 1995

Cx43 ( 1)
A.Folding model for 1 connexin = Cx43. The aminoacid is coded as follows: hydrophobic in yellow, acidic in red, basic in blue, and cysteine in green. Hydropaphy analysis predicts four membrane-spanning domains M1-M4. Site directed antibodies showed extracellular and cytoplasmic domains (blue and yellow bars respectively). The three cysteine residues (shown in green) located in each of the extracellular loops (E1 & E2) are conserved amongst the connexins.
B.Location of functionally important residues as determined by mutagenesis and chimera studies. Domain 1 (yellow) is the predominant determinant for specificity of heterotypic interactions between Cx43 and Cx50, Cx46. Domain 4 (blue) impart high sensitivity to pH gating of Cx43.
From Yeager M, ibid.
