
4 курс / Дерматовенерология / Современные_технологии_лечения_тяжелых_форм_аллергодерматозов_у
.pdf
Л Е К Ц И Я
Современные технологии лечения тяжелых форм аллергодерматозов у детей
É.à.ëÏË ÌÓ‚‡
еУТНУ‚ТН‡fl ПВ‰ЛˆЛМТН‡fl ‡Н‡‰ВПЛfl ЛПВМЛ а.е.лВ˜ВМУ‚‡
Обследовано 442 больных в возрасте 5–15 лет с тяжелыми формами аллергодерматозов, из них: с токсидермией – 409, с многоформной экссудативной эритемой – 12, с синдромом Стивенса–Джонсона – 11 и с синдромом Лайелла – 10 детей. На основании собственных результатов и данных литературы обсуждаются вопросы этиологии, патогенеза, клинической манифестации и этапного лечения тяжелых аллергических поражений кожи у детей. Показана эффективность современных методов терапии тяжелых форм аллергодерматозов у детей.
Ключевые слова: аллергодерматозы, тяжелые формы, этиология, патогенез, клинические проявления, лечение
Modern treatment of children with severe allergodermatosis
G.I.Smirnova
I.M.Sechenov Moscow Medical Academy, Moscow
Severe allergodermatosis (toxidermia, erythema multiforme, Stevens-Johnson syndrome and toxic epidermal necrolysis) are a classic example of severe mucocutaneous reactions that can result in severe morbidity of children. It is usually attributed to a drug exposure or viral infection. Author discusses etiology, pathogenesis, clinical manifestations, treatment and prognosis of severe allergodermatosis basing on own expiriense of managing of 442 patients aged 5–15 years with toxiderme (409 children), erythema multiforme (12), Steven–Johns syndrome (11) and toxic epidermal necrolysis (10).
Key words: allergodermatosis, severe forms, etiology, pathogenesis, clinical manifestations, treatment
Вструктуре аллергической патологии у детей ведущее место занимают аллергические болезни кожи – аллерго-
дерматозы, обусловленные наследственной предрасположенностью к аллергии, IgE-зависимым механизмом формирования
исклонностью к хроническому, рецидивирующему течению.
Ктяжелым формам аллергодерматозов относятся токсидермия, многоформная экссудативная эритема, синдром Стивен- са–Джонсона, синдром Лайелла. Эти угрожающие жизни детей патологические состояния характеризуются не только поражением кожных покровов с вовлечением слизистых оболочек и внутренних органов, но и формированием серьезных осложнений, которые требуют срочной дифференциальной диагностики и быстрого начала активной терапии. Однако, несмотря на многочисленные исследования, клинико-патогенетические особенности течения тяжелых форм аллергодерматозов изучены еще недостаточно [1–3]. Нет единой тактики лечения больных с тяжелыми формами аллергических поражений кожи. Важно отметить также, что в последние годы увеличилась частота острых тяжело протекающих токсико-аллергических реакций у детей [4], что определяет необходимость их комплексного изучения для улучшения диагностики и патогенетического обоснования лечения с целью повышения его эффективности.
Для корреспонденции:
Смирнова Галина Ивановна, доктор медицинских наук, профессор кафедры педиатрии факультета повышения послевузовского образования Московской медицинской академии им. И.М.Сеченова
Адрес: 119092, Москва, ул. Б. Пироговская, 2/6 Телефон: (095) 259-2012, 256-6026
Статья поступила 14.02.2002 г., принята к печати 20.05.2002 г.
Основу наших наблюдений составили результаты комплексного обследования 442 детей в возрасте 5–15 лет с тяжелыми формами аллергодерматозов, из них с токсидермией было 409, с многоформной экссудативной эритемой – 12, с синдромом Стивенса–Джонсона – 11 и с синдромом Лайелла – 10 больных. Исследования были проведены на базе клинических отделений Тушинской детской городской больницы и детской городской больницы №9 им. Г.Н.Сперанского (Москва), а также на кафедре педиатрии факультета послевузовского профессионального образования ММА им.И.М.Сеченова. Все больные были комплексно обследованы с использованием клинико-лабораторных, аллергологических и иммунологических методов [5].
Анализ полученных данных показал, что ведущими факторами риска развития тяжелых форм аллергодерматозов у детей являются: наследственная предрасположенность к аллергии и высокий уровень общего IgE в крови (74,5%); внутриутробная сенсибилизация к различным аллергенам, заболевания матери, лекарственная терапия во время беременности и избыточное потребление высокоаллергенных продуктов (75,8%).
Высокая частота искусственного вскармливания (59,5%), введение продуктов, не соответствующих возрасту, злоупотребление высокоаллергенными продуктами и особенно ранние проявления аллергии в форме атопического дерматита (45,7%) в 2,5–3 раза повышают риск развития тяжелых форм аллергодерматозов [6].
Большое значение в формировании тяжелых аллергодерматозов играет патология органов гепатобилиарной системы, особенно выраженные нарушения ацетилирования лекарственных препаратов и ксенобиотиков, а также врожденный дефект их метаболизма (так называемый ацетиляторный фено-
66
лУ‚ ВПВММ˚В ЪВıМУОУ„ЛЛ ОВ˜ВМЛfl ЪflКВО˚ı ЩУ П ‡ООВ „У‰В П‡ЪУБУ‚ Ы ‰ВЪВИ |
|
||||
тип), при котором у детей наиболее часто возникают тяжелые |
Анализ частоты причинно-значимых аллергенов при форми- |
||||
токсико-аллергические реакции [1, 2, 5]. |
ровании тяжелых форм аллергодерматозов у детей показал |
||||
Хронические болезни желудочно-кишечного тракта и нару- |
высокую |
выявляемость |
лекарственных |
аллергенов |
|
шение нормального микробиоценоза кишечника (94,8%) также |
(65,7–96,5% наблюдений). Из них наиболее часто тяжелые ток- |
||||
являются важными факторами, способствующими сенсибили- |
сико-аллергические реакции вызывали: антибиотики пеницил- |
||||
зации и реализации аллергического воспаления кожи у детей. |
линового ряда и их полусинтетические производные (72,4%), |
||||
Значимыми факторами риска являются частые вирусные |
левомицетин, тетрациклины и сульфаниламидные препараты. |
||||
инфекции (64,7%), при которых снижается иммунная толерант- |
В развитии синдромов Стивенса–Джонсона и Лайелла у детей |
||||
ность, увеличивается продукция IgE, количество эозинофилов |
была выявлена особая роль применения так называемых «ле- |
||||
в крови и скорости их миграции в шоковый орган, что опреде- |
карственных коктейлей», состоящих из 1–2 антибиотиков и |
||||
ляет темпы манифестации тяжелых форм аллергических пора- |
сульфаниламидных препаратов (78,7%). Кроме того, острые |
||||
жений кожи [1, 7–9]. |
токсико-аллергические реакции возникали при лечении несте- |
||||
Установлено также значение очагов хронической инфекции, |
роидными противовоспалительными средствами (32,6%), про- |
||||
особенно в носоглотке и полости рта (56,2%). Ранее проведен- |
тивосудорожными препаратами (15,9%), при введении вакцин |
||||
ными исследованиями было показано, что микробные токсины |
и сывороток (12,2%). Важно отметить, что чем более тяжелой и |
||||
способствуют гиперпродукции IgE и усиливают готовность ор- |
острой является клиническая форма аллергического пораже- |
||||
ганизма больного к гиперергической реакции на антигенную |
ния кожи, тем выше была частота выявления лекарственных |
||||
нагрузку. Установлена связь между уровнем общего IgE и на- |
аллергенов [3, 5]. |
|
|
||
личием очагов бактериальной инфекции, у таких детей уровень |
Пищевые аллергены реже вызывали развитие тяжелых |
||||
общего IgE в крови в 3 раза выше контрольных значений, что |
форм аллергодерматозов (12–35%). Острые тяжелые реакции |
||||
поддерживает упорное, рецидивирующее течение аллергодер- |
развивались у детей после употребления цитрусовых (31,4%), |
||||
матозов [1, 5]. |
шоколада (22,6%), рыбы (18,7%), ананасов (15,7%), консерви- |
||||
Особым фактором риска формирования тяжелых аллерги- |
рованных соков (14,3%), арахиса (11,6%). |
|
|||
ческих поражений кожи у детей в последние годы становится |
В 5% случаев была выявлена персистирующая вирусная ин- |
||||
экологическое неблагополучие [10, 11]. Причем особенно опас- |
фекция преимущественно у детей с многоформной экссудатив- |
||||
ны многочисленные химические агенты – промышленные ал- |
ной эритемой. Это, по-видимому, было связано с уменьшением |
||||
лергены и поллютанты (диоксиды серы и азота, озон, формаль- |
продукции интерферонов (ИФ) и ассоциацией вирусов с анти- |
||||
дегид и другие соединения), которые усиливают экспрессию ге- |
генами [8, 9, 14, 15]. |
|
|
||
нов аллергического воспаления и потенцируют их действие, |
Исследования механизмов развития тяжелых форм аллер- |
||||
вызывая выраженную сенсибилизацию. Важно отметить, что |
годерматозов у детей показали, что в 80% наблюдений осно- |
||||
аллергены более агрессивны в промышленных зонах по срав- |
вой их патогенеза является IgE-зависимый механизм реализа- |
||||
нению с экологически чистыми районами [10, 12, 13]. |
ции аллергического воспаления, характерным признаком кото- |
||||
|
рого было увеличение содержания общего сывороточного IgE, |
||||
|
выявление специфических IgE к различным классам аллерге- |
||||
|
нов. При этом нами была установлена зависимость изменений |
||||
|
содержания общего IgE от распространенности аллергическо- |
||||
|
го поражения кожи у детей. При локализованных формах его |
||||
|
содержание составляло 257,6±21,4 МЕ/л (p<0,05), а при рас- |
||||
|
пространенных и диффузных поражениях кожных покровов со- |
||||
|
ответственно 396,9±23,5 МЕ/л (p<0,01) (при токсидермии) и |
||||
|
632,4±20,3 МЕ/л (p<0,001) (при синдроме Лайелла). Эти показа- |
||||
|
тели указывают на диагностическую значимость названного |
||||
|
критерия, что согласуется с данными ряда авторов о том, что |
||||
|
повышенная концентрация общего IgE в сыворотке крови явля- |
||||
|
ется достоверным признаком атопической гиперчувствитель- |
||||
|
ности [5, 16]. Наряду с этим при тяжелых формах аллергодер- |
||||
|
матозов у детей были выявлены изменения Th1- и Th2-лимфо- |
||||
|
цитов с усилением дифференцировки в сторону активации |
||||
|
Т-хелперов-2, повышение уровней В-лимфоцитов и особенно |
||||
|
циркулирующих иммунных комплексов соответственно в 7,5 и |
||||
|
9,0 раз при синдромах Стивенса–Джонсона и Лайелла. Однов- |
||||
|
ременно |
было |
установлено |
уменьшение продукции ИФ-γ |
|
|
в 2 раза, а ИФ-α |
– в 1,4 раза, что сочеталось с достоверным |
|||
|
снижением фагоцитарной активности нейтрофилов на 36–57% |
||||
|
у детей с тяжелым течением аллергодерматозов. Наряду с |
||||
|
этим у таких больных нами были установлены выраженные на- |
||||
|
рушения гемостаза, обусловленные гиперкоагуляцией и нару- |
||||
|
шениями микроциркуляции с развитием генерализованного |
||||
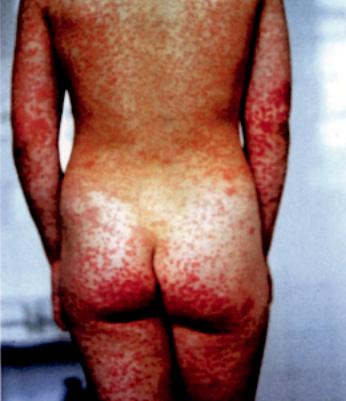
Рисунок 1. Токсикодермия. |
тромбоваскулита [5, 17]. |
|
|
||
67

Й.а.лПЛ МУ‚‡ / ЗУФ УТ˚ ТУ‚ ВПВММУИ ФВ‰Л‡Ъ ЛЛ, 2002, Ъ. 1, ‹3, Т. 66–72
Рисунок 2. Многоформная экссудативная эритема.
Следовательно, патогенез тяжелых форм аллергических поражений кожи определяется иммунопатологически опосредованными реакциями, при которых возможно повреждение органов, содержащих цитохромы (печень, легкие, желу- дочно-кишечный тракт) [3, 7], различная степень вовлеченности которых определяет клинические особенности течения аллергодерматозов. До настоящего времени тяжелые формы аллергодерматозов являются относительно редкими [1, 3, 5, 15, 18], хотя их частота неуклонно увеличивается, что требует особого внимания детских аллергологов, клинических иммунологов и педиатров.
У обследованных детей токсидермия была самой распространенной из тяжелых форм аллергодерматозов, она диагностировалась у 6,5% больных и выявлялась чаще у детей в возрасте 1–7 лет (70% наблюдений). Клинически токсидермия проявляется одномоментным появлением на всей поверхности тела обильной, диссеминированной, преимущественно пятни- сто-папулезной сыпи с легким шелушением (рис. 1). После угасания сыпи остаются гиперпигментация и шелушение. При тяжелом течении на поверхности высыпаний появляются буллезные элементы (буллезная токсидермия). Кроме местных симптомов в 32% случаев у детей было выявлено тяжелое общее состояние, в 57% – выраженные симптомы интоксикации, а в 65% – нарушения микроциркуляции в виде мраморности кожи и цианоза кожных покровов. Важным диагностическим признаком токсидермии у 72,8% больных было наличие признаков цитолиза гепатоцитов, который характеризовался повышением активности трансаминаз крови (в 1,5–2 раза по сравнению с контролем) и выявлялся у детей с патологией гепато-билиар- ной системы.
Многоформная экссудативная эритема относится к более тяжелым формам аллергодерматозов и составляет 0,2% от общего числа обследованных больных [5,19]. Наиболее характер-
ные ее проявления – высыпания на коже в виде эритематозных пятен округлой формы диаметром 3–15 мм с западением в центре (рис. 2). Через несколько часов на поверхности пятен возникают буллезные элементы, после вскрытия которых образуются болезненные эрозии. Распространенный характер высыпаний был отмечен у 7 из 12 обследованных нами больных. Важно отметить, что наряду с поражением кожных покровов у больных детей всегда выявлялись поражения слизистых оболочек в области естественных отверстий, наиболее выраженные
вполости рта с развитием язвенно-некротического стоматита, наружных половых органов и глаз, последние – в виде блефароконъюнктивита и реже – эрозивных поражений роговицы. При этом было отмечено очень тяжелое общее состояние у 4 детей. У 6 больных было тяжелое, а у 2 – средне-тяжелое состояние. У всех детей были выражены симптомы интоксикации и признаки нарушения микроциркуляции, у 5 – определялись боли в мышцах и артралгии, а у 7 – воспалительные изменения
вклинических анализах крови. Для этой формы патологии типичным было рецидивирующее течение с обострениями более чем в 30% случаев, преимущественно в весенне-осеннее время, после очередного курса лекарственной терапии или перенесенной вирусной инфекции. Связь этой формы аллергического поражения кожи у детей с инфицированием вирусами герпеса и аденовирусами была установлена ранее рядом авторов [8, 9, 15].
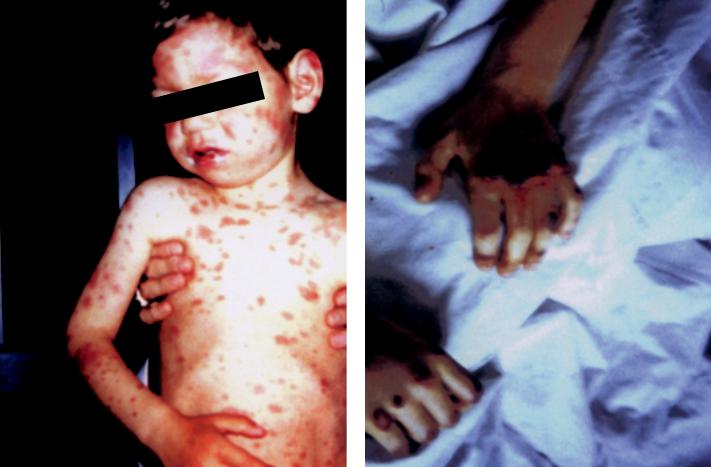
Синдром Стивенса–Джонсона – еще более тяжелая форма аллергического поражения кожи – был выявлен у 0,1% обследованных детей. Заболевание характеризуется острым началом, очень тяжелым общим состоянием, выраженными симптомами интоксикации и болезненными высыпаниями на коже в виде обширных эритематозных участков разной формы и величины (рис. 3). Через несколько часов на месте эритематозных пятен появлялись пузыри, которые быстро вскрывались с образованием глубоких эрозий и язв с некротической пленкой. Характерным было также некротическое поражение кожных покровов дистальных отделов конечностей (рис. 4). У всех обследованных детей симптом Никольского был отрицательным, что обусловлено некрозом преимущественно поверхностных слоев эпидермиса [20–22]. Кроме болезненных высыпаний на коже у всех больных было отмечено поражение слизистых оболочек глаз, полости рта и глотки, желудочно-кишечного тракта и наружных половых органов.
Важной особенностью клинической картины этого синдрома у обследованных детей явилось особенно выраженное поражение слизистой оболочки глаз с развитием блефароконъюнктивита с серозно-гнойным отделяемым из глазной щели и реже – эрозивно-язвенных поражений роговицы, что требует особого внимания при выхаживании этих больных [23]. Наряду с этим у всех больных были выявлены воспалительные изменения картины крови: ускорение СОЭ, лейкоцитоз, гранулоцитопения, анемия, увеличение числа палочкоядерных нейтрофилов и их токсическая зернистость [3, 5, 18].
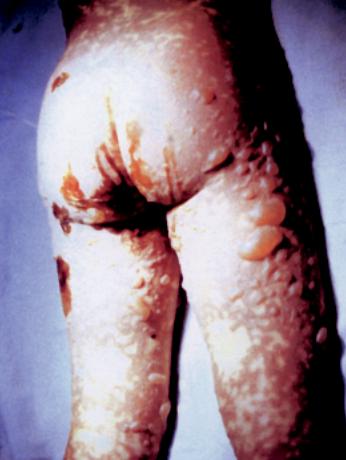
Синдром Лайелла – токсический эпидермальный некролиз – самая тяжелая форма аллергодерматозов у детей, был выявлен в 0,1% случаев. Как было отмечено выше, наиболее значимыми в развитии этого синдрома у детей были лекарственные аллергены и значительно реже – пищевые аллергены. У 6 детей первые проявления заболевания наблюдались через 10–14 дней после приема «лекарственных коктейлей», состоящих из
68
лУ‚ ВПВММ˚В ЪВıМУОУ„ЛЛ ОВ˜ВМЛfl ЪflКВО˚ı ЩУ П ‡ООВ „У‰В П‡ЪУБУ‚ Ы ‰ВЪВИ
Рисунки 3–4. Синдром Стивенса–Джонсона. |
|
антибиотиков и сульфаниламидов. У 4 больных синдром разви- |
ражения почек. Прогноз для жизни и здоровья при токсическом |
вался через 1–2 дня также после приема комбинаций лекарств. |
эпидермальном некрозе зависел от возраста детей, площади |
Клинически синдром Лайелла характеризовался острым нача- |
поражения кожи, быстроты наступления острой почечной недо- |
лом, крайне тяжелым общим состоянием больных детей с вы- |
статочности и развития септических осложнений. Учитывая эти |
раженной интоксикацией, повышением температуры тела до |
факторы, некоторые авторы указывают на то, что показатели |
41 °С и высыпаниями на коже в виде полиморфных диффузных |
смертности при этой форме аллергодерматозов колеблются от |
болезненных эритематозных участков, которые через 1–2 ч с |
36 до 70% [2–4, 21, 23, 25]. |
момента появления трансформировались во множественные |
Комплексный анализ данных, полученных при исследовани- |
пузыри (рис. 5), быстро вскрывавшиеся с образованием чрез- |
ях детей с тяжелыми формами аллергодерматозов, и более |
вычайно болезненных эрозий и язв [18, 21, 24]. У всех больных |
чем 15-летний опыт клинического ведения таких больных поз- |
определялся положительный симптом Никольского I–III степе- |
волили разработать программу их патогенетического лечения, |
ни, обусловленный тотальным некрозом всех слоев эпидерми- |
которая реализуется поэтапно. |
са. Одновременно в острой фазе отмечалось выраженное по- |
Прежде всего необходимо отметить, что развитие тяжелых |
ражение всех слизистых оболочек, особенно глаз, полости рта, |
форм аллергодерматозов у детей требует обязательной госпи- |
глотки и гортани. Особенно характерным было поражение сли- |
тализации в 100% случаев. Проводить ее надо как можно рань- |
зистой оболочки желудочно-кишечного тракта и дыхательных |
ше с целью максимально быстрого начала активной терапии |
путей, что было отмечено также другими авторами [3, 5, 18, 25]. |
[3–5, 25]. Больные должны быть госпитализированы в реанима- |
Причем поражения слизистой оболочки пищевода, желудка и |
ционное или ожоговое отделение, лучше всего в первый день |
прямой кишки были настолько выражены, что у 1/3 больных со- |
манифестации, что особенно важно при синдромах Стивен- |
провождались желудочно-кишечным кровотечением. При этом |
са–Джонсона и Лайелла. |
у всех больных были установлены существенные нарушения |
Следующим этапом является прекращение поступления ал- |
микроциркуляции и электролитного баланса, гиповолемия, ги- |
лергенов в организм больного путем отмены лекарственного |
поальбуминемия, гипонатриемия, гиперкальциемия, гиперфиб- |
препарата, назначения строгой гипоаллергенной диеты, выве- |
риногенемия, нейтропения, токсическая зернистость нейтро- |
дение аллергенов и продуктов аллергической реакции посред- |
филов, анемия, что отмечалось также и другими исследовате- |
ством проведения энтеросорбции с использованием Энтероде- |
лями [1, 3–5, 25]. У 8 больных из 10 было выявлено также хара- |
за, Полифепана, Альгисорба и особенно – Энтеросгеля, кото- |
ктерное для этого синдрома вовлечение в процесс внутренних |
рый является селективным энтеросорбентом, обладает наибо- |
органов с развитием реактивного гепатита и токсического по- |
лее высокой сорбционной способностью, выраженной гидро- |
69
Й.а.лПЛ МУ‚‡ / ЗУФ УТ˚ ТУ‚ ВПВММУИ ФВ‰Л‡Ъ ЛЛ, 2002, Ъ. 1, ‹3, Т. 66–72
Рисунок 5. Синдром Лайелла.
фобностью и не повреждает слизистую оболочку желудочнокишечного тракта [5]. Для снижения всасывания аллергенов и улучшения пищеварения целесообразно применение полиферментных препаратов (Мезим-форте, Креон).
Другим важным этапом лечения является применение антигистаминных препаратов. В острый период для получения быстрого эффекта необходимо парентеральное введение антигистаминных средств, преимущественно 1-го поколения (Тавегил внутримышечно в возрастной дозировке). При уменьшении тяжести процесса лучше использовать антигистаминные препараты 2-го поколения (Кларитин, Зиртек, Кестин и др.). По своей клинической эффективности эти средства примерно равны, но по безопасности препаратом выбора является Кларитин (лоратадин), который не обладает седативным эффектом в отличие от Зиртека и не имеет кардиотоксического действия в отличие от Астемизола и Терфенадина [3, 5, 26].
Основу базового лечения детей с тяжелыми формами аллергодерматозов составляет интенсивная инфузионная терапия с использованием сосудистых препаратов (Трентал, Агапурин), дезагрегантов (Тиклид) и антикоагулянтов (гепарин). Такая терапия проводится с первых часов развития острых токси- ко-аллергических реакций для уменьшения гиперкоагуляции, улучшения микроциркуляции и купирования явлений тромбоваскулита. Причем в особенно тяжелых случаях при синдромах Стивенса–Джонсона и Лайелла мы рекомендуем постоянную инфузию гепарина из расчета 300–500 ед/кг массы тела с помощью инфузионной системы «Линеомат» в первые часы после поступления больных. Такая методика позволяет быстро ку-
пировать нарушения гемостаза, предупредить формирование некроза тканей и образование пузырей, что существенно улучшает прогноз и сокращает сроки пребывания больных в стационаре [5].
Обязательным компонентом комплексного лечения тяжелых форм аллергодерматозов у детей являются местные антибактериальные средства. При поражении конъюнктивы проводят промывание антисептическими и солевыми растворами каждые 1–2 часа для устранения некротических элементов и восстановления ее физиологического дренажа [1, 3, 4, 23]. Необходимым этапом является удаление в стерильных условиях разрушенного эпидермиса и освобождение эрозий от корочек, промывание и обработка раневых поверхностей для профилактики инфицирования и развития септических осложнений. На эрозивные поверхности рекомендуется осторожно наносить аппликатором смеси топических кортикостероидов, анестезирующих, кератопластических и противовоспалительных средств [3, 5].
Собственный многолетний опыт позволяет рекомендовать применение современных безопасных топических кортикостероидов в такой лекарственной форме, как крем. В отличие от мазей крем – «масло в воде» – длительно удерживается в верхних слоях эпидермиса, медленно поступает в кровоток и поэтому обладает малым системным и сильным местным противовоспалительным действием. С этой целью мы использовали крем Элоком 0,1% в сочетании с Актовегином или Солкосерилом.
Элоком (0,1% мометазона фуроат) – синтетический кортикостероид нового поколения, не содержащий фтора. Особенностью молекулы Элокома являются наличие хлора в 9-й и 21-й позициях и боковая цепь фуроата. Уникальное строение молекулы определяет выраженный и длительный противовоспалительный эффект препарата, что позволяет использовать его 1 раз в сутки.
Отличительными особенностями Элокома являются:
•высокая местная эффективность по сравнению с другими кортикостероидами, что позволяет отнести препарат к 3-му классу кортикостероидов по силе действия;
•большая местная безопасность, свойственная 1%-му гидрокортизону;
•низкий системный эффект, что особенно важно, так как Элоком удерживается в эпидермисе в течение 24 часов, практически не проникает в кровоток (0,4%) и не влияет на обмен кортикостероидов;
•наличие трех лекарственных форм (крем, мазь, лосьон), что позволяет осуществить рациональный выбор в зависимости от характера воспалительных изменений и локализации поражений.
Одним из преимуществ Элокома является его способность замедлять образование и высвобождение воспалительных медиаторов, активно ингибировать секрецию цитокинов и фактора некроза опухолей в более низких концентрациях по сравнению с другими кортикостероидами [5, 27]. Как показали наши исследования, применение Элокома в форме крема, особенно при синдромах Стивенса–Джонсона и Лайелла, способствовало более быстрому купированию аллергического воспаления кожи, предупреждало прогрессирование некротического процесса и образование пузырей. Элоком хорошо переносится, ни у одного больного, из наблюдавшихся на-
70
Й.а.лПЛ МУ‚‡ / ЗУФ УТ˚ ТУ‚ ВПВММУИ ФВ‰Л‡Ъ ЛЛ, 2002, Ъ. 1, ‹3, Т. 66–72
ми детей, не было отмечено побочных реакций. Анализ содержания в моче 17-оксикортикостероидов не выявил нарушений выделения этих соединений, что свидетельствовало об отсутствии системных побочных эффектов при применении Элокома [27].
При недостаточной эффективности терапии в течение первых 12–24 ч, в дальнейшем нарастании сыпи и образовании пузырей показано применение гормональной терапии парентерально, коротким курсом, с использованием глюкокортикостероидов, обладающих выраженным противовоспалительным и мембраностабилизирующим эффектами. Чаще рекомендуется применение преднизолона парентерально коротким курсом (5–7 дней) в дозе от 3 мг до 5–8–10 мг на 1 кг массы тела в сутки, особенно при синдромах Стивенса–Джонсона и Лайелла.
Впоследние годы нами была установлена также высокая эффективность бетаметазона (Целестона), который наиболее целесообразно использовать для лечения синдромов Стивен- са–Джонсона и Лайелла у детей в дозе 20–125 мг на 1 кг массы тела. По сравнению с преднизолоном действие Целестона наступает значительно быстрее (через 1–2 ч) и является более продолжительным, так как период полувыведения препарата составляет 36–72 ч. Вместе с тем, наш опыт и данные ряда авторов свидетельствуют о том, что длительное использование гормонов в больших дозах, особенно при синдромах Стивен- са–Джонсона и Лайелла у детей, оказывается неэффективным
инеоправданным, так как сопровождается иммуносупрессивным действием и способствует развитию септических осложнений [5, 27, 28].
Втяжелых случаях, при отсутствии эффекта от вышеуказанной этапной терапии, особенно при большой площади поражений кожи, появлении новых пузырей и нарастании некроза тканей, мы рекомендуем проведение лечебного плазмофереза. Лечебный плазмоферез является методом выбора в таких случаях и проводится по жизненным показаниям [3, 5, 29]. Нами была использована щадящая методика проведения плазмофереза на фоне иммуномодулирующей терапии препаратами интерферона (Лейкинферон, Реаферон), что позволило в 87,4% случаев обеспечить улучшение общего состояния больных, уменьшение зуда, экссудации и интоксикации, а также способствовало увеличению продолжительности ремиссии [5].
Таким образом, предложенная программа лечения тяжелых форм аллергодерматозов у детей позволила предупредить летальность в 100% случаев, снизить число осложнений, получить в короткие сроки желаемый терапевтический эффект (в 72% случаев) и уменьшить продолжительность пребывания больного в клинике.
Литература
1.Knowles S., Shapiro L., Shear N.H. Serious dermatologic reactions in children. Curr Opin Pediatr, 1997, vol. 9, p. 388–395.
2.Roujeau J.C., Stern R.S. Severe adverse cutaneous reactions to drugs. N Engl J Med, 1994, vol. 331, p. 1272–1285.
3.Овчинникова Е.А., Овчинникова Л.К., Ушкалова А.В. О развитии тяжелых токсико-аллергических реакций лекарственного происхождения. Фарматека, 2002, №2/3, с. 46–54.
4.Kathy G. Toxic epidermal necrolysis: a critical challenge. BMJ, 1998, vol. 316, p. 1295–1298.
5.Смирнова Г.И. Аллергодерматозы у детей. М.: БУК лтд,1998, с. 300.
6.Зверькова Ф.А. Болезни кожи детей раннего возраста. СПб.: Сотис, 1994, с. 236.
7.Smith K.J., Skelton H.G., Yeager J., et al. Increased drug reactions in HIV-1-positive patients. Clin Exp Dermatol, 1997, vol. 22, p. 118–123.
8.Orton P.W., Huff J.C., Tonnesen M.G., et al. Detection of a herpes simplex viral antigen in skin lesions of erythema multiforme. Ann Intern Med, 1984, vol. 101, p. 48–50.
9.Detjen P.F., Patterson R., Noskin G.A., et al. Herpes simplex virus (HSV) associated with reccurrent Stevens–Johnson syndrome: a management strategy. Arch Intern Med, 1992, vol. 152, p. 1513–1516.
10.Адо А.Д. Экология и аллергология. Клин. мед, 1990, №9, с. 3–6.
11.Вельтищев Ю.Е. Экологически детерминированная патология детского возраста. Рос. вестн. перинатол. и педиатрии, 1996, №2, с. 5–12.
12.Балаболкин И.И., Ефимова А.А, Авдеенко Н.В. и др. Влияние экологических факторов на распространенность и течение аллергических болезней у детей. Иммунология, 1991, №4, с. 34–36.
13.Хаитов Р.М., Пинегин Б.В., Истамов Х.И. Экологическая иммунология. М., 1995, с. 219.
14.Диел Ф. Цитокины у больных с атопией и без атопии – влияние факторов внешней среды. Мед. иммунология, 2001, №1, с. 15–19.
15.Holland W.W., Golitz L.E., Weston W.L. Erythema multiforme: clinical, histopathologic, and immunologic study. J Am Acad Dermatol, 1984, vol. 10, p. 438–446.
16.Bernstein L., Storms W. Diagnostics tests of IgE-dependent reactions. Ann Allergy, 1995, vol. 75, p. 554–617.
17.Кузнецов В.П. Интерфероны как средство иммуномодуляции. Иммунология, 1987, №4, с. 30–34.
18.Bastuji-Garin S., Rzany B., Stem R.S., et al. Clinical classification of cases of toxic epidermal necrolysis, Stevens–Johnson syndrome, and erythema multiforme. Arch Dermatol, 1993, vol. 129, p. 92–96.
19.Patterson R., Dykewicz M.S., Gonzalzes A., et al. Erythema multiforme and Stevens–Johnson syndrome: descriptive and therapeutic controversy. Chest, 1990, vol. 98, p. 331–336.
20.Stevens A.M., Johnson F.C. A new eruptive fever associated with stomatitis and оphthalmia: report of two cases in children. Am J Dis Child, 1922, vol. 24, p. 526–533.
21.Roujeau J-C., Kelly J.P, Naldi L., et al. Medication use and the risk of Stevens–Johnson syndrome or toxic epidermal necrolysis. N Engl J Med, 1995, vol. 333, p. 1600–1607.
22.Беренбейн Б.А., Студницин А.А. Дифференциальная диагностика кожных болезней. 2-е изд. М.,1989, с. 672.
23.Калугина О.Л., Ковалевский Е.И., Балаболкин И.И. Аллергические заболевания глаз у детей. Педиатрия, 1993, №3, с. 49–53.
24.Lyell A. Toxic epidermal necrolysis (the scalded skin syndrome): a reappraisal. Brit J Dermatol, 1979, vol. 100, p. 69–86.
25.Roupe G., Ahlmen M., Fagerberg B., et al. Toxic epidermal necrolysis with extensive mucosal erosions of the gastrointestinal and respiratory tracts. Int Arch Allergy Appl Immunol, 1986, vol. 80, p. 145–151.
26.Смирнова Г.И. Антигистаминные препараты для лечения аллергических болезней у детей. М., 1999, с.30.
27.Смирнова Г.И. Современные топические кортикостероиды в лече-
нии аллергодерматозов у детей. Детский доктор, 1999, №4,
с. 38–40.
28.Correia O., Chosidow O., Saiag P.et al. Еvolving pattern of drug-induced toxic epidermal necrolysis. Dermatology, 1993, vol.186, p.32–37.
29.Малаховский Ю.Е., Педанова А.А., Макарец Б.Г. Лечебный плазмоферез в дерматологической практике. Гематология и трансфузиология, 1988, №9, с. 60–62.
72
