
4 курс / Дерматовенерология / ПОДЛИННОСТЬ_КАК_ГАРАНТИЯ_КАЧЕСТВА
.pdf










 КОНТРОЛЬ КАЧЕСТВА В КОСМЕТОЛОГИИ
КОНТРОЛЬ КАЧЕСТВА В КОСМЕТОЛОГИИ
ПОДЛИННОСТЬ
КАК ГАРАНТИЯ КАЧЕСТВА
ЧАСТЬ I. МЕДИЦИНСКИЕ ИЗДЕЛИЯ. ЛЕГКО ПРОВЕРИТЬ И УБЕДИТЬСЯ!
Контроль качества и безопасности медицинской деятельности начинается с понимания ответственности за происходящее.
Несут эту ответственность совокупно руководитель медицинской организации, главный врач, врачи-специалисты. Процессы, которые обеспечивают безопасность и эффективность, перечислены в приказе Минздрава России от 07.06.2019 № 381н «Об утверждении Требований к организации и проведению внутреннего контроля качества и безопасности медицинской деятельности».
Журнал «Метаморфозы» планирует в 2020 году опубликовать цикл статей, посвященных обращению лекарственных препаратов, медицинских изделий и косметических средств, объединив его общим названием «Подлинность как гарантия качества».
Москвичева
Елена
Васильевна
аналитик
индустрии
красоты,
Москва
МЕТАМОРФОЗЫ № 29 ФЕВРАЛЬ 2020
Начнем, пожалуй, с самого актуального. С 2019 г. все клиники обязаны зарегистрироваться в ЕГИСЗ, внести в Федеральный
реестр медицинских организаций информацию о главном: адрес, лицензия, помещение, оборудование…
Проверка клиник теперь может происходить «без взаимодействия», то есть надзорный орган – Росздравнадзор – заходит в Единую государственную информационную систему, открывает Федеральный реестр медицинских организаций и сверяет наличие оборудования в конкретной клинике.
Федеральная служба по надзору в сфере здравоохранения и раньше это делала, но для работы с медицинскими изделиями необходимо было выезжать в клиники, ползать на четвереньках, отыскивая шильдик на задней панели прибора, сверять с Государственным реестром медицинских изделий и т.д. Теперь в три клика можно оценить законность оснащения любой клиники.
Поэтому к покупке оборудования и к документам, сопровождающим ме дицинское изделие, пора отнестись всерьез, по-взрослому.
Продукция, появившаяся в клинике до 1 марта 2019 г., могла быть куплена у любой компании. Лицензии на продажу медицинских изделий не существует. Но с 1 марта 2019 г. организация, торгующая медицинскими изделиями, обязана подать в Росздравнадзор уведомление о начале осуществления деятельности в сфере обращения медицинских изделий. Эта информация вносится в Реестр уведомлений об осуществлении деятельности в сфере обращения медицинских изделий и становится доступна каждому. Поэтому, приобретая продукцию, вы можете зайти в реестр, набрать юридическое наименование компании и проверить, имеет ли она право на торговлю медицинскими изделиями (обращаю ваше внимание, что это касается не только приборов, но и инъекционных медицинских изделий). Идем по этой
72
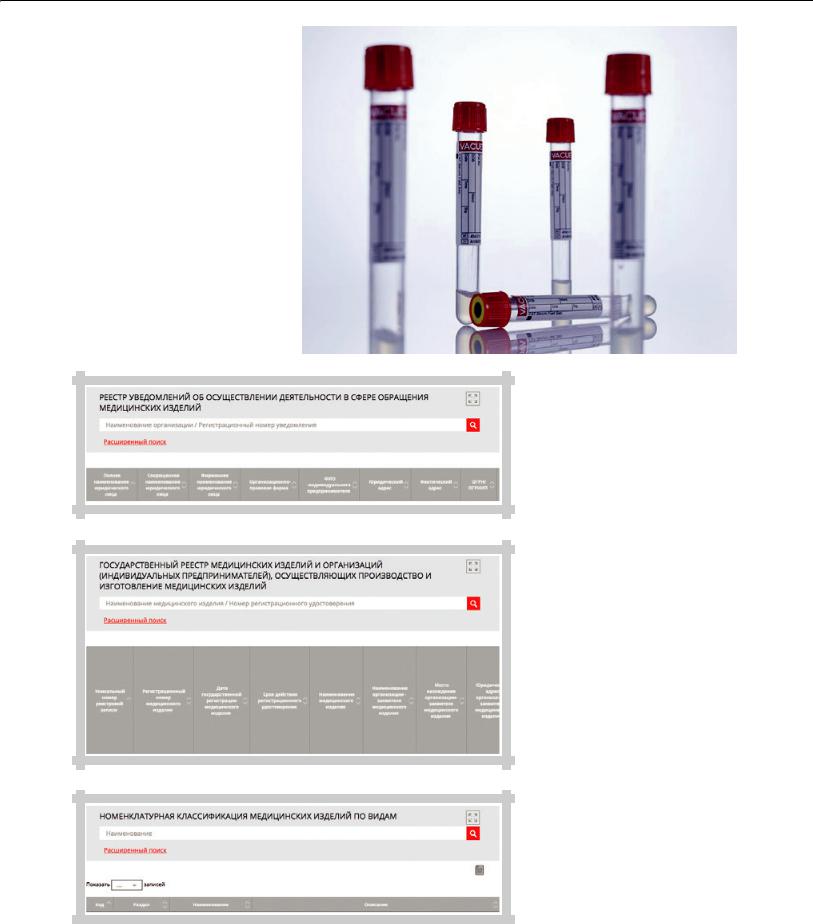
ссылке: http://www.roszdravnadzor.ru/ services/medact (рис. 1).
Убедившись, что организация официально торгует медицинскими изделиями, делаем следующий шаг: проверяем легальность самого изделия.
Сделать это можно, воспользовавшись еще одной ссылкой: http://www. roszdravnadzor.ru/services/misearch
(рис. 2).
Это Государственный реестр медицинских изделий и организаций (индивидуальных предпринимателей), осуществляющих производство и изготовление медицинских изделий.
Если мы внесли в поисковую строку наименование изделия и увидели, что оно в реестре не значится, значит, это изделие не имеет регистрационного удостоверения (РУ) Росздравнадзора и
Рис. 1
Рис. 2
Рис. 3
ввезено в Российскую Федерацию незаконно. Если же изделие в реестре присутствует, не спешите сразу радоваться, мы еще не все о нем узнали. На третьем шаге открываем страницу с информацией об изделии и сверяем указанное в РУ полное наименование изделия (должно быть указано на корпусе, если это прибор, или на упаковке, если это инъекционный препарат, шприц, пробирка, игла и т.д.). Если название совпадает, отлично. В наших руках изделие, которое может легально применяться в России. Дальше мы задаем себе вопрос: «А как именно применяться?» Теперь на помощь придет Номенклатурная классификация медицинских изделий по видам. Ее мы тоже найдем на сайте Росздравнадзора, пройдя по ссылке: http://www.roszdravnadzor.ru/services/ mi_reesetr (рис. 3).
Зачем это нам нужно? Чтобы определить, можем ли мы, например, использовать пробирки, зарегистрированные под разными номенклатурными кодами (код этот указан в регистрационном удостоверении Росздравнадзора).
Так, в табл. 1 указан код изделия, которое можно использовать для получения аутологичной плазмы крови с целью ее подкожного введения, а в табл. 2 указано изделие, для этих целей не предназначенное.
И в том и в другом случае вам продадут зарегистрированные пробирки,
МЕТАМОРФОЗЫ № 29 ФЕВРАЛЬ 2020
73










 КОНТРОЛЬ КАЧЕСТВА В КОСМЕТОЛОГИИ
КОНТРОЛЬ КАЧЕСТВА В КОСМЕТОЛОГИИ
МЕТАМОРФОЗЫ № 29 ФЕВРАЛЬ 2020
Техническая документация производителя (изготовителя) на медицинское изделие (далее – техническая документация), представляемая производителем (изготовителем) медицинского изделия или уполномоченным представителем производителя (изготовителя) медицинского изделия в составе регистрационного досье на медицинское изделие, должна содержать:
1) наименование медицинского изделия, иную информацию, позволяющую идентифицировать медицинское изделие, например, номер модели, варианты модификаций (исполнений) медицинского изделия;
2) назначение медицинского изделия и принципы действия;
3) показания и противопоказания к применению медицинского изделия;
4) информацию о потенциальных потребителях медицинского изделия;
5) описание основных функциональных элементов медицинского изделия, которое может сопровождаться схемами, фотографическими изображениями, рисунками, диаграммами и иными пояснениями;
6) описание составных частей (узлов) медицинского изделия (при наличии);
7) описание принадлежностей, медицинских изделий или изделий, не являющихся медицинскими, но предусмотренных для использования в комбинации с заявленным медицинским изделием (при наличии);
8) перечень и описание материалов медицинского изделия, вступающих в непосредственный или опосредованный контакт с организмом пациента (телом человека);
9) данные о маркировке медицинского изделия и его упаковке;
10) перечень рисков, идентифицированных в процессе анализа риска, и описание способов управления этими рисками в целях снижения их до допустимого уровня (при наличии);
11) сведения о верификации и валидации медицинского изделия, которые использовались для доказательства соответствия медицинского изделия установленным требованиям, в том числе результаты:…
12) перечень материалов животного и (или) человеческого происхождения с указанием сведений об их биологической совместимости и безопасности, о выборе источников (доноров), взятии проб, обработке, хранении и обращении с данными материалами (при наличии);
13) информацию о проведенных испытаниях, протоколах испытаний, анализе полученных данных;
14) ссылки на предыдущие модификации медицинского изделия или подобные модификации медицинских изделий, находящихся в обращении, в случае
использования в технической документации информации о подобных или предыдущих модификациях медицинского изделия для доказательства соответствия медицинского изделия требованиям безопасности и эффективности;
15) информацию об основных стадиях проектирования медицинского изделия и производственных процессах, которая может сопровождаться схемами, фотографическими изображениями, рисунками, диаграммами и иными пояснениями;
16) информацию в соответствии с данными государственного реестра лекарственных средств для медицинского применения о содержащихся в медицинском изделии:
– лекарственном препарате для медицинского применения, в том числе о наименовании (международном непатентованном, или группировочном, или химическом и торговом), наименовании производителя лекарственного препарата для медицинского применения, дате и номере регистрационного удостоверения лекарственного препарата для медицинского применения;
– фармацевтической субстанции, в том числе о наименовании (международном непатентованном, или группировочном, или химическом и торговом), наименовании производителя фармацевтической субстанции, дате и номере реестровой записи государственного реестра лекарственных средств для медицинского применения;
17) описание метода стерилизации, сведения о методах валидации в отношении процесса стерилизации (включая испытания на биологическую нагрузку, наличие пирогенных веществ, наличие остаточного количества стерилизующего вещества) и о валидации процесса упаковывания (в случае если медицинское изделие поставляется в стерильном виде);
18) информацию о процессе проектирования, разработки и валидации программного обеспечения, используемого в готовом медицинском изделии (в случае наличия в медицинском изделии программного обеспечения, обеспечивающего его правильную эксплуатацию и (или) применение по назначению);
19) требования к техническому обслуживанию и ремонту медицинского изделия;
20) порядок и условия утилизации или уничтожения медицинского изделия.
Рис. 4. Выдержка из приказа Минздрава России от 19.01.2017 № 11н «Об утверждении требований к содержанию технической и эксплуатационной документации производителя (изготовителя) медицинского изделия»
74

Таблица 1
330700 |
8. Медицинские |
Набор |
Набор стерильных изделий, используемый для быстрого |
|
изделия для |
изделий для |
приготовления тромбоцитарной плазмы из аутологичного |
|
пластической |
процедуры |
небольшого образца крови с целью последующей инъекции |
|
хирургии, |
регенерации ткани, |
в зоны, требующие лечения и/или восстановления. |
|
дерматологии и |
тромбоцитарная |
Кровь собирается путем венозной пункции |
|
косметологии |
фракция |
и обрабатывается в центрифуге. |
|
|
|
Полученный продукт вводится в виде подкожных инъекций |
|
|
|
с целью регенерации мягких тканей. |
|
|
|
Применяется в эстетической медицине, пластической хирургии. |
|
|
|
Это изделие одноразового использования |
|
|
|
|
Таблица 2 |
|
|
|
|
|
|
|
293590 |
5. Медицинские |
Пробирка |
Стерильная стеклянная или пластиковая пробирка, закупоренная |
|
изделия для in vitro |
вакуумная для |
заглушкой, содержащая определенный объем вакуума |
|
диагностики (ИВД) |
взятия образцов |
и антикоагулянт гепарин натрия (sodium heparin) и гель |
|
|
крови ИВД, с |
для отделения плазмы от клеток. |
|
5.02. Емкости/ |
натрия гепарином |
Предназначена для использования при взятии и консервации |
|
контейнеры для |
и разделительным |
и/или транспортировании крови для анализа и/или другого |
|
проб ИВД |
гелем |
исследования (например, для химического анализа плазмы). |
|
|
|
Это изделие для одноразового использования |
|
|
|
|
Рис. 5
но только пробирки с «правильным кодом» можно использовать в столь популярной услуге, как подкожное введение аутологичной плазмы крови.
Я часто слышу от руководителей сетования на то, что продающая компания не обеспечивает клиники необходимой информацией о
медицинском изделии. При покупке медицинского изделия вы можете сослаться на приказ Минздрава России от 19.01.2017 № 11н «Об утверждении требований к содержанию технической и эксплуатационной документации производителя (изготовителя) медицинского изделия». Этот документ очень четко прописывает требования к информации о медицинском изделии (рис. 4).
И последнее: обращайте внимание на то, чтобы в товарной накладной на инъекционные медицинские изделия был указан лот продукта. Для медицинских изделий еще не создан национальный реестр с индивидуальными идентификаторами. Проверить подлинность именно этой упаковки самостоятельно невозможно, поэтому необходимо, чтобы компания-поставщик брала на себя ответственность за легальность поставляемой партии и для этого в товарной накладной сама указывала номер лота
(рис. 5).
С лекарственными изделиями дело обстоит проще, но об этом мы расскажем в следующем номере журнала «Метаморфозы». 
МЕТАМОРФОЗЫ № 29 ФЕВРАЛЬ 2020
75
