
2 курс / Гистология / Цитология,_гистология_и_эмбриология_Часть_1_Вишневская_Т_Я_
.pdf
ФЕДЕРАЛЬНОЕ ГОСУДАРСТВЕННОЕ БЮДЖЕТНОЕ ОБРАЗОВАТЕЛЬНОЕ УЧРЕЖДЕНИЕ ВЫСШЕГО ПРОФЕССИОНАЛЬНОГО ОБРАЗОВАНИЯ
«ОРЕНБУРГСКИЙ ГОСУДАРСТВЕННЫЙ АГРАРНЫЙ УНИВЕРСИТЕТ»
Л.Л. Абрамова Т.Я. Вишневская М.Т. Куспакова
ЦИТОЛОГИЯ,
ГИСТОЛОГИЯ И ЭМБРИОЛОГИЯ
Часть 1
Допущено Учебно-методическим объединением высших учебных заведений Российской Федерации по образованию в области зоотехнии и ветеринарии в качестве учебно-методического пособия для студентов высших учебных заведений, обучающихся
по направлению подготовки (специальности) 111801 «Ветеринария» (квалификация (степень) «специалист»)
Москва |
|
Оренбург |
|
|
Издательский центр |
|
|
ОГАУ |
|
|
2014
УДК 576.3 : 591.8 : 591.3 ББК 28.65 : 28.66 : 28.63
А16
Рекомендовано к изданию редакционно-издательским советом Оренбургского государственного аграрного университета (председатель совета – профессор В. В. Каракулев).
Рецензенты:
О.Л. Карташова– д-рбиол. наук, проф., зав. лабораториейИКВСУрОРАН; М.С. Сеитов – д-р биол. наук, проф., зав. кафедрой внутренних незаразных болезней ФГБОУ ВПО Оренбургский ГАУ; М.А. Слесаренко – д-р биол. наук, проф., зав. кафедрой анатомии
и гистологии животных им. А.Ф. Климова ФГБОУ ВПО МГАВМиБ
Абрамова, Людмила Леонидовна.
А16 |
Цитология, гистология и эмбриология : учебно-методическое пособие |
|
длясамостоятельнойработыстудентов. Ч. 1 / Л.Л. Абрамова, Т.Я. Вишневская, |
|
М.Т. Куспакова. – М. : Издательство «Омега-Л»; Оренбург : Издательский |
центр ОГАУ, 2014. – 96 с.
ISBN 978-5-370-03400-8 (Издательство «Омега-Л») ISBN 978-5-88838-870-9 (Издательский центр ОГАУ)
I. Вишневская, Татьяна Яковлевна.
II. Куспакова, Маргарита Тлеуловна.
Представленное учебно-методическое пособие включает методический материал по темам общей части цитологии, гистологии и эмбриологии, который излагается в соответствии с требованиями ФГОС ВПО третьего поколения, учебным планом, рабочей учебной программой по дисциплине «Цитология, гистология и эмбриология».
Учебно-методическое пособие предназначено для аудиторной и самостоятельной работы студентов по специальности 111801 «Ветеринария».
Для успешной реализации студентами самостоятельной работы в пособии приводятся вопросы, позволяющие им получить хорошие знания и более полные
икомплексные представления о происхождении и строении клеток тканей животных,
итесты для самопроверки.
|
УДК 576.3 : 591.8 : 591.3 |
|
ББК 28.65 : 28.66 : 28.63 |
ISBN 978-5-370-03400-8 |
© Абрамова Л.Л., Вишневская Т.Я., |
(Издательство «Омега-Л») |
Куспакова М.Т., 2014 |
ISBN 978-5-88838-870-9 |
© ООО «Издательство «Омега-Л», 2014 |
(Издательский центр ОГАУ) |
© Издательский центр ОГАУ, 2014 |
ВВЕДЕНИЕ
«Цитология, гистологияиэмбриология» являетсядисциплинойбазового уровня обучения и представлена в структуре основной образовательной программы в цикле «Общепрофессиональные ветеринарно-биологические дисциплины».
Основная цель дисциплины «Цитология, гистология и эмбриология» при подготовке ветеринарных врачей состоит в том, чтобы дать студентам основополагающие морфологические знания на клеточном и субклеточном уровняхофункционирующем, развивающемсяиприспосабливающемсяорганизмеизакономерностяхегоразвитиявонтогенезе. Учебно-методическое пособие может помочь студентам в самостоятельном изучении микроскопических препаратов при прохождении практического курса предмета. Оно требует обязательного предварительного знакомства с теоретическим материалом занятия, позволяющим судить о строении, функциональном значении и методах выявления изучаемых структур, дает студентам возможность познакомиться с основами техники приготовления гистологических препаратов, помогает выработать навыки работы с микроскопом. Контрольные вопросы в конце каждого раздела рекомендуются студентам при самоподготовке. Изучение общей части дисциплины «Цитология, гистология и эмбриология» предполагается в течение 3 семестра.
Обучение по дисциплине помогает студенту:
–овладеть культурой мышления, способностью к обобщению, анализу, восприятию информации, постановке цели и выбору путей ее достижения
(ОК-1);
–уметь логически верно, аргументировано и ясно строить устную и письменную речь (ОК-2);
–осознать социальную значимость своей будущей профессии, обладает высокой мотивацией к выполнению профессиональной деятельности
(ОК-4);
–приобрести способность и готовность анализировать закономерности функционирования органов и систем организма, использовать знания морфофизиологических основ, основные методики клиникоиммунологического исследования и оценки функционального состояния организма животного для своевременной диагностики заболеваний (ПК-5).
3
1 МЕТОДЫ МИКРОСКОПИЧЕСКИХ ИССЛЕДОВАНИЙ
Основным рабочим инструментом на лабораторно-практических занятиях по гистологии является световой микроскоп. Исследование с помощью микроскопа производится преимущественно в проходящем свете, поэтому исследуемый объект должен быть тонким (не более 10 мкм) и прозрачным.
Тканииорганыдлягистологическогоисследованиявбольшинствеслучаев подвергаются сложной обработке. Основными этапами такой подготовки материала являются:
–взятие материала (витальная биопсия или поствитально);
–фиксация;
–обезвоживание и уплотнение;
–заливка в плотную среду;
–изготовление срезов;
–окрашивание, обезвоживание, просветление и заключение срезов
всреду, обеспечивающую долговременное сохранение препарата.
ВЗЯТИЕ МАТЕРИАЛА. Необходимым условием взятия материала (тканей и органов) является «свежесть» материала. В органах после смерти животного или в образце органа, взятом прижизненно, происходят необратимые диссимилятивные процессы, в результате чего изменяются структуры клеток и тканей, что не соответствует их строению в норме. Поэтому материал для гистологического исследования берется сразу после иссечения или убоя животного. Из органа удаляется кусочек размером до 1 см3. И поскольку в его тканях и клетках совершаются процессы разрушения, необходимо исследуемый материал зафиксировать (законсервировать) в таком состоянии, в каком материал был взят из организма.
ФИКСАЦИЯ МАТЕРИАЛА. Этот процесс заключается в действии на материал фиксирующих жидкостей и сопровождается быстрым свертыванием белков (коагуляцией). При этом отношение между структурами ткани сохраняется. В качестве фиксаторов используют либо одно вещество (простые фиксаторы), либо несколько компонентов (сложные фиксаторы). Такими веществами являются формалин, спирт, уксусная кислота, сулема и др. Наиболее распространенным и в какой-то степени универсальным является 10 – 15%-ныйводный раствор нейтрального формалина.
Фиксатор подбирается в зависимости от целей исследования. Так для изучения содержания гликогена (животный крахмал) наилучшим фикса-
4
тором является (абсолютный или 100о) спирт, а для сохранения в клетках жира нужно применять формалин и т.д.
Если фиксатор содержит вещества, мешающие дальнейшей обработке, например, сулему, двухромовокислый калий, кислоты, то после фиксации кусочки промывают в проточной воде.
ОБЕЗВОЖИВАНИЕ И УПЛОТНЕНИЕ МАТЕРИАЛА. С этой целью обезвоживание материала производится в спиртах с возрастающей концентрацией (50о, 70о, 90о, 100о), здесь же осуществляется и частичное обезжиривание. Затем материал выдерживают в смеси 100о спирта и эфира, где осуществляется окончательное обезвоживание и интенсивное обезжиривание. Однако в результате такой обработки материал оказывается недостаточно плотен, а главное, недостаточно однороден, поэтому его необходимо залить в специальную плотную среду.
ЗАЛИВКА МАТЕРИАЛА. В качестве плотных сред используются целлоидин, парафин, желатин, смолы и др. Материал проводится постепенно черезрядсредотжидкойдоплотной. Кусочек, темсамым, равномернопропитывается и становится однородным и плотным.
Принципзаливкизаключаетсявпоследовательномпроведениикусочка через ряд жидкостей, каждая предыдущая из которых должна обладать способностью смешиваться с последующей. Схема заливки в парафин: 1) 100о спирт; 2) смесь 100о спирта и ксилола (либо хлороформа) 1:1; 3) ксилол (хлороформ); 4) раствор парафина в ксилоле (хлороформе) в термостате при t=37о С; 5) расплавленный парафин.
Время заливки определяется величиной объекта. После пребывания
врасплавленном парафине (в термостате при t=54о С) кусочек полностью им пропитывается. После этого кусочек в формочке заливается расплавленным парафином, осторожно погружается в проточную воду и застывает
вплотный блок.
ИЗГОТОВЛЕНИЕ СРЕЗОВ. На специальных аппаратах – микротомах производится приготовление очень тонких срезов толщиной 5 – 10 мкм. В последующем срезы освобождают от пропитывающих плотных сред. Возникает дальнейшая необходимость препараты контрастировать, т.е. окрасить различные компоненты тканей и клеток в яркие контрастные цвета для детального изучения.
При необходимости получения препарата в короткий срок (с диагностической целью) используют замораживающий микротом, который позволяет изготовить срезы из кусочка, только что зафиксированного жидким азотом (t = -180о С), углекислотой и др. Недостатком этого метода является
5
то, что срезы получаются более толстыми, чем из парафиновых (или целлоидиновых) блоков (более 10 мкм).
ОКРАСКА ПРЕПАРАТОВ. Основной принцип окраски заключается
визбирательном окрашивании кислыми и основными красителями различных тканевых структур. Наиболее распространенным основным красителем является гематоксилин. Структуры, имеющие кислую реакцию обладают сродством с основным красителем, окрашиваются гематоксилином
всиний или фиолетовый цвет, поэтому эти структуры называют базофильными (ядра клеток).
Наиболее распространенным кислым красителем является эозин. Структуры, имеющие щелочную реакцию, обладают сродством с кислыми красителями, окрашиваются эозином в розовый цвет, и их называют ацидофильными (цитоплазма клеток, волокна межклеточного вещества). В результате окраски срезов основными и кислыми красителями получается контрастный препарат с отчетливыми структурами.
Окраска срезов гематоксилином и эозином:
–окрашивание гематоксилином – 3 мин.
–промывка в водопроводной воде – 5 мин.
–окрашивание эозином – 1 мин.
–промывка в дистиллированной воде – 2 мин.
–обезвоживание в 96о спирте – 2 мин.
–обезвоживавание в 100о спирте – 2 мин.
–просветление в ксилоле-1 – 2 мин.
–просветление в ксилоле-2 – 2 мин.
–заключение срезов в бальзам.
Чтобы приготовить постоянный гистологический препарат с большим сроком хранения, окрашенные в водной среде срезы обезвоживают в спиртах возрастающей крепости (96ои 100о), просветляют в ксилоле. Затем срезы помешают на предметные стекла, наносят каплю бальзама (раствор кедровой или пихтовой смолы в ксилоле) и накрывают покровным стеклом. Срезы оказываются заключенными в прозрачную среду.
Изготовленные гистологические препараты изучают в световом микроскопе, зарисовывают и подписывают учебные элементы:
–ядро (базофильная окраска);
–цитоплазма (ацидофильная, оксифильная, эозинофильная окраска).
МЕТОДЫ БИОМЕТРИИ (морфометрии). Включают подсчет клеток, объем ядер, цитоплазмы, их ядерно-цитоплазматическое отношение, количество митотически делящихся клеток в процентах, как показатель степени регенерации.
6
МЕТОД ЦИТОФОТОМЕТРИИ позволяет с помощью специального прибора (спектрометра) дать количественную оценку вещества, фермента и т.д., входящего в состав клетки.
МЕТОД ФАЗОВОГО КОНТРАСТА дает изображения объектов, невидимых при обычных методах микроскопии. Он основан на различном преломлении света в зависимости от плотности структур. Требует использования специальных микроскопов или приставок к ним.
МЕТОД РАДИОАВТОГРАФИИ применяется для изучения синтетическихпроцессоввклетке, поступленияивыведениявеществ, распределения их в клетке и т.д. Сущность метода состоит в том, что в организм вводится вещество, содержащее радиоактивные (меченые) Р, Н, С и др., которые включаются в ткани клетки. Место нахождения введенного вещества определяется на гистологическом препарате по излучению, которое улавливается чувствительной эмульсией, нанесенной на препарат. Фотография этих следов (треков) излучения позволяет судить о распределении введенного радиоактивного элемента в клетках и тканях.
ЭЛЕКТРОННАЯ МИКРОСКОПИЯ. Метод позволяет получить увеличение объектов в десятки и сотни тысяч раз. Объект просматривается в потоке электронов, концентрация которых и направления на объект регулируются магнитными устройствами. Изображение изучаемого объекта видно на специальном экране микроскопа и фотографируется на фотопластинку.
Как и в случае световой микроскопии, исследуемый материал подвергается фиксации, обезвоживанию и заливке в плотные среды. Для фиксации берется свежий материал, размеры кусочков не должны превышать 1 мм3. Обычно для фиксации используется глютаровый альдгидочетырехокись осмия, марганцовокислый калий. Обезвоживание производят быстро в спиртах (ацетонах) возрастающей крепости.
Для заливки используют эпоксидные смолы (аралдит и энон). Изготовление ультратонких срезов (40 – 50 нм) производят на ультратоме. Затем срезы помешают на металлическую сеточку, контрастируют и рассматривают в потоке электронов.
МЕТОД ПРИЖИЗНЕННОГО НАБЛЮДЕНИЯ. Маленький кусочек ткани помещается на предметное стекло в физиологический раствор (для млекопитающих 0,9%-ный раствор NаСl), покрывается покровным стеклом и исследуется в световой микроскоп.
Метод позволяет исследовать и фотографировать поведение живой клетки в течение недолгого времени.
7
1.1 Правила работы с микроскопом
Микроскоп следует установить на рабочем столе в удобном для работы положении. Лучше всего установить на рабочем месте стола слева, т.к. справа будет лежать тетрадь для зарисовки препаратов. Микроскоп нужно установить так, чтобы его не сдвигать с места до конца занятия.
Прежде чем установить освещение, необходимо чтобы револьвер был замкнут на малый объектив (×8), конденсор максимально поднят вверх
иего диафрагма полностью открыта. Затем, поворачивая зеркало вогнутой стороной, наводимсвет. Он долженбытьдостаточноинтенсивным иравномерно освещать все поле зрения микроскопа.
Гистологический препарат помещается на предметный столик обязательно покровным стеклом вверх и устанавливается четкость изображения вращением макрометрического винта, затем при малом увеличении микроскопа препарат перемещается рукой и осуществляется общее знакомство с препаратом, находят необходимые структуры, ставят их в центр поля зрения микроскопа и переводят на большое увеличение.
Для изучения препарата при большом увеличении необходимо не меняя положения тубуса, повернуть плавным движением револьвер, поставить объектив большего увеличения (×40).
Уловить изображение препарата и установить его четкость осторожным вращением микрометрического винта. Расстояние между объективами и препаратом оказывается очень небольшим, около 0,5 мм, поэтому вращение микрометрического винта допускается не более одного оборота. Перемещается препарат по плоскости вращением винтов предметного столика. Для улучшения освещенности и контрастности изображения препарата допускается перемещение конденсора (винт справа ниже столика).
Зарисовка гистологического препарата производится чаще всего с использованием изображений при малом и большом увеличениях микроскопа. С малого увеличения зарисовывается общий план строения органов
итканей, а детали зарисовываются в данный рисунок при большом увеличении микроскопа.
Зарисовав и изучив препарат при большом увеличении, следует плавно повернуть револьвер на объектив малого увеличения и только после этого снять препарат с предметного столика.
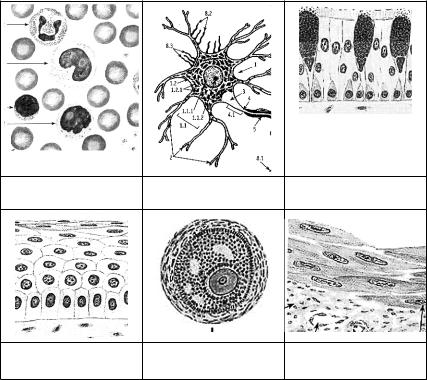
2 ЦИТОЛОГИЯ
Практическиецелидлялабораторно-практическихзанятийпоцитологии:
1)уметь пользоваться микроскопом для исследования;
2)уметь различать клетки и неклеточные структуры в срезах органов;
3)уметь идентифицировать в клетках ядро, цитоплазму и плазмолемму на микроскопическом уровне;
4)уметь дать функциональную характеристику периодам жизненного цикла клетки, идентифицировать стадии митоза;
5)уметь определять половые клетки и детали их строения на микроскопическом уровне.
2.1 Форма клеток, неклеточные структуры
СХЕМА. Различные формы клеток.
9

ПРЕПАРАТ№ 46. СИМПЛАСТ(поперечно-полосатаямышечнаяткань языка кролика)
1. Ядра
2. Сарколемма
3. Саркоплазма
4. Поперечнаяисчерченность
ПРЕПАРАТ №19. СИНЦИТИЙ (ретикулярная ткань лимфатического узла овцы)
1. Ядра
2. Цитоплазма
3. Отростки клеток
2.2 Органоиды и включения
ПРЕПАРАТ № 6. МИТОХОНДРИИ (хондриом) Окраска: по Альтману.
При малом увеличении нужно найти покровную ткань кишки с вертикально разрезанными клетками, основания которых располагаются на ярко-розовой базальной мембране, а верхушки покрыты толстым слоем – кутикулой.
При большом увеличении рассмотрите митохондрии, имеющие вид ярко-красных зернышек и палочек, располагающиеся в верхней надъядерной части клеток.
Препарат рассмотреть и зарисовать.
1. Ядро клетки
2. Скопления митохондрий
3. Цитоплазма
10
