
42.Сахарный диабет - эндокринно-обменное заболевание, проявляющееся нарушением углеводного, а затем и других видов обмена. Нормальный обмен веществ - необходимое условие нормальной жизни и функционирования органов и всех систем организма. Основой его являются процессы усвоения и распада, обеспечивающие потребности живого организма. Обмен веществ и энергии осуществляется благодаря взаимодействию тесно связанных между собой процессов обмена белков, жиров, углеводов, минеральных солей, воды и витаминов. Регулируют обмен веществ центральная нервная и эндокринная системы (гипофиз, щитовидная железа, надпочечники, поджелудочная железа). Нормальный обмен углеводов является условием нормального обмена жиров и белков. Поступающие с пищей углеводы после переваривания и всасывания в кишечнике попадают в кровь в виде легкоусвояемых моносахаридов - глюкозы, фруктозы, галактозы. Поддержание нормальной концентрации основного моносахарида - глюкозы, усвоение ее тканями различных органов, участие в общем обмене веществ и энергии зависит от полноценного функционирования бета-клеток островков Лангерганса поджелудочной железы, которые продуцируют в кровь гормон инсулин. При отсутствии или недостаточности инсулина или блокировании его контринсулярными факторами концентрация глюкозы в крови повышается, что обусловливает развитие сахарного диабета. Из-за недостатка инсулина или из-за других причин затрудняется переход глюкозы в ткани организма, снижается образование гликогена в печени, усиливается образование глюкозы из белков, и в результате содержание глюкозы в крови превышает 7 ммоль/литр, а в тяжелых случаях порой достигает 15-25 ммоль/литр и более. При концентраций глюкозы в крови свыше 10 ммоль/литр она начинает выделяться с мочой, что сопровождается увеличением количества мочи, усилением жажды, слабостью. Организм обезвоживается, возникает сухость слизистых оболочек рта и глотки. Потеря глюкозы с мочой, которая может достигать 150-200 г в сутки, приводит к потере веса. При нарушении углеводного обмена изменяется и жировой обмен ("жиры сгорают в пламени углеводов", как говорят биохимики). В крови появляются токсические недоокисленные продукты жирового обмена (ацетон, ацетоуксусная кислота и другие). В моче обнаруживается ацетон и наступает угроза диабетической комы, из которой больного вывести трудно. Ослабляется синтез белков, без которых невозможен рост и восстановление тканей. Усиливается превращение белков в углеводы в печени, в крови нарастает содержание азотсодержащих продуктов распада белков (мочевина), что небезразлично для человека.
41. При отсутствии жёлчи (или недостатке в ней жёлчных кислот) жиры перестают абсорбироваться и выделяются с калом, который вместо обычного коричневого становится белого или серого цвета жирной консистенции. Такое состояние называется стеаторея, её следствием является отсутствие в организме важнейших жирных кислот, жиров и витаминов, а также патологии нижних отделов кишечника, которые не приспособлены к столь насыщенному непереваренными жирами химусу. Атеросклероз (от греч. athere — кашицеобразная масса и лат. scleros — твердый)—хроническое заболевание, возникающее в результате нарушения обмена липидов и проявляющееся отложением холестерина в интиме артерий крупного и среднего калибра и в меньшей степени вен. В ответ на отложение холестерина происходит реактивное разрастание в интиме соединительной ткани, в результате чего возникает бляшкообразное утолщение интимы с кашицеобразным распадом в центре, суживающие просвет артерий и приводящие к гемодинамическим нарушениям Гиперлипопротеинемия - общее наименование пяти различных типов нарушений обмена веществ, при которых в крови больных обнаруживают жиры. Заболевание может быть наследственным. При некоторых формах гиперлипопротеинемий симптомы выражены слабо, от них можно избавиться, соблюдая диету. Тяжелое течение заболевания может привести к смерти. Гиперлипопротеинемия обнаруживается примерно у каждого пятого человека с повышенным содержанием липидов и липопротеинов в крови. Это нарушение может быть также связано с наличием другого заболевания, например, диабета, болезни почек или поджелудочной и щитовидной желез.
39.

38 Под термином «кетоновые (ацетоновые) тела» подразумевают ацетоук-сусную кислоту (ацетоацетат) СН3СОСН2СООН, β-оксимасляную кислоту (β-оксибутират, или D-3-гидроксибутират) СН3СНОНСН2СООН и ацетон СН3СОСН3
Кето́новые тела́ (синоним: ацето́новые тела, ацето́н [распространённый медицинский жаргонизм]) — группа продуктов обмена веществ, которые образуются в печени из ацетил-КоА[2]: ацетон (пропанон) [H3C—CO—CH3] ацетоуксусная кислота (ацетоацетат) [H3C—CO—CH2—COOH] бета-гидроксимасляная кислота (β-гидроксибутират) [H3C—CHOH—CH2—COOH]
кетоновые тела являются промежуточными продуктами бета-окисления жирных кислот, оказались ошибочными[2]: во-первых, в обычных условиях промежуточными продуктами бета-окисления жирных кислот являются КоА-эфиры этих кислот: β-оксибутирил-КоА или ацетоацетил-КоА; во-вторых, β-оксибутирил-КоА, образующийся в печени при бета-окислении жирных кислот, имеет L-конфигурацию, в то время как β-оксибутират, обнаруживаемый в крови, представляет собой D-изомер. Именно β-оксибутират D-конфигурации образуется в ходе м Повышение содержания кетоновых тел в организме связано прежде всего с дефицитом углеводов в обеспечении организма энергией: перегрузка белками и жирами на фоне недостатка легкоперевариваемых углеводов в рационе, истощение, ожирение, нарушение эндокринной регуляции (сахарный диабет, тиреотоксикоз), отравления, травма черепа и т. д.
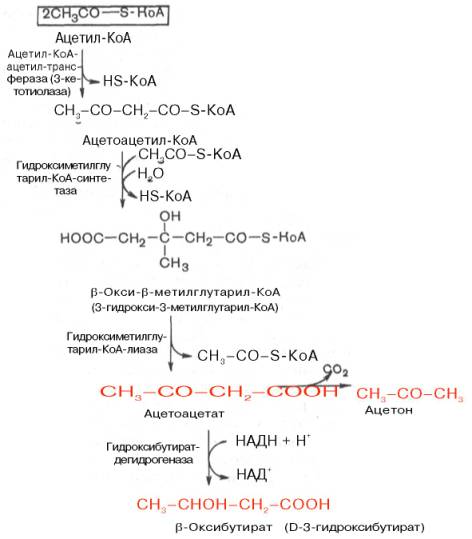
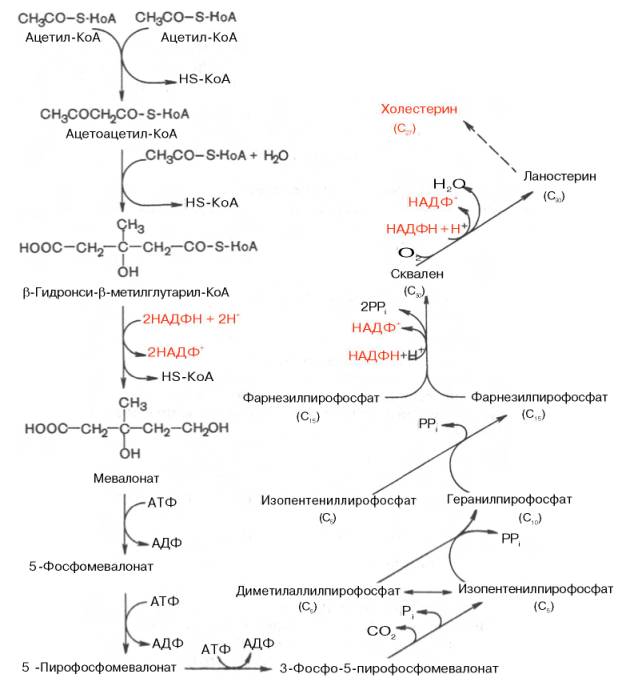
37.Холестерин синтезируется главным образом в печени (~50% от общего количества), кишечник е (~15%) и коже (большая часть остальной доли). Ранней стадией синтеза холестерина является превращение ацетата в мевалоновую кислоту . Фермент, определяющий скорость этого процесса, называется бета-гидрокси-бета-метилглутарил- коэнзим А-редуктаза ( ГМГ-КоА-редуктаза ). Его активность регулируется по принципу обратной связи с помощью конечного продукта реакции, холестерина. Основные метаболиты холестерина - это желчные кислоты , которые синтезируются исключительно в печени . Ключевым ферментом в этом случае служит холестерол-7-альфа-гидроксилаза. Синтез этого вещества происходит в несколько стадий. 1) Мевалонат , в состав молекулы которого входит 6 атомов углерода, синтезируется из ацетил-CoA 2). При отщеплении от мевалоната CO2 образуется изопреноидная единица 3). Шесть изопреноидных единиц конденсируются с образованием промежуточного соединения сквален а. 4). Сквален циклизуется, образуя исходный стероид ланостерол .5). Путем дальнейших превращений, включающих удаление трех метильных групп, ланостерол превращается в холестерол

36 Синтез триацилглицеридов и фосфоглицеролипидов. В животных тканях биосинтез триацилглицеридов и главных фосфолипидов – фосфатидилэтаноламина и фосфатидилхолина – начинается с двух общих предшественников и имеет несколько общих этапов. Общими предшественниками служат СоА-эфиры жирных кислот и глицерол-3-фосфат. Глицеролфосфат может образовываться двумя путями: 1) в ходе гликолиза он возникает из дигидроксиацетонфосфата под действием цитоплазматического НАД-зависимого фермента глицеролфосфатдегидрогеназы: дигидроксиацетонфосфат глицерол-3-фосфат 2) он может образовываться из глицерола под действием глицеролкиназы: глицерол глицерол-3-фосфат На первом этапе биосинтеза триацилглицеридов происходит ацилирование двух свободных гидроксильных групп глицеролфосфата двумя молекулами СоА-производных жирных кислот с образованием диацилглицеролфосфата (чаще его называют фосфатидной кислотой). Фосфатидная кислота встречается в клетках лишь в следовых количествах, однако она является важным промежуточным продуктом в биосинтезе липидов. В случае синтеза триациоглицеролов фосфатная группа фосфатидной кислоты гидролизуется фосфатазой и по третьему положению присоединяется третий остаток жирной кислоты. Образование каждой сложноэфирной связи в молекуле триацилглицеролов сопровождается пирофосфатным расщеплением 2 молекул АТФ. Из фосфатидной кислоты может образоваться мембранный фосфолипид фосфатидилэтаноламин. Сначала под действием этаноламинкиназы происходит образование фосфоэтаноламина: этаноламин фосфоэтаноламин Затем фосфоэтаноламин реагирует с ЦТФ, образуя цитидиндифосфатэтаноламин и пирофосфат. Цитидиновые нуклеотиды специфичны для данной реакции, никакие другие не могут заменить их в животных тканях: фосфоэтаноламин цитидиндифосфатэтаноламин Присоединение полярной головы к диацилглицеролу с образованием фосфатидилэтаноламина осуществляется при помощи фермента этаноламинфосфаттрансферазы: диацилглицерол цитидиндифосфоэтаноламин фосфатидилатаноламин ЦМФ Фосфатидилхолин образуется двумя разными путями. Один путь называется синтезом de novo («с самого начала»), поскольку в этом случае не требуется наличия предобразованного холина в качестве предшественника. При синтезе de novo холиновая голова молекулы фосфатидилхолина не встраиваются в молекулу в готовом виде, а образуются из этаноламина, входящего в состав фосфатидилэтаноламина, путем трехкратного метилирования. Донором метильных групп служит S-аденозилметионин – активированная форма метионина, в которой метильная группа обладает повышенной реакционной способностью. S-аденозилметионин S-аденозилгомоцистеин фосфатидилхолин Другой путь синтеза фосфатидилхолина получил название «спасательного» пути, поскольку холин, образовавшийся при распаде фосфатидилхолина в процессе метаболизма, как бы спасается от разрушения и вновь используется в готовом виде для построения фосфатидилходина. Этот путь аналогичен пути синтеза фосфатидилэтаноламина. «Спасательный» путь синтеза фосфатидилхолина необходим многим животным, так как их способность синтезировать это соединение de novo ограничена. Метильные группы в форме S-аденозилметионина образуются из незаменимой аминокислоты метионина. При недостаточном содержании метионина в пище возможность метилирования фосфатидилэтаноламина становится ограниченной. В этих условиях организм старается спасти и повторно использовать уже метилированный свободный холин. Другие обнаруживаемые в мембранах фосфолипиды – фосфатидилсерин, фосфатидилинозитол и кардиолипин – образуются из диацилглицеролов и ЦДФ-производных в реакциях, аналогичных описанным выше.
32. Фруктоземия-Заболевание обусловлено врожденным отсутствием ферментов фруктозофосфатальдолазы и фруктозодифосфатальдолазы. Избыточное накопление фруктозофосфата нарушает гликогенолиз, что приводит к гипогликемии. В печени имеется недостаточное количество фермента фруктозо-1-фосфат-альдолазы, в результате продукты обмена (фруктозо-1-фосфат) накапливаются в организме (печени, почках, слизистых оболочках кишечника) и оказывают повреждающее действие. Морфологически в печени выявляются жировая инфильтрация, умеренный перилобулярный фиброз. Галактоземия-В основе галактоземии (рис. 1) лежит нарушение обмена галактозы в связи с отсутствием фермента галактозофосфат-уридилтрансферазы. В результате в крови накапливаются в больших концентрациях галактоза и галактозофосфат. Происходит нарушение процесса ферментативного превращения галактозы в глюкозу с накоплением галактозы и продуктов ее обмена в клетках, что оказывает повреждающее действие на функции печени, головного мозга, хрусталика глаза, почек. Лактаза – это фермент, который расщепляет лактозу. Дефицит этого фермента в организме (лактазная недостаточность) приводит к нарушению всасывания лактозы и плохой переносимости продуктов питания, содержащих молочный сахар (лактозная непереносимость). Лактазная недостаточность бывает первичной (наследственной) или вторичной (на фоне общей ферментативной незрелости). Следует отметить, что значительную долю лактазы (до 80%) вырабатывают бактерии нормальной кишечной микрофлоры. Болезнь Гирке — гликогеноз (гликогеновая болезнь) вызванная недостаточностью глюкозо-6-фосфатазы.Недостаточность этого фермента приводит к невозможности превращения глюкозо-6-фосфата в глюкозу, что сопровождается накоплением гликогена в печени и почках.Болезнь Гирке характеризуется генетически обусловленной почти полной неспособностью клеток продуцировать глюкозо-6-фосфатазу — ключевой фермент как гликогенолиза, так и глюконеогенеза. Болезнь наследуется по аутосомно-рецессивному типу. Поступление глюкозы в организм с пищей, являющееся нормальным возмущающим процессом, в принципе дает возможность поддерживать в крови нормальный уровень глюкозы, однако для этого поступление пищи, содержащей глюкозу, должно быть практически непрерывным. В реальных условиях существования, то есть при отсутствии непрерывного поступления глюкозы, в здоровом организме депонируется и при необходимости используется гликоген, образующийся при ее полимеризации
29.

Основная биологическая роль пентозофосфатного цикла связана с продукцией НАДФН и рибозо-5-фосфата. НАДФ -Н используется: • как восстановитель в реакциях синтеза жирных кислот, холестерина и его производных - желчных кислот и стероидных гормонов (половые гормоны, глюкокортикоиды, минералокортикоиды); •для обезвреживания токсинов и лекарственных препаратов в процессах микросомального окисления; • в системе антиоксидантной защиты клетки как восстановитель глута-тиона. Пентозофосфатный путь активен в тех тканях и органах, в которых интенсивно идут восстановительные синтезы, а также образование нуклео¬тидов и нуклеиновых кислот: в жировой ткани, печени, ткани молочной железы в период лактации, половых железах, надпочечниках, костном моз¬ге, лимфоидной ткани, клетках слизистых оболочек и др.
28.Метаболизм фруктозы осуществляется превращением ее в глюкозу (на схеме слева). Вначале фруктоза фосфорилируется при участии фермента кетогексокиназы (фруктокиназы) [1] с образованием фруктозо-1-фосфата, который далее расщепляется альдолазой до глицеральдегида (глицераля) и дигидроксиацетон-3-фосфата [2]. Последний уже является промежуточным продуктом гликолиза (в центре схемы), а глицераль фосфорилируется в присутствии триокиназы, образуя глицераль-3-фосфат [3]. Затем глицеральдегид частично восстанавливается до глицерина [4] или окисляется до глицерата. После фосфорилирования оба соединения вновь включаются в гликолиз (на схеме не приведено). При восстановлении глицеральдегида [4]расходуется НАДН (NADH). Поскольку при конверсии этанола лимитирующим фактором является низкое соотношение концентраций НАД+/НАДН (NAD+/NADH). Этот процесс ускоряется в присутствии фруктозы (см. с. 312). Кроме того, в печени реализуется полиольный путь трансформации фруктозы в глюкозу (на схеме не приведен): фруктоза за счет восстановления С-2 превращается в сорбит, а при последующем дегидрировании С-1 — в глюкозу.
Метаболизм галактозы также начинается с фосфорилирования с образованием галактозо-1-фосфата [5] (на схеме справа). Далее следует эпимеризация С-4 с образованием производного глюкозы. Биосинтез УДФ-глюкозы (UDP-глюкозы), промежуточного продукта обмена глюкозы, осуществляется обходным путем — через УДФ-галактозу (UDP-галактозу) и последующую эпимеризацию [6, 7]. По такому же пути идет биосинтез самой галактозы, поскольку все реакции за исключением [5] обратимы.
27

I этап — распад глюкозы или гликогена до пировиноградной кислоты; II этап — превращение пировиноградной кислоты в аце-тил-КоА; III этап — окисление ацетил-КоА в цикле Кребса. Реакции I этапа аналогичны процессу анаэробного распада углеводов, но имеют две особенности: 1) этап заканчивается образованием Двух молекул пировиноградной кислоты; 2) при этом образуются 6—7 молекул АТФ вместо 2—3 молекул при анаэробных условиях.
II этапе пировиноградная кислота подвергается окислительному декарбоксилированию с образованием двух молекул ацетил-КоА с накоплением молекул АТФ.
III этап характеризуется полным окислением двух молекул ацетилкофермента А в цикле Кребса до углекислого газа и воды, пр этом накапливается 24 молекулы АТФ.
В итоге непрямое аэробное окисление одной молекулы глюкозы обеспечивает выход 36 молекул АТФ, а если процесс начинается с распада гликогена, то 37 молекул. Остальная часть образовавшейся энергии рассеивается в виде тепла. Такой путь преобладает в печени, почках
26.Глюкоза как моносахарид свободно диффундирует через мембрану печеночных клеток, она не может служить резервом углеводородов в печени. Так как фосфатные эфиры глюкозы и фруктозы не столь легко проникают через мембраны, фосфорилирование этих сахаров создает как бы ловушку для них, эффективно изолируя реакции гликолиза и фосфоглюконатного пути в пределах внутриклеточного отсека. Тем не менее фосфаты сахаров не могут накапливаться в больших количествах в печени, так как благодаря осмосу увеличение их запасов будет сопровождаться накоплением больших количеств воды.
В печени происходит превращение избытка углеводов в нерастворимый полимер – гликоген. Эта резервная форма глюкозы может составлять одну десятую всей массы печени. При голодании запас гликогена почти полностью истощается.
Обмен гликогена включает в себя 2 процесса: гликогенез или синтез гликогена и гликогенолиз или распад гликогена.
Гликогенез – синтез гликогена – это анаболический процесс, требующий затраты энергии в форме как АТФ, так и уридинтрифосфата (УТФ). Исходным источником для синтеза гликогена является глю, d под действием глюкокиназы превращается в глю-6-фосфат.
Глю-6-ф занимает ключевое положение как общий промежуточный продукт ряда процессов углеводного обмена: он способен к обратимому превращению в пируват путем гликолиза или глюконеогенеза, а также к необратимому – в пентозы в ходе фосфоглюконатного пути. Глю-6-ф может обратимо превращаться в гликоген.
Затем глю-6-ф превращается в глю-1-ф. В процессе активации глю-1-ф участвуют уридиннуклеотиды. В ходе этого процесса два концевых фосфорных остатка УДФ освобождаются в виде неорганического пирофосфата, остаток УМФ соединяется с глю-1-ф, образуя УДФ-глюкозу.
Источником глю при синтезе гликогена является УДФ-глю, d образуется из глюкозо-1-ф и УТФ:
Глю-1-ф + УТФ → УДФ=глю + Н4Р2О7
На следующей стадии происходит перенос остатка глю с УДФ-глю на затравку гликогена с помощью гликогенсинтетазы:
УДФ-глю + (глю)n → УДФ +(глю)n+1
Гликогенсинтетаза катализирует образование только α -1,4-гликозидных связей. «Ветвящий» фермент образует α -1-6 гликозидные S (точки ветвления).
Гликогенолиз –
распад гликогена идет путем фосфоролиза.
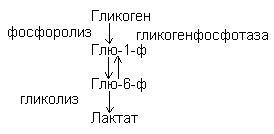
24. Регуляция синтеза гликогена осуществляется через регуляцию активности гликоген- синтазы. Гликогенсинтаза в клетках присутствует в двух формах: гликогенсинтаза в (D) — фосфорилированная неактивная форма, гликогенсинтаза а (I) — нефосфорилированная активная форма. Глюкагон в гепатоцитах и кардиомиоцитах по аденилатциклазному механизму инактивирует гликогенсинтазу. Аналогично действует адреналин в скелетных мышцах. Гликогенсинтаза D может аллостеричес активироваться высокими концентрациями глюкозо-6-фосфата. Инсулин активирует гликогенсинтазу. Итак, инсулин и глюкоза стимулируют гликогенез, адреналин и глюкагон — тормозят.
Синтез гликогена бактериями полости рта. Некоторые бактерии полости рта способны синтезировать гликоген при избытке углеводов. Механизм синтеза и распада гликогена бактериями подобен таковым у животных за исключением того, что для синтеза используются не УДФ-производные глюкозы, а АДФ-производные. Гликоген используется этими бактериями для поддержки жизнеобеспечения в отсутствие углеводов.

23 Анаэробный гликолиз
В аэробных условиях пируват большинства клеток дальше идёт в цикл Кребса. В анаэробных условиях (а в эритроцитах и в аэробных условиях) пируват превращается в лактат с помощью фермента лактатдегидрогеназы (ЛДГ). После этого лактат выходит из клеток в кровь. Реакция превращает НАДН (который образовался в 3-ФГАДГ-реакции) в НАД+.
21 Микросомальное окисление - совокупность реакций первой фазы биотрансформации ксенобиотиков и эндогенных соединений, катализирующихся ферментными системами мембран эндоплазматического ретикулума гепатоцитов при участии цитохрома Р-450. При дифференциальном центрифугировании эндоплазматический ретикулум оказывается в микросомальной фракции, поэтому эти реакции получили название микросомальных, а соответствующие ферменты - микросомальных оксигеназ.
Цитохром P450 (цитохром P450-зависимая монооксигеназа, англ. Cytochrome P450, CYP) — общее название ферментов семейства P450. Входят в класс гемопротеинов, относятся к цитохромам типа b[1]. Цитохром P450, связанный с монооксидом углерода, имеет максимум поглощения света при длине волны 450 нм, что определило его название[1][2].
Цитохромы P450 обнаружены во всех без исключения царствах живых существ — у животных, растений, грибов, бактерий, архей[3]. Эти белки отсутствуют только у облигатно анаэробных организмов[3]. Описано около 11 500 белков системы CYP. P450 бактерий и архей растворён в цитоплазме, в эволюционном смысле это наиболее древняя форма цитохрома P450. У эукариотических организмов P450 являются мембранными белками[3].
Система цитохрома P450 участвует в окислении многочисленных соединений, как эндогенных, так и экзогенных. Ферменты этой группы играют важную роль в обмене стероидов, желчных кислот, ненасыщеных жирных кислот, а также в нейтрализации ксенобиотиков (лекарств, ядов, наркотиков
20,Окислительное фосфорилирование — один из важнейших компонентов клеточного дыхания, приводящего к получению энергии в виде АТФ. Субстратами окислительного фосфорилирования служат продукты расщепления органических соединений — белки, жиры и углеводы. Процесс окислительного фосфорилирования проходит на кристах митохондрий
.Однако чаще всего в качестве субстрата используются углеводы. Так, клетки головного мозга не способны использовать для питания никакой другой субстрат, кроме углеводов.
Предварительно сложные углеводы расщепляются до простых, вплоть до образования глюкозы. Глюкоза является универсальным субстратом в процессе клеточного дыхания. Окисление глюкозы подразделяется на 3 этапа:гликолиз;окислительное декарбоксилирование и цикл Кребса;окислительное фосфорилирование.
Хемиосмотическая гипотеза, одна из гипотез в биохимии о механизме преобразования энергии в биологических мембранах при синтезе аденозинтрифосфорной кислоты (АТФ). Высказана английским биохимиком П. Митчеллом в 1961 и в более развитом виде в 1966. Согласно Х. г., на ряде биологических мембран, названных П. Митчеллом "сопрягающими" (внутренние мембраны митохондрий, хлоропластов, плазматические мембраны бактерий), имеется разность электрических потенциалов и разность концентраций ионов водорода. Разность электрохимических потенциалов ионов водорода образуется за счёт энергии, выделяемой при деятельности цепи окислительно-восстановительных ферментов, и, в свою очередь, является источником энергии для синтеза АТФ из аденозиндифосфорной кислоты и неорганического фосфата. Образование разности электрохимических потенциалов ионов водорода на сопрягающих мембранах митохондрий, хлоропластов и некоторых бактерий можно считать доказанным. В последнее время показано, что функции разности электрохимических потенциалов ионов водорода не ограничиваются ролью источника энергии для синтеза АТФ. Поэтому Х. г. стимулировала изучение процессов транспорта ионов и ряда биологически важных молекул (например, аминокислот, Сахаров) через биомембраны, а также движения бактерий и регуляции активности мембранных белков.
19. Дыхательная электронтранспортная цепь (ЭТЦ, ETC, Electron transport chain) — система структурно и функционально связанных трансмембранных белков и переносчиков электронов. ЭТЦ позволяет запасти энергию, выделяющуюся в ходе окисления НАД•Н и ФАДН2 молекулярным кислородом (в случае аэробного дыхания) или иными веществами (в случае анаэробного) в форме трансмембранного протонного потенциала за счёт последовательного переноса электрона по цепи, сопряжённого с перекачкой протонов через мембрану. Электронтранспортные цепи митохондрий эукариот
Комплексы дыхательной цепи. Комплекс I (НАДН дегидрогеназа) окисляет НАД-Н, отбирая у него два электрона и перенося их на растворимый в липидах убихинон, который внутри мембраны диффундирует к комплексу III. Вместе с этим, комплекс I перекачивает 4 протона из матрикса в межмембранное пространство митохондрии.
Комплекс II (Сукцинат дегидрогеназа) не перекачивает протоны, но обеспечивает вход в цепь дополнительных электронов за счёт окисления сукцината.
Комплекс III (Цитохром bc1 комплекс) переносит электроны с убихинола на два водорастворимых цитохрома с, расположенных на внутренней мембране митохондрии. Убихинол передаёт 2 электрона, а цитохромы за один цикл переносят по одному электрону. При этом туда также переходят 2 протона убихинола и перекачиваются комплексом.
