

Билет 1
1)белки как основа жизни. Роль белков…
Белки – это высокомолекулярные азотсодержащие органические вещества, молекулы которых построены из остатков аминокислот.
Каталитическая функция. Транспортная функция. Защитная функция. Сократительная функция. Структурная функция. Гормональная функция. Питательная функция
Молекулы белков представляют собой линейные полимеры, состоящие из α-L-аминокислот и, в некоторых случаях, из модифицированных основных аминокислот.
Аминокислоты — органические соединения, в молекуле которых одновременно содержатся карбоксильные и аминные группы.
Классификация аминокислот.
I. Физико-химическая – основана на различиях в физико-химических свойствах аминокислот. 1) Гидрофобные аминокислоты (неполярные). Компоненты радикалов содержат обычно углеводородные группы и ароматические кольца. К гидрофобным аминокислотам относятся ала, вал, лей, иле, фен, три, мет. 2) Гидрофильные (полярные) незаряженные аминокислоты. Радикалы таких аминокислот содержат в своем составе полярные группировки (-ОН, -SH, -NH2). К полярным незаряженным относятся гли, сер, тре, тир, цис, глн, асн. 3) Полярные отрицательно заряженные аминокислоты. К ним относятся аспарагиновая и глутаминовая кислоты. 4) Полярные положительно заряженные аминокислоты: аргинин, лизин и гистидин.
II. Биологическая классификация. 1) Незаменимые аминокислоты (вал, иле, лей, лиз, мет, тре, три, фен). 2)Заменимые аминокислоты. Строение аминокислот. Все аминокислоты являются α- аминокислотами. Аминокислоты амфотерные соединения. Хим св-ва АК: вступают во все реакции свойственные для амино- и карбоксильной группы; могут взаимодействовать друг с другом; в водных растворах существуют в виде диполя. Р-и на АК: биуретовая (на пепт св ), ксанопротеиновая (на ароматические АК), р-я Миллона (на тир), Р-я Фоля (на серосодержащие АК), р-я Шульце-Распайля
(на триптофан)(формулы аминокислот) |
|
|
2)основные углеводы пищи… |
|
|
По количеству углеводных остатков УВ разделяются на 3 основных класса: 1. |
моносахариды |
|
(глюкоза, фруктоза, галактоза, манноза и др.); 2. дисахариды (мальтоза, сахароза, |
лактоза); 3. |
|
полисахариды (гомополисахариды крахмал, гликоген, клетчатка). |
Крахмал |
– резервный |
гомополисахарид растений, построенный из остатков α-глюкозы. Крахмал представляет собой смесь двух гомополисахаридов: амилозы и амилопектина. В амилозе остатки глюкозы связаны α-1,4- гликозидными связями, в точках ветвления амилопектина - α-1,6-гликозидными связями. Молекулярная масса крахмала – 106-107. Гликоген – резервный гомополисахарид высших животных и человека, построенный из остатков α–Д-глюкозы. Гликоген содержится практически во всех органах и тканях человека и животных; наибольшее его количество находится в печени и мышцах. Молекулярная масса гликогена 107 – 109 и выше. Гликоген по своему строению близок к амилопектину. Остатки глюкозы связаны α-1,4-гликозидными и α-1,6-гликозидными связями (в точках ветвления). В молекуле гликогена имеется большее число α-1,6-гликозидных связей по сравнению с крахмалом. Клетчатка – это единственный гомополисахарид, который не переваривается в ЖКТ человека, т.к. пищеварительные железы человека не вырабатывают β–глюкозидазу. Однако клетчатка выполняет ряд важных функций: 1. способствует формированию кала; 2. усиливает перистальтику кишечника; 3. является адсорбентом, с которым из кишечника выводятся излишки холестерина, соли тяжелых металлов. Роль углеводов: 1. Энергетическая (глюкоза – основной источник энергии для организма. При сгорании 1 г УВ выделяется 4 ккал энергии). 2. Структурнофункциональная (УВ – обязательный компонент гликопротеинов и протеогликанов, которые выполняют разнообразные функции: гормональную, рецепторную, защитную, ферментативную и др.). 3. Метаболическая (пентозы участвуют в синтезе нуклеиновых кислот и нуклеотидных коферментов). Суточная потребность в углеводах составляет 400-500 г. Переваривание углеводов -
это совокупность процессов поэтапного ферментативного гидролиза полисахаридов до моносахаридов, которые всасываются в кишечнике, разносятся током крови к печени и другим тканям организма, где подвергаются различным метаболическим превращениям. Переваривание УВ начинается в ротовой полости под действием фермента амилазы слюны (оптимум рН=6,8-7,2), которая гидролизует в крахмале α -1,4-гликозидные связи с образованием декстринов. Всасывание УВ из просвета кишечника в энтероцит и из энтероцита в кровь происходит: 1) облегченной
диффузией с участием переносчиков; 2) вторично активным транспортом |
(симпортом с ионами |
натрия) с использованием энергии K, Na-АТФ-азы. Быстрее всех всасываются |
глюкоза и галактоза. |
От кишечника всосавшиеся моносахариды транспортируются в печень, где |
происходит до 90% |
превращений моносахаров. Поступление глюкозы в клетки сердечной, скелетных мышц и жировой ткани регулируется инсулином.\
3) количественное определение остаточного азота в сыворотке крови.
Определение остаточного азота ведут в безбелковом фильтрате крови. При нагревании с конц. серной кислотой безбелковый фильтрат минерализуется, затем определяются колориметрически с реактивом Несслера. Сульфат аммония образует с реактивом Несслера желто-оранжевое окрашивание. Расчет ведут по количеству стандартного раствора NH4Cl, пошедшего на титрование опытной пробы:
(А · 0.05) ·100% = мг%
0.066
мг% = 0.714 = ммоль/л, где А – количество стандартного раствора, пошедшего на титрование. норма: 20 – 40 мг% 15 – 25 ммоль/л
клинико-диагностическое значение: Подъем уровня остаточного азота (азотемия) наблюдается при ряде патологических состояний. В клинической практике азотемию подразделяют на 2 типа: ретенционную и продукционную. Ретенционная в основном зависит от недостаточной функции почек и обусловлена недостатком мочевины. Продукционная азотемия связана с поступлением в кровоток избыточного количества азотсодержащих веществ, как правило, за счет повышенного распада тканевых белков при сохраненной выделительной функции почек. Повышенное содержание остаточного азота (свыше 80 – 90 мг%) – уремия.
4) В стационар поступил больной в активной стадии атеросклероза. В какой фракции липопротеидов крови больше всего содержится холестерин?
Больше все холестерина содержится в липопротеинах низкой плотности (ЛПНП), их еще называют атерогенными.
Билет 2
1)Физ-хим св-ва беков…
1. Молекулярная масса. Молекулярная масса белков зависит от количества аминокислот в каждой субъединице. 2. Буферные свойства. Белки – амфотерные полиэлектролиты, т.е. они сочетают в себе кислые и основные свойства. В зависимости от этого белки могут быть кислыми и основными. 3. Факторы стабилизации белка в растворе. ГИДРАТНАЯ ОБОЛОЧКА – это слой молекул воды, определенным образом ориентированных на поверхности белковой молекулы. 4. Факторы, снижающие растворимость белков. Значение рН, при котором белок становится электронейтральным, называется изоэлектрической точкой (ИЭТ) белка. Денатурация – это последовательное нарушение четвертичной, третичной, вторичной структур белка, сопровождающееся потерей биологических свойств. Денатурированный белок выпадает в осадок. Осадить белок можно, изменяя рН среды (ИЭТ), либо высаливанием(р-ми NaCl, (NH4)2SO4), либо действуя каким-либо фактором денатурации. Физические факторы: 1. Высокие температуры. Часть белков подвергается денатурации уже при 40-50 2. Ультрафиолетовое облучение 3. Рентгеновское и радиоактивное облучение 4. Ультразвук 5. Механическое воздействие (например, вибрация).
Химические факторы: 1. Концентрированные кислоты и щелочи. 2. Соли тяжелых металлов (например, CuSO4). 3. Органические растворители (этиловый спирт, ацетон) 4. Нейтральные соли щелочных и щелочноземельных металлов (NaCl, (NH4)2SO4)
2)Пищ.жиры,их гидролиз…
Жиры, или триглицериды — природные органические соединения, полные сложные эфиры глицерина и одноосновных жирных кислот; входят в класс липидов. В живых организмах выполняют структурную, энергетическую и др. функции. Наряду с углеводами и белками, жиры — один из главных компонентов питания. Жидкие жиры растительного происхождения обычно называют маслами. Гидролиз жиров. Расщепление жиров на глицерин и жирные кислоты проводится обработкой их щёлочью — (едким натром), перегретым паром, иногда — минеральными кислотами. Этот процесс называется омылением. Липопротеинлипаза — фермент, относящийся к классу липаз. ЛПЛ расщепляет триглицериды самых крупных по размеру и богатых липидами липопротеинов плазмы крови — хиломикронов и липопротеинов очень низкой плотности (ЛПОНП или ЛОНП)). ЛПЛ регулирует уровень липидов в крови, что определяет её важное значение в атеросклерозе. Гиперлипидемия (гиперлипопротеинемия) — аномально повышенный уровень липидов и/или липопротеинов в крови человека. Нарушение обмена липидов и липопротеинов встречается довольно часто в общей популяции. Гиперлипидемия является важным фактором риска развития сердечно-сосудистых заболеваний в основном в связи со значительным влиянием холестерина на развитие атеросклероза. Кроме этого, некоторые гиперлипидемии влияют на развитие острого панкреатита.
3) количественное определение мочевой кислоты в крови
Метод Мюллера-Зейферта основан на способности мочевой кислоты взаимодействовать с фосфорновольфрамовым реактивом с образованием соединения, окрашенного в синий цвет. Интенсивность окрашивания пропорциональна количеству мочевой кислоты. По показаниям ФЭКа и по формуле рассчитывают содержание мочевой кислоты:
Сст - Еоп Мг% = Ест Ест = 0,06
норма: 2-6 мг% 0,12-0,36 ммоль/л
клинико-диагностическое значение: Гиперурикемия является основным симптомом подагры, а также наблюдается при синдроме Леша-Нихана – врожденном дефиците фермента гуанингипоксантинфосфорибозилтрансферазы. Подъем мочевой кислоты может быть следствием усиленного распада тканевых нуклеотидов (патологическое изменение крови, миелоз). Это явление носит название «вторичной» подагры. Некоторое нарастание мочевой кислоты наблюдается при диете, богатой пуринами. Снижение мочевой кислоты наблюдается при акромегалии, болезни Коновалова-Вильсона, ксантинурии.
4) Пожилой больной с резко выраженным сахарным диабетом внезапно потерял сознание (диабетическая кома). Может ли врач установить характер этой комы без лабораторного подтверждения?
При сахарном диабете наблюдается кетонемия (повышение кетоновых тел в крови). Одним из кетоновых тел является ацетон. От таких пациентов пахнет ацетоном.
Билет 3
1)Струк.орг-ия белк.молекул…
Первичная структура белка - последовательность аминокислот в полипептидной цепи (ППЦ). Пептидная связь формируется только за счет альфа-аминогруппы и альфа-карбоксильной группы аминокислот. Вторичная структура - это пространственная организация стержня полипептидной цепи в виде α-спирали или β-складчатой структуры. В α-спирали на 10 витков приходится 36
аминокислотных остатков. Фиксируется α-спираль с помощью водородных связей между NHгруппами одного витка спирали и С=О группами соседнего витка. β-Складчатая структура удерживается также водородными связями между С=О и NH-группами. Третичная структура - трехмерное взаимное расположение в пространстве спиралеобразных и складчатых участков полипептидной цепи. В формировании третичной структуры участвуют прочные дисульфидные связи и все слабые типы связей (ионные, водородные, гидрофобные, Ван-дер-ваальсовые взаимодействия). Четвертичная структура – трехмерная организация в пространстве нескольких полипептидных цепей. Каждая цепь называется субъединицей (или протомером). Поэтому белки, обладающие четвертичной структурой, называют полигомерными белками.
2)Особ-ти хим.состава и метаб.нерв.ткани..
Дыхание. На долю головного мозга приходится 2–3% от массы тела. В то же время потребление кислорода головным мозгом в состоянии физического покоя достигает 20–25% от общего потребления его всем организмом, а у детей в возрасте до 4 лет мозг потребляет даже 50% кислорода, утилизируемого всем организмом. Во время прохождения через мозг кровь теряет около 8 об.% кислорода. В 1 мин на 100 г мозговой ткани приходится 53–54 мл крови. Следовательно, 100 г мозга потребляет в 1 мин 3,7 мл кислорода, а весь головной мозг (1500 г) – 55,5 мл кислорода. Метаболизм углеводов. Основным субстратом дыхания мозговой ткани является глюкоза. В 1 мин 100 г ткани мозга потребляют в среднем 5 мг глюкозы. Подсчитано, что более 90% утилизируемой глюкозы в ткани мозга окисляется до СО2 и Н2О при участии цикла трикарбоновых кислот. В физиологических условиях роль пентозофосфатного пути окисления глюкозы в мозговой ткани невелика, однако этот путь окисления глюкозы присущ всем клеткам головного мозга. Образующаяся в процессе пентозофосфатного цикла восстановленная форма НАДФ (НАДФН) используется для синтеза жирных кислот и стероидов. Интересно отметить, что в расчете на всю массу головного мозга содержание глюкозы в нем составляет около 750 мг. За 1 мин тканью мозга окисляется 75 мг глюкозы. Следовательно, количество глюкозы, имеющееся в ткани головного мозга, могло бы быть достаточным лишь на 10 мин жизни человека. Метаболизм макроэргов. Интенсивность обновления богатых энергией фосфорных соединений в головном мозге очень велика. Именно этим можно объяснить, что содержание АТФ и креатинфосфата в мозговой ткани характеризуется значительным постоянством. В случае прекращения доступа кислорода мозг может просуществовать немногим более минуты за счет резерва лабильных фосфатов. Метаболизм аминокислот и белков Общее содержание аминокислот в ткани мозга человека в 8 раз превышает концентрацию их в крови. Аминокислотный состав мозга отличается определенной специфичностью. Так, концентрация свободной глутаминовой кислоты в мозге выше, чем в любом другом органе млекопитающих (10 мкмоль/г). На долю глутаминовой кислоты вместе с ее амидом глутамином и трипептидом глутатионом приходится более 50% α-аминоазота головного мозга. Известно, что обмен аминокислот в мозговой ткани протекает в разных направлениях. Прежде всего пул свободных аминокислот используется как источник сырья для синтеза белков и биологически активных аминов. Метаболизм липидов Липиды составляют около половины сухой массы головного мозга. Как отмечалось, в нервных клетках серого вещества особенно много фосфоглицеридов, а в миелиновых оболочках нервных стволов – сфингомиелина. Из фосфоглицеридов серого вещества мозга наиболее интенсивно обновляются фосфатидилхолины и особенно фосфатидилинозитол. Обмен липидов миелиновых оболочек протекает с небольшой скоростью. Холестерин, цереброзиды и сфингомиелины обновляются очень медленно. Ткань головного мозга взрослого человека содержит много холестерина (около 25 г). У новорожденных в головном мозге всего 2 г холестерина; количество его резко возрастает в первый год жизни (примерно в 3 раза), при этом биосинтез холестерина происходит в самой мозговой ткани. У взрослых людей синтез холестерина в головном мозге резко снижается. Основная часть холестерина в зрелом мозге находится в неэтерифицированном состоянии, эфиры холестерина обнаруживаются в относительно высокой концентрации в участках активной миелинизации.

3)количественное определение активности трансаминаз в сыворотке крови: Количественное определение активности амилазы сыворотки крови амилокластическим методом. Амилаза сыворотки крови гидролизует крахмал в течение 60 минут. Остаток крахмала выявляется качественной реакцией с йодом. Активность амилазы определяется по разности окраски между контролем и опытом на ФЭКе. 16 – 30 мг крахмала, гидролизуемого за 1 час 1 мл сыворотки крови.
Определение активности амилазы сыворотки крови является диагностическим тестом при заболеваниях поджелудочной железы. Фермент обладает небольшой молекулярной массой и размерами, легко проникает в кровь из поджелудочной железы и кишечника, фильтруется в мочу. Увеличение активности амилазы крови наблюдается при заболеваниях поджелудочной и околоушной желез, диабетическом кетоацидозе, заболеваниях желчных путей.
4)Больному с наклонностью к полноте рекомендовано ограничить употребление углеводов и заниматься физкультурой. Объясните почему?
При недостаточности движения происходит снижение утилизации Ацетил-КоА в цикле Кребса и направление его на синтетические процессы, в том числе и синтез жирных кислот и жиров. Углеводы, являются одним из источникв Ацетил-КоА для организма.
Билет 4
1)Строение ферментов…
По строению ферменты могут быть:
1.однокомпонентные (простые белки),
2.двухкомпонентные (сложные белки).
Кферментам - простым белкам – относятся пищеварительные ферменты (пепсин, трипсин). К ферментам – сложным белкам – можно отнести ферменты, катализирующие окислительно - восстановительные реакции. Для каталитической активности двухкомпонентных ферментов необходим дополнительный химический компонент, который называется кофактор, их могут играть
как неорганические вещества (ионы железа, магния, цинка, меди и др.), так и органические вещества
– коферменты (например, активные формы витаминов). Для работы ряда ферментов необходимы и кофермент, и ионы металлов (кофактор). Коферменты – низкомолекулярные органические вещества небелковой природы, связанные с белковой частью фермента временно и непрочно. В случае, когда небелковая часть фермента (кофермент) связана с белковой прочно и постоянно, то такую небелковую часть называют простетической группой. Белковая часть сложного белка-фермента называют апоферментом. Вместе апофермент и кофактор образуют холофермент.
В процессе ферментативного катализа, принимает участие не вся белковая молекула, а лишь определенный участок – активный центр фермента. Активный центр ферментов представляет часть молекулы фермента, к которой присоединяется субстрат и от которой зависят каталитические свойства молекулы фермента. В активном центре фермента выделяют «контактный» участок – участок, притягивающий и удерживающий субстрат на ферменте благодаря своим функциональным группам и «каталитический» участок, функциональные группы которого непосредственно участвуют в каталитической реакции. У некоторых ферментов, кроме активного центра, имеется еще «другой» центр – аллостерический. С аллостерическим центром взаимодействуют различные вещества (эффекторы), чаще всего различные метаболиты. Соединение этих веществ с аллостерическим центром приводит к изменению конформации фермента (третичной и четвертичной структуры). Активный центр в молекуле фермента либо создается, либо он нарушается. В первом случае реакция ускоряется, во втором случае тормозится. Поэтому аллостерический центр называют регуляторным центром фермента. Ферменты, имеющие в своей структуре аллостерический центр, называются регуляторными или аллостерическими. В основу теории механизма действия ферментов положено образование фермент-субстратного комплекса. Механизм действия фермента:
1.образование фермент-субстратного комплекса, субстрат прикрепляется к активному центру фермента.
2.на второй стадии ферментативного процесса, которая протекает медленно, происходят электронные перестройки в фермент-субстратном комплексе. Фермент (En) и
субстрат (S) начинают сближаться, чтобы вступить в максимальный контакт и образовать единый фермент-субстратный комплекс. Продолжительность второй стадии зависит от энергии активации субстрата или энергетического барьера данной химической реакции. Энергия активации – энергия, необходимая для перевода всех молекул 1 моля S в активированное состояние при данной температуре. Для каждой химической реакции существует свой энергетический барьер. Благодаря образованию фермент-субстратного комплекса снижается энергия активации субстрата, реакция начинает протекать на более низком энергетическом уровне. Поэтому вторая стадия процесса лимитирует скорость всего катализа.
3. на третьей стадии происходит сама химическая реакция с образованием продуктов реакции. Третья стадия процесса непродолжительна. В результате реакции субстрат превращается в продукт реакции; фермент-субстратный комплекс распадается и фермент выходит неизмененным из ферментативной реакции. Таким образом, фермент дает возможность за счет образования фермент-субстратного комплекса проходить химической реакции обходным путем на более низком энергетическом уровне.
Кофактор - небелковое вещество, которое обязательно должно присутствовать в организме в небольших количествах, чтобы соответствующие ферменты смогли выполнить свои функции. В состав кофактора входят коферменты и ионы металлов (например, ионы натрия и калия).
Все ферменты относятся к глобулярным белкам, причем каждый фермент выполняет специфическую функцию, связанную с присущей ему глобулярной структурой. Однако активность многих ферментов зависит от небелковых соединений, называемых кофакторами. Молекулярный комплекс белковой части (апофермента) и кофактора называется холоферментом. Роль кофактора могут выполнять ионы металлов (Zn2+, Mg2+, Mn2+, Fe2+, Cu2+, K+, Na+) или сложные органические соединения. Органические кофакторы обычно называют коферментами, некоторые из них являются производными витаминов. Тип связи между ферментом и коферментом может быть различным. Иногда они существуют отдельно и связываются друг с другом во время протекания реакции. В других случаях кофактор и фермент связаны постоянно и иногда прочными ковалентными связями. В последнем случае небелковая часть фермента называется простетической группой. Роль кофактора в основном сводится
кследующему:
•изменение третичной структуры белка и создание комплементарности между ферментом и субстратом;
•непосредственное участие в реакции в качестве еще одного субстрата.
Активаторами могут быть:
1)кофакторы, т.к. они важные участники ферментативного процесса. Например, металлы, входящие в состав каталитического центра фермента: амилаза слюны активна в присутствии ионов Са, лактатдегидрогеназа (ЛДГ) – Zn, аргиназа – Mn, пептидаза – Mg и коферменты: витамин С, производные различных витаминов (НАД, НАДФ, ФМН, ФАД, КоАSH и др.). Они обеспечивают связывание активного центра фермента с субстратом.
2)анионы также могут оказывать активирующее влияние на активность фермента, например, анионы
Сlактивируют слюнную амилазу;
3)активаторами могут служить также вещества, создающие оптимальное значение рН среды для проявления ферментативной активности, например, НСl для создания оптимальной среды желудочного содержимого для активации пепсиногена в пепсин;
4)активаторами являются также вещества, переводящие проферменты в активный фермент,
например, энтерокиназа кишечного сока активирует превращение трипсиногена в трипсин; 5) активаторами могут быть разнообразные метаболиты, которые связываются с аллостерическим центром фермента и способствуют формированию активного центра фермента.
Ингибиторы - это вещества, которые тормозят активность ферментов. Различают два основных типа ингибирования: необратимое и обратимое. При необратимом ингибировании - ингибитор прочно (необратимо) связывается с активным центром фермента ковалентными связями, изменяет конформацию фермента. Таким образом, могут действовать на ферменты соли тяжелых металлов (ртути, свинца, кадмия и др.). Обратимое ингибирование - это такой тип ингибирования, когда активность ферментов может восстанавливаться. Обратимое ингибирование бывает 2-х типов: конкурентное и неконкурентное. При конкурентном ингибировании обычно субстрат и ингибитор очень похож по химическому строению. При этом виде ингибирования субстрат (S) и ингибитор (I) одинаково могут связываться с активным центром фермента. Они конкурируют друг с другом за место в активном центре фермента. Классический пример, конкурентного ингибирование – торможение действия сукцинатдегидрогеназы малоновой кислотой. Неконкурентные ингибиторы связываются с аллостерическим центром фермента. Вследствие этого происходят изменения конформации аллостерического центра, которые приводят к деформации каталитического центра фермента и снижению ферментативной активности. Часто аллостерическими неконкурентными ингибиторами выступают продукты метаболизма. Лекарственные свойства ингибиторов ферментов (Контрикал, Трасилол, Аминокапроновая кислота, Памба). Контрикал (апротинин) применяют для лечения острого панкреатита и обострения хронического панкреатита, острого панкреонекроза, острых кровотечений.
2)Понятие о белках крови…
Из 9–10% сухого остатка плазмы крови на долю белков приходится 6,5–8,5%. Используя метод высаливания нейтральными солями, белки плазмы крови можно разделить на три группы: альбумины, глобулины и фибриноген. Нормальное содержание альбуминов в плазме крови составляет 40–50 г/л, глобулинов – 20–30 г/л, фибриногена – 2,4 г/л. Плазма крови, лишенная фибриногена, называется сывороткой. Синтез белков плазмы крови осуществляется преимущественно в клетках печени и ретикулоэндотелиальной системы. Физиологическая роль белков плазмы крови многогранна. 1. Белки поддерживают коллоидно-осмотическое (онкотическое) давление и тем самым постоянный объем крови. Содержание белков в плазме значительно выше, чем в тканевой жидкости. Белки, являясь коллоидами, связывают воду и задерживают ее, не позволяя выходить из кровяного русла. Несмотря на то что онкотическое давление составляет лишь небольшую часть (около 0,5%) от общего осмотического давления, именно оно обусловливает преобладание осмотического давления крови над осмотическим давлением тканевой жидкости. 2. Белки плазмы принимают активное участие в свертывании крови. Ряд белков, в том числе фибриноген, являются основными компонентами системы свертывания крови. 3. Белки плазмы в известной мере определяют вязкость крови, которая, как отмечалось, в 4– раз выше вязкости воды и играет важную роль в поддержании гемодинамических отношений в кровеносной системе.
крови.
3) Количественное определение витамина С в моче. Количество аскорбиновой кислоты определяется титриметрически по количеству 2,6-дихлорфенолиндо-фенола, пошедшего на титрование, и рассчитывается на суточное количество мочи. 2,6-дихлорфенолиндофе-нол (синего цвета) восстанавливается и обесцвечивается витамином С. 20 – 30 мг аскорбиновой кислоты за сутки Экскреция витамина С с мочой снижается при цинге, острых и хронических инфекционных заболеваниях, при недостаточном поступлении вит. С с пищей.
ДИАГНОСТИКА ГИПОВИТАМИНОЗА С: при введении в организм 100 мг аскорбиновой кислоты у здорового человека концентрация витамина С в моче увеличивается. При гиповитаминозе ткани задерживают аскорбиновую кислоту и ее выведение из организма снижается.
4)У больного в моче методом хроматографии обнаружена фенилпировиноградная кислота, в крови фенилаланин (0,4 г/л). Встречается ли фенилпировиноградная кислота в моче здоровых людей? Каково происхождение этого соединения? Для какого заболевания типичны подобные данные биохимического анализа мочи и крови?
У здоровых людей фенилпировиноградная кислота в моче отсутствует. Ее наличие указывает на наследственное заболевание фенилкетонурия, при котором нарушается гидроксилирование аминокислоты фенилаланина. В этом случае происходит превращение ее в фенилпируват и фениллактат, которые и обнаруживаются в моче.
Билет 5
1)Углеводосод.белки…
Углеводсодержащие белки (гликопротеины и протеогликаны). Простетическая группа гликопротеинов может быть представлена моносахаридами (глюкозой, галактозой, маннозой, фруктозой, 6-дезоксигалактозой), их аминами и ацетилированными производными аминосахаров (ацетилглюкоза, ацетилгалактоза. На долю углеводов в молекулах гликопротеинов приходится до 35%. Гликопротеины преимущественно глобулярные белки. Углеводный компонент протеогликанов может быть представлен несколькими цепями гетерополисахаридов. Биологические функции гликопротеинов: 1. транспортная (белки крови глобулины транспортируют ионы железа, меди, стероидные гормоны); 2. защитная: фибриноген осуществляет свертывание крови; б. иммуноглобулины обеспечивают иммунную защиту; 3. рецепторная (на поверхности клеточной мембраны расположены рецепторы, которые обеспечивают специфическое взаимодействие).4. ферментативная (холинэстераза, рибонуклеаза); 5. гормональная (гормоны передней доли гипофиза – гонадотропин, тиреотропин). Биологические функции протеогликанов: гиалуроновая и хондроитинсерная кислоты, кератинсульфат выполняют структурную, связующую, поверхностномеханическую функции.
2)Ферм-ты крови….
Ферменты, которые обнаруживаются в норме в плазме или сыворотке крови, условно можно разделить на 3 группы: секреторные, индикаторные и экскреторные. Секреторные ферменты, синтезируясь в печени, в норме выделяются в плазму крови, где играют определенную физиологическую роль. Типичными представителями данной группы являются ферменты, участвующие в процессе свертывания крови, и сывороточная холинэстераза. Индикаторные (клеточные) ферменты попадают в кровь из тканей, где они выполняют определенные внутриклеточные функции. Один из них находится главным образом в цитозоле клетки (ЛДГ, альдолаза), другие – в митохондриях (глутаматдегидрогеназа), третьи – в лизосомах (β- глюкуронидаза, кислая фосфатаза) и т.д. Большая часть индикаторных ферментов в сыворотке крови определяется в норме лишь в следовых количествах. При поражении тех или иных тканей ферменты из клеток вымываются в кровь; их активность в сыворотке резко возрастает, являясь индикатором степени и глубины повреждения этих тканей. Экскреторные ферменты синтезируются главным образом в печени (лейцинаминопептидаза, щелочная фосфатаза и др.). В физиологических условиях эти ферменты в основном выделяются с желчью. Еще не полностью выяснены механизмы,
регулирующие поступление данных ферментов в желчные капилляры. При многих патологических процессах выделение экскреторных ферментов с желчью нарушается, а активность в плазме крови повышается. Большинство ферментов, содержащихся в печени, присутствуют и в других органах тканей. Однако известны ферменты, которые более или менее специфичны для печеночной ткани. К таким ферментам, в частности, относится γ-глутамилтранспептидаза, или γ-глутамилтрансфераза (ГГТ). Данный фермент – высокочувствительный индикатор при заболеваниях печени. Повышение активности ГГТ отмечается при остром инфекционном или токсическом гепатите, циррозе печени, внутрипеченочной или внепеченочной закупорке желчных путей, первичном или метастатическом опухолевом поражении печени, алкогольном поражении печени. Иногда повышение активности ГГТ наблюдается при застойной сердечной недостаточности, редко – после инфаркта миокарда, при панкреатитах, опухолях поджелудочной железы. Органоспецифическими ферментами для печени считаются также гистидаза, сорбитолдегидрогеназа, аргиназа и орнитинкарбамоилтрансфераза. Изменение активности этих ферментов в сыворотке крови свидетельствуето поражении печеночной
ткани. В настоящее время особо важным лабораторным тестом стало исследование активности |
аминам |
относятся дофамин, норадреналин и адреналин (синтезируются |
изначально |
из |
|||||||||||||||||||||||
изоферментов в сыворотке крови, в частности изоферментов ЛДГ. Известно, что в сердечной мышце |
аминокислоты тирозина), серотонин, мелатонин и триптамин и |
многие другие соединения. |
В |
||||||||||||||||||||||||
наибольшей активностью обладают изоферменты ЛДГ1 и ЛДГ2, а в ткани печени – ЛДГ4 и ЛДГ5. |
|
организме |
животных многие |
биогенные |
амины выполняют |
роль гормонов и нейромедиаторов. |
|||||||||||||||||||||
3) Определение холестеринового индекса атерогенности. К=Х – Х ЛВП |
|
|
|
|
Разлагаются в организме при участии ферментов аминоксидаз. Реакции декарбоксилирования |
||||||||||||||||||||||
ХЛВП |
Здоровые 20 – 30 лет 2 – 2.5 |
|
|
|
|
|
|
|
|
|
являются необратимыми. Они катализируются специфическими ферментами – декарбоксилазами |
||||||||||||||||
Старше 30 лет 3 – 3.5 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
аминокислот, отличающимися от декарбоксилаз α-кетокислот как белковым компонентом, так и |
||||||||||||
Больные атеросклерозом 4 - 7 |
Индекс |
|
атерогенности |
является прогностическим |
показателем |
природой кофермента. |
|
|
|
|
|
|
|
|
|||||||||||||
развития атеросклероза. |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
3) Количественное определение активности амилазы сыворотки крови |
||||||||||||
4) Ребенок поступил в детскую больницу с явлениями отсталости умственного развития. При |
амилокластическим методом. |
Амилаза сыворотки крови гидролизует крахмал в течение 60 минут. |
|||||||||||||||||||||||||
исследовании мочи выявлено наличие фенилпировиноградной кислоты. Какая пища нужна |
Остаток крахмала выявляется качественной реакцией с йодом. Активность амилазы определяется по |
||||||||||||||||||||||||||
этому ребенку? |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
разности окраски между контролем и опытом на ФЭКе. |
16 – 30 мг крахмала, гидролизуемого за |
|||||||||||
Необходимо полностью исключить фенилаланин из рациона. Ребенка переводят на искусственное |
1 час 1 мл сыворотки крови. |
Определение |
активности |
амилазы |
сыворотки |
крови |
является |
||||||||||||||||||||
питание. |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
диагностическим тестом при заболеваниях поджелудочной железы. Фермент обладает небольшой |
||||||||||
Билет 6 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
молекулярной массой и размерами, легко проникает в кровь из поджелудочной железы и кишечника, |
||||||||||
1)Половые гормоны… |
|
|
|
|
|
|
|
|
|
|
|
|
|
фильтруется в мочу. Увеличение активности амилазы |
крови наблюдается |
при заболеваниях |
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
поджелудочной и околоушной желез, диабетическом кетоацидозе, заболеваниях желчных путей. |
|
|||||||||||||
|
Женские половые гормоны. Основным местом синтеза женских половых гормонов – |
|
|||||||||||||||||||||||||
|
4. В инфекционное отделение поступил больной с предположительным диагнозом вирусный |
||||||||||||||||||||||||||
эстрогенов – |
являются яичники и желтое тело. В настоящее время открыты 2 |
группы женских |
|||||||||||||||||||||||||
гепатит. Биохимическое определение каких пигментов мочи поможет врачу в диагностике |
|||||||||||||||||||||||||||
половых гормонов, |
различающихся |
своей химической |
структурой |
и |
биологической |
функцией: |
|||||||||||||||||||||
этого заболевания? |
|
|
|
|
|
|
|
|
|||||||||||||||||||
эстрогены |
(главный |
представитель |
– |
эстрадиол) и |
прогестины |
(главный |
представитель |
– |
|
|
|
|
|
|
|
|
|||||||||||
Причиной вирусного гепатита является разрушение клеток печени под влиянием вирусов. Это |
|||||||||||||||||||||||||||
прогестерон). |
Наиболее |
активный |
эстроген – |
эстрадиол, |
синтезируется преимущественно |
в |
|||||||||||||||||||||
приводит к повышению в крови общего и прямого билирубина, который через почки попадает в мочу. |
|||||||||||||||||||||||||||
фолликулах; два остальных эстрогена являются производными эстрадиола и синтезируются также в |
|||||||||||||||||||||||||||
Именно его появление в моче вместе с уменьшением уробилина поможет диагностировать это |
|||||||||||||||||||||||||||
надпочечниках и плаценте. Все эстрогены состоят из 18 атомов углерода. Секреция эстрогенов и |
|||||||||||||||||||||||||||
заболевание. |
|
|
|
|
|
|
|
|
|||||||||||||||||||
прогестерона яичником носит циклический характер, зависящий от фазы полового цикла: в первой |
|
|
|
|
|
|
|
|
|||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||
фазе цикла синтезируются в основном эстрогены, а во второй – преимущественно прогестерон. |
Билет 7 |
|
|
|
|
|
|
|
|
|
|||||||||||||||||
Основная биологическая роль эстрогенов и прогестерона, синтез которых начинается после |
1)Нуклеопротеины… |
|
|
|
|
|
|
|
|
||||||||||||||||||
наступления половой зрелости, заключается в обеспечении репродуктивной функции организма |
|
Нуклеопротеины - сложные белки, в состав которых входит белок (протамин или гистон), |
|||||||||||||||||||||||||
женщины. В этот период они вызывают развитие вторичных половых признаков и создают |
небелковая часть представлена нуклеиновыми кислотами (НК): дезоксирибонуклеиновой кислотой |
||||||||||||||||||||||||||
оптимальные условия, обеспечивающие возможность оплодотворения яйцеклетки после овуляции. |
(ДНК) и рибонуклеиновой кислотой (РНК). |
Протамины и гистоны – белки с резко выраженными |
|||||||||||||||||||||||||
Прогестерон выполняет в организме ряд специфических функций: подготавливает слизистую |
основными свойствами, т.к. они содержат более 30% арг и лиз. Нуклеиновые кислоты (НК) - это |
||||||||||||||||||||||||||
оболочку матки к успешной имплантации яйцеклетки в случае ее оплодотворения, а при наступлении |
длинные полимерные цепи, состоящие из многих тысяч мономерных единиц, которые соединяются |
||||||||||||||||||||||||||
беременности основная роль – сохранение беременности; оказывает тормозящее влияние на |
между собой 3`,5`- фосфоди-эфирными связями. Мономером НК является мононуклеотид, который |
||||||||||||||||||||||||||
овуляцию и стимулирует развитие ткани молочной железы. Эстрогены оказывают анаболическое |
состоит из азотистого основания, пентозы и остатка фосфорной кислоты. Азотистые основания |
||||||||||||||||||||||||||
действие на организм, стимулируя синтез белка. Мужские половые гормоны. Биосинтез андрогенов |
бывают пуриновые (А и Г) и пиримидиновые (Ц, У, Т). В качестве пентозы выступает β– Д- рибоза |
||||||||||||||||||||||||||
осуществляется главным образом в семенниках и частично в яичниках и надпочечниках |
или β –Д- дезоксирибоза. Азотистое основание соединено с пентозой N-гликозидной связью. Пентоза |
||||||||||||||||||||||||||
Биологическая роль андрогенов в мужском организме в основном связана с дифференцировкой и |
и фосфат связаны друг с другом сложноэфирной связью между –ОН группой, расположенной у С5’- |
||||||||||||||||||||||||||
функционированием репродуктивной системы, причем в отличие от эстрогенов андрогенные |
атома пентозы, и фосфатом. Виды нуклеиновых кислот: 1. ДНК содержит А, Г, Т и Ц, дезоксирибозу |
||||||||||||||||||||||||||
гормоны уже в эмбриональном периоде оказывают существенное влияние на дифференцировку |
и фосфорную кислоту. ДНК находится в ядре клетки и составляет основу сложного белка хроматина. |
||||||||||||||||||||||||||
мужских половых желез, а также других тканей, определяя характер секреции гонадотропных |
2. РНК содержит А, Г, У и Ц, рибозу и фосфорную кислоту. Различают 3 вида РНК: |
а) м-РНК |
|||||||||||||||||||||||||
гормонов у взрослых. Во взрослом организме андрогены регулируют развитие мужских вторичных |
(информационная или матричная) – копия участка ДНК, содержит информацию о структуре белка; б) |
||||||||||||||||||||||||||
половых признаков, сперматогенез в семенниках и т.д. |
|
|
|
|
|
|
|
|
р-РНК образует скелет рибосомы в цитоплазме, выполняет важную роль при сборке белка на |
||||||||||||||||||
2)Декарбоксил-е ак… |
|
|
|
|
|
|
|
|
|
|
|
|
|
рибосоме в процессе трансляции; в) т-РНК участвует в активации и транспорте АК к рибосоме, |
|||||||||||||
|
Процесс отщепления карбоксильной группы аминокислот в виде CO2 получил название |
локализована в цитоплазме. НК имеют первичную, вторичную и третичную структуры. Первичная |
|||||||||||||||||||||||||
декарбоксилирования. |
В |
животных |
тканях |
установлено |
декарбоксилирование |
следующих |
структура НК одинакова для всех видов – линейная полинуклеотидная цепь, в которой |
||||||||||||||||||||
аминокислот |
|
и |
|
их |
|
производных: тирозина,триптофана, |
|
5- |
мононуклеотиды связаны 3’, 5’-фосфодиэфирными связями. Каждая полинуклеотидная цепь имеет 3’ |
||||||||||||||||||
окситриптофана, валина, серина, гистидина, глутаминовой и |
γ-оксиглутаминовой |
кислот, 3,4- |
и 5’ , эти концы заряжены отрицательно. Вторичная структура ДНК представляет собой двойную |
||||||||||||||||||||||||
диоксифенилаланина, цистеина, аргинина, орнитина, S-аденозилметионина и α-аминомалоновой |
спираль. ДНК состоит из 2-х цепей, закрученных в спираль вправо вокруг оси. Виток спирали = 10 |
||||||||||||||||||||||||||
кислоты. Помимо этого, у микроорганизмов и растений открыто декарбоксилирование ряда других |
нуклеотидов, что составляет в длину 3,4 нм. Обе спирали антипараллельны. Третичная структура |
||||||||||||||||||||||||||
аминокислот. Биогенные амины — вещества, обычно образующиеся в организме животных или |
ДНК. Это результат дополнительного скручивания в пространстве молекулы ДНК. Это происходит |
||||||||||||||||||||||||||
растений |
из |
аминокислот |
при их декарбоксилировании (удалении |
карбоксильной группы) |
при взаимодействии ДНК с белком. При взаимодействии с октамером гистона двойная спираль |
||||||||||||||||||||||
ферментами декарбоксилазами и обладающие высокой биологической активностью. |
К биогенным |
накручивается на октамер, |
т.е. превращается в суперспираль. |
Вторичная |
структура РНК |
– |
|||||||||||||||||||||
полинуклеотидная нить, изогнутая в пространстве. Эта изогнутость обусловлена образованием |
б) Недостаток галактокиназы. Происходит накопление галактозы и ее превращение в галактитол. |
|||
водородных связей между комплементарными азотистыми основаниями. У |
т-РНК вторичная |
Следствие: раннее развитие катаракты |
||
структура |
представлена «клеверным листом», в котором |
различаю |
комплементарные и |
|
некомплементарные участки. Вторичная структура р-РНК – спираль одиночной изогнутой РНК, а |
|
|||
третичная – |
скелет рибосомы. Поступая из ядра в ЦЗ, м-РНК образует со специфическими белками – |
|
||
информомерами комплексы (третичная структура м-РНК) и называются информосомами. |
|
|||
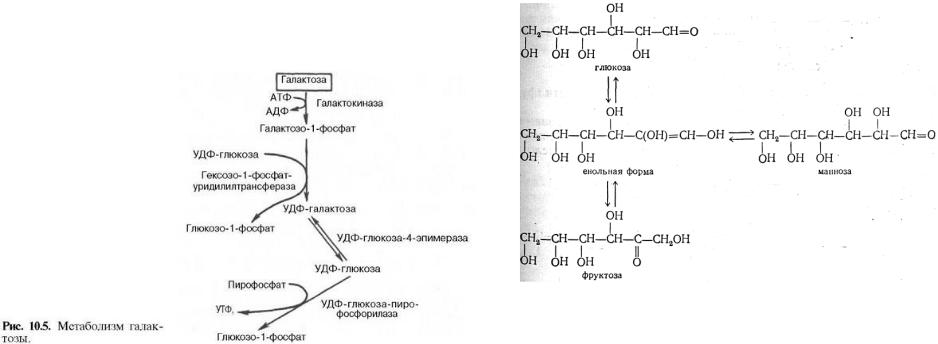
2)Обмен галактозы,фруктозы,…
Нарушения, связанные с недостаточностью ферментов, которые принимают участие в переваривании и всасывании УВ. 1. Непереносимость лактозы: а) врожденная. Дефект по лактазе в просвете тонкого кишечника. Большой осмотический эффект невсосавшейся лактозы вызывает приток жидкости в тонкий кишечник, поэтому клиническими симптомами являются вздутие живота, тошнота, судороги, боль и водная диарея. Наследуется по аутосомно-рецессивному типу. б) приобретенная (временная). Может быть, и у взрослых вследствие инфекционных заболеваний или интенсивного лечения антибактериальными препаратами. 2. Нарушения обмена фруктозы: а) Фруктоземия (наследственная непереносимость фруктозы). Недостаточность фермента кетозо-1- фосфатальдолазы приводит к резкому увеличению концентрации фруктозо-1-фосфата в клетках печени, вследствие чего развиваются хроническая недостаточность функций печени и почек, гипогликемия, диарея, рвота, боли в животе. б) Эссенциальная фруктозурия. Причина: недостаток фруктокиназы. Следствие: нарушение фосфорилирования фруктозы приводит к повышению содержания фруктозы в крови и аномальному выведению фруктозы с мочой. Это нарушение не вызывает патологических симптомов. 3. Нарушения обмена галактозы: а) Галактоземия. Причина: недостаток фермента гексозо-1-фосфатуридилтрансфераза печени. Больные дети плохо растут, прием молока вызывает рвоту и понос. Происходит увеличение печени и желтуха. При этом заболевании увеличивается концентрация галактозы и галактозо-1-фосфата. Галактоземия сопровождается галактозурией. У детей галактоземия приводит к умственной отсталости и катаракте хрусталика. Определяющим диагностическим критерием служит отсутствие в эритроцитах гексозо-1-фосфатуридилтрансферазы.

3) Количественное определение содержания ЛПНП в сыворотке крови. ЛПНП способны осаждаться в присутствии хлорида кальция и гепарина. По степени помутнения раствора судят о концентрации ЛПНП в сыворотке крови. 3 – 4.5 г/л Увеличение ЛПНП наблюдается при наследственном холестеринозе, сахарном диабете, нефрозах, гепатитах, хроническом алкоголизме, ксантоматозе, ожирении.
4. При исследовании крови больного в сыворотке обнаружено 0,2 г/л мочевой кислоты. Сколько мочевой кислоты содержится в крови здоровых людей? Могут ли данные этого анализа быть надежным критерием для распознавания заболевания? Каков диагноз заболевания? Каковы биохимические нарушения типичные для данного заболевания?
Концентрация мочевой кислоты в крови человека в норме от 0,06 до 0,07 г/л у мужчин и от 0,05 до 0,06 г/л у женщин. Гиперурикемия является основным симптомом подагры, а также наблюдается при синдроме Леша-Нихана – врожденном дефиците фермента гуанингипоксантинфосфорибозилтрансферазы. Подъем мочевой кислоты может быть следствием усиленного распада тканевых нуклеотидов (патологическое изменение крови, миелоз). Это явление носит название «вторичной» подагры. Некоторое нарастание мочевой кислоты наблюдается при диете, богатой пуринами.
Билет 8
1)Глюкагон и инсулин…
Инсулин, получивший свое название от наименования панкреатических островков. Молекула инсулина, содержащая 51 аминокислотный остаток, состоит из двух полипептидных цепей, соединенных между собой в двух точках дисульфидными мостиками. В физиологической регуляции синтеза инсулина доминирующую роль играет концентрация глюкозы в крови. Так, повышение содержания глюкозы в крови вызывает увеличение секреции инсулина в панкреатических островках, а снижение ее содержания, наоборот,– замедление секреции инсулина. Этот феномен контроля по типу обратной связи рассматривается как один из важнейших механизмов регуляции содержания глюкозы в крови. При недостаточной секреции инсулина развивается специфическое заболевание – сахарный диабет. Физиологические эффекты инсулина: Инсулин — единственный гормон, снижающий содержание глюкозы в крови, это реализуется через:
▪усиление поглощения клетками глюкозы и других веществ;
▪активацию ключевых ферментов гликолиза;
▪увеличение интенсивности синтеза гликогена — инсулин форсирует запасание глюкозы клетками печени и мышц путём полимеризации её в гликоген;
▪уменьшение интенсивности глюконеогенеза — снижается образование в печени глюкозы из
различных веществ Анаболические эффекты
▪усиливает поглощение клетками аминокислот (особенно лейцина и валина);
▪усиливает транспорт в клетку ионов калия, а также магния и фосфата;
▪усиливает репликацию ДНК и биосинтез белка;
▪усиливает синтез жирных кислот и последующую их этерификацию — в жировой ткани и в печени инсулин способствует превращению глюкозы в триглицериды; при недостатке инсулина
происходит обратное — мобилизация жиров. Антикатаболические эффекты
▪подавляет гидролиз белков — уменьшает деградацию белков;
▪уменьшает липолиз — снижает поступление жирных кислот в кровь.
Глюкагон — гормон альфа-клеток островков Лангерганса поджелудочной железы. По химическому строению глюкагон является пептидным гормоном. Молекула глюкагона состоит из
29 аминокислот и имеет |
молекулярный вес 3485. |
Первичная структура молекулы глюкагона |
|||
следующая: |
|
|
|
|
|
NH2-His-Ser-Gln-Gly-Thr-Phe- Thr-Ser-Asp-Tyr-Ser-Lys-Tyr-Leu-Asp-Ser- Arg-Arg-Ala-Gln-Asp-Phe- |
|||||
Val-Gln-Trp-Leu- Met-Asn-Thr-COOH |
|
|
|
||
Механизм действия |
глюкагона обусловлен |
его связыванием |
со |
специфическими |
|
глюкагоновыми рецепторами клеток печени. Это приводит к повышению опосредованной G-белком |
|||||
активности аденилатциклазы и |
увеличению образования цАМФ. Результатом |
является усиление |
|||
катаболизма депонированного |
в печени гликогена. |
Глюкагон оказывает |
сильное инотропное и |
||
хронотропное действие на миокард вследствие увеличения образования. Результатом является повышение артериального давления, увеличение частоты и силы сердечных сокращений
2)Биосинтез пирим.нукл….
Синтез пуринов и пиримидинов приводит к монофосфатам, соответственно ИМФ (IMP] и
УМФ (UMP). Из этих двух предшественников синтезируются все |
другие |
нуклеотиды. |
||||||||||
Синтез пуриновых |
нуклеотидов осуществляется |
из инозинмонофосфата [ИМФ |
|
(IMP)]. |
Его |
|||||||
основание гипоксантин превращается в |
две |
стадии соответственно |
в |
аденин |
или |
гуанин. |
||||||
Образующиеся |
нуклеозидмонофосфаты АМФ (AMP) |
и ГМФ (GMP) |
|
переходят |
в |
|||||||
дифосфаты АДФ(ADP) |
и ГДФ (GDP) |
под |
действием нуклеозидфосфаткиназ и, |
наконец, |
||||||||
фосфорилируютсянуклеозиддифосфаткиназами до |
трифосфатов АТФ (АТР) |
|
и ГТФ (GTP). |
|||||||||
|
|
Нуклеозидтрифосфаты служат строительными блоками для РНК |
||||||||||
|
|
(RNA) или функционируют в качестве коферментов. |
||||||||||
|
|
Преобразование |
рибонуклеотидов |
в дезоксирибонуклеотиды |
||||||||
|
|
происходит на стации дифосфатов и катализируется |
||||||||||
|
|
нуклеозиддифосфат-редуктазой. |
|
|
|
|
|
Пути |
||||
|
|
биосинтеза пиримидиновых |
нуклеотидов: |
прежде |
|
всего |
||||||
|
|
исходный УМФ фосфорилируется |
до |
ди-, |
а |
|
затем |
|||||
|
|
трифосфата УТФ. |
УТФ |
превращается цитидинтрифосфат- |
||||||||
|
|
синтазой (CTP-синтаза) в ЦТФ. 2'-Дезоксирибоза, структурный |
||||||||||
|
|
элемент ДНК, не синтезируется в виде свободного сахара, а |
||||||||||
|
|
образуется |
на |
стадии |
дифосфата |
при |
восстановлении |
|||||
|
|
ρибонуклеозиддифосфатов. Такое восстановление — сложный |
||||||||||
|
|
процесс, в котором участвует несколько белков. |
Необходимые |
|||||||||
восстановительные эквиваленты поставляются НАДФН (NADPH). Тем не менее, они не переносятся непосредственно от кофермента к субстрату, а проходит прежде всего через ряд окислительновосстановительных реакций. На первой стадии тиоредоксинредуктаза восстанавливает с помощью связанного с ферментом флавинадениндинуклеотида небольшой белок, тиоредоксин. При этом дисульфидный мостик в тиоредоксине расщепляется. Образующиеся SH-группы снова восстанавливают каталитически активный дисульфидный мостик в нуклеозиддифосфатредуктазе («рибонуклеотид-редуктаза»). Свободные SH-группы являются действенными донорами электронов для восстановления рибонуклеотиддифосфатов. Рибонуклеотид-редуктаза эукариот представляет собой тетрамер, состоящий из двух R1- и R2 -субъединиц. Кроме упомянутого дисульфидного мостика, в ферменте во время реакции образуется тирозин-радикал, генерирующий радикал в субстрате. Последний отщепляет молекулу воды и вследствие этого переходит в радикал-катион. При последующем восстановлении образуется остаток дезоксирибозы и регенерируется тирозиновый радикал. Процесс регуляции рибонуклеотид-редуктазы имеет довольно сложный механизм. Субстратная специфичность и активность фермента контролируются двумя аллостерическими центрами связывания R1-субъединицы. АТФ и дАТФ соответственно повышают и уменьшают активность редуктазы, связываясь с центром а. С центром б взаимодействует другой нуклеотид, изменяющий в результате связывания субстратную специфичность фермента.
3, Количественное определение витамина С в моче. Количество аскорбиновой кислоты определяется титриметрически по количеству 2,6-дихлорфенолиндо-фенола, пошедшего на

титрование, и рассчитывается на суточное количество мочи. 2,6-дихлорфенолиндофе-нол (синего цвета) восстанавливается и обесцвечивается витамином С. 20 – 30 мг аскорбиновой кислоты за сутки Экскреция витамина С с мочой снижается при цинге, острых и хронических инфекционных заболеваниях, при недостаточном поступлении вит. С с пищей.
ДИАГНОСТИКА ГИПОВИТАМИНОЗА С: при введении в организм 100 мг аскорбиновой кислоты у здорового человека концентрация витамина С в моче увеличивается. При гиповитаминозе ткани задерживают аскорбиновую кислоту и ее выведение из организма снижается.
4) В клинику нервных болезней поступил больной с диагнозом прогрессирующая мышечная дистрофия. В крови обнаружено высокое содержание креатина и снижение уровня креатинина. Какова биологическая роль креатина? Почему у больного снижено содержание креатинина в моче?
В мышцах происходит синтез из креатина креатинфосфата, который используется в первые секунды работы мышц. Креатинин является продуктом деградации креатина. В норме креатинин выделяется из организма с мочой. Выделение креатина с мочой наблюдается при потере мышечной массы.
Билет 9
1)Гормоны щит.железы…
Тироксин и трийодтиронин – основные гормоны фолликулярной части щитовидной железы. Помимо этих гормонов (биосинтез и функции которых будут рассмотрены ниже), в особых клетках – так называемых парафолликулярных клетках, или С-клетках щитовидной железы, синтезируется гормон пептидной природы, обеспечивающий постоянную концентрацию кальция в крови. Он получил название кальцитонин . Биологическое действие кальцитонина прямо противоположно эффекту паратгормона: он вызывает подавление в костной ткани резорбтивных процессов и соответственно гипокальциемию и гипофосфатемию. Из L-тиронина легко синтезируется гормон щитовидной железы тироксин, содержащий в 4 положениях кольцевой структуры йод Биологическое действие гормонов щитовидной железы распространяется на множество физиологических функций организма. В частности, гормоны регулируют скорость основного обмена, рост и дифференцировку тканей, обмен белков, углеводов и липидов, водноэлектролитный обмен, деятельность ЦНС, пищеварительного тракта, гемопоэз, функцию сердечнососудистой системы, потребность в витаминах, сопротивляемость организма инфекциям и др. Гипофункция щитовидной железы в раннем детском возрасте приводит к развитию болезни, известной в литературе как кретинизм. Помимо остановки роста, специфических изменений кожи, волос, мышц, резкого снижения скорости процессов обмена, при кретинизме отмечаются глубокие нарушения психики; специфическое гормональное лечение в этом случае не дает положительных результатов. Повышенная функция щитовидной железы (гиперфункция) вызывает развитие гипертиреоза
L-тироксин L-3,5,3'-трийодтиронин
2)Аэробный распад глюкозы…
Аэробный путь окисления глюкозы и его энергетика. Аэробный путь окисления глюкозы происходит в 3 этапа: 1. окисление молекулы глюкозы до 2 молекул пирувата; 2. окислительное декарбоксилирование пирувата (с образованием 2 молекул ацетил-КоА); 3. реакции цикла Кребса, где каждая молекула ацетил-КоА сгорает с образованием 12 АТФ. 1-ый этап. Окисление молекулы глюкозы до 2 молекул пирувата - это первые 10 реакций гликолиза. Суммарная реакция 1 этапа:
Глюкоза + 2 НАД++ 2 АДФ → 2 пирувата + 2 НАДН + Н+ + 2 АТФ 2-ой этап. Окислительное декарбоксилирование пирувата (с образованием
2 молекул ацетилКоА) происходит в матриксе митохондрий и осуществляется мультиферментным комплексом пируватдегидрогеназой.
В его состав входят 3 фермента и 5 коферментов: |
1. |
Пируватдекарбоксилаза – кофермент тиаминпирофосфат (активная форма витамина В1). 2. Дегидролипоилацетилтрансфераза – кофермента: в активном центре – липоевая кислота (витаминоподобное вещество), из матрикса митохондрий используется Коэнзим А (КоА~SH). 3. Дигидролипоилдегидрогеназа – коферменты: в активном центре – ФАД, из матрикса митохондрий используется – НАД. Суммарная реакция:
2 Пируват + 2 НАД+ + КоА → 2 ацетил-КоА + 2 НАДН + Н+ Каждый восстановленный НАД в митохондриях отдает протоны и электроны в полную ц.п.э., где
образуется 2 х 3 АТФ = 6 АТФ. Таким образом, ценность второго этапа – 6 АТФ. Эти реакции происходят только в аэробных условиях! 3-ий этап. Реакции цикла Кребса, где каждая молекула ацетил-КоА сгорает с образованием 12 АТФ. Следовательно, энергетический выход третьего этапа (в расчете на молекулу глюкозы) – 2 х 12 АТФ = 24 АТФ . Энергетическая ценность аэробного окисления глюкозы: 1 этап – 8 (6) АТФ 2 этап – 6 АТФ 3 этап – 24 АТФ Итого: 38 (36) АТФ (разница в 2 АТФ зависит от челнока, который переносит протоны и электроны из цитозоля от НАДН, образованного в 6-ой реакции гликолиза в митохондрии в ц.п.э.). Аэробное окисление глюкозы является главным источником энергии для большинства клеток организма
3) Наличие свободной HCl в желудочном содеожимом.Определение свободной HCl в желудочном содержимом. Для реакции на свободную HCl используют бумагу Конго. В сильно кислой среде Конго имеет синюю окраску, а в слабо кислой, нейтральной и щелочной – красную.
Титрование желудочного содержимого 0.1N раствором NaOH в присутствии фенолфталеина и диметиламиноазобензола. О содержании свободной HCl судят по количеству 0.1 N NaOH, пошедшего на титрование 100 мл желудочного содержимого 20 – 40 титр. ед.
40 – 60 титр. ед. В клинической практике широко используется как качественный, так и количественный метод анализа желудочного содержимого. Патологические изменения содержания HCl: гиперхлоргидрия – увеличение свободной HCl характерно для гиперацидного гастрита, язвы желудка и 12-перстной кишки.
Гипохлоргидрия – снижение свободной HCl наблюдается при гипоацидном гастрите.
Ахлоргидрия – полное отсутствие HCl в желудочном содержимом. Повышение общей кислотности более 60 т. ед. – гиперацидитас (язва желудка, 12-перстной кишки, гиперацидный гастрит). Снижение общей кислотности (менее 40 т.ед.) – гипоацидитас наблюдается при гипоацидном гастрите, снижении секреторной функции обкладочных клеток слизичтой желудка.
4) Врач предполагает наличие гиповитаминоза С у больного. Как можно провести биохимическую диагностику гиповитаминоза С?
Диагностика гиповитаминоза С проводится следующим образом: при введении в организм 100 мг аскорбиновой кислоты у здорового человека концентрация витамина С в моче увеличивается. При гиповитаминозе ткани задерживают аскорбиновую кислоту и ее выведение из организма снижается. Экскреция витамина С с мочой снижается при цинге, острых и хронических инфекционных заболеваниях, при недостаточном поступлении вит. С с пищей.
Билет 10
1)Простые и сложные белки…
Простые белки построены из остатков аминокислот и при гидролизе распадаются соответственно только на свободные аминокислоты. Сложные белки – это двухкомпонентные белки, которые состоят из какого-либо простого белка и небелкового компонента, называемого простетической группой. При гидролизе сложных белков, помимо свободных аминокислот, освобождается небелковая часть или продукты ее распада. Классификация сложных белков: фосфопротеины (содержат фосфорную кислоту, кот присоединяется к ОН сер и тре), хромопротеины (флавопротеины(ФМН и ФАД) и гемопротеины(ферменты – цитохромы, каталаза и пероксидаза и неферменты – гемоглобин и миоглобин)), нуклеопротеины (содержат ДНК и РНК – рибосомы и хроматин), гликопротеины (содержат углеводы, кот связаны ковалентно с ОН гр сер и тре через О-гликозижную связь и с NH-гр арг и асп через N-гликозидную связь), липопротеины (содержат липиды, связанные с пом. нековалентных св: гидрофобных и ионных) и металлопротеины (содержат металлы). При

функционировании белков может происходить их связывание с лигандами –низкомолекулярными веществами. Лиганд присоединяется к определенному участку в белковой молекуле – активному центру. Активный центр формируется на третичном и четвертичном уровнях организации белковой молекулы и образуется благодаря притяжению боковых радикалов определенных аминокислот (между -ОН группами сер формируются водородные связи, ароматические радикалы связаны гидрофобными взаимодействиями, -СООН и –NH2 - ионными связями).
2)Пентозофосф. Путь превр.глюкозы…
3) Белок плазмы крови |
|
А) экспресс-метод (метод «висящей» капли) |
В основу метода положена зависимость между |
содержанием белков в плазме и цельной крови и ее удельным весом. Определение удельного веса плазмы и цельной крови осуществляется путем погружения капли в растворы CuSO4 известного веса. Тот раствор CuSO4 , в котором капля сначала повисает, а затем опускается, равен удельному весу
исследуемой жидкости. |
65-85 г/л |
|
6.5-8.5 мг% |
Гиперпротеинемия – увеличение общего содержания белков плазмы крови |
|
наблюдается при диарее у детей, рвоте, непроходимости верхнего отдела тонкой кишки, обширных ожогах. Потеря воды организмом приводит к повышению концентрации белка в крови: а) относительная гиперпротеинемия связана с потерей воды организмом (диарея, рвота, ожоговая болезнь, травмы); б) абсолютная гиперпротеинемия обусловлена резким нарастанием глобулинов при инфекциях, а также синтезом патологических белков или белков «острой фазы».
Гипопротеинемия – снижение общего содержания белков плазмы может быть обусловлено с несколькими причинами: а) нарушение белок-синтезирующей функции печени (паренхиматозная желтуха, гепатиты, цирроз печени). Происходит снижение белкового коэффициента за счет снижения синтеза альбуминов; б) задержкой воды при заболеваниях сердечно-сосудистой системы; в) потерей белка с мочой при патологии почек; г) кровопотерями при травмах и операциях
Б) биуретовый метод Метод основан на образовании биуретового комплекса Cu(OН)2 с пептидными связями, имеющего розово-фиолетовое окрашивание. Интенсивность окраски пропорциональна количеству пептидных связей.
В) метод Лоури. Метод основан на способности белков образовывать окрашенные комплексы синего цвета при осуществлении двух цветных реакций – биуретовой и реакции Фолина (восстановление белками смеси фосфорновольфрамовой и фосфорномолиюденовой кислот – реактив Фолина). Интенсивность окраски зависит от количества белка.
Активность аминотрансфераз (АлАт и АсАт) в крови. Метод определения активности АлАт и АсАт основан на определении оптической плотности дифенилгидразона пирувата, явлвющегося продуктом дезаминирования аланина и иаспартата. АлАт 0.1-0.7

АсАт 0.1-0.55 Повышение активности аминотрансфераз в сыворотке крови отмечено при целом ряде заболеваний и особенно при поражении органов и тканейЮ, богатых данными ферментами (печень, миокард). АсАт – резкое повышение через 6-12 часов после возникновения инфаркта миокарда, достигает максимума к 24-48 часам, а затем постепенно к 5 дню приходит к норме. Если к
4-5 дню активность АсАт не снижается, то пророгноз плохой.
АлАт – при заболеваниях печени, токсических поражениях печени, холепатиях, холестазе, дерматомиозите. Повышение активности АлАт наблюдается при остром инфаркте миокарда, но не столь резко по сравнению с изменением АсАт. В норме соотношение акимвности АлАт и АсАт= 1.33±0.42. У больных инфекционным гепатитом происходит снижение коэффициента, а при инфаркте миокарда – резко возрастает.
4) У больного с наклонностью к гиперхолестеринемии, прием даже умеренного количества
углеводов с пищей ведет к гиперхолестеринемическому кризу. Почему ?
Углеводы, являются одним из источников Ацетил-КоА для организма, который в норме утилизируется в цикле Кребса. При предрасположенности к гиперхолестеринемии происходит снижение утилизации Ацетил-КоА в и направление его на синтетические процессы, в том числе и синтез холестерина.
Билет 11
1)Регуляция действия ферментов…
2)Биосинтез глюкозы…
Биосинтез глюкозы (глюконеогенез) из молочной кислоты. Глюконеогенез – обращение реакций гликолиза. Из 11 реакций гликолиза 3 необратимы (1-ая, 3-я и 10-я):
1.глюкоза → глюкозо-6 фосфат
2.фруктозо-6-фосфат → фруктозо-1,6-дифосфат
3.фосфоенолпируват → пируват
Для этих реакций существуют обходные пути. Первый обходной путь начинается в матриксе митохондрий. Пируват проникает сквозь мембрану митохондрий в матрикс митохондрии, затем пируват подвергается карбоксилированию под действием фермента пируваткарбоксилаза (с использованием биотина и энергии АТФ). В результате этой реакции образуется оксалоацетат. Затем оксалоацетат превращается в малат, чтобы выйти из митохондрий в цитозоль клетки для дальнейшего превращения. В цитозоле малат обратимо превращается в оксалоацетат (под действием цитозольной малатдегидрогеназы). Образовавшийся оксалоацетат под действием фермента фосфоенолпируваткарбоксикиназы (при участии биотина и энергии ГТФ) превращается в фосфоенолпируват. В дальнейшем реакции глюконеогенеза идут до образования фруктозо-1,6-дифосфата (обратимые реакции гликолиза). Второй обходной путь: Фруктозо-1,6-дифосфат + Н2О → фруктозо-6-фосфат + Фн (реакцию катализирует фруктозо-1,6-бифосфатаза) Третий обходной путь: Глюкозо-6-фосфат + Н2О → глюкоза + Фн (реакцию катализирует глюкозо-6-фосфатаза) В процессе глюконеогенеза 7-я реакция гликолиза (1,3-дифосфоглицерат + АДФ ↔ 3- фосфоглицерат + АТФ) расходуется 2 АТФ. В ходе синтеза глюкозы используются макроэргические соединения: 4 АТФ и 2 ГТФ. Регуляция глюконеогенеза происходит с участием гормонов и с участием метаболитов.
1.Гормональная регуляция. Глюкокортикоиды проникают в клетку, усиливают биосинтез ферментов глюконеогенеза, способствуют повышению уровня сахара в крови.
2.Метаболическая регуляция. Ацетил-КоА стимулирует пируваткарбоксилазу, осуществляющую реакцию превращения пирувата в ЩУК и далее в глюкозу. АТФ участвует в процессах карбоксилирования, стимулирует глюкозо-6-
фосфатазу и фруктозо-1,6-бисфосфатазу, усиливает процессы глюконеогенеза. Витамин Н (биотин) – кофермент пируваткарбоксилазы. Фруктозо-2,6- дифосфат ингибирует фруктозо-1,6-бисфосфатазу.
Цикл Кори. В процессе анаэробного гликолиза в скелетных мышцах образуется лактат, который выходит из клеток в кровь, доставляется в печень, где включается в реакции глюконеогенеза с образованием глюкозы. Глюкоза выходит в кровь, доставляется к тканям, где используется как источник энергии. Цикл Кори выполняет две важные функции: 1) обеспечивает утилизацию лактата
