
РНКаза II
Кодируется геном rnb. Как и полинуклеотидфосфорилаза, процессивно деградирует однонитевую РНК с 3' конца, однако делает это путем гидролиза, а не фосфоролиза мРНК, освобождая нуклеозидмонофосфаты. Мономер с молекулярной массой 72.3 кДа. Содержит карбоксиконцевой РНКсвязывающий S1 домен. Экспрессия РНКазы II находится в обратной корреляции с уровнем полинуклеотидфосфорилазы, что предполагает участие этих двух РНКаз в деградации матричных РНК друг друга
Активность обеих экзорибонуклеаз ингибируется элементами вторичной структуры, однако полинуклеотидфосфорилаза к такому ингибированию значительно менее чувствительна.
Мультибелковые комплексы деградации РНК.
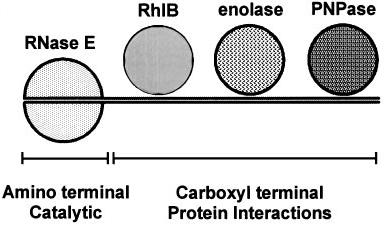
При очистке РНКазы Е из E. coli был обнаружен крупный мультибелковый комплекс – РНКдеградосома. Основными компонентами этого комплекса являются РНКаза Е, ПНФаза и РНК-хеликаза RhlB (Рис. 17.4). Ассоциация РНКазы Е с ПНФазой в одном комплексе дает прямое доказательство их кооперации при деградации мРНК. В составе комплекса также выделяется енолаза (гликолитический фермент) и (в субстехиометрических количествах) полифосфаткиназа PPK и шапероны DnaK и GroEL; роль этих компонентов в деградации мРНК неясна.
РНКаза Е – крупный мультидоменный белок. Эндонуклеазная активность связана с N-концевым доменом. Этот же домен обладает дополнительной активностью, отвечающей за деградацию поли(А) и поли(U) хвостов. C-концевая половина белка взаимодействует с тремя основными компонентами деградосомы, RhlB, PNPазой и енолазой. Таким образом, РНКаза Е – сложный мультидоменный белок, N-конец которого является каталитическим, а C-конец выполняет роль каркаса, на котором собираются
остальные компоненты деградосомы. |
|
|
|||||
Несколько |
мультибелковых |
РНК- |
|
||||
деградирующих комплексов, структурно и |
|
||||||
функционально гомологичных бактериальной |
|
||||||
РНК-деградосоме, описано у эукариот. Все |
|
||||||
эти комплексы отвечают за деградацию РНК |
|
||||||
в 3'->5' направлении. Комплекс, содержащий |
|
||||||
гомологи PNPазы и РНКазы Е, участвует в |
|
||||||
процессинге и деградации мРНК в |
|
||||||
хлоропластах шпината. Еще два комплекса |
|
||||||
описаны у дрожжей. Комплекс mtEXO, |
|
||||||
содержащий экзонуклеазу, сходную с |
|
||||||
РНКазой II из E. coli, деградирует интроны |
|
||||||
мРНК |
в |
митохондриях |
Saccharomyces |
|
|||
cerevisiae. |
Экзосома |
S. |
cerevisiae, |
Рис.17.4. Прокариотическая РНК-деградосома |
|||
участвующая как в процессинге рибосомной |
|||||||
РНК, |
так |
и в |
деградации |
мРНК, |
содержит |
|
|
пять 3'->5' экзорибонуклеаз, четыре из
которых гомологичны РНКазе II или PNPазе из E. coli. Человеческий гомолог дрожжевой экзонуклеазы Rpr4p был обнаружен в составе большого комплекса, что свидетельствует в пользу наличия экзосомы и в клетках животных.
РНК-хеликазы в деградации РНК
Идентификация РНК-хеликазы RhlB в составе бактериальной деградосомы явилась первым свидетельством активной роли РНК-хеликаз в деградации РНК. RhlB принадлежит к классу DEAD-бокс белков. Это семейство АТФ-зависимых РНК-хеликаз, имеющих 8 консервативных мотивов, включая аминокислоты аспартат (D), глутамат (E), аланин (A) и опять аспартат (D). Белки-члены этого семейства участвуют в разнообразных процессах, включая сборку рибосом, инициацию трансляции и сплайсинг РНК. В экспериментах in vitro функция RhlB в составе деградосомы была четко показана. Элементы вторичной структуры в РНК часто создают препятствия для продвижения таких ферментов, как ПНФаза. Показано, что присутствие RhlB в составе деградосомы стимулирует в АТФ-зависимой манере деградацию при помощи ПНФазы субстрата с выраженной вторичной структурой. RhlB "раскручивает"
- 87 -

двухцепочечные участки РНК, что позволяет экзорибонуклеазе продвинуться дальше по субстрату. RhlB сильно активируется взаимодействием с C-концевой частью РНКазы Е. Дрожжевые экзосома и комплекс mtEXO также имеют в своем составе хеликазы, подобные RhlB.
Полиаденилирование оказывает противоположный эффект на стабильность бактериальных и эукариотических мРНК.
Поли(А)-полимераза I (PAP I) из E. coli кодируется геном pcnB (plasmid copy number), который был первоначально идентифицирован по его действию на копийность плазмид с ColEI репликоном. PAP I участвует в деградации РНК I – небольшой регуляторной РНК, которая взаимодействует с РНК II – праймером, инициирующим репликацию ДНК ColEI. РНК I, время полужизни которой составляет 2 минуты, первоначально укорачивается РНКазой Е на 5 нуклеотидов с 5' конца. Время полужизни полученного интермедиата (РНК I-5) возрастает в 10 раз в pcnB штамме (у которого отсутствует PAP I активность). E. coli имеет еще один белок с поли(A)-полимеразной активностью (PAP II). Инактивация обеих поли(A)-полимераз летальна. PAP I из E. coli гомологичен эукариотическим поли(A)- полимеразам.
Степень полиаденилирования бактериальных мРНК невысока, и у E. coli только небольшой процент всех транскриптов полиаденилирован. Однако, несмотря на низкую степень полиаденилирования, оно выполняет существенную функцию при деградации РНК. Добавление поли(А) способствует деградации РНК, чьи концы защищены от действия экзонуклеаз вторичной структурой. Такие экзорибонуклеазы, как ПНФаза и РНКаза I, нуждаются в одноцепочечном "хвосте", за который можно "ухватить" 3' конец мРНК и начать ее деградацию. Полиаденилирование 3' конца как раз и создает сайт связывания для экзорибонуклеаз.
Открытие дестабилизирующего влияния 3' поли(А)-хвостов на мРНК у бактерий явилось сюрпризом, поскольку у эукариот функция полиаденилирования противоположная (стабилизирующая). Такое отличие объясняется тем, что поли(А)-хвосты эукариот значительно длиннее и, кроме того, защищены особым белком PAB (poly(A)-binding). Короткие не связанные с белком поли(А) последовательности и у эукариот оказывают дестабилизирующее действие на мРНК.
Литература:
1. M. Grunberg-Manago. Messenger rna stability and its role in control of gene expression in bacteria and phages Annu. Rev. Genet. 1999. 33:193–227
- 88 -
