
II. Трансферазы – катализируют реакции переноса функциональных групп с одной молекулы на другую.
Основные подклассы:
1.Киназы – катализируют перенос фосфатной группы, донором которой является АТФ (реже ГТФ).
Примеры:
1) H2C |
|
OH |
|
H2C |
|
OH |
+ АДФ |
||
|
|
||||||||
|
|
|
OH + АТФ |
|
|
|
|
OH |
|
HC |
|
|
HC |
|
|||||
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
H2C |
|
OH |
|
H2C |
|
OPO3H2 |
|||
|
|
||||||||
Глицерол |
|
Глицерол- |
|||||||
|
|
|
|
|
-3-фосфат |
||||
2)
OH |
OPO3H2 |
+ АТФ |
+ АДФ |
протеин фосфопротеин
Кофакторы: ионы Mg2+ и Mn2+.
Реакции, которые катализируют киназы, называются р-циями фосфорилирования.
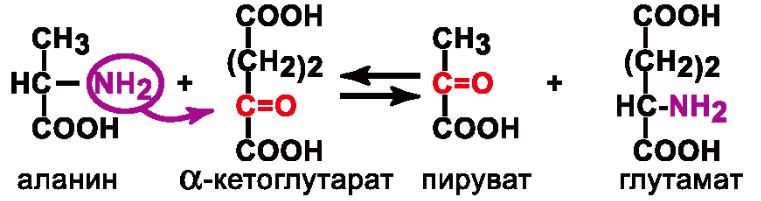
2.Аминотрансферазы – катализируют перенос аминогруппы с аминокислоты на кетокислоту.
Пример:
Кофермент: Пиридоксальфосфат, производное витамина B6.
3.Метилтрансферазы – перенос метильной группы.
4.Ацилтрансферазы – перенос ацильной группы.
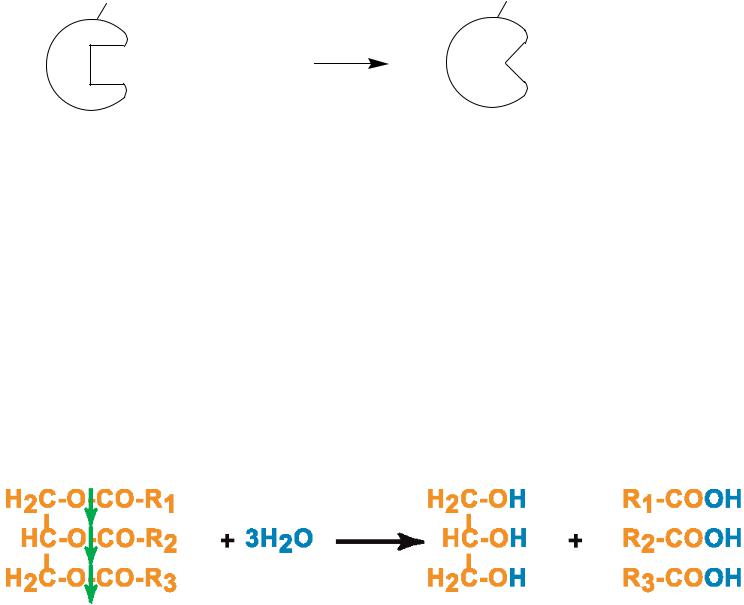
III. Гидролазы – катализируют реакции разрыва связей в молекуле с участием воды, т.е. путем гидролиза.
Основные подклассы:
1. Фосфатазы – катализируют гидролитическое отщепление фосфатной группы:
OPO3H2 |
OH |
+ H2O |
+ H3PO4 |
Фосфопротеин Протеин
Реакции, которые катализируют фосфатазы,
называются р-циями дефосфорилирования.
2. Липазы – гидролиз связей в жирах:
3.Пептидазы
4.Гликозидазы
5.Эстеразы
IV. Лиазы.
Существует 2 разновидности лиаз:
1 разновидность: Лиазы, катализирующие реакции разрыва связей способом, отличным от гидролиза и окисления.
Для этой разновидности лиаз существуют подклассы:
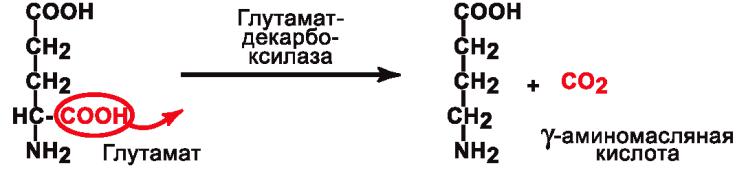
1. Декарбоксилазы – катализируют реакции отщепления карбоксильной группы в виде CO2.
Пример:
Кофермент – Пиридоксальфосфат (Производное витамина B6).
2. Дегидратазы – катализируют реакции отщепления воды от молекулы с образованием двойной связи.
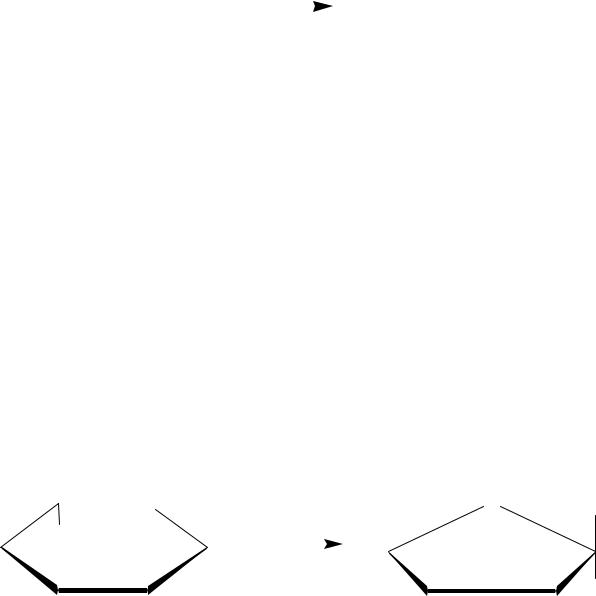
2 разновидность: Лиазы, катализирующие реакции присоединения молекул по двойной связи.
Подклассы: Гидратазы – катализирующие реакции присоединения молекулы воды по двойной связи.
COOH |
|
|
|
COOH |
|||||||
|
|
|
|
+ |
H2O |
|
фумараза |
|
|
OH |
|
CH |
|
HC |
|
||||||||
|
|
|
|
||||||||
|
|
|
|||||||||
|
|
|
|
||||||||
|
|
|
|||||||||
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
CH |
|
|
|
|
|
CH2 |
||||
|
|
|
|
|
|
|
|
|
|||
COOH |
|
COOH |
|||||||||
Фумарат |
|
|
|
Малат |
|||||||
V. Изомеразы – катализируют взаимопревращение изомеров.
Подклассы: изомеразы, мутазы.
Пример:
|
CH OPO H |
|
|
|
|
CH2OPO3H2 |
|
|
|
||||||
|
|
2 |
3 |
|
2 |
|
|
|
|
|
O |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
H |
|
|
|
O |
H |
|
|
|
|
|
CH2OH |
||||
|
|
|
|||||||||||||
|
|
|
|
|
|
|
|
|
|
||||||
|
H |
|
H |
|
|
|
|
|
|
|
|
|
|||
|
|
OH |
|
|
|
|
|
H |
OH |
|
|||||
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
OH |
|
|
|
|
|
|
|
|
OH |
|
|
|
|
|
|||
OH |
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
H |
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
H |
|
OH |
|
|
|
|
|
|
H |
|||||
|
|
|
|
|
|
OH |
|||||||||
Глюкозо - 6-фосфат Фруктозо - 6-фосфат
Кофакторов нет.
VI. Лигазы.
2 разновидности:
1 разновидность: Синтетазы – катализируют реакции соединения 2-х молекул при участии энергии АТФ (реже ГТФ).
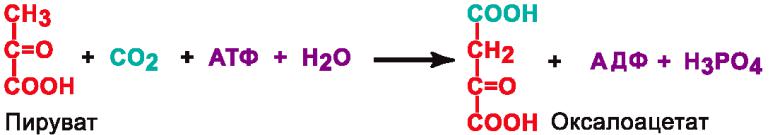
Подклассы: Карбоксилазы – катализируют реакции присоединения карбоксильной группы к молекуле в виде CO2.
Пример:
Кофермент: биотин (витамин H).
2 разновидность: Синтазы – катализируют соединение молекул при участии энергии макроэргических связей субстрата.

Активность фермента.
В условиях избытка субстрата скорость ферментативной реакции прямо пропорциональна концентрации фермента.
V |
[E] |
Концентрация E крайне мала (обычно для протекания р-ции с большой скоростью требуется буквально несколько десятков молекул E).
Поэтому, на практике пользуются условными величинами, характеризующими активность E:
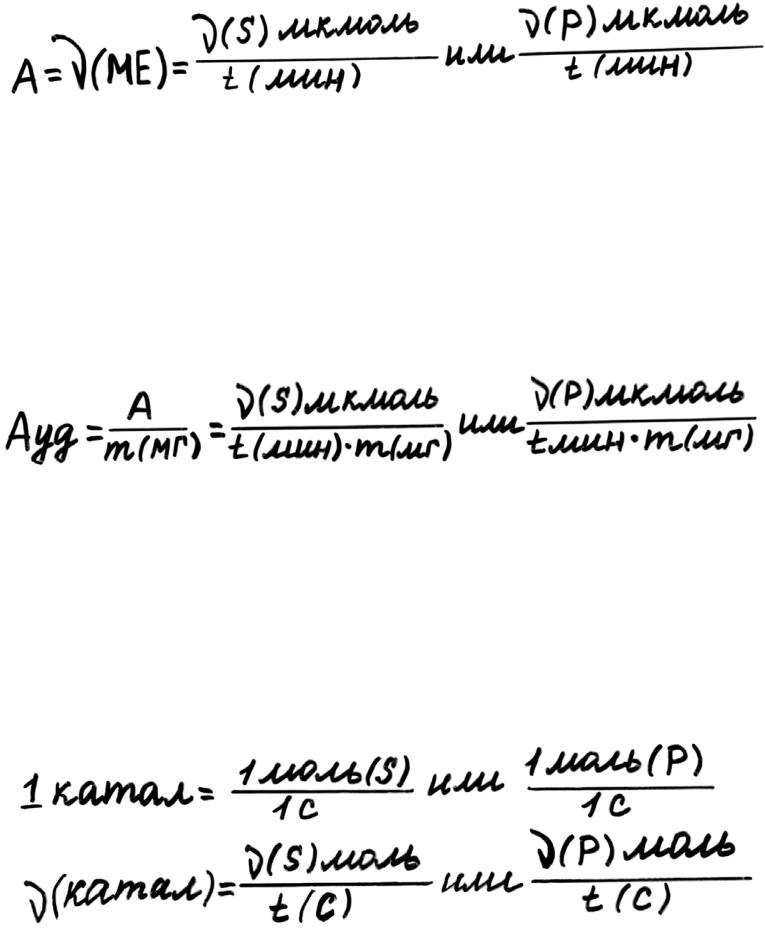
1 МЕ (международная единица активности) – это такое количество фермента, которое катализирует превращение 1 мкмоль субстрата за 1 мин или образование 1 мкмоль продукта за 1 мин при оптимальных условиях.
Оптимальные условия индивидуальны для каждого E и зависят от температуры, pH среды, наличия Ko (если есть), отсутствие активаторов и ингибиторов.
Для того, чтобы оценить количество молекул E среди других белков данной ткани, определяют удельную активность.
Удельная активность – это отношение количества единиц активности фермента в образце ткани к массе белка (в мг) в этой ткани.
По удельной активности часто судят об очистке E: чем меньше посторонних белков, тем выше Aуд.
(В обязательную программу по Биохимии не входит):
В 1973 году была принята новая единица активности – катал.

Ингибиторы ферментов
Ингибиторы – это вещества полностью или частично подавляющие активность ферментов.
Типы ингибиторов
Обратимые |
Необратимые |
Конкурентные Неконкурентные Специфические Неспецифические
Обратимые ингибиторы присоединяются к
ферменту слабыми связями и могут легко отделяться от фермента.
Обратимые конкурентные ингибиторы:
1)являются структурными аналогами субстрата;
2)конкурируют с S за связывание с активным центром E;
3)При увеличении концентрации субстрата степень ингибирования уменьшается.
А при избытке субстрата действие ингибитора на фермент практически полностью прекращается.
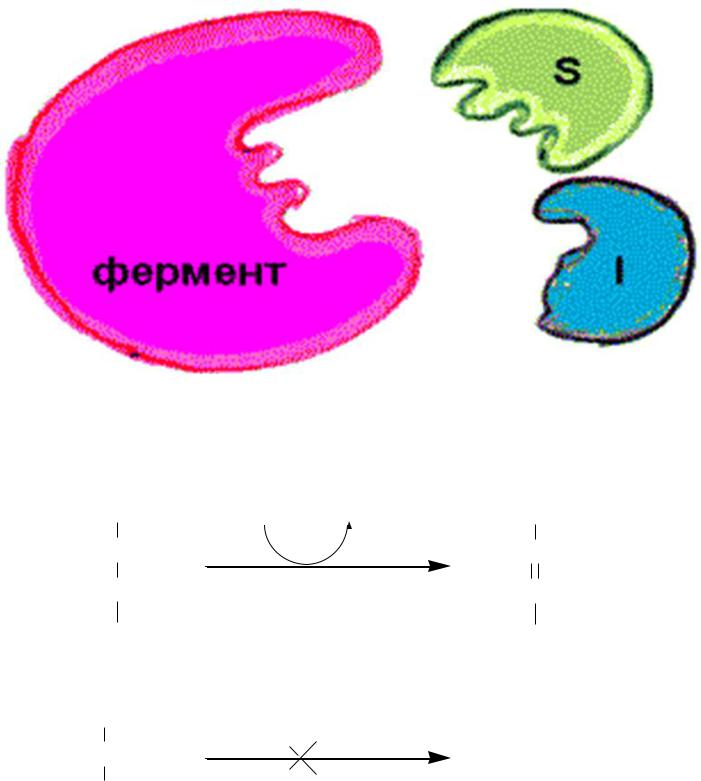
Пример:
COOH FAD FAD.H2 CH2
CH2 сукцинатдегидрогеназа
COOH
Сукцинат
COOH
CH2
COOH сукцинатдегидрогеназа Малонат
COOH
CH
CH
COOH
Фумарат
